修回日期: 2016-12-10
接受日期: 2016-12-19
在线出版日期: 2017-02-18
探讨缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)在高原地区胃癌及癌前病变患者中的表达与胃黏膜恶变过程中的临床联系及预后评价.
利用RT-PCR检测7株胃癌细胞系及其27对胃癌和配癌旁正常组织中HIF-1α的表达; 进一步利用组织微阵列和免疫组织化学染色检测37例萎缩性胃炎, 34例胃黏膜肠化组织, 146例胃癌和57例癌旁正常组织中HIF-1α的表达情况.
RT-PCR检测显示, HIF-1α在7株胃癌细胞系存在差异表达. 同时在胃癌组织的表达水平66.6%(18/27)高于癌旁正常组织14.8%(4/27)(P<0.001). 免疫组织化学显示, HIF-1α在癌旁正常组织中表达阳性率为26.3%(15/57); 萎缩性胃炎组织为64.8%(24/37); 肠化生组织为61.7%(21/34); 胃癌组织为56.8%(83/146). 并且HIF-1α的表达与年龄相关(P<0.05), 而与性别、胃癌的分化程度、胃癌患者临床分期等无关. Kaplan-Meier法和COX多因素回归分析提示HIF-1α高表达是术后胃癌患者独立的危险因素(P<0.001), RR = 3.229(95%CI: 2.024-5.151).
HIF-1α表达在胃黏膜恶变过程中表达增加, 并且与高原地区胃癌患者不良预后的密切相关.
核心提要: 青海地区胃癌的发生率与死亡率均较高, 研究证明高原环境肿瘤组织中存在的缺氧状态是肿瘤预后不良的重要指标; 亦可能与世居者生活饮食习惯相关. 缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是参与调节肿瘤细胞适应缺氧的核心转录因子, 为明确HIF-1α高原地区胃癌发生发展进程中的变化, 本文在mRNA和蛋白水平分析了胃癌细胞系和配对胃癌组织及胃黏膜癌前病变中的表达, 并分析其与临床病理学特征及其预后的关系.
引文著录: 安娟, 康倩, 潘元明, 孙伟, 王昕, 祁玉娟. HIF-1α在高原地区胃癌及胃黏膜癌前病变组织中的表达及临床意义. 世界华人消化杂志 2017; 25(5): 404-411
Revised: December 10, 2016
Accepted: December 19, 2016
Published online: February 18, 2017
To detect the expression of hypoxia inducible factor-1α (HIF-1α) in gastric malignant transformation in people from high altitude area of Qinghai, China.
RT-PCR was used to detect the expression of HIF-1α gene in 7 cell lines and 27 pairs of GC and matched tumor adjacent normal gastric mucosa tissues. Using tissue microarray including 57 normal gastric mucosa tissues, 37 chronic atrophic gastritis tissues, 34 intestinal metaplasia tissues, and 146 gastric cancer (GC) tissues, immunohistochemistry (IHC) was performed to detect the level of HIF-1α protein expression.
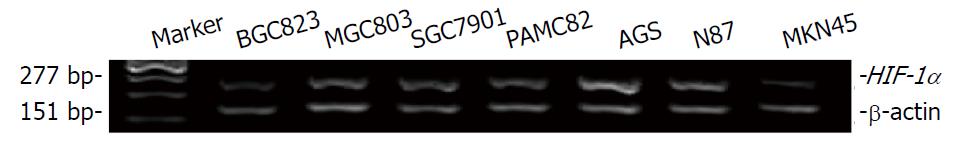
The expression of HIF-1α at the mRNA level was different in GC cell lines. HIF-1αexpression in AGS, SGC7901, and N87 cells was higher than that in MGC803, BGC823, PAMC82 and MKN45 cells. The level of HIF-1α expression was significantly higher in GC tissues (66.6%, 18/27) compared with normal gastric mucosa tissues (26.3%, 15/57; P < 0.001). IHC data showed that the positive rate of HIF-1α was 64.8% (24/37) in chronic atrophic gastritis tissues, 61.7% (21/34) in intestinal metaplasia tissues, and 56.8% (83/146) in GC tissues, all of which were significantly higher than that in normal tissues (26.3%, 15/57). Expression of HIF-1α was positively associated with age in GC (P < 0.05). Kaplan-Meier analysis showed that patients with a low level of HIF-1α had apparently better survival than those with a high level (P < 0.0001). HIF-1α protein (RR = 3.229, 95%CI: 2.024-5.151) was identified to be an independent risk factor for the outcome of GC patients.
High HIF-1α expression is associated with gastric malignant transformation and poor prognosis in high altitude areas.
- Citation: An J, Kang Q, Pan YM, Sun W, Wang X, Qi YJ. Clinical significance of HIF-1α expression in gastric malignant transformation in people from high altitude area of Qinghai. Shijie Huaren Xiaohua Zazhi 2017; 25(5): 404-411
- URL: https://www.wjgnet.com/1009-3079/full/v25/i5/404.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i5.404
青海省胃癌发病率居全国首位, 据统计, 青海世居人群胃癌发病率高于移居人群. 按区域胃癌的发病率在农村、牧区为第1位, 在城市为第2位[1]. 临床上多数患者就诊时, 已经发展到中晚期, 治疗效果差[1,2]. 其中高海拔地区寒冷、低压、低氧、太阳辐射等环境因素, 特殊生活习惯, 都可能与青海地区胃癌发生及其进展迅速、预后差相关[2,3]. 同时, 在恶性肿瘤中肿瘤细胞失控性增殖, 局部组织血管生长滞后, 会造成实质性肿瘤物理微环境严重缺氧. 在缺氧条件下, 缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)的关键亚基, 参与调节肿瘤细胞适应缺氧的核心转录因子, 能通过诱导参与多种基因的转录调控, 促进肿瘤血管生成, 增加肿瘤细胞的侵袭和转移, 促进肿瘤的生长、浸润和转移[4]. 最近发现许多类型的肿瘤中HIF-1α高表达[5], 并和肿瘤生物学行为密切相关[6,7]. 为了进一步明确HIF-1α在高原地区胃癌发生发展进程中的变化, 本研究利用RT-PCR和免疫组织化学染色, 在mRNA水平和蛋白水平分析了胃癌细胞系和配对胃癌组织及胃黏膜癌前病变中的表达, 并分析其与临床病理学特征及其预后的关系.
1.1.1 细胞系: 人胃癌细胞系BGC823、MGC803、SGC7901、PAMC82、AGS、N87、MKN45由北京肿瘤防治研究所提供.
1.1.2 组织标本及临床病例资料: 用于提RNA的27例胃癌组织标本来源于青海大学附属医院胃肠外科和青海省人民医院, 为2014-01/2015-12的手术切除标本. 其中男性16例, 女性11例, 年龄42-73岁, 4例弥漫型癌, 23例溃疡型癌, 14例高分化, 13例低分化, 新鲜癌组织与配对癌旁形态学正常组织(距癌灶5 cm以上)在停止血供30 min内放入液氮, -70 ℃保存. 肿瘤标本确认无明显坏死, 所有标本均经病理证实. 用于免疫组织化学染色的37例萎缩性胃炎组织, 34例胃黏膜癌前病变组织来源于青海大学附属医院腔镜检查中心及病理科. 胃癌组织芯片标本共146例, 为2005-01/2012-12的组织蜡块标本, 来源于青海大学附属医院病理科及陆军总医院青海分区的病理科, 年龄29-82岁, 其中高分化44例, 中低分化102例, Ⅰ、Ⅱ期肿瘤43例, Ⅲ、Ⅳ肿瘤103例, 36例胃体, 15例胃底, 46例胃窦, 49例全胃, 53例有远处转移.
1.1.3 试剂来源: 胎牛血清购自Hyclone公司; DMEM培养基和RNA提取试剂盒购自Invitrogen公司; RNeasy mini spin column试剂盒购自Qiagen公司; cDNA合成试剂盒购自TaKaRa公司; Oligo(dT)15购自上海博亚生物技术有限公司; 基因引物由北京奥科生物公司合成; HIF-1α(MAB5382)抗体购自CHEMICON公司; 通用型鼠二步法(PV6001, Power VisionTM)试剂盒和DAB显色试剂盒购自北京中杉生物技术公司.
1.2.1 细胞培养: 细胞培养均在含10%(v/v)胎牛血清的DMEM培养基, 37 ℃、50 mL/L CO2条件下培养, 隔48 h换液.
1.2.2 细胞总RNA提取: 细胞系去培养液收集细胞后, TRIzol一步法提取贴壁细胞株总RNA. 取TRIzol 1 mL裂解细胞, 0.2 mL氯仿液相分离RNA, 取上清加1 mL异丙醇沉淀浓缩RNA, 沉淀中加入2 mL 75%乙醇洗盐, RNA以DEPC水溶解, 紫外定量, -20 ℃储存备用.
1.2.3 组织总RNA提取: 将组织标本利用液氮冷冻法破碎研磨, TRIzol一步法提取组织块总RNA, 通过异丙醇沉淀法浓缩RNA, 并进一步采用RNeasy mini spin column试剂盒对总RNA进行过柱, 最后用分光光度计定量, 电泳质检, -20 ℃储存备用.
1.2.4 RT-PCR: 以T7-Oligo(dT)15为引物, 用cDNA Synthesis Kit合成双链cDNA. 用Oligo7.0软件设计目的基因引物, HIF-1α-up: CATCTCCATCTCCTACCCAC, HIF-1α-down: ACTGCTTGAAAAAGTGAACCA, 目的片段长277 bp, PCR反应, 62 ℃退火, 循环28次. 内对照β-actin和目的基因的扩增在同一反应中进行, 采用灰度分析软件分析电泳条带, 去除本底, 用目的基因与β-actin相对比值计算表达水平.
1.2.5 组织芯片构建与免疫组织化学染色: 本实验制备的石蜡块大小为26 mm×22 mm×10 mm. HE染色后病理诊断, 标记蜡块取材部位, 设计芯片作出草图; 在组织阵列操作仪上用直径0.6 mm孔径细针在空白蜡块上穿出隧道再从标本蜡块中根据预先确定的取材部位穿取组织条, 将组织条精确填入空白蜡块的隧道中. 重复以上步骤, 直至所有标本取完. 组织条穿刺断面直径0.6 mm, 高度1 mm, 空白蜡块中组织条间距1 mm. 将阵列蜡块置于39 ℃烤箱中20 min, 取出后以洁净玻片将蜡块表面压平, 室温下彻底冷却后常规切片, 厚度4 μm, 置60 ℃烤箱中过夜, 取出后备用. 免疫组织化学染色采用二步法(PV6001, Power VisionTM). 1:50稀释的鼠抗人一抗HIF-1α, 利用通用型鼠二步法试剂盒和DAB显色试剂盒, 免疫组织化学染色参照使用说明进行, 最后中性树胶封片. PBS替代一抗为阴性对照. 由病理医生进行结果判断, 在400倍镜下观察和计数, 阳性细胞比例≤5%为阴性(-), 5%-25%为弱阳性(+), 25%-50%为阳性(++), ≥75%为强阳性(+++).
统计学处理 利用SPSS15.0软件对数据进行处理. 若总分析例数(n)>40, 且最小期望频数>1, 使用Pearson检验进行统计; 若1<最小期盼频数<5, n>40时使用连续校正χ2检验; 若n≤40, 或最小期望频数<1, 则应用Fisher精确检验进行统计. 应用Kaplan-Meier法分析蛋白阳性和阴性表达的生存曲线, Cox多因素生存分析.
RT-PCR扩增产物与所设计的大小完全一致, PCR凝胶电泳成像及灰度值扫描显示在mRNA水平, HIF-1α在7株胃癌细胞系的表达存在差异, 其中AGS、N87和SGC7901表达较高(图1).
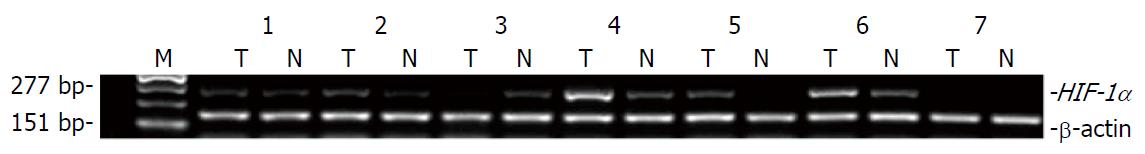
27例胃癌肿瘤组织和配对癌旁正常组织进行HIF-1α基因的RT-PCR检测, 凝胶电泳成像及灰度值扫描结果显示: HIF-1α基因在肿瘤组织中高表达, 阳性率为66.6%(18/27), 在癌旁正常组织中表达程度低, 阳性率为14.8%(4/27), 结果显示其在肿瘤组织表达程度高于癌旁正常组织(P<0.01, 图2, 表1).
| 组织类型 | HIF-1α mRNA水平表达 | HIF-1α蛋白表达 | P值 | ||||
| n | 高表达 | 低表达 | n | ++/+++ | +/- | ||
| 肿瘤组织 | 27 | 18(66.6) | 9(33.4) | 146 | 83(56.8) | 63(43.2) | <0.001 |
| 癌旁组织 | 27 | 4(14.8) | 23(85.2) | 57 | 15(26.3) | 42(73.7) | |
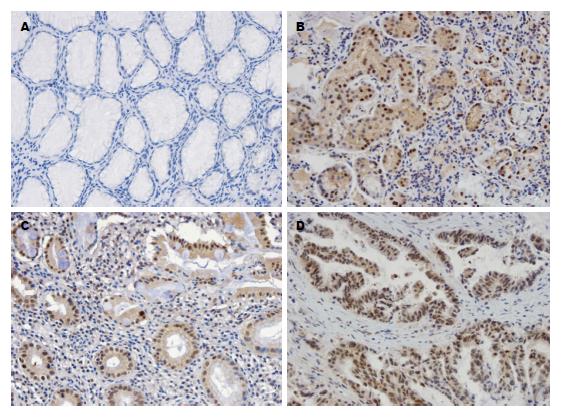
免疫组织化学结果显示, HIF-1α在胃癌组织细胞胞核、胞浆均有表达, 但以细胞核表达为主, 呈棕黄色灶性或散在分布. 在400倍镜下选择肿瘤细胞密集区域, 观察5个视野, 计数500个细胞中阳性细胞所占百分率(图3). HIF-1α在癌旁正常组织中表达阳性率26.3%(15/57); 萎缩性胃炎组织中表达阳性率为64.8%(24/37), 肠化组织中的表达阳性率61.7%(21/34), 胃癌组织中的表达为56.8%(83/146)(P<0.01, 表1). 并且HIF-1α的表达与年龄相关, >60岁的患者HIF-1α的表达较高(P<0.05), 而与性别、胃癌肿瘤的部位、分化程度、胃癌患者临床分期、远端转移等无关(表2).
| 因素 | n | HIF-1α蛋白的表达 | χ2值 | P值 | |
| 高表达 | 低表达 | ||||
| 年龄(岁) | 4.160 | 0.041 | |||
| <60 | 58 | 27 | 31 | ||
| ≥60 | 88 | 56 | 32 | ||
| 性别 | 0.049 | 0.826 | |||
| 男 | 78 | 45 | 33 | ||
| 女 | 68 | 38 | 30 | ||
| 肿瘤部位 | 2.098 | 0.552 | |||
| 胃体 | 36 | 20 | 16 | ||
| 胃底 | 15 | 11 | 4 | ||
| 胃窦 | 46 | 24 | 22 | ||
| 全胃 | 49 | 28 | 21 | ||
| 分化程度 | 0.001 | 0.996 | |||
| 高分化 | 44 | 25 | 19 | ||
| 中低分化 | 102 | 58 | 44 | ||
| 临床分期 | 0.281 | 0.596 | |||
| Ⅰ、Ⅱ | 43 | 23 | 20 | ||
| Ⅲ、Ⅳ | 103 | 60 | 43 | ||
| 远处转移 | 0.994 | 0.319 | |||
| 有 | 53 | 33 | 20 | ||
| 无 | 93 | 50 | 43 | ||
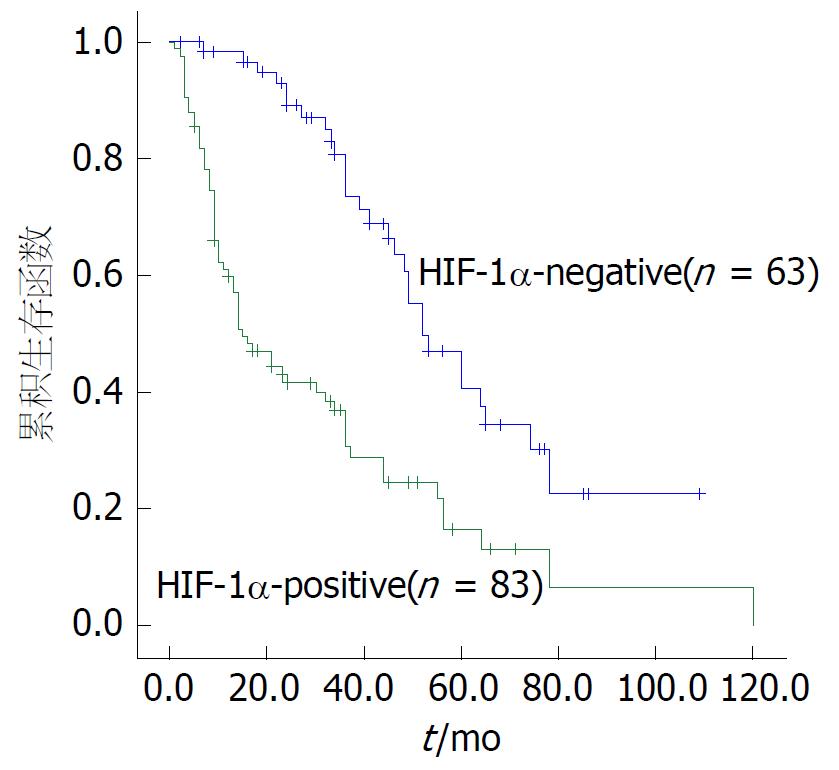
我们收集到有随访的胃癌组织共146例, 应用Kaplan-Meier法分析HIF-1α阳性和阴性表达与预后的关系, 差别有统计学意义(P<0.001, 图4), 说明HIF-1α阳性表达可能是胃癌患者预后不良的危险因素之一. 进一步通过Cox多因素分析结果显示: HIF-1α表达是胃癌患者术后生存的独立的危险因素(P<0.001), 相对危险度为RR = 3.229(95%CI: 2.024-5.151), 证明HIF-1α高表达是胃癌患者预后的不良因素(表3).
| 临床因素 | B | SE | P值 | Exp(B) | 95%CI用于Exp(B) | |
| 下部 | 上部 | |||||
| HIF-1α | 1.172 | 0.238 | <0.001 | 3.229 | 2.024 | 5.151 |
| 远端转移 | -0.366 | 0.235 | 0.120 | 0.694 | 0.438 | 1.099 |
| TNM分期 | -0.393 | 0.271 | 0.146 | 0.675 | 0.397 | 1.147 |
| 分化 | -0.382 | 0.280 | 0.172 | 0.683 | 0.395 | 1.181 |
| 年龄 | 0.627 | 0.256 | 0.014 | 1.872 | 1.134 | 3.090 |
| 性别 | -0.290 | 0.240 | 0.227 | 0.748 | 0.468 | 1.198 |
我们的研究显示, HIF-1α在正常组织中表达较低, 阳性率为26.3%; 而在萎缩性胃炎组织, 肠化组织和胃癌组织中的表达均较高, 即表达的上调从胃黏膜炎性病变开始, 直至病变恶化一直处于高水平. 可见, HIF-1α在胃黏膜病变的早期已经发挥了作用. Griffiths等发现HIF-1α在正常胃黏膜无表达, 而在胃癌组织中高表达, 并且侵袭, 淋巴结转移, TNM分期有关. 认为与术后生存期长短有关. Mizokami等[8]、Chen等[9]及吴友亮等[10]也发现在胃癌组织中HIF-1α高表达, 且和肿瘤大小, 浸润深度有关.
缺氧包括外环境缺氧与组织细胞微环境缺氧[11]. 高原环境缺氧状态时, 胃是首先暴露的消化器官, 在缺氧状态下, 迷走神经常常处于兴奋状态, 迷走神经兴奋可促使胃泌素分泌增加, 进而促进胃酸、胃蛋白酶的分泌增加, 从而加重对胃肠黏膜的损害[11]. 同时, 高原缺氧还可引起胃肠黏膜分泌型免疫球蛋白的分泌减少, 黏膜特异性免疫屏障作用减弱, 并可释放多种蛋白水解酶引起胃肠黏膜的损伤, 导致胃黏膜屏障损伤甚至急慢性胃炎的发生[12]. 青藏高原环境缺氧, 加上特殊的生活习惯, 造成了胃黏膜炎性病变的危险因素之一[13], 而青海地区胃癌的高发生率与死亡率, 与高海拔地区高寒缺氧的环境因素有一定相关性, 以往的研究[13]证明高原环境肿瘤组织中存在的缺氧状态是肿瘤预后不良的重要指标; 亦可能与世居者嗜烟、嗜酒, 长年食用腌制酸及高盐食物相关[1,2]. 尤其青海农牧区藏族居民常吃干硬食物并以肉食为主, 饮食中新鲜蔬菜水果摄入较平原地区明显偏少而增加了胃癌发生的风险[2].
然而, 实质性肿瘤微环境的缺氧是肿瘤细胞增殖的结果之一[14,15], 同时也是肿瘤进一步恶化, 并发生侵袭和转移的因素[16,17]. 我们收集到有随访的胃癌组织共146例, 应用Kaplan-Meier法分析HIF-1α表达阳性的患者生存期缩短, 同时发现年龄>60岁的患者HIF-1α表达阳性. 并且分析发现HIF-1α表达是胃癌患者预后不良的危险因素之一. 研究证明, HIF-1α是HIF-1的关键亚基, 在调节缺氧诱导的基因表达中起着关键作用. 新生血管的生成在肿瘤恶性增殖中扮演着重要的角色; 当肿瘤组织缺血, 微环境严重缺氧, 在缺氧时HIF-1α的泛素化作用受到抑制, 导致HIF-1α在细胞内的蓄积, 并与HIF-1β亚基二聚体化, 形成HIF-1, 后者可与其靶基因的低氧反应元件中的核心序列5'-RCGTG-3'(R表示嘌呤)相结合, 促进其转录, 诱导(1)血管内皮生长因子[18-20]; (2)促红细胞生成素[21,22]; (3)血红素氧合酶-1[23]和诱导型一氧化氮合酶[24]; (4)葡萄糖载体蛋白-1和3-磷酸甘油醛脱氢酶[25]; (5)胰岛素样生长因子-2[26]; (6)酪氨酸羟化酶及糖酵解酶类等基因的转录调控[27], 从而加速肿瘤细胞对缺氧的适应过程, 而增加供血、供氧、供能, 反过来促进肿瘤的生长、浸润和转移[28-30]. 因此, 对HIF-1α表达的检测, 将为临床上开展胃癌分子分型和个体化治疗方案的选择以及预后的判断提供了参考的依据, 为解决肿瘤细胞在缺氧条件下产生的放化疗耐受性问题提供了依据. 进一步可设想如何通过HIF-1α参与的信号通路, 使其成为肿瘤基因治疗新的切入点.
青海省胃癌发病率居全国首位, 多数患者就诊时已到中晚期, 疗效差. 这可能与高寒缺氧等因素相关. 缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是参与调节肿瘤细胞适应缺氧的核心转录因子, 能通过诱导参与多种基因的转录调控, 促进肿瘤血管生成, 增加肿瘤细胞的侵袭和转移, 促进肿瘤的生长、浸润和转移.
实质性肿瘤微环境的缺氧是肿瘤细胞增殖的结果之一, 同时也是肿瘤进一步恶化, 并发生侵袭和转移的因素. HIF-1α是参与调节肿瘤细胞适应缺氧的核心转录因子, 对HIF-1α表达的检测, 将为临床上开展胃癌分子分型和个体化治疗方案的选择以及预后的判断提供参考的依据, 为解决肿瘤细胞在缺氧条件下产生的放化疗耐受性问题提供依据. 进一步可设想如何通过HIF-1α参与的信号通路, 使其成为肿瘤基因治疗新的切入点.
Griffiths等、Mizokami等及吴友亮等的研究均较为系统的进行了HIF-1α在胃癌组织中表达的检测和临床病理学数据的分析, Shenberger等、Kim等及Guleng等对HIF-1α在各个肿瘤组织中的表达和在肿瘤发生发展过程中的机制做了较为系统的研究, Wei等、Choi等及Folkman等对HIF-1α在肿瘤缺氧的机制做了较为详尽的综述.
本文以青海高原地区胃癌患者为研究对象, 在mRNA水平和蛋白水平, 从细胞系, 正常癌旁组织, 胃黏膜癌前病变到肿瘤组织, 系统地分析了HIF-1α的表达模式, 并分析其与临床病理学特征及其预后的关系.
对HIF-1α表达的检测, 可进一步研究高原地区胃癌发生发展的分子机制, 并将为临床上开展胃癌分子分型和个体化治疗方案的选择以及预后的判断提供依据, 为解决肿瘤细胞在缺氧条件下产生的放化疗耐受性问题提供了依据. 进一步可设想如何通过HIF-1α参与的信号通路, 使其成为肿瘤基因治疗新的切入点.
缺氧: 包括外环境缺氧与组织细胞微环境缺氧, 青藏高原环境缺氧, 加上特殊的生活习惯, 造成了胃黏膜炎性病变的危险因素之一; 然而, 实质性肿瘤微环境的缺氧是肿瘤细胞增殖的结果之一, 同时也是肿瘤进一步恶化, 并发生侵袭和转移的因素.
黄河, 副教授, 中南大学湘雅医学院组织学与胚胎学系
本文较为系统的探讨了HIF-1α在高原地区胃癌及癌前病变患者中的表达与胃黏膜恶变过程中的临床联系与预后评价. 该研究为探讨高原地区胃癌发生发展的分子机制提供了参考依据, 并为临床上开展胃癌分子分型以及预后的判断提供了参考的依据, 论文写作逻辑性强, 结果较为可靠, 具有一定的研究价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 青海省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Zhao JD, Geng PL, Li ZQ, Cui S, Zhao JH, Wang LJ, Li JZ, Ji FX, Li GY, Shen GS. Associations between interleukin-1 polymorphisms and gastric cancers among three ethnicities. World J Gastroenterol. 2012;18:7093-7099. [PubMed] [DOI] |
| 2. | Qi YJ, Cui S, Yang YZ, Han JQ, Cai BJ, Sheng CF, Ma Y, Wuren T, Ge RL. Excision repair cross-complementation group 1 codon 118 polymorphism, micro ribonucleic acid and protein expression, clinical outcome of the advanced gastric cancer response to first-line FOLFOX-4 in Qinghai-Tibetan plateau population. J Cancer Res Ther. 2013;9:410-415. [PubMed] [DOI] |
| 3. | Jing JJ, Liu HY, Hao JK, Wang LN, Wang YP, Sun LH, Yuan Y. Gastric cancer incidence and mortality in Zhuanghe, China, between 2005 and 2010. World J Gastroenterol. 2012;18:1262-1269. [PubMed] [DOI] |
| 4. | Hicks TP, Stark CA, Fletcher WA. Origins of afferents to visual suprageniculate nucleus of the cat. J Comp Neurol. 1986;246:544-554. [PubMed] [DOI] |
| 5. | Medina Villaamil V, Aparicio Gallego G, Santamarina Caínzos I, Valladares-Ayerbes M, Antón Aparicio LM. Searching for Hif1-α interacting proteins in renal cell carcinoma. Clin Transl Oncol. 2012;14:698-708. [PubMed] [DOI] |
| 6. | Nam SY, Ko YS, Jung J, Yoon J, Kim YH, Choi YJ, Park JW, Chang MS, Kim WH, Lee BL. A hypoxia-dependent upregulation of hypoxia-inducible factor-1 by nuclear factor-κB promotes gastric tumour growth and angiogenesis. Br J Cancer. 2011;104:166-174. [PubMed] [DOI] |
| 7. | Rohwer N, Lobitz S, Daskalow K, Jöns T, Vieth M, Schlag PM, Kemmner W, Wiedenmann B, Cramer T, Höcker M. HIF-1alpha determines the metastatic potential of gastric cancer cells. Br J Cancer. 2009;100:772-781. [PubMed] [DOI] |
| 8. | Mizokami K, Kakeji Y, Oda S, Irie K, Yonemura T, Konishi F, Maehara Y. Clinicopathologic significance of hypoxia-inducible factor 1alpha overexpression in gastric carcinomas. J Surg Oncol. 2006;94:149-154. [PubMed] [DOI] |
| 9. | Chen L, Shi Y, Yuan J, Han Y, Qin R, Wu Q, Jia B, Wei B, Wei L, Dai G. HIF-1 alpha overexpression correlates with poor overall survival and disease-free survival in gastric cancer patients post-gastrectomy. PLoS One. 2014;9:e90678. [PubMed] [DOI] |
| 11. | Folkman J. Proceedings: Tumor angiogenesis factor. Cancer Res. 1974;34:2109-2113. [PubMed] |
| 12. | Wu TY, Ding SQ, Liu JL, Jia JH, Dai RC, Zhu DC, Liang BZ, Qi DT, Sun YF. High-altitude gastrointestinal bleeding: an observation in Qinghai-Tibetan railroad construction workers on Mountain Tanggula. World J Gastroenterol. 2007;13:774-780. [PubMed] [DOI] |
| 13. | Wang ZT, Yao YM, Xiao GX, Sheng ZY. Risk factors of development of gut-derived bacterial translocation in thermally injured rats. World J Gastroenterol. 2004;10:1619-1624. [PubMed] [DOI] |
| 14. | Wei H, Li F, Fu P, Liu X. Effects of the silencing of hypoxia-inducible Factor-1 alpha on metastasis of pancreatic cancer. Eur Rev Med Pharmacol Sci. 2013;17:436-446. [PubMed] |
| 15. | Choi KS, Bae MK, Jeong JW, Moon HE, Kim KW. Hypoxia-induced angiogenesis during carcinogenesis. J Biochem Mol Biol. 2003;36:120-127. [PubMed] [DOI] |
| 16. | Majmundar AJ, Wong WJ, Simon MC. Hypoxia-inducible factors and the response to hypoxic stress. Mol Cell. 2010;40:294-309. [PubMed] [DOI] |
| 17. | Shenberger JS, Zhang L, Powell RJ, Barchowsky A. Hyperoxia enhances VEGF release from A549 cells via post-transcriptional processes. Free Radic Biol Med. 2007;43:844-852. [PubMed] [DOI] |
| 18. | Rigiracciolo DC, Scarpelli A, Lappano R, Pisano A, Santolla MF, De Marco P, Cirillo F, Cappello AR, Dolce V, Belfiore A. Copper activates HIF-1α/GPER/VEGF signalling in cancer cells. Oncotarget. 2015;6:34158-34177. [PubMed] [DOI] |
| 19. | Kim DH, Sung B, Kang YJ, Hwang SY, Kim MJ, Yoon JH, Im E, Kim ND. Sulforaphane inhibits hypoxia-induced HIF-1α and VEGF expression and migration of human colon cancer cells. Int J Oncol. 2015;47:2226-2232. [PubMed] [DOI] |
| 20. | Guleng B, Han J, Yang JQ, Huang QW, Huang JK, Yang XN, Liu JJ, Ren JL. TFF3 mediated induction of VEGF via hypoxia in human gastric cancer SGC-7901 cells. Mol Biol Rep. 2012;39:4127-4134. [PubMed] [DOI] |
| 21. | Griffiths EA, Pritchard SA, McGrath SM, Valentine HR, Price PM, Welch IM, West CM. Hypoxia-associated markers in gastric carcinogenesis and HIF-2alpha in gastric and gastro-oesophageal cancer prognosis. Br J Cancer. 2008;98:965-973. [PubMed] [DOI] |
| 22. | Wong PP, Bodrug N, Hodivala-Dilke KM. Exploring Novel Methods for Modulating Tumor Blood Vessels in Cancer Treatment. Curr Biol. 2016;26:R1161-R1166. [PubMed] [DOI] |
| 23. | Li B, Takeda K, Yokoyama S, Shibahara S. A prolyl-hydroxylase inhibitor, ethyl-3,4-dihydroxybenzoate, induces haem oxygenase-1 expression in human cells through a mechanism independent of hypoxia-inducible factor-1alpha. J Biochem. 2008;144:643-654. [PubMed] [DOI] |
| 24. | Fitzpatrick B, Mehibel M, Cowen RL, Stratford IJ. iNOS as a therapeutic target for treatment of human tumors. Nitric Oxide. 2008;19:217-224. [PubMed] [DOI] |
| 25. | Chen T, Ren Z, Ye LC, Zhou PH, Xu JM, Shi Q, Yao LQ, Zhong YS. Factor inhibiting HIF1α (FIH-1) functions as a tumor suppressor in human colorectal cancer by repressing HIF1α pathway. Cancer Biol Ther. 2015;16:244-252. [PubMed] [DOI] |
| 26. | Mancini M, Gariboldi MB, Taiana E, Bonzi MC, Craparotta I, Pagin M, Monti E. Co-targeting the IGF system and HIF-1 inhibits migration and invasion by (triple-negative) breast cancer cells. Br J Cancer. 2014;110:2865-2873. [PubMed] [DOI] |
| 27. | Muz B, de la Puente P, Azab F, Azab AK. The role of hypoxia in cancer progression, angiogenesis, metastasis, and resistance to therapy. Hypoxia (Auckl). 2015;3:83-92. [PubMed] [DOI] |
| 28. | Allen M, Louise Jones J. Jekyll and Hyde: the role of the microenvironment on the progression of cancer. J Pathol. 2011;223:162-176. [PubMed] [DOI] |
| 29. | Abdel-Rahman O. Targeting vascular endothelial growth factor (VEGF) pathway in gastric cancer: preclinical and clinical aspects. Crit Rev Oncol Hematol. 2015;93:18-27. [PubMed] [DOI] |
| 30. | Griffiths EA, Pritchard SA, Valentine HR, Whitchelo N, Bishop PW, Ebert MP, Price PM, Welch IM, West CM. Hypoxia-inducible factor-1alpha expression in the gastric carcinogenesis sequence and its prognostic role in gastric and gastro-oesophageal adenocarcinomas. Br J Cancer. 2007;96:95-103. [PubMed] [DOI] |