修回日期: 2017-11-10
接受日期: 2017-11-18
在线出版日期: 2017-12-28
肝再生增强因子(augmenter of liver regeneration, ALR)又名肝刺激物质或肝细胞生成素, 广泛表达于全身各组织器官, 尤其是在肝细胞中. 近年来不断有研究证实, ALR具有强大的促进肝脏再生和受损肝脏细胞增殖的功能, 在肝细胞移植、重型肝炎的发病、肝脏的再生和肝癌发生发展中发挥重要作用.
核心提要: 肝再生增强因子具有强大的促进肝细胞增殖功能, 在肝脏的再生和肝癌发生发展中发挥重要作用. 且他有别于目前已知的肝再生相关因子, 肝细胞生长因子、转化生长因子α、表皮生长因子等作用靶细胞的广泛性, 他是肝细胞特异的.
引文著录: 张超, 安威. 肝再生增强因子研究进展. 世界华人消化杂志 2017; 25(36): 3171-3179
Revised: November 10, 2017
Accepted: November 18, 2017
Published online: December 28, 2017
Augmenter of liver regeneration (ALR), also known as hepatic stimulatory substance or hepatopoietin, is expressed ubiquitously in all organs, and exclusively in hepatocytes in the liver. Over the past decade, research indicates that ALR is able to promote growth of hepatocytes in the regenerating or injured liver, and plays an important role in hepatocyte transplantation, the pathogenesis of fulminant hepatitis, liver regeneration, and the development of hepatocellular carcinoma.
- Citation: Zhang C, An W. Progress in research of augmenter of liver regeneration. Shijie Huaren Xiaohua Zazhi 2017; 25(36): 3171-3179
- URL: https://www.wjgnet.com/1009-3079/full/v25/i36/3171.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i36.3171
肝再生增强因子(augmenter of liver regeneration, ALR)是肝细胞的生存因子, 他存在于线粒体、胞浆、内质网以及胞核之中, 与酵母菌的存活能力必需基因1(essential for respiratory and viability 1, EERV1)蛋白质具有高度同源性[1-3]. 线粒体中ALR可能参与细胞氧化磷酸化过程, 具有巯基氧化酶和细胞色素C还原酶的作用, 并促进Fe/S蛋白的成熟. ALR由肝细胞分泌, 在枯否细胞中通过G-蛋白耦联的受体刺激肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素(interleukin, IL)-6和一氧化氮(nitric oxide, NO)的合成. 有报道ALR具有与转化生长因子(transforming growth factor, TGF)-α和肝细胞生长因子(hepatocyte growth factor, HGF)均等甚至更强的刺激肝脏细胞分裂的能力[4]. 在某些病理条件下, 血清ALR水平会发生改变, 因而他可能在诊断某些肝脏损伤或疾病中发挥重要作用. 尽管ALR呈现出多种功能, 但对其在各个器官中作用的认识, 包括在肝脏中, 都严重不足, 未来应该更深入地研究这个神秘分子的表达和功能. 本文将从以下几个方面总结现阶段对ALR的研究进展.
肝刺激因子(hepatic stimulator substance, HSS)为LaBrecque于1975年自初断乳大鼠肝脏及部分切除后的再生肝细胞中首次分离得到, 由于其具有特异性刺激肝细胞增殖的特点, 故谓之肝刺激因子[5]. 随后研究表明, 该因子广泛地存在于哺乳动物胚胎、幼仔及再生的肝组织中. HSS刺激肝再生具有明显的器官特异性, 而无种属特异性. 后来发现, HSS只对处于增殖状态的肝脏(如再生肝)具有刺激作用, 对静止期肝细胞(如原代肝细胞)无刺激能力. 然而, 当与表皮生长因子(epidermal growth factor, EGF)(或HGF)等生长因子合用时, HSS可使这些因子促肝细胞增殖的活力大大增加, 因此, 人们又将HSS称作ALR[6]. 1996年, 从人胎肝cDNA文库中筛选出的人肝再生增强因子(human aurmenter of liver regeneration, hALR)与随后克隆得到的hALR编码区cDNA具有99%以上的同源性.
同时, 在酵母细胞中克隆出一种与线粒体呼吸链氧化磷酸化及细胞分裂周期调节有关的基因, 其编码产物是酵母细胞呼吸与存活所必不可少的, 故而称其为酵母细胞呼吸与EERV1, 最终从核苷酸结构和功能上证实人细胞中也存在ERV1基因, 且与人ALR是同一种基因[3]. 随后, 在人第16号染色体上的多囊肾疾病1基因区克隆到人的ERV1基因, 并分别证实酵母和人的ERV1基因都能互补酵母菌株的ERV1基因突变, 提示人ERV1与酵母ERV1基因从功能上是高度保守的基因. 后续工作又在酵母中确定了另一个基因ERV2, 在羧基端与ERV1有30%的同源性[7].
大鼠ALR的cDNA最早被克隆得到, 其全长1.2 kb, 由299 bp的5'非翻译区(5' untranslated region, 5'UTR), 375 bp的编码区(coding sequence, CDS)和550 bp的3'非翻译区(3' untranslated region, 3'UTR)3部分组成. 1996年, 以大鼠ALR cDNA为探针, 首次获得了人ALR的cDNA. 人ALR cDNA全长1.5 kb以上, 编码区与大鼠ALR的cDNA有87%的同源性. 对比人和大鼠ALR基因组DNA的结构可以发现, ALR基因在进化过程中是高度保守的, 其编码基因区都包含有3个外显子和2个内含子, 并且3个外显子长度相同, 只有2个内含子长度有所不同. 人ALR定位于16号染色体, 第一外显子为5'-UTR和CDS前18 bp, 第二外显子长198 bp, 第三外显子为其余CDS和3'-UTR. 人ALR及同源蛋白质间的氨基酸残基如图1所示.
375 bp的CDS编码125个氨基酸(分子量约15 kDa), 但动物体内提纯的天然ALR分子量约30 kDa, ERV1/ALR蛋白家族的C末端有保守的CXXC(Cys-X-X-Cys)功能序列, 可通过C30和C33形成稳定的等二聚体形式而存在. 进一步研究发现ALR基因还存在一个包含198-205个氨基酸的转录本, 其在125个氨基酸的基础上加上一段额外的线粒体导入序列, 分子量约22-23 kDa, 主要位于线粒体中[4], 但这段信号序列的加工机制目前尚不清楚. ALR基因不同种属间的比较如表1所示.
| 项目 | 人ALR | 大鼠ALR | 小鼠ALR | 酵母ERV1 |
| 基因组定位 | 16号染色体 | 10号染色体 | 17号染色体 | 7号染色体 |
| 基因家族 | ERV1/ALR家族 | ERV1/ALR家族 | ERV1/ALR家族 | ERV1/ALR家族 |
| 肽链长度 | 198-205aa(23 kDa) 125aa(15 kDa) | 125aa(15 kDa) | 198aa | 189aa(22 kDa) |
| 蛋白亚基 | 同源或异源二聚体 | 同源二聚体 | 同源二聚体 | 同源二聚体 |
| 蛋白质功能 | 肝再生及精子发生 | 肝再生及精子发生 | 肝再生及精子发生 | 线粒体生成及细胞生长 |
| 与人同源性比较 | - | 核酸水平85.87% 蛋白质水平85.6% | 核酸水平85.6% 蛋白质水平87.2% | 核酸水平52.85% 蛋白质水平46.85% |
| 亚细胞定位 | 细胞核(15 kDa) 细胞质(23 kDa) 线粒体膜间隙(23 kDa) | 胞质及线粒体膜间隙 | 线粒体膜间隙 | 胞质及线粒体膜间隙 |
ALR在各种组织器官中分布广泛, ALR mRNA在大鼠和小鼠的心、脑、脾、肺、骨骼肌、肾、肝和睾丸中均有表达, ALR在睾丸中的表达量最高, 肝脏次之. ALR仅存在于肝细胞中, 且在肝脏的所有区域中均匀存在. ALR和ERV1存在于线粒体的膜间隙, 也位于胞浆和胞核中, ERV2存在内质网中. 不同于ERV1仅仅是一个细胞内蛋白质, ALR可由肝细胞组成性地分泌到血清中. 尽管ALR在肝细胞中表达丰富, ERV1在酵母中的表达却非常低. 结构上的差异和定位的不同可能与ALR、ERV1和ERV2蛋白质的不同功能有关[8,9].
ALR也被发现于大脑的各个区域, 在神经元中与神经胶质纤维蛋白(glial fibrillary acidic protein, GFAP)共定位, 尤其出现在细胞核与线粒体的外膜. 有报道在肾腺癌、囊性肾小管上皮细胞和大脑有人类ALR同系物mRNA低水平的表达. 在非肝器官中ALR特殊的细胞和亚细胞定位及其功能特征仍有待确定.
酵母中ALR的同源蛋白ERV1对线粒体的生物起源、线粒体的正常形态和线粒体稳定性的保护至关重要, 表明ALR可能是一个具有关键生理重要性的蛋白质. 既然酵母ERV1基因与线粒体氧化磷酸化有关, 作为人类细胞中的ALR是否也具有同样功能? 将ALR注入到成年大鼠腹腔和肝脏, 检测与线粒体发生相关的两个不同基因: 线粒体腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)酶和线粒体烟酰胺腺嘌呤二核苷酸脱氢酶亚基1基因的表达水平, 同时观察线粒体转录因子A(mitochondrial transcription factorA, TFAM或mTFA)的表达情况, 同时评估肝脏诱导产生的线粒体氧化磷酸化能力和细胞色素含量. 结果显示, ALR可诱导肝线粒体TFAM的转录和翻译, 使线粒体基因表达增加, 同时还能促进线粒体氧化磷酸化酶的合成, 提高和维持线粒体的功能, 增强由肝脏诱导的线粒体氧化磷酸化的能力和细胞色素含量[10,11]. 同时, 线粒体转录因子A可能通过调控线粒体通透性转换, 终止部分肝切引发的肝再生过程.
ALR和ERV1存在于线粒体的膜间隙发挥功能. 在单倍体菌株中破坏ERV1基因可致线粒体基因组完整丧失、线粒体内膜发生变化、细胞分裂周期阻滞, 几个复制周期后酵母菌死亡. 破坏ERV1基因后酵母菌推迟死亡的一个原因可能是由于ERV1蛋白质和mRNA在体内的高稳定性, 尽管ERV1的初始表达水平很低. 相比于ERV1基因突变后酵母菌死亡前几天的一段滞后期, 使用ALR-mRNA的反义寡核苷酸(antisense oligonucleotides of ALR-mRNA, ALR-AS)抑制ALR的合成则引起肝细胞快速的(数小时内)凋亡或者坏死. 在转染ALR-AS的细胞中亚细胞组分检测显示, 线粒体ALR强烈地损耗, ATP的损耗紧随其后, 这些结果表明ALR进出线粒体的高速动态运动的可能性[12].
Schaefer-Ramadan等[13]发现在属于巯基氧化酶(QSOX)的Q6蛋白质的氨基末端存在ALR/ERV1同源基序, 硫氧还原蛋白是QSOX羧基末端的另一个蛋白质基序. 这些发现提示ALR/ERV1可能发挥巯基氧化酶的作用. 事实上, ERV1和ERV2以及纯化的ALR已被发现包含FAD耦联的巯基氧化酶活性[8]. 这些蛋白质的晶体结构显示在羧基端有一个富含螺旋的结构, 有FAD的结合位点和一个保守的近端CxxC基序, 包含核心巯基氧化酶活性. ALR是一种FAD依赖性巯基氧化酶, 由两条单链(体)聚合而成等大二聚体. 每个单体呈圆锥形, 在圆锥的入口处与FAD结合, 形成了ALR/ERV家族特有的螺旋束-FAD结合域. FAD作为氧化还原反应的电子传递体, 呈伸展的构象. 值得一提的是, ALR单链的C端有一段保守的CxxC序列(C62-C65), 可与辅基FAD结合. 如将C62或C65突变为S62或S65, 则ALR的活性完全丧失[14]. ALR和ERV1均属于相对较弱的巯基氧化酶类, 或许ALR和ERV1是作为特定细胞器的专门巯基氧化酶在发挥作用[15,16]. ALR相关的巯基氧化酶活性的功能方面最近在斑马鱼肝脏器官形成中被报道. 使用siRNA技术干扰ALR的表达后, 斑马鱼肝脏的生长受到抑制, 而且这种抑制作用可能被ALR过表达所逆转, 但若使用的突变ALR缺乏巯基氧化酶活性则只能部分逆转[17].
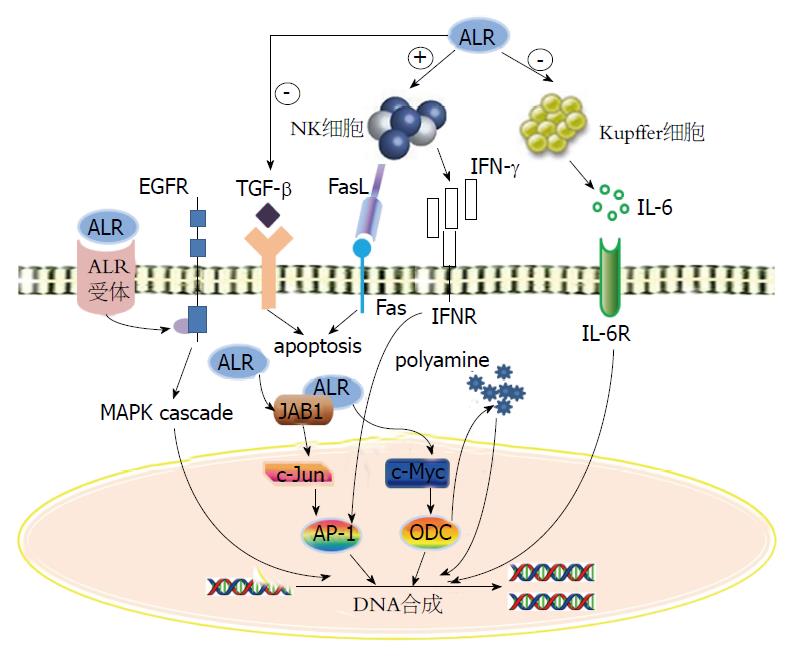
不论胞内还是胞外的ALR均可发挥其促进细胞分裂/增殖的作用, 但他们通过的信号转导途径却不尽相同. 胞内的ALR在c-Jun激活区结合蛋白1(jun activation domain-binding protein 1, JAB1)介导下, 通过一种非c-Jun氨基末端激酶依赖的途径促进c-Jun基因磷酸化, 从而激活AP-1的活性, 以非促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)的途径发挥其促进肝细胞增殖的作用[18]. 胞内ALR与JAB1结合, 依赖于ALR自身的巯基氧化酶活性提高JAB1磷酸化的能力, 从而增强AP-1的转录活性, 这种作用与MAPK途径无关. ALR与JAB1的结合作用可能还与硫氧还蛋白有关, 而硫氧还蛋白是已知的参与AP-1和核因子-κB(nuclear factor κB, NF-κB)活性调控的蛋白. 因此, ALR可能通过硫氧还蛋白发挥增强AP-1和NF-κB活性的作用[19].
胞外ALR可能通过诱导MAPK级联反应和表皮生长因子受体(epithelial growth factor receptor, EGFR)的磷酸化来促进肝细胞DNA合成, 发挥其刺激肝细胞增殖及促进肝脏再生的作用[20]. 存在于肝细胞表面的ALR受体、EGF受体可能在这一过程中均发挥了作用. 以往研究表明, 抑制EGFR的蛋白激酶活性后, 即可抑制ALR的促有丝分裂作用, 这说明ALR发挥促肝细胞增殖的作用是通过诱导EGFR的酪氨酸磷酸化来发挥的. 同时, 将EGF与EGFR结合的位点阻断后发现, 其并未影响ALR引起的酪氨酸磷酸化, 由此可推测ALR与EGFR的结合可能具有配体独立性. ALR还可抑制EGF诱导的受体下调, 同时诱导EGFR的表达, 促进EGF与其受体结合, 而EGFR的酪氨酸磷酸化可以增强MAPK途径的信号转导, 从而诱导肝细胞增殖[21,22].
ALR在肝脏再生中的重要作用机制可能是他通过影响免疫系统的细胞、浸润炎性细胞和巨噬细胞来预防肝细胞的损伤. 正常肝脏中的肝细胞可以抵抗自然杀伤细胞(natural killer cell, NK)的损害效应, 而在再生肝细胞中则高度敏感. 因此, 肝再生时肝脏内贮存的NK可轻度损害肝细胞, 造成增殖停滞. 而ALR可抑制肝脏NK的溶菌活性, 从而解除NK对再生肝细胞的损害作用, 使得肝脏再生得以持续. 此外, 临床研究发现血清中ALR的含量与外周血NK细胞的活性呈负相关, 且ALR对NK细胞的抑制效果与HGF和胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)类似[23]. 研究发现, 在动物体内外观察到ALR明显抑制肝内NK细胞杀伤力, 而对于脾脏和外周血的NK细胞则没有明显作用, 由此可见, ALR对肝脏NK细胞的作用是特异性的. 在对各型急性肝病患者外周血NK细胞活性和血清ALR水平研究后发现, 相较于非肝病对照组, 急性肝病患者血清ALR水平显著升高, 且与外周血NK细胞活性呈负相关, 由此可以推测当肝损伤时, 产生和释放ALR增多, 抑制肝NK细胞对再生肝细胞的细胞毒性, 从而保证肝细胞再生[24].
ALR能抑制NK细胞产生IL-γ, 而干扰素-γ(interferon-γ, IFN-γ)对线粒体转录因子A的表达具有明显地调控作用, 故而ALR还可能通过抑制NK细胞产生IFN-γ来诱导肝线粒体基因表达上调[25].
肝脏再生的速度、能力以及结局是体内其他任何实质器官所无法比拟的. 实验表明, 切除大鼠2/3的肝脏, 术后7 d肝脏体积即可完全恢复. 将大鼠肝脏组织切除2/3后12 h, 肝细胞中ALR的mRNA表达水平增加, 24 h后大鼠肝脏组织中DNA合成达到高峰, ALR的表达增加早于肝细胞的DNA合成高峰, 这提示ALR可能是一种重要的肝再生刺激因子[26]. 但不同于HGF和TGF-α等启动肝再生的生长因子, HGF和TGF-α分别于肝切除术后1-2 h和4 h表达即开始增加[27,28], ALR mRNA表达增加相对较迟. 由此推测, ALR属于肝再生的刺激因子, 但并不是肝再生的启动因子. 在原代培养的肝细胞中, ALR可刺激肝细胞DNA合成, 并具有一定的剂量-效应关系. 其刺激作用低于同剂量的TGF-α, 但略强于EGF, 表明ALR在肝脏再生时是一种重要的再生调节因子.
ALR不仅能够促进肝细胞增殖和肝再生, 还可以保护肝细胞免于细胞凋亡, 在多种肝脏疾病和肝损伤中发挥保护作用. 许多研究表明, ALR能够保护肝脏免受各种类型的毒素的伤害, 如四氯化碳(carbon tetrachloride, CCl4)、d-氨基半乳糖、乙醇、H2O2等. 有研究报道, ALR能明显提高CCl4诱导的急性肝损伤小鼠的存活率; 外源给予ALR可以减轻细菌脂多糖和d-氨基半乳糖联合应用引起的急性爆发性肝炎的损伤; CCl4诱导的大鼠肝纤维化过程中, ALR能够显著降低血清谷草转氨酶、谷丙转氨酶、乳酸脱氢酶和细胞外基质水平及肝纤维化程度. 同样的, 运用siRNA技术抑制内源性ALR的表达, 可降低肝细胞的生存能力及对自由基的抵抗力, 提示ALR可能是细胞存活因子[29]. 而外源性给予ALR可以使小鼠免受肝衰竭打击, 显著减轻硫代乙酰胺诱导的肝纤维化, 并抑制肝硬化的发生, 这意味着其在临床应用中的潜在作用[30]. 这些均表明在各种原因引起的肝损伤及其修复过程中, ALR都发挥着重要作用, 这一作用可能与其促进肝脏再生有关[31]. 而且在原代培养的肝细胞和肝癌细胞系中发现, ALR能够显著降低由乙醇、TRAIL、TGF-β及放线菌素D等所诱导的凋亡. 但在支气管(BC1)、结肠(SW480)、胃(GC1)和胰腺(L3.6PL)等非肝源的癌细胞株中却没有发现类似的作用[32], 所以推测ALR对肝脏的保护作用可能是特异性的.
体外培养的大鼠肝脏细胞中聚胺在生长因子诱导DNA合成中发挥重要作用. 多胺可提高大鼠肝移植后的存活率, 是肝再生过程中所必需的. 体外培养的肝脏细胞DNA合成与体内肝脏再生时, HGF和EGF也能促进聚胺和腐胺的表达水平. 因此推测, ALR促进肝再生可能是通过提高聚胺的水平来实现的. ALR被发现可以增加c-Myc的表达和鸟甘酸脱羧酶及S-腺苷甲硫氨酸脱羧酶的活性, 这些都参与到聚胺的合成. 有多组报道[33-35]HGF、TNF-α、EGF、IL-1和IL-6等能激活NF-κB和c-Myc信号转导通路, 也能直接充当促进肝脏再生的启动因子, 抑制细胞色素P-450. 在人肝细胞中ALR下调细胞色素P-450, 这可能是ALR在肝再生过程中的另一个作用机制. 总之, 我们可以推定ALR可能通过影响聚胺、NF-κB、c-Myc和细胞色素P450来维持细胞增殖及肝脏的再生.
大鼠部分肝切除术后肝脏中的ALR立即释放, 释放的ALR可能刺激非实质细胞产生刺激肝再生的因子. 研究发现, ALR通过一个霍乱毒素敏感的G蛋白耦联的高亲和力受体的介导, 刺激Kupffer细胞释放TNF-α和IL-6, 及通过增加NO合酶的表达来释放NO. 肝再生因子受制于Kupffer细胞, 抑制肝细胞DNA的合成, 而当DNA合成受限时ALR的存在可以逆转抑制效应. 这些现象可以说明, ALR能够阻止或抑制Kupffer细胞释放肝细胞抑制因子. 部分肝切除后, 体内的ALR促进肝再生很有可能是刺激TNF-α、IL-6和NO等的释放, 同时又抑制Kupffer细胞释放抗有丝分裂剂. 可以推测外源给予ALR可以在实验的爆发性肝衰竭和肝硬化中保护性作用是通过他对非实质细胞抑或肝细胞的作用.
肝星状细胞(hepatic stellate cell, HSC)在肝纤维化的发生发展过程中发挥了重要作用. HSC不仅是细胞外基质(extracellular matrix, ECM)的主要细胞来源, 同时也是参与ECM降解代谢的基质金属蛋白酶及其组织抑制因子(tissue inhibitor of matrix metalloproteinases, TIMPs)的主要细胞来源. ALR可通过抑制HSC的Ⅰ/Ⅲ型胶原的基因表达来发挥其抗肝纤维化活性. ALR可促进MMP13基因表达, 抑制TIMP1的表达, 而MMP13是大鼠纤维化逆转的主要因素, 可见ALR的抗肝纤维化活性是其对ECM合成与降解代谢综合作用的结果[36,37]. 图2中把ALR对肝脏细胞及信号通路等进行了概括描述.
有研究[38]表明, 将ALR表达质粒转染入肝癌细胞Bel-7402中, 可明显增强其对抗H2O2所引起的细胞凋亡的能力. 体外培养的HepG2细胞中, 利用siRNA技术降低ALR的表达和单克隆抗体阻断ALR的作用后, 细胞的生长明显受到抑制, 且能够明显抑制裸鼠异种移植瘤的生长[39]. ALR还具有抑制肝癌细胞迁移和侵袭的作用, 研究发现利用siRNA技术干扰ALR的表达, 阻断其发挥作用后, 肝癌细胞的迁移受到明显抑制[37]. 在HepG2细胞中稳定转染ALR基因, 与对照组细胞相比, ALR过表达可增加上皮细胞标志物的表达, 使基质金属蛋白酶-1(matrix metallopeptidase 9, MMP-1)和MMP-3的表达和活性降低, 由此推测细胞内ALR可能作为一个抗肿瘤细胞上皮-间质转化和转移的蛋白, 发挥降低肝癌细胞迁移的作用.
在肝脏特异性敲除(ALR-L-KO)的小鼠实验中发现, ALR是肝脏中维持线粒体功能和脂肪稳态所必需的, ALR-L-KO的小鼠较之正常小鼠发展为脂肪性肝炎和肝癌的速度明显加快[40,41]. 研究[42]指出, ALR在提高肝癌细胞HepG2自噬水平上也发挥了重要作用, 当自噬作用被抑制时, ALR的保护作用明显减弱或者消失, 所以ALR在HepG2中的抗凋亡作用一定程度上可能是增加了细胞自噬活性. 在乙型肝炎病毒(hepatitis B virus, HBV)相关的慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)中, 血清中ALR的水平是肝细胞增殖和肝脏再生的指示物, 如果在ACLF的早期, 血清中ALR的水平较高, 则预示良好的预后[43].
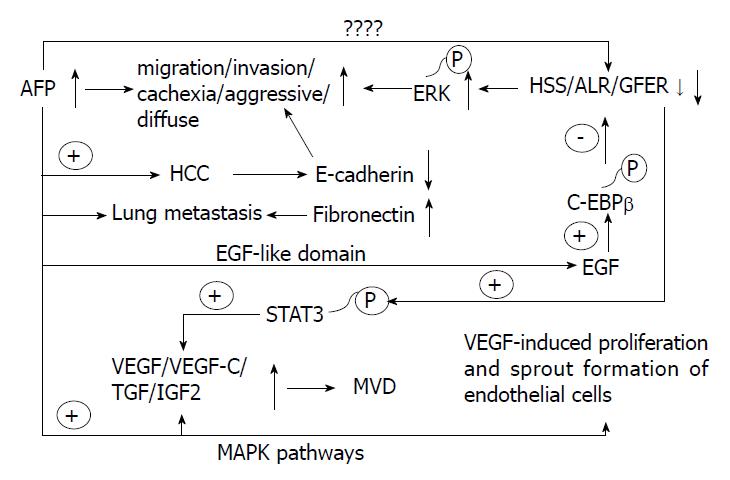
HBV的长期慢性感染可以导致肝癌的发生, 这也正是我国80%以上肝癌的发病原因. 临床诊断肝癌的肿瘤标志物甲胎蛋白(alpha-feroprotein, AFP)近年来被发现具有信号分子的作用, 他的表达和HBV的感染具有相关性, 可协同促进肝癌的进程. 那么ALR在发挥保护作用和AFP发挥促进作用之间又是否存在联系呢, 如果找到两者之间的联系或许可为肝癌的治疗提供新的线索. 肝癌患者中ALR低表达水平可以激活细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)通路, 致肝癌更易发生转移, 而AFP的表达也可以激活与迁移、侵袭及扩散等相关的ERK通路[22]; AFP抑制E钙黏蛋白的表达, 而ALR促进其表达[44,45]; EGF能够促进CCAAT/enhancer-binding protein β的磷酸化, 进而抑制ALR的表达[45], 又发现在AFP的结构中也存在一个EFG-like domain, 那么AFP是否能作用于ALR则需要进一步研究; 不仅如此, AFP还可以促进血管内皮生长因子、TGF和IGF等的表达, 而ALR被抑制后可以促进Stat3的磷酸化[46], 同样可以促进上述因子的表达, 这些的共同结果均导致肿瘤微血管密度的增加, 为肿瘤的迁移和侵袭准备了必要条件. 在肝癌的发生发展过程中ALR和AFP究竟是否存在直接或间接相互作用, 则需要进一步研究, ALR与AFP之间的联系如图3.
ALR是一个"披着面纱"的蛋白质, 尽管他被发现有40年历史, 克隆其基因也有20年, 但其功能特征和潜在机制仍不完全清楚. 起初他被定义为一个肝再生增强因子并且认为只存在于增生的肝脏, 现在我们知道ALR以多种形式广泛存在于真核细胞各种细胞器和细胞外, 这表明他可能具有独特的、重要的生理功能. 肝脏是人体内少有的能够进行快速再生的器官之一. 肝部分切除、多种肝炎病毒的感染以及各种不同的化学药物也可导致肝脏的损伤, 从而触发肝细胞的再生过程. 因此, 作为一种器官、组织再生的合适模型, 肝脏损伤与再生的分子生物学机制一直是人们研究的热点课题之一. 有研究称ALR具有与HGF和TGF-α均等的刺激DNA合成的能力, 这个重要的观察引出了一个问题, 即ALR促有丝分裂的性质是否可以作为肝脏受损条件下刺激肝再生的潜在治疗方法被发掘. 我国是乙型肝炎病毒高发的大国, 仅携带者的数量就将近1亿, 这其中每年又有人发展为慢乙型肝炎、肝硬化和肝癌. 每年的新发肝癌病例超过60多万, 发病率居恶性肿瘤第5位, 而且发病率有逐年上升趋势, 肝癌病程短、进展快、治疗难、易复发, 目前尚无有效治疗方法. 全球每年约有50-60万人死于肝癌, 在癌症的死亡原因中高居第3位, 因而了解肝细胞损伤与再生的分子生物学机制, 开发治疗肝损伤的药物, 具有十分重要的意义.
业已明确, ALR在维持肝细胞的生存能力上起着至关重要的作用, 然而在其他器官的细胞中是否执行类似的功能则有待探究. 尽管ALR蛋白表现出某些的酶活性(例如巯基氧化酶、Fe/S蛋白酶和细胞色素c还原酶等), 但这些酶活性与原型酶功能差异、作用特点、作用效果等存在诸多未知. 是否ALR作为特定蛋白质执行他的酶功时能具有高度选择性, 则鲜有报道. 这显然需要做进一步更深入的工作去理解和阐释ALR这一神秘蛋白的多种功能.
肝再生增强因子(augmenter of liver regeneration, ALR)能够特异性地促进肝细胞的增殖和肝脏再生, 是肝细胞的生存因子, 他广泛存在于线粒体、胞浆、内质网以及胞核之中. 已发现其能够发挥巯基氧化酶和细胞色素C还原酶的作用, 并促进Fe/S蛋白的成熟, 同时发现其在肝损伤或肝脏疾病中也发挥一定的生物学作用.
肝刺激因子(hepatic stimulator substance, HSS)能够保护肝脏免受各种类型的毒素的伤害; 增强细胞的生存能力及对对抗自由基的能力, 提示HSS可能是细胞存活因子; 可以保护小鼠不受肝衰竭的影响, 抑制肝纤维化、肝硬化的发生, 这意味着其在临床应用中的潜在作用.
本文尽可能详尽地收集ALR在氧化磷酸化、信号通路、免疫调节、肝脏实质细胞、非实质细胞及肝癌细胞中所发挥的生物学作用, 从众多篇文献中收集亮点和创新点, 所引用的参考文献都值得阅读.
本述评的创新点在于将ALR参与能量代谢、信号转导、免疫调节、对肝实质及非实质细胞, 以及肝癌等的相互作用联系起来, 发掘了ALR在肝损伤的治疗、肝癌的治疗和预防肿瘤转移中的作用以及临床应用前景.
实用价值即为临床预防肝损伤和促进肝再生提供了一种新的思考途径, 在现有治疗的基础上, 尝试利用ALR的作用, 可以达到更佳的治疗效果.
本文较全面系统地综述了ALR相关的研究进展, 有重要的学习和参考价值.
李瀚旻, 教授, 主任医师, 湖北中医药大学附属医院湖北省中医院
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | Giorda R, Hagiya M, Seki T, Shimonishi M, Sakai H, Michaelson J, Francavilla A, Starzl TE, Trucco M. Analysis of the structure and expression of the augmenter of liver regeneration (ALR) gene. Mol Med. 1996;2:97-108. [PubMed] |
| 2. | Hagiya M, Francavilla A, Polimeno L, Ihara I, Sakai H, Seki T, Shimonishi M, Porter KA, Starzl TE. Cloning and sequence analysis of the rat augmenter of liver regeneration (ALR) gene: expression of biologically active recombinant ALR and demonstration of tissue distribution. Proc Natl Acad Sci USA. 1994;91:8142-8146. [PubMed] [DOI] |
| 3. | Lisowsky T. Dual function of a new nuclear gene for oxidative phosphorylation and vegetative growth in yeast. Mol Gen Genet. 1992;232:58-64. [PubMed] [DOI] |
| 4. | Gandhi CR. Augmenter of liver regeneration. Fibrogenesis Tissue Repair. 2012;5:10. [PubMed] [DOI] |
| 5. | LaBrecque DR, Pesch LA. Preparation and partial characterization of hepatic regenerative stimulator substance (SS) from rat liver. J Physiol. 1975;248:273-284. [PubMed] [DOI] |
| 6. | Francavilla A, Hagiya M, Porter KA, Polimeno L, Ihara I, Starzl TE. Augmenter of liver regeneration: its place in the universe of hepatic growth factors. Hepatology. 1994;20:747-757. [PubMed] [DOI] |
| 7. | Wang W, Winther JR, Thorpe C. Erv2p: characterization of the redox behavior of a yeast sulfhydryl oxidase. Biochemistry. 2007;46:3246-3254. [PubMed] [DOI] |
| 8. | Lange H, Lisowsky T, Gerber J, Mühlenhoff U, Kispal G, Lill R. An essential function of the mitochondrial sulfhydryl oxidase Erv1p/ALR in the maturation of cytosolic Fe/S proteins. EMBO Rep. 2001;2:715-720. [PubMed] [DOI] |
| 9. | Liu Q, Yu HF, Sun H, Ma HF. Expression of human augmenter of liver regeneration in pichia pastoris yeast and its bioactivity in vitro. World J Gastroenterol. 2004;10:3188-3190. [PubMed] [DOI] |
| 10. | Han LH, Dong LY, Yu H, Sun GY, Wu Y, Gao J, Thasler W, An W. Deceleration of liver regeneration by knockdown of augmenter of liver regeneration gene is associated with impairment of mitochondrial DNA synthesis in mice. Am J Physiol Gastrointest Liver Physiol. 2015;309:G112-G122. [PubMed] [DOI] |
| 11. | Polimeno L, Capuano F, Marangi LC, Margiotta M, Lisowsky T, Ierardi E, Francavilla R, Francavilla A. The augmenter of liver regeneration induces mitochondrial gene expression in rat liver and enhances oxidative phosphorylation capacity of liver mitochondria. Dig Liver Dis. 2000;32:510-517. [PubMed] [DOI] |
| 12. | Thirunavukkarasu C, Wang LF, Harvey SA, Watkins SC, Chaillet JR, Prelich J, Starzl TE, Gandhi CR. Augmenter of liver regeneration: an important intracellular survival factor for hepatocytes. J Hepatol. 2008;48:578-588. [PubMed] [DOI] |
| 13. | Schaefer-Ramadan S, Gannon SA, Thorpe C. Human augmenter of liver regeneration: probing the catalytic mechanism of a flavin-dependent sulfhydryl oxidase. Biochemistry. 2013;52:8323-8332. [PubMed] [DOI] |
| 14. | Li W, Zhang J, An W. The conserved CXXC motif of hepatic stimulator substance is essential for its role in mitochondrial protection in H2O2-induced cell apoptosis. FEBS Lett. 2010;584:3929-3935. [PubMed] [DOI] |
| 15. | Hoober KL, Thorpe C. Flavin-dependent sulfhydryl oxidases in protein disulfide bond formation. Methods Enzymol. 2002;348:30-34. [PubMed] [DOI] |
| 16. | Lisowsky T, Lee JE, Polimeno L, Francavilla A, Hofhaus G. Mammalian augmenter of liver regeneration protein is a sulfhydryl oxidase. Dig Liver Dis. 2001;33:173-180. [PubMed] [DOI] |
| 17. | Li Y, Farooq M, Sheng D, Chandramouli C, Lan T, Mahajan NK, Kini RM, Hong Y, Lisowsky T, Ge R. Augmenter of liver regeneration (alr) promotes liver outgrowth during zebrafish hepatogenesis. PLoS One. 2012;7:e30835. [PubMed] [DOI] |
| 18. | Lu C, Li Y, Zhao Y, Xing G, Tang F, Wang Q, Sun Y, Wei H, Yang X, Wu C. Intracrine hepatopoietin potentiates AP-1 activity through JAB1 independent of MAPK pathway. FASEB J. 2002;16:90-92. [PubMed] [DOI] |
| 19. | Li Y, Liu W, Xing G, Tian C, Zhu Y, He F. Direct association of hepatopoietin with thioredoxin constitutes a redox signal transduction in activation of AP-1/NF-kappaB. Cell Signal. 2005;17:985-996. [PubMed] [DOI] |
| 20. | Li Y, Li M, Xing G, Hu Z, Wang Q, Dong C, Wei H, Fan G, Chen J, Yang X. Stimulation of the mitogen-activated protein kinase cascade and tyrosine phosphorylation of the epidermal growth factor receptor by hepatopoietin. J Biol Chem. 2000;275:37443-37447. [PubMed] [DOI] |
| 21. | Balogh T, Szarka A. ALR, the multifunctional protein. Orv Hetil. 2015;156:503-509. [PubMed] [DOI] |
| 22. | Yan R, Zhang L, Xia N, Liu Q, Sun H, Guo H. Knockdown of augmenter of liver regeneration in HK-2 cells inhibits inflammation response via the mitogen-activated protein kinase signaling pathway. Inflamm Res. 2015;64:453-462. [PubMed] [DOI] |
| 23. | Tanigawa K, Sakaida I, Masuhara M, Hagiya M, Okita K. Augmenter of liver regeneration (ALR) may promote liver regeneration by reducing natural killer (NK) cell activity in human liver diseases. J Gastroenterol. 2000;35:112-119. [PubMed] [DOI] |
| 24. | Vujanovic NL, Polimeno L, Azzarone A, Francavilla A, Chambers WH, Starzl TE, Herberman RB, Whiteside TL. Changes of liver-resident NK cells during liver regeneration in rats. J Immunol. 1995;154:6324-6338. [PubMed] |
| 25. | Polimeno L, Margiotta M, Marangi L, Lisowsky T, Azzarone A, Ierardi E, Frassanito MA, Francavilla R, Francavilla A. Molecular mechanisms of augmenter of liver regeneration as immunoregulator: its effect on interferon-gamma expression in rat liver. Dig Liver Dis. 2000;32:217-225. [PubMed] [DOI] |
| 26. | Fausto N. Protooncogenes and growth factors associated with normal and abnormal liver growth. Dig Dis Sci. 1991;36:653-658. [PubMed] [DOI] |
| 27. | Michalopoulos GK, Zarnegav R. Hepatocyte growth factor. Hepatology. 1992;15:149-155. [PubMed] [DOI] |
| 28. | Mead JE, Fausto N. Transforming growth factor alpha may be a physiological regulator of liver regeneration by means of an autocrine mechanism. Proc Natl Acad Sci USA. 1989;86:1558-1562. [PubMed] [DOI] |
| 29. | Jiang SJ, Li W, An W. Adenoviral gene transfer of hepatic stimulator substance confers resistance against hepatic ischemia-reperfusion injury by improving mitochondrial function. Hum Gene Ther. 2013;24:443-456. [PubMed] [DOI] |
| 30. | Gribilas G, Zarros A, Zira A, Giaginis C, Tsourouflis G, Liapi C, Spiliopoulou C, Theocharis SE. Involvement of hepatic stimulator substance in experimentally induced fibrosis and cirrhosis in the rat. Dig Dis Sci. 2009;54:2367-2376. [PubMed] [DOI] |
| 31. | Song M, Yi X, Chen W, Yuan Y, Zhang X, Li J, Tong M, Liu G, You S, Kong X. Augmenter of liver regeneration (ALR) gene therapy attenuates CCl4-induced liver injury and fibrosis in rats. Biochem Biophys Res Commun. 2011;415:152-156. [PubMed] [DOI] |
| 32. | Ilowski M, Kleespies A, de Toni EN, Donabauer B, Jauch KW, Hengstler JG, Thasler WE. Augmenter of liver regeneration (ALR) protects human hepatocytes against apoptosis. Biochem Biophys Res Commun. 2011;404:148-152. [PubMed] [DOI] |
| 33. | Jover R, Bort R, Gómez-Lechón MJ, Castell JV. Down-regulation of human CYP3A4 by the inflammatory signal interleukin-6: molecular mechanism and transcription factors involved. FASEB J. 2002;16:1799-1801. [PubMed] [DOI] |
| 34. | Levitchi M, Fradette C, Bleau AM, Michaud D, Kourylko O, Arcand M, du Souich P. Signal transduction pathways implicated in the decrease in CYP1A1, 1A2 and 3A6 activity produced by serum from rabbits and humans with an inflammatory reaction. Biochem Pharmacol. 2004;68:573-582. [PubMed] [DOI] |
| 35. | Tinel M, Berson A, Elkahwaji J, Cresteil T, Beaune P, Pessayre D. Downregulation of cytochromes P450 in growth-stimulated rat hepatocytes: role of c-Myc induction and impaired C/EBP binding to DNA. J Hepatol. 2003;39:171-178. [PubMed] [DOI] |
| 36. | Sun B, Zhang X, Cheng X, Zhang Y, Chen L, Shi L, Liu Z, Qian H, Wu M, Yin Z. Intratumoral hepatic stellate cells as a poor prognostic marker and a new treatment target for hepatocellular carcinoma. PLoS One. 2013;8:e80212. [PubMed] [DOI] |
| 37. | Dayoub R, Wagner H, Bataille F, Stöltzing O, Spruss T, Buechler C, Schlitt HJ, Weiss TS. Liver regeneration associated protein (ALR) exhibits antimetastatic potential in hepatocellular carcinoma. Mol Med. 2011;17:221-228. [PubMed] [DOI] |
| 38. | Wu Y, Chen L, Yu H, Liu H, An W. Transfection of hepatic stimulator substance gene desensitizes hepatoma cells to H2O2-induced cell apoptosis via preservation of mitochondria. Arch Biochem Biophys. 2007;464:48-56. [PubMed] [DOI] |
| 39. | Tang L, Sun H, Zhang L, Deng JC, Guo H, Zhang L, Liu Q. Effects of the augmenter of liver regeneration on the biological behavior of hepatocellular carcinoma. Saudi Med J. 2009;30:1001-1009. [PubMed] |
| 40. | Gandhi CR, Chaillet JR, Nalesnik MA, Kumar S, Dangi A, Demetris AJ, Ferrell R, Wu T, Divanovic S, Stankeiwicz T. Liver-specific deletion of augmenter of liver regeneration accelerates development of steatohepatitis and hepatocellular carcinoma in mice. Gastroenterology. 2015;148:379-391.e4. [PubMed] [DOI] |
| 41. | Maehara Y, Fernandez-Checa JC. Augmenter of liver regeneration links mitochondrial function to steatohepatitis and hepatocellular carcinoma. Gastroenterology. 2015;148:285-288. [PubMed] [DOI] |
| 42. | Shi HB, Sun HQ, Shi HL, Ren F, Chen Y, Chen DX, Lou JL, Duan ZP. Autophagy in anti-apoptotic effect of augmenter of liver regeneration in HepG2 cells. World J Gastroenterol. 2015;21:5250-5258. [PubMed] [DOI] |
| 43. | Hongbo S, Yu C, Ming K, Honglin S, Ping HY, Ping DZ. Augmenter of liver regeneration may be a candidate for prognosis of HBV related acute-on-chronic liver failure as a regenerative marker. Hepatogastroenterology. 2012;59:1933-1938. [PubMed] [DOI] |
| 44. | Guo C, Liu QG, Yang W, Zhang ZL, Yao YM. Relation among p130Cas, E-cadherin and beta-catenin expression, clinicopathologic significance and prognosis in human hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2008;7:490-496. [PubMed] |
| 45. | Zhang H, Dong LY, Sun G, An W. Downregulation of hepatic stimulator substance during the early phase of liver regeneration inhibits E-cadherin expression in mice. Int J Biochem Cell Biol. 2014;47:38-46. [PubMed] [DOI] |
| 46. | Sun GY, Dong LY, An W. Involvement of hepatic stimulator substance in the regulation of hepatoblast maturation into hepatocytes in vitro. Stem Cells Dev. 2014;23:1675-1687. [PubMed] [DOI] |