修回日期: 2017-09-27
接受日期: 2017-10-08
在线出版日期: 2017-11-18
探讨联合检测血清miR-21/miR-24表达水平与DNA定量分析对良恶性腹腔积液鉴别的临床意义及价值.
收集岳阳市二人民医院2016-01/2016-10收治的腹腔积液患者58例, 其中恶性腹腔积液患者27例, 良性腹腔积液患者31例. qPCR检测血清miR-21/miR-24表达水平, DNA图像定量分析技术测定腹水DNA含量. 应用多因素Logistic回归分析, 绘制受试者工作特征曲线并计算曲线下面积(area under curve, AUC)来评价血清miR-21/miR-24、DNA定量分析、常规脱落细胞学检测及其联合检测在腹腔积液鉴别诊断的意义.
恶性腹腔积液患者血清miR-21/miR-24的相对表达水平显著高于良性腹腔积液患者(P<0.05). 多因素Logistic回归分析显示, 常规脱落细胞学、DNA定量分析以及血清miR-21/miR-24均是鉴别良恶性腹腔积液的敏感指标, 且常规脱落细胞学、血清miR-21/miR-24均与DNA定量分析正相关(P<0.05). 常规脱落细胞学和DNA定量分析的AUC分别为0.766、0.857, 二者联合诊断AUC为0.873(P<0.001). 血清miR-21、miR-24的AUC分别为0.857、0.866, 血清miR-21联合miR-24的AUC为0.890(P<0.001). 而血清miR-21或miR-24联合DNA定量分析的AUC分别增至0.910、0.932. 此外, 血清miR-21/miR-24在DNA定量分析阳性患者中表达水平均高于DNA定量分析阴性患者(P<0.05).
恶性腹腔积液患者血清miR-21/miR-24的相对表达水平明显高于良性患者, 联合血清miR-21/miR-24与DNA定量分析检测能够显著提高良恶性腹腔积液的鉴别价值, 弥补常规诊断的不足.
核心提要: 细胞学及DNA定量分析检测是目前诊断恶性腹腔积液的推广方法, 血清miRNAs是恶性肿瘤诊断的潜在生物标志物. 本文发现恶性腹水患者血清miR-21/-24的相对表达水平明显升高, 联合血清miR-21/-24与DNA定量分析能够显著提高良恶性腹水的鉴别价值.
引文著录: 刘崇梅, 张雪纯, 余飞跃, 黄柳炎, 高亚. 血清miR-21/miR-24表达及联合DNA定量分析对良恶性腹腔积液鉴别的临床价值. 世界华人消化杂志 2017; 25(32): 2888-2895
Revised: September 27, 2017
Accepted: October 8, 2017
Published online: November 18, 2017
To assess the clinical value of serum miR-21/miR-24 detection combined with quantitative analysis of DNA content in the differential diagnosis of benign and malignant ascites.
A total of 58 patients with ascites treated at Yueyang Second People's Hospital from January to October 2016 were included. These cases were divided into either a malignant ascites group (27 cases) or a benign ascites group (31 cases). Serum miR-21/miR-24 levels were quantified by real-time quantitative polymerase chain reaction. DNA content in ascites was determined by quantitative analysis. The receiver operating characteristic (ROC) curves were plotted to calculate the area under the ROC curve (AUC) to evaluate the significance of each index or their combination in the differential diagnosis of benign and malignant ascites.
The relative expression of serum miR-21/miR-24 in malignant ascites patients was significantly higher than those in benign ascites patients (P < 0.05). Multivariate Logistic regression analysis showed that conventional cytology, DNA quantitative analysis, and serum miR-21/miR-24 were sensitive indicators for the differential diagnosis of benign and malignant ascites. Conventional cytology and serum miR-21/miR-24 were positively correlated with DNA quantitative analysis (P < 0.05). The AUCs of conventional cytology, DNA quantitative analysis, and their combination were 0.766, 0.857, and 0.873, respectively (P < 0.001). The AUCs of serum miR-21, serum miR-24, and their combination were 0.857, 0.866, and 0.890, respectively (P < 0.001). Notably, the AUC was significantly increased to 0.910 (or 0.932) when DNA quantitative analysis was combined with serum miR-21 (or miR-24). The expression of serum miR-21and miR-24 was significantly higher in DNA positive patients than in DNA negative patients.
The relative expression of serum miR-21/miR-24 is significantly increased in malignant ascites patients. Combined determination of serum miR-21/miR-24 and DNA quantitative analysis can improve the effectiveness of differential diagnosis of benign and malignant ascites.
- Citation: Liu CM, Zhang XC, Yu FY, Huang LY, Gao Y. Clinical value of serum miR-21/miR-24 detection combined with quantitative analysis of DNA content in differential diagnosis of benign and malignant ascites. Shijie Huaren Xiaohua Zazhi 2017; 25(32): 2888-2895
- URL: https://www.wjgnet.com/1009-3079/full/v25/i32/2888.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i32.2888
腹腔积液根据其产生的性质可分为良性和恶性腹腔积液, 恶性腹腔积液常见于晚期或转移性肿瘤患者, 良性腹腔积液常见于心、肝、肾功能不全的患者等. 临床上鉴别良恶性腹腔积液常用细胞形态学检查, 但诊断阳性率低, 灵敏度和特异度均未能达到理想要求[1]. 微小RNA(microRNA, miRNA)s是一类由19-22个核苷酸组成的单链非编码内源性微小RNA, 他们广泛存在于各种真核生物中, 主要通过与靶点mRNAs结合抑制其翻译或启动降解发挥其重要调控功能[2]. 目前大量研究[3]表明, 血清miRNAs与肿瘤关系密切, 且部分miRNAs(如miR-21、miR-24等[4])在良性与恶性胸腹腔积液之间存在差异表达, 具有潜在的鉴别诊断价值. 此外, DNA含量改变也与肿瘤密切相关, 恶性肿瘤常表现为DNA非整倍增多, 可以通过检测细胞核内DNA结构和含量来鉴别正常细胞周期变化及发生恶性克隆增殖的癌细胞, 因此DNA含量的测定也可以用于良恶性腹腔积液的诊断[5,6]. 本研究以良性和恶性腹腔积液患者为研究对象, 测定血清miR-21/miR-24的相对表达水平, 并与DNA定量分析、常规脱落细胞学进行比较, 进一步分析miR-21/miR-24联合DNA定量分析对良恶性腹腔积液鉴别的临床意义, 为临床诊断提供理论依据.
入选岳阳市二人民医院2016-01/2016-10腹腔积液患者58例, 男性33例, 女性25例, 平均年龄55.38岁±10.86岁. 恶性腹腔积液组(实验组)27例, 其中肠癌14例, 胃癌5例、肝细胞肝癌5例、胆管囊腺癌2例、胰腺导管腺癌1例; 良性腹水组(对照组)31例, 其中结核性腹腔积液8例、非炎性腹腔积液19例、非结核性炎性腹腔积液4例; 收集患者血清标本和腹水标本.
1.2.1 纳入与排除标准: 纳入标准: 实验组: (1)由腹部B超或计算机断层扫描(computed tomography, CT)证实患者存在中等量以上腹腔积液; (2)由组织病理学确诊为恶性; (3)未行特殊治疗, 如全身或腹腔局部放疗、化疗、免疫抑制剂等特殊治疗. 对照组: (1)由腹部B超或CT证实患者存在中等量以上腹腔积液; (2) 经组织病理学、细胞学、影像学、血液学及其他相关检查未发现恶性肿瘤相关病变; (3)无恶性肿瘤病史. 排除标准: (1)腹腔积液病因复杂未明确; (2)患者临床病史及诊疗资料不全者; (3)不愿意配合诊疗者; (4)其他不可抗因素导致实验中断者.
1.2.2 标本处理: 腹水标本: 所有研究对象常规腹部B超定位后行诊断性穿刺术, 腹水抽出后3000 r/min离心3 min, 弃置上清, 留取底部沉渣, 常规行脱落细胞学及DNA定量分析. 血清标本: 入院第2天采集清晨空腹静脉血4 mL置于EDTA抗凝管, 12000 r/min离心10 min, 转移血清至新离心管中再离心5 min以完全去除血细胞, 将血清转移至无RNA酶的EP管中, -80 ℃储存.
1.2.3 常规脱落细胞学: 将离心后的腹水细胞沉渣混匀, 滴1-2滴沉渣液均匀涂抹于玻片上, 固定30 min后进行HE染色, 中性树胶封固. 由岳阳市二人民医院2位资深病理医师阅片诊断.
1.2.4 DNA定量分析: 将混匀后的腹水细胞沉渣滴1-2滴到玻片上, 均匀涂抹, 自然风干后行Feulgon染色. 制备好的玻片由麦克奥迪公司的专业技术人员操控全自动DNA图像分析仪进行扫描处理. 依据细胞DNA指数≥2.5考虑为DNA倍体异常细胞, 结果分为以下3种情况: (1)未见明显DNA倍体异常细胞; (2)可见1-2个DNA倍体异常细胞; (3)可见≥3个DNA倍体异常细胞, 诊断为恶性. 本研究默认(1)和(2)为DNA定量分析检测结果阴性, (3)为DNA定量分析检测结果阳性.
1.2.5 实时荧光定量PCR: 用Gene Copoeia公司的游离miRNA提取试剂盒提取总RNA, 逆转录, 荧光定量PCR测定miR-21/miR-24. 扩增程序: 预变性95 ℃ 10 min循环1次; 变性95 ℃ 10 s、退火60 ℃ 20 s、延伸72 ℃ 10 s, 循环40次. 引物序列: miR-21: 5'-TAGCTTATCAGACTGATGTTGA-3', miR-24: 5'-TGGCTCAGTTCAGCAGGAACAG-3'; 内参U6 RNA: 5'-GCTTCGGCAGCACATATACTAAAAT-3'. 结果采用2-△△Ct法, 标准化的Ct值: △△Ct = (Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)参照组, 计算miR-21、miR-24的相对表达水平.
统计学处理 采用SPSS18.0进行统计分析. 计量资料采用mean±SD表示. 组间资料比较采用独立样本t检验, 两组独立样本非参数采用Mann-whitney U检验, 组间计数资料采用χ2检验. 相关性研究分类变量采用Spearman相关分析, 连续变量采用Pearson相关分析. 采用逐步条件法建立Logistic回归模型作多因素回归分析, 并绘制受试者工作特征(receiver operating characteristic, ROC)曲线评价各个指标和联合指标的诊断价值, 计算ROC曲线下面积(area under curve, AUC)、95%近似参考置信区间(95%CI). P<0.05为差异有统计学意义.
恶性腹腔积液患者血清miR-21/miR-24表达水平均高于良性腹腔积液患者, 且差异倍数均超过了2倍(P<0.05, 表1).
| microRNA | 实验组 | 对照组 | 实验组/对照组(倍) | P值 |
| 血清miR-21 | 4.21±2.27 | 1.58±1.59 | 3.43±1.36 | 0.008 |
| 血清miR-24 | 3.07±2.10 | 0.91±1.09 | 3.97±1.52 | 0.012 |
2.2.1 组间资料单因素分析与逐步条件Logistic回归分析: 对两组研究对象的组间资料进行单因素分析, 发现两组患者常规脱落细胞学阳性率、DNA定量分析阳性率以及血清miR-21/miR-24表达水平比较, 差异具有统计学意义(P<0.001, 表2). 根据单因素分析结果, 采用逐步条件法建立Logistic回归方程, 因变量为分组, 自变量为单因素存在显著性差异的变量, 设置变量进入水准为0.05, 删除水准为0.10. 常规脱落细胞学、DNA定量分析、血清miR-21/miR-24进入最终回归模型, 均为诊断恶性腹腔积液的危险因素(表3).
| 变量 | 实验组 | 对照组 | t/χ2值 | P值 |
| 常规脱落细胞学阳性 n (%) | 17 (62.96) | 3 (9.68) | 5.048 | 0.000 |
| DNA定量分析阳性 n (%) | 21 (77.78) | 2 (4.45) | 7.930 | 0.000 |
| 血清miR-21 | 4.21±2.27 | 1.58±1.59 | 5.897 | 0.000 |
| 血清miR-24 | 3.07±2.10 | 0.91±1.09 | 4.919 | 0.000 |
| 变量 | b值 | SE | Wald | OR值 | P值 |
| 常规脱落细胞学 | 0.352 | 0.142 | 4.404 | 1.304 | 0.036 |
| DNA定量分析 | 2.759 | 0.963 | 7.059 | 11.925 | 0.008 |
| 血清miR-21 | 0.549 | 0.227 | 5.879 | 1.732 | 0.015 |
| 血清miR-24 | 0.899 | 0.350 | 6.600 | 2.458 | 0.010 |
2.2.2 各指标相关性: 分类变量采用Spearman相关分析, 连续变量采用Pearson相关分析, 发现常规脱落细胞学与DNA定量分析、血清miR-21与DNA定量分析、血清miR-24与DNA定量分析以及血清miR-21与血清miR-24在恶性腹腔积液诊断中的相关系数分别为0.672、0.643、0.655、0.688, 均呈正相关, 差异具有统计学意义(P<0.001).
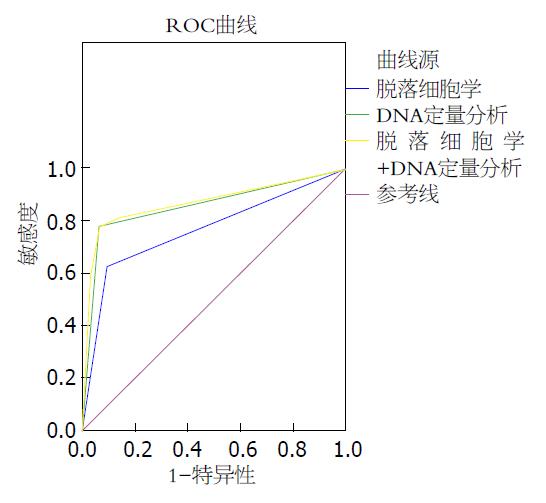
2.3.1 常规脱落细胞学与DNA定量分析的诊断价值: 常规脱落细胞学和DNA定量分析敏感性分别为62.96%(17/27)和80.77%(21/26)(P<0.05); 特异性分别为90.32%(28/31)和93.55%(29/31)(P<0.05); 正确诊断率分别为53.28%和74.32%(P<0.05); 阴性预测值分别为73.68%和85.29%; 阳性预测值分别为85%和91.3%(P<0.05), 差异均具有统计学意义(表4). 常规脱落学与DNA定量分析的AUC分别为0.766(95%CI: 0.638-0.895, P<0.001)和0.857(95%CI: 0.750-0.963, P<0.001), 两者联合的AUC为0.873(95%CI: 0.750-0.963, P<0.001, 图1).
| 组织病理学诊断 | 脱落细胞学 | DNA定量分析 | ||
| + | - | + | - | |
| + | 17 | 10 | 21 | 6 |
| - | 3 | 28 | 2 | 29 |
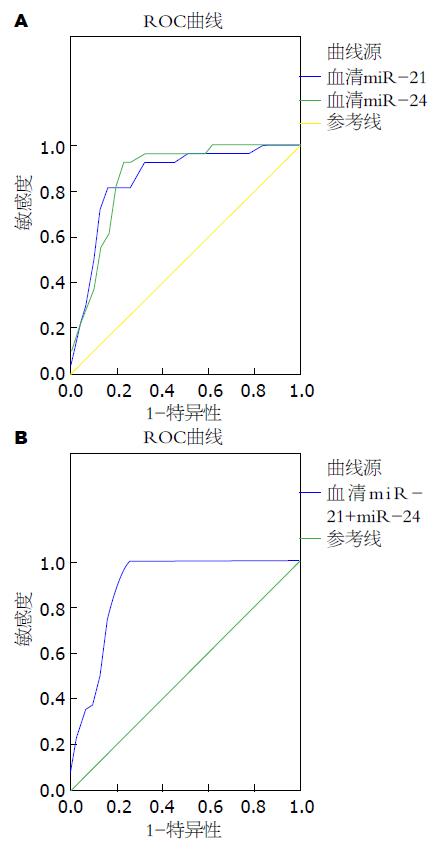
2.3.2 血清miR-21与miR-24的诊断价值: 血清miR-21与miR-24的AUC分别为0.857(95%CI: 0.754-0.959, P<0.001)和0.866(95%CI: 0.768-0.963, P<0.001). 联合两组腹腔积液患者的血清miR-21与 miR-24的相对表达水平的AUC为0.890(95%CI: 0.801-0.979, P<0.001, 图2).
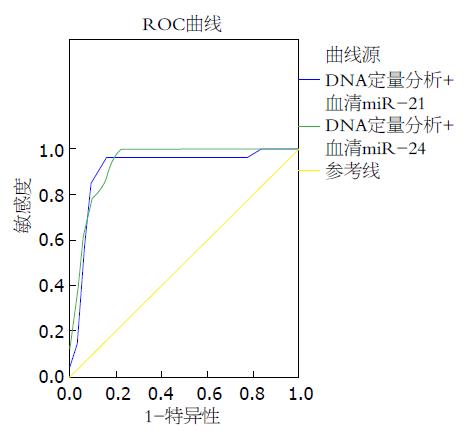
2.3.3 DNA定量分析联合血清miR-21/miR-24的诊断价值: DNA定量分析联合血清miR-21的AUC为0.910(95%CI: 0.819-1.000, P<0.001). DNA定量分析联合血清miR-24的AUC为0.936(95%CI: 0.871-1.000, P<0.001, 图3). 此外, 血清miR-21/miR-24在DNA定量分析阳性患者中表达水平均高于DNA定量分析阴性患者, 采用Mann-whitney U检验表达有显著差异(P<0.05, 表5).
| 血清miRNAs | DNA定量分析阳性组 | DNA定量分析阴性组 | P值 |
| miR-21 | 4.54±2.32 | 1.67±1.51 | 0.037 |
| miR-24 | 3.34±2.20 | 0.98±1.01 | 0.005 |
良恶性腹腔积液的鉴别诊断一直是临床需要解决的一道难题, 细胞学检测是目前诊断恶性腹腔积液的标准方法之一, 其敏感性在50%-70%之间, 特异性在80%-100%之间[1,7], 由于阳性率低, 易漏诊, 这种情况导致各研究者们不断寻求有效的方法补充细胞学检测, 特别是那些高灵敏度和高特异度的诊断方法.
miRNAs是一类具有调控功能的非编码小RNA, 研究发现有大量细胞内表达的miRNAs也能在血清中检测到, 恶性肿瘤患者体内部分血清miRNAs存在表达异常, 血清miRNAs被认为是恶性肿瘤诊断的潜在生物标志物[8]. 血清miR-21、miR-24是一类在人体组织和细胞中较早发现、广泛存在且目前研究较多的miRNAs, 近年来研究显示血清miR-21、miR-24在多种类型的人类肿瘤中过度表达, 如肝癌[9,10]、胃癌[11-13]、结直肠癌[14,15]、肺癌[16,17]等. 本研究发现恶性腹腔积液患者体内血清miR-21和血清miR-24的表达均明显高于良性腹腔积液患者, 我们推测血清miR-21/miR-24在良恶性腹腔积液的鉴别上具有潜在价值.
DNA含量与细胞群的增生能力和增殖速度密切相关, 在细胞恶变的过程中, 染色体的畸变常表现非整倍体增多, DNA含量增加[18]. 目前临床上常用的检测DNA含量的技术为DNA定量分析技术, 他是早期恶性肿瘤诊断的一项新兴技术, 其敏感性和特异性均不低于80%[5]. 本研究通过组间资料单因素分析发现良性腹腔积液组和恶性腹腔积液组在常规脱落细胞学、DNA定量分析以及血清miR-21/miR-24表达水平方面有显著差异. 建立多因素Logtisc回归模型后, 发现该四项均为诊断恶性腹腔积液的独立敏感因素, 其中DNA定量分析检测为最危险因素, 其次为血清miR-24、miR-21关联强度一般, 常规脱落细胞学关联强度弱. 指标间相关性分析发现, 血清miR-21与miR-24相关性最大, 这可能与miR-21和miR-24能受到同一转录因子调控有关[19].
脱落细胞学检查是临床上用来鉴别良恶性腹腔积液的标准方法, DNA定量分析检测是目前临床广泛推广的方法[20]. 本研究运用脱落细胞学和DNA定量分析对比比较得出, 常规脱落细胞学在敏感性、特异性和正确诊断率上明显低于DNA定量分析, 但由于脱落细胞学价格低廉, 操作简便, 在细胞形态上瘤细胞异型性明显, 目前仍是鉴别良恶性腹腔积液临床最常运用的方法. 而将这两种方法相联合后, 可以显著提高对恶性腹腔积液的诊断准确性.
目前大量研究[4,21]报道miRNAs有望成为新一代肿瘤检测生物标志物. 肿瘤标志物一般有以下特点, 含量变化应与肿瘤的发生、进展、消退、转移有着一定的比例关系; 具有较高的特异性和灵敏性; 检测方法简单易行, 成本低[22]. 本研究通过对血清miR-21和miR-24的相对表达水平分别进行ROC曲线分析, 发现两者的AUC分别为0.857、0.858. 而血清miR-21、miR-24二者联合的AUC为0.890. 依照ROC曲线结果评判标准, 二者联合准确度中等偏高, 具有很高的诊断价值. DNA定量分析可检测到在细胞发生恶变的过程中, DNA出现含量的改变比形态学要早, 因此DNA定量分析能更早检测到癌前病变, 且具有一定的客观性, 诊断准确度中等偏高. 本研究通过对两组患者DNA含量与血清miR-21/miR-24表达进行检测, 并运用ROC曲线分析, 发现DNA定量分析联合血清miR-21或miR-24的AUC分别增至0.910、0.936, 依照ROC曲线结果评判标准, 两者诊断价值均较高, 其价值要高于脱落细胞学联合DNA定量分析、血清miR-21联合miR-24. 此外本研究还发现血清miR-21/miR-24在DNA定量分析阳性患者中表达水平均要明显高于DNA定量分析阴性患者.
总之, 血清miR-21、miR-24的相对表达水平明显高于良性患者, 可作为潜在的鉴别良恶性腹腔积液的分子生物学指标. DNA定量分析联合血清miR-21/miR-24能显著提高鉴别良恶性腹腔积液的效能.
良恶性腹腔积液的鉴别一直受到临床研究者们的关注, 微小RNA(microRNA, miRNA)s和DNA含量改变均与肿瘤关系密切, 对良恶性腹腔积液的鉴别诊断具有重要价值.
良恶性腹腔积液的鉴别对疾病的诊断、治疗及预后均有很大的影响, 目前鉴别良恶性腹腔积液常用细胞形态学检查, 但诊断阳性率低, 易漏诊. 分子生物学相关实验技术的发展, 为诊断提供了更多检测指标和方法, 但目前尚未发现种敏感性和特异性均优的检测指标, 使得多种指标联合测定成为了研究热点.
目前研究者们发现循环miRNAs在一些恶性肿瘤中存在差异性表达, 因此可以利用这一特征来对恶性肿瘤进行鉴别诊断. 循环miR-21与循环miR-24在大部分恶性肿瘤中过度表达, 并且胸腹腔积液miR-21、miR-24在良恶性胸腹腔积液组中表达存在差异, 而利用循环miRNAs对腹腔积液患者进行诊断在国内外报道研究罕见.
本研究采用qPCR测定血清miR-21/miR-24的相对表达水平, 并运用DNA定量分析技术测定腹水细胞DNA含量, 探讨miR-21/miR-24联合DNA定量分析对良恶性腹腔积液鉴别的临床意义, 为提高临床诊断效能提供理论依据.
通过测定血清miR-21/miR-24的相对表达水平, 并与DNA定量分析、常规脱落细胞学进行比较, 研究miR-21/miR-24与DNA定量分析联合检测在良恶性腹腔积液鉴别的作用, 为良性和恶性腹腔积液鉴别提供新思路、 新方法, 也为临床恶性肿瘤做出早期诊断提供了参考依据.
miRNA: 是一类内源性非编码微小RNA, 广泛存在于自然界各种动、植物的真核细胞中, 在进化中高度稳定保守, 成熟的miRNA能与靶mRNA的3'UTR结合, 在转录后水平对靶基因表达进行负性调控. miRNA参与了凋亡、增殖、分化、转移、血管生成及免疫等多种生理过程, 对人体多种生命活动有重要意义.
曹邦伟, 教授, 主任医师, 首都医科大学附属北京友谊医院; 鞠少卿, 教授, 南通大学附属医院检验医学中心, 南通大学附属医院外科综合实验室; 刘树业, 主任技师, 天津市第三中心医院医学检验中心
本文具有一定的科学性、创新性, 对目前良恶性腹腔积液的鉴别有进一步的临床价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Jung M, Pützer S, Gevensleben H, Meller S, Kristiansen G, Dietrich D. Diagnostic and prognostic value of SHOX2 and SEPT9 DNA methylation and cytology in benign, paramalignant, and malignant ascites. Clin Epigenetics. 2016;8:24. [PubMed] [DOI] |
| 2. | Abreu FB, Liu X, Tsongalis GJ. miRNA analysis in pancreatic cancer: the Dartmouth experience. Clin Chem Lab Med. 2017;55:755-762. [PubMed] [DOI] |
| 3. | Rupaimoole R, Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat Rev Drug Discov. 2017;16:203-222. [PubMed] [DOI] |
| 4. | Xie L, Chen X, Wang L, Qian X, Wang T, Wei J, Yu L, Ding Y, Zhang C, Liu B. Cell-free miRNAs may indicate diagnosis and docetaxel sensitivity of tumor cells in malignant effusions. BMC Cancer. 2010;10:591. [PubMed] [DOI] |
| 5. | Zhang W, Tong Q, Wang X, Wang Q, Li S. T lymphocyte subsets determination and DNA ploidy analysis in the differential diagnosis between benign and malignant ascites. Cancer Invest. 2009;27:67-69. [PubMed] [DOI] |
| 6. | Bisht B, Handa U, Mohan H, Lehl SS. Complementary value of DNA flow cytometry and image morphometry in detection of malignant cells in effusion fluids. Malays J Pathol. 2014;36:83-90. [PubMed] |
| 7. | Liu F, Kong X, Dou Q, Ye J, Xu D, Shang H, Xu K, Song Y. Evaluation of tumor markers for the differential diagnosis of benign and malignant ascites. Ann Hepatol. 2014;13:357-363. [PubMed] |
| 8. | Wu HH, Lin WC, Tsai KW. Advances in molecular biomarkers for gastric cancer: miRNAs as emerging novel cancer markers. Expert Rev Mol Med. 2014;16:e1. [PubMed] [DOI] |
| 9. | Meng XZ, Zheng TS, Chen X, Wang JB, Zhang WH, Pan SH, Jiang HC, Liu LX. microRNA expression alteration after arsenic trioxide treatment in HepG-2 cells. J Gastroenterol Hepatol. 2011;26:186-193. [PubMed] [DOI] |
| 10. | Ma Y, She XG, Ming YZ, Wan QQ. miR-24 promotes the proliferation and invasion of HCC cells by targeting SOX7. Tumour Biol. 2014;35:10731-10736. [PubMed] [DOI] |
| 11. | Tsukamoto Y, Nakada C, Noguchi T, Tanigawa M, Nguyen LT, Uchida T, Hijiya N, Matsuura K, Fujioka T, Seto M. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta. Cancer Res. 2010;70:2339-2349. [PubMed] [DOI] |
| 12. | Effatpanah H, Yadegarazari R, Karami M, Majlesi A, Shabab N, Saidijam M. Expression Analysis of mir-21 and mir-221 in Cancerous Tissues from Iranian Patients with Gastric Cancer. Iran Biomed J. 2015;19:188-193. [PubMed] |
| 13. | Zhang H, Duan J, Qu Y, Deng T, Liu R, Zhang L, Bai M, Li J, Ning T, Ge S. Onco-miR-24 regulates cell growth and apoptosis by targeting BCL2L11 in gastric cancer. Protein Cell. 2016;7:141-151. [PubMed] [DOI] |
| 14. | Mishra PJ, Song B, Mishra PJ, Wang Y, Humeniuk R, Banerjee D, Merlino G, Ju J, Bertino JR. MiR-24 tumor suppressor activity is regulated independent of p53 and through a target site polymorphism. PLoS One. 2009;4:e8445. [PubMed] [DOI] |
| 15. | Kerimis D, Kontos CK, Christodoulou S, Papadopoulos IN, Scorilas A. Elevated expression of miR-24-3p is a potentially adverse prognostic factor in colorectal adenocarcinoma. Clin Biochem. 2017;50:285-292. [PubMed] [DOI] |
| 16. | Franchina T, Amodeo V, Bronte G, Savio G, Ricciardi GR, Picciotto M, Russo A, Giordano A, Adamo V. Circulating miR-22, miR-24 and miR-34a as novel predictive biomarkers to pemetrexed-based chemotherapy in advanced non-small cell lung cancer. J Cell Physiol. 2014;229:97-99. [PubMed] [DOI] |
| 17. | Zhao W, Zhao JJ, Zhang L, Xu QF, Zhao YM, Shi XY, Xu AG. Serum miR-21 level: a potential diagnostic and prognostic biomarker for non-small cell lung cancer. Int J Clin Exp Med. 2015;8:14759-14763. [PubMed] |
| 19. | Schmeier S, MacPherson CR, Essack M, Kaur M, Schaefer U, Suzuki H, Hayashizaki Y, Bajic VB. Deciphering the transcriptional circuitry of microRNA genes expressed during human monocytic differentiation. BMC Genomics. 2009;10:595. [PubMed] [DOI] |
| 20. | Kentrou NA, Tsagarakis NJ, Tzanetou K, Damala M, Papadimitriou KA, Skoumi D, Stratigaki A, Anagnostopoulos NI, Malamou-Lada E, Athanassiadou P. An improved flow cytometric assay for detection and discrimination between malignant cells and atypical mesothelial cells, in serous cavity effusions. Cytometry B Clin Cytom. 2011;80:324-334. [PubMed] [DOI] |
| 21. | Wu X, Zhi X, Liu M, Xie J, Zhao S. Elevated levels of dendritic cell-correlated miRNAs in ascites and sera of patients with ovarian cancer. Xibao Yu Fenzi Mianyixue Zazhi. 2015;31:383-386. [PubMed] |
| 22. | Zhu FL, Ling AS, Wei Q, Ma J, Lu G. Tumor markers in serum and ascites in the diagnosis of benign and malignant ascites. Asian Pac J Cancer Prev. 2015;16:719-722. [PubMed] [DOI] |