修回日期: 2017-10-13
接受日期: 2017-10-17
在线出版日期: 2017-11-08
焦亡是一种caspase-1/4/5/11介导的程序性细胞死亡方式, 腺泡细胞死亡方式是急性胰腺炎(acute pancreatitis, AP)早期最重要的病理学变化, 不同的死亡方式可影响AP病情发展. 目前大部分学者认为凋亡腺泡细胞比例增加可以减轻AP病情, 而坏死则相反. 我们前期实验中用电镜观察AP腺泡细胞的形态, 发现许多细胞非常符合焦亡特点, 免疫组织化学结果发现AP腺泡细胞存在caspase-1活化. 提示焦亡可能参与的炎症反应. 因此了解细胞焦亡的发生和调控, 分析和探讨AP腺泡细胞可能发生焦亡的机制及临床意义, 有助于为AP的临床诊治提供新思路. 但其深层机制仍需进一步实验证明.
核心提要: 在前期实验中用电镜观察急性胰腺炎(acute pancreatitis, AP)腺泡细胞的形态, 发现许多细胞非常符合焦亡特点, 免疫组织化学结果发现AP腺泡细胞存在caspase-1活化, 提示焦亡可能参与的炎症反应. 因此了解细胞焦亡的发生和调控, 分析和探讨AP腺泡细胞可能发生焦亡的机制及临床意义, 有助于为AP的临床诊治提供新思路.
引文著录: 金相任, 孙备, 白雪巍. 焦亡的研究进展及胰腺腺泡细胞焦亡的研究现状. 世界华人消化杂志 2017; 25(31): 2798-2804
Revised: October 13, 2017
Accepted: October 17, 2017
Published online: November 8, 2017
Pyroptosis is a kind of programmed cell death mediated by caspases-1/4/5/11. Pancreatic acinar cell death is the major pathophysiological change in early acute pancreatitis (AP), which is an important factor determining its progression and prognosis. Different ways of cell death affect AP progression differently. At present, most scholars believe that the increased proportion of apoptotic cells can mitigate AP, while necrosis has an opposite effect. In our early study, we used electron microscope to observe the morphology of acinar cells and found that there are many cells consistent with the characteristics of pyroptosis. The expression of caspase-1 was analyzed via immunohistochemical staining in acinar cells in AP, which suggests that pyroptosis may play a role in acinar cell death and inflammation. In this review, we review the recent findings regarding the occurrence and modulation of pyroptosis by caspase-1 and inflammsome, and in particular, discuss the potential mechanism and clinical significance of pyroptosis in AP, with an aim to provide new clues to the clinical diagnosis and therapy of this disease.
- Citation: Jin XR, Sun B, Bai XW. Progress in research of pyroptosis of pancreatic acinar cells. Shijie Huaren Xiaohua Zazhi 2017; 25(31): 2798-2804
- URL: https://www.wjgnet.com/1009-3079/full/v25/i31/2798.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i31.2798
急性胰腺炎(acute pancreatitis, AP)的发生发展及转归一直是外科领域研究的重点. AP病情凶险多变, 特别是重症急性胰腺炎(sever acute pancreatitis, SAP)病情危、急、重, 病死率高[1,2]. AP发病初期, 激活的胰酶、过量的氧自由基和促炎细胞因子使腺泡细胞发生损伤, 部分损伤的腺泡细胞在炎症介质(如肿瘤坏死因子α、血小板活化因子、一氧化氮等)及促炎性细胞的作用下胞膜破裂, 胞内容物及炎症因子释放, 细胞坏死, 加重了炎症反应; 部分细胞经线粒体途径或死亡受体途径发生凋亡, 使染色质聚集、DNA片段化降解, 细胞膜内陷形成凋亡小体, 无细胞内容物和炎症因子的外溢, 有助于减轻炎症反应. 腺泡细胞包含多种死亡方式: 凋亡、坏死、自噬和坏死性凋亡等[3-11]. 当腺泡细胞损伤以凋亡为主时, 临床表现为轻度水肿型胰腺炎, 病情较轻, 发展缓慢, 预后较好; 当腺泡细胞损伤以坏死为主时, 临床表现为出血坏死型胰腺炎, 病情危重, 发展迅速, 死亡率高. 因此腺泡细胞死亡方式一直是AP研究热点.
焦亡与凋亡同属基因调控下的细胞"主动"死亡方式, 二者形态特征相似, 但在炎症反应中的作用却截然相反, 因此, 明确炎症反应中细胞的死亡方式是焦亡还是凋亡, 关系到是抑炎还是促炎, 是维持机体免疫平衡、改善预后的重要环节. 以Gilad Doitsh团队[12]2014年发表在Nature的关于艾滋病的研究为例, 既往认为艾滋病病毒诱导的CD4+ T淋巴细胞死亡以凋亡为主, 但根据焦亡的定义重新研究发现, 凋亡细胞仅占全部死亡细胞的一小部分, 而在剩余的死亡细胞中促炎的焦亡细胞占到95%. 这一重要发现为艾滋病的治疗提供了新思路, 受此启发, 我们对AP腺泡细胞焦亡展开了初步研究.
早在1992年, Zychlinsky等[13]在研究弗氏志贺氏杆菌诱导巨噬细胞发生程序性死亡时即描述了焦亡现象, 但由于当时认识及实验条件不足, 将其归为"apoptosis". 1999年在沙门氏杆菌感染巨噬细胞的研究中也发现这种依赖caspase-1的细胞死亡方式的存在[14]. 随着研究的深入, 这种"细胞死亡方式"的差异性逐渐从诸多细胞凋亡机制研究中浮现, 并被多位学者证实, 2001年Cooksen等[15]首次将其定名为焦亡. 2002年Lee等[16]的研究认为caspase-11调控凋亡. 2012年Case等[17]认为caspase-11可以被军团菌激活并进一步调控巨噬细胞介导焦亡, 而此过程并无caspase-1的参与. 在2015年发现的Gasdermin D蛋白也被证实参与焦亡过程[18]. 关于焦亡的研究已经成为近年来国际炎症领域的研究热点, 在肝炎、神经系统疾病、血管性疾病、炎性肠病及艾滋病等多个领域陆续展开, 并取得显著的研究成果, 但国际上在AP焦亡领域的研究较少[19-23].
焦亡广泛存在于单核巨噬细胞和树突状细胞等其他细胞中, 诱导细胞焦亡的刺激源也不仅局限于弗氏志贺氏杆菌、沙门氏杆菌及绿脓杆菌等病原体, 损伤相关模式分子(danger/damage associated molecularpattern, DAMP)、缺血坏死的产物等非生物性的刺激源也可诱导细胞发生焦亡. 细胞焦亡早期, 细胞膜上形成许多直径为1-2 nm的微小孔隙, 其完整性丧失. 随后, 水分内流、细胞膜内外离子梯度消失, 细胞发生肿胀、渗透性溶解最终导致细胞破裂死亡[24]. 此外, 焦亡过程还伴有细胞核浓缩及染色体DNA的断裂、降解[25]. 因此, 焦亡细胞在形态学上同时表现出凋亡和坏死的特征.
Caspase家族是一组同源性高且结构十分相似的蛋白酶家族, 根据其结构和功能的不同, 可分为凋亡相关caspase和炎症相关caspase两大类[26,27]. 凋亡相关caspase以介导细胞凋亡的caspase-3为代表, 此外还包括caspase-2、caspase-6、caspase-8、caspase-9等; 炎症相关caspase主要包含caspase-1、caspase-4、caspase-5、caspase-11、caspase-12、caspase-13和caspase-14等, 参与介导细胞的炎症反应[25,28]. 研究[25,28]表明凋亡相关的caspase及其底物不参与细胞焦亡, 而细胞焦亡形成所依赖的caspase-1也不参与凋亡途径, 因此可用caspase-1标记的方法来区分细胞凋亡和焦亡. caspase-11激活后能引发一系列炎症反应[29,30]. 焦亡是由caspase-1、caspase-4、caspase-5和caspase-11介导的[25]在Man等[31]的研究中发现caspase-11也参与焦亡途径, 但此途径caspase-1与炎症小体并不参与.
Caspase-1又称白介素-1β(interleukin-1β, IL-1β)转化酶, 在细胞焦亡形成的过程中起决定性作用. 初合成的caspase-1前体不具活性, 包含CARD结构域以及分子量分别为20000和10000的大小亚基三个结构域, 其四聚体caspase-1为其活化形式[28]. Caspase-1主要功能之一是介导细胞焦亡. 研究[24,28]发现, caspase-1特异性阻滞剂可抑制焦亡细胞胞膜微孔的形成, 而正是这种微孔导致了细胞内外水电解质失衡、细胞肿胀胞膜破裂及炎症因子释放等一系列形态学改变, 进而引发反应. 细胞焦亡的DNA降解也与caspase-1相关, 具体机制尚不明确[24]. 此外, caspase-1还可将Pro-IL-1β、Pro-IL-18转化为具有促炎活性的IL-1β、IL-18, 分泌到细胞外, 后两者能募集并激活其他免疫细胞, 诱导合成炎症因子、黏附性因子和趋化因子等(IL-1β可诱导白细胞迁移、分泌细胞因子和趋化因子; IL-18诱导IFN-γ产生, 激活T淋巴细胞和巨噬细胞), 从而放大局部和全身炎症反应[32,33].
鼠源性caspase-11及人源性caspase-4和caspase-5是在固有免疫应答期间被TLR4和TLR3信号激活的细胞内受体蛋白酶. 也是焦亡非典型炎症小体通路的重要组成部分. Caspase-11由TLR3/TLR4-TRIF信号传导, 并直接结合革兰氏阴性细菌细胞壁的主要成分脂多糖(lipopolysaccharides, LPS), LPS引起的caspase-11的激活导致其他caspase的激活, 导致败血性休克、焦亡. 目前Man等[31]的研究说明caspase-11介导的焦亡不需炎症小体参与, caspase-11直接切割Gasdermin D进而介导焦亡. Pro-caspase-11(caspase-11的无活性前体)的表达和caspase-11介导的焦亡需要TRIF的活化[34]. 已经提出焦亡通过将感染焦斑细胞的细胞溶质细胞暴露于细胞外免疫防御(包括其他免疫细胞, 如嗜中性粒细胞)来提供免疫防御. 虽然caspase-11介导的焦亡提供防御病原体, 但也显示也会对宿主造成损害[15].
复合物炎症小体(inflammasomes)是存在于细胞胞浆内的一种高分子量蛋白复合物, 2002年由Martinon等[35]首次提出. 他包含NOD样受体(NOD-like receptors, NLRs)、凋亡相关点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)和无活性的caspase-1前体等. NOD样受体是具有核苷酸结合寡聚化结构域的细胞内模式识别受体(pattern recognition receptors, PRRs), 广泛参与机体免疫应答和炎症反应. 根据NLRs中NOD结构域的不同, NLRs家族又可分为NODs、NLRPs和IPAF三大亚家族[36]. NLR分子合成后处于无活性状态, 其LRR结构域(leucine-rich receptors, LRRs)隐藏于分子内部, 阻碍效应结构域发挥作用.
当外界刺激作用于细胞时, 细胞通过PRRs识别病原体相关分子模式(pathogen-associated molecular patterns, PAMPs), 如LPS、细胞鞭毛、病毒等, 和危险相关分子模式(danger-associated molecular patterns, DAMPs), 如三磷酸腺苷(adenosine-triphosphate, ATP)、腺苷等, 将刺激信号向细胞内传递[37]. 细胞接受配体刺激后, LRR伸展与配体结合, 并暴露热蛋白结构域(pyrindomain, PYD), 通过PYD-PYD相互作用募集含有CARD的ASC并与其PYD结构域结合, ASC再通过CARD-CARD相互作用募集结合Pro-caspase-1, 至此NLR/ASC/Pro-caspase-1聚合完毕, 炎症小体形成[25,38,39].
需要指出的是, 作为链接NLRs和caspase-1的衔接分子, ASC并非炎症小体形成所必需, 少数炎症小体的合成不依赖ASC, 但ASC的参与可增强此类炎症小体的活性. 此外, 有研究指出体外条件下ASC可不依赖NLRs而自我聚集形成ASC二聚体, 继而激活ceaspase-1, 介导细胞发生焦亡, 即所谓的"焦亡小体(pyroptosome)", 其本质为ASC二聚体[40]. 另一种非NLRs家族成员AIM2(absent in melanoma 2)也含有PYD结构域, 可通过募集ASC及Pro-caspase-1组成AIM2炎症小体[41]. 炎症小体是细胞焦亡启动的关键靶点, 研究证实, 在炎症初始阶段, 细胞接受刺激信号启动后, 如果没有稳定的、高强度的炎症小体, 即使增加刺激信号, 焦亡也无法持续进行. 炎症小体可以将无活性的caspase-1裂解成具有活性的caspase-1, 后者为细胞焦亡的特异执行蛋白, 缺乏caspase-1, 细胞无法完成焦亡[33,42].
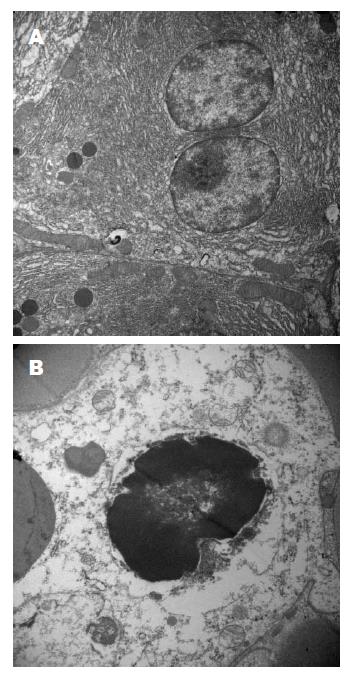
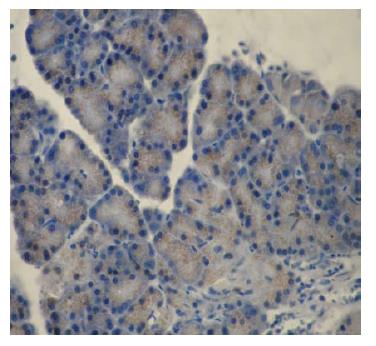
最新研究结果表明在传统的TUNEL染色阳性的凋亡细胞中"混有"一类可以促进炎症反应的焦亡细胞, 这种现象是否也存在AP中值得研究. 此前, 我们在大鼠AP模型的腺泡细胞中发现许多既伴随细胞核固缩又存在细胞破裂的特殊细胞, 查阅相关文献, 发现此类细胞的形态特征与焦亡特征十分相符(图1). 为初步验证这种"特殊"细胞是否为焦亡细胞, 我们以免疫组织化学法检测AP胰腺标本中的caspase-1, 结果显示caspase-1阳性, 证实了胰腺腺泡细胞中存在caspase-1活化(图2). 此外, 相关研究证实, 焦亡所依赖的caspase-1在AP炎症反应过程发挥了不可替代作用, caspase-1基因缺乏可减轻由雨蛙素诱导的AP大鼠炎症的严重程度[43,44]. 焦亡过程中caspase-1可使Pro-IL-1β转化为具有活性的IL-1β并释放到细胞外, 而野生型大鼠注射雨蛙素后其使Pro-IL-1βmRNA水平明显升高[44]; 另有研究证实SAP患者血清中IL-1含量显著高于正常人血清中IL-1的含量, 虽然该研究未能进一步标示IL-1α或IL-1β, 但由于人的IL-1α或IL-1β分子量十分接近, 此结果在一定程度上仍具有参考价值[4,16,45,46]. 因此, 无论从理论依据还是前期实验结果我们都有充足的理由相信AP炎症局部存在腺泡细胞焦亡.
Alegre等[47]对于肝脏纤维化的研究认为: 肝细胞受DAMPs, PAMPs刺激后激活核因子-κB, 进而激活NLRP3, 使得NLRP3-ASC焦亡小体装配成功, 进一步激活Pro-caspase-1, 启动肝细胞焦亡. Palacios-Macapagal等[48]在后续的研究中证实这一机制. Shi等[18]关于GSMD的研究认为. Pro-caspase-1对于GSDMD有切割作用, Pro-caspase-1被激活之后切割GSDMD, 进而启动细胞焦亡. Chang等[49]关于阿尔茨海默病的研究认为, 阿尔茨海默病病程中巨噬细胞的焦亡也是由于caspase-1活化所激活. Naji等[50]关于呼吸系统疾病的研究发现, 间充质干细胞移植能抑制NLRP3-ASC焦亡小体的装配, 进而阻止焦亡. 基于目前对焦亡的研究我们认为: AP时腺泡细胞发生损伤, 钙离子超载, ATP减少, 刺激NLRPx-ASC焦亡小体装配, 装配成功的NLRPx-ASC焦亡小体活化Pro-caspase-1进而切割Gasdermin D, 暴露N端, 从而启动腺泡细胞焦亡. Caspase-11则不需炎症小体参与, 直接切割Gasdermin D暴露N端启动焦亡. 此假说本课题组正在进一步实验验证.
尽管焦亡也能快速清除各种病原微生物, 限制细菌生长, 加强机体防御能力而对机体起到一定的保护作用, 但是, 腺泡细胞在发生焦亡的同时还释放了大量的炎性细胞因子如IL-1β、IL-18等, 后者可激活其他免疫细胞, 诱导其他炎症细胞浸润, 形成了发热、内毒素血症甚至感染性休克等病理过程产生的基础, 进而促进AP局部炎症反应及全身炎症反应的发展, 加重疾病严重程度, 提高死亡率. 而与焦亡在AP中的作用相反, 凋亡可能保护胰腺以避免发生进一步损伤. 发生焦亡与凋亡的腺泡比例的不同, 又可以引起不同的炎症反应发展趋势: 以凋亡为主时, 焦亡促炎的作用微弱, 炎症反应较轻; 以焦亡为主时, 炎症因子的链式反应难以抑制, 产生炎症反应恶化循环, 往往导致不良结局; 二者比例相近时, 则可能进入"僵持期". 因此, 将混淆在凋亡的腺泡细胞中的焦亡细胞区分出来并明确二者的比例, 在此基础上制定合理的、更具针对性的治疗方案, 有助于阻止AP向SAP发展, 减少病死率.
焦亡在炎症领域的重要性已日益凸显, 但国内外关于AP腺泡细胞焦亡的研究仍为空白. 根据初步试验及相关研究我们认为AP发生时腺泡细胞存在焦亡, 焦亡可加重AP炎症反应, 导致病情恶化. 如果能够了解其确切的调控机制, 不仅有助于AP的治疗, 还将为AP的后续基础研究提供理论基础和参考.
急性胰腺炎(acute pancreatitis, AP)腺泡细胞有多种死亡方式, 包括凋亡、坏死、自噬、坏死性凋亡, 而关于焦亡的研究极少, 因此本文对此展开了研究.
部分学者认为凋亡可以减轻炎症反应, 而坏死会加重炎症反应, 焦亡在炎症反应中也起到重要作用, 那么AP腺泡细胞是否存在焦亡, 焦亡的意义又是什么, 值得我们研究.
邵峰等在2015年发现Gasdermin D蛋白可以切割caspase-1, 进而启动焦亡. 2016年发现Gasdermin D蛋白也可以切割caspase-11启动焦亡.
本文重点综述焦亡的特点和细胞通路, 涉及作者部分关于腺泡细胞焦亡的实验结果. 关于腺泡细胞焦亡的实验结果是本文创新之处.
部分学者认为焦亡会加重炎症反应, AP属于炎症性疾病. 如果能研究焦亡在AP中的作用, 对于AP的抗炎治疗将有重要意义.
Caspases: 是近年来发现的一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶, 他们的一个重要共同点是活性位点都含有半胱氨酸, 并特异地断开天冬氨酸残基后的肽键, 包括caspase-1, 3, 4, 5, 9, 11, 12等.
陈光, 教授, 吉林大学第一医院消化器官外科; 夏时海, 教授, 主任医师, 武警后勤学院附属医院肝胆胰脾科(中心); 郑盛, 副教授, 副主任医师, 云南省第三人民医院消化内科
本文选择了目前关注较少的胰腺腺泡细胞焦亡作为研究切入点, 具备较好的原始创新性, 文章整体结构清晰, 用语规范, 可读性强, 使读者对细胞焦亡及胰腺腺泡细胞焦亡的可能机制均有较好的认识.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 黑龙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Liu Y, Chen XD, Yu J, Chi JL, Long FW, Yang HW, Chen KL, Lv ZY, Zhou B, Peng ZH. Deletion Of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-κB activity. Cell Death Dis. 2017;8:e2685. [PubMed] [DOI] |
| 2. | Thrower EC, Gorelick FS, Husain SZ. Molecular and cellular mechanisms of pancreatic injury. Curr Opin Gastroenterol. 2010;26:484-489. [PubMed] [DOI] |
| 3. | Ji L, Li L, Qu F, Zhang G, Wang Y, Bai X, Pan S, Xue D, Wang G, Sun B. Hydrogen sulphide exacerbates acute pancreatitis by over-activating autophagy via AMPK/mTOR pathway. J Cell Mol Med. 2016;20:2349-2361. [PubMed] [DOI] |
| 4. | Bai X, Song Z, Zhou Y, Pan S, Wang F, Guo Z, Jiang M, Wang G, Kong R, Sun B. The apoptosis of peripheral blood lymphocytes promoted by hyperbaric oxygen treatment contributes to attenuate the severity of early stage acute pancreatitis in rats. Apoptosis. 2014;19:58-75. [PubMed] [DOI] |
| 5. | Jorgensen I, Rayamajhi M, Miao EA. Programmed cell death as a defence against infection. Nat Rev Immunol. 2017;17:151-164. [PubMed] [DOI] |
| 6. | Fuchs Y, Steller H. Programmed cell death in animal development and disease. Cell. 2011;147:742-758. [PubMed] [DOI] |
| 7. | Taylor RC, Cullen SP, Martin SJ. Apoptosis: controlled demolition at the cellular level. Nat Rev Mol Cell Biol. 2008;9:231-241. [PubMed] [DOI] |
| 8. | Vanden Berghe T, Hassannia B, Vandenabeele P. An outline of necrosome triggers. Cell Mol Life Sci. 2016;73:2137-2152. [PubMed] [DOI] |
| 9. | Dillon CP, Tummers B, Baran K, Green DR. Developmental checkpoints guarded by regulated necrosis. Cell Mol Life Sci. 2016;73:2125-2136. [PubMed] [DOI] |
| 10. | Dondelinger Y, Darding M, Bertrand MJ, Walczak H. Poly-ubiquitination in TNFR1-mediated necroptosis. Cell Mol Life Sci. 2016;73:2165-2176. [PubMed] [DOI] |
| 11. | Jorgensen I, Miao EA. Pyroptotic cell death defends against intracellular pathogens. Immunol Rev. 2015;265:130-142. [PubMed] [DOI] |
| 12. | Doitsh G, Galloway NL, Geng X, Yang Z, Monroe KM, Zepeda O, Hunt PW, Hatano H, Sowinski S, Muñoz-Arias I. Cell death by pyroptosis drives CD4 T-cell depletion in HIV-1 infection. Nature. 2014;505:509-514. [PubMed] [DOI] |
| 13. | Zychlinsky A, Prevost MC, Sansonetti PJ. Shigella flexneri induces apoptosis in infected macrophages. Nature. 1992;358:167-169. [PubMed] [DOI] |
| 14. | Kepp O, Galluzzi L, Zitvogel L, Kroemer G. Pyroptosis - a cell death modality of its kind? Eur J Immunol. 2010;40:627-630. [PubMed] [DOI] |
| 15. | Cookson BT, Brennan MA. Pro-inflammatory programmed cell death. Trends Microbiol. 2001;9:113-114. [PubMed] [DOI] |
| 16. | Lee J, Hur J, Lee P, Kim JY, Cho N, Kim SY, Kim H, Lee MS, Suk K. Dual role of inflammatory stimuli in activation-induced cell death of mouse microglial cells. Initiation of two separate apoptotic pathways via induction of interferon regulatory factor-1 and caspase-11. J Biol Chem. 2001;276:32956-32965. [PubMed] [DOI] |
| 17. | Case CL, Kohler LJ, Lima JB, Strowig T, de Zoete MR, Flavell RA, Zamboni DS, Roy CR. Caspase-11 stimulates rapid flagellin-independent pyroptosis in response to Legionella pneumophila. Proc Natl Acad Sci USA. 2013;110:1851-1856. [PubMed] [DOI] |
| 18. | Shi J, Zhao Y, Wang K, Shi X, Wang Y, Huang H, Zhuang Y, Cai T, Wang F, Shao F. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 2015;526:660-665. [PubMed] [DOI] |
| 19. | Wree A, Eguchi A, McGeough MD, Pena CA, Johnson CD, Canbay A, Hoffman HM, Feldstein AE. NLRP3 inflammasome activation results in hepatocyte pyroptosis, liver inflammation, and fibrosis in mice. Hepatology. 2014;59:898-910. [PubMed] [DOI] |
| 20. | Adamczak SE, de Rivero Vaccari JP, Dale G, Brand FJ 3rd, Nonner D, Bullock MR, Dahl GP, Dietrich WD, Keane RW. Pyroptotic neuronal cell death mediated by the AIM2 inflammasome. J Cereb Blood Flow Metab. 2014;34:621-629. [PubMed] [DOI] |
| 21. | Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, Abela GS, Franchi L, Nuñez G, Schnurr M. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature. 2010;464:1357-1361. [PubMed] [DOI] |
| 22. | Ey B, Eyking A, Klepak M, Salzman NH, Göthert JR, Rünzi M, Schmid KW, Gerken G, Podolsky DK, Cario E. Loss of TLR2 worsens spontaneous colitis in MDR1A deficiency through commensally induced pyroptosis. J Immunol. 2013;190:5676-5688. [PubMed] [DOI] |
| 23. | Monroe KM, Yang Z, Johnson JR, Geng X, Doitsh G, Krogan NJ, Greene WC. IFI16 DNA sensor is required for death of lymphoid CD4 T cells abortively infected with HIV. Science. 2014;343:428-432. [PubMed] [DOI] |
| 24. | Fink SL, Cookson BT. Caspase-1-dependent pore formation during pyroptosis leads to osmotic lysis of infected host macrophages. Cell Microbiol. 2006;8:1812-1825. [PubMed] [DOI] |
| 26. | Aziz M, Jacob A, Wang P. Revisiting caspases in sepsis. Cell Death Dis. 2014;5:e1526. [PubMed] [DOI] |
| 27. | Jiménez Fernández D, Lamkanfi M. Inflammatory caspases: key regulators of inflammation and cell death. Biol Chem. 2015;396:193-203. [PubMed] [DOI] |
| 28. | Yazdi AS, Guarda G, D'Ombrain MC, Drexler SK. Inflammatory caspases in innate immunity and inflammation. J Innate Immun. 2010;2:228-237. [PubMed] [DOI] |
| 29. | Shao W, Yeretssian G, Doiron K, Hussain SN, Saleh M. The caspase-1 digestome identifies the glycolysis pathway as a target during infection and septic shock. J Biol Chem. 2007;282:36321-36329. [PubMed] [DOI] |
| 30. | Keller M, Rüegg A, Werner S, Beer HD. Active caspase-1 is a regulator of unconventional protein secretion. Cell. 2008;132:818-831. [PubMed] [DOI] |
| 31. | Man SM, Karki R, Kanneganti TD. Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases. Immunol Rev. 2017;277:61-75. [PubMed] [DOI] |
| 32. | Bergsbaken T, Fink SL, Cookson BT. Pyroptosis: host cell death and inflammation. Nat Rev Microbiol. 2009;7:99-109. [PubMed] [DOI] |
| 33. | Brydges SD, Broderick L, McGeough MD, Pena CA, Mueller JL, Hoffman HM. Divergence of IL-1, IL-18, and cell death in NLRP3 inflammasomopathies. J Clin Invest. 2013;123:4695-4705. [PubMed] [DOI] |
| 34. | Meunier E, Dick MS, Dreier RF, Schürmann N, Kenzelmann Broz D, Warming S, Roose-Girma M, Bumann D, Kayagaki N, Takeda K. Caspase-11 activation requires lysis of pathogen-containing vacuoles by IFN-induced GTPases. Nature. 2014;509:366-370. [PubMed] [DOI] |
| 35. | Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell. 2002;10:417-426. [PubMed] [DOI] |
| 36. | Nyström S, Antoine DJ, Lundbäck P, Lock JG, Nita AF, Högstrand K, Grandien A, Erlandsson-Harris H, Andersson U, Applequist SE. TLR activation regulates damage-associated molecular pattern isoforms released during pyroptosis. EMBO J. 2013;32:86-99. [PubMed] [DOI] |
| 37. | Bortoluci KR, Medzhitov R. Control of infection by pyroptosis and autophagy: role of TLR and NLR. Cell Mol Life Sci. 2010;67:1643-1651. [PubMed] [DOI] |
| 38. | Hagar JA, Powell DA, Aachoui Y, Ernst RK, Miao EA. Cytoplasmic LPS activates caspase-11: implications in TLR4-independent endotoxic shock. Science. 2013;341:1250-1253. [PubMed] [DOI] |
| 39. | Qu Y, Misaghi S, Izrael-Tomasevic A, Newton K, Gilmour LL, Lamkanfi M, Louie S, Kayagaki N, Liu J, Kömüves L. Phosphorylation of NLRC4 is critical for inflammasome activation. Nature. 2012;490:539-542. [PubMed] [DOI] |
| 40. | Fernandes-Alnemri T, Wu J, Yu JW, Datta P, Miller B, Jankowski W, Rosenberg S, Zhang J, Alnemri ES. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death Differ. 2007;14:1590-1604. [PubMed] [DOI] |
| 41. | Fernandes-Alnemri T, Yu JW, Datta P, Wu J, Alnemri ES. AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA. Nature. 2009;458:509-513. [PubMed] [DOI] |
| 42. | Strowig T, Henao-Mejia J, Elinav E, Flavell R. Inflammasomes in health and disease. Nature. 2012;481:278-286. [PubMed] [DOI] |
| 43. | Norman JG, Franz MG, Fink GS, Messina J, Fabri PJ, Gower WR, Carey LC. Decreased mortality of severe acute pancreatitis after proximal cytokine blockade. Ann Surg. 1995;221:625-631; discussion 631-634. [PubMed] [DOI] |
| 44. | Hoque R, Sohail M, Malik A, Sarwar S, Luo Y, Shah A, Barrat F, Flavell R, Gorelick F, Husain S. TLR9 and the NLRP3 inflammasome link acinar cell death with inflammation in acute pancreatitis. Gastroenterology. 2011;141:358-369. [PubMed] [DOI] |
| 45. | Vanaja SK, Rathinam VA, Fitzgerald KA. Mechanisms of inflammasome activation: recent advances and novel insights. Trends Cell Biol. 2015;25:308-315. [PubMed] [DOI] |
| 46. | Vince JE, Silke J. The intersection of cell death and inflammasome activation. Cell Mol Life Sci. 2016;73:2349-2367. [PubMed] [DOI] |
| 47. | Alegre F, Pelegrin P, Feldstein AE. Inflammasomes in Liver Fibrosis. Semin Liver Dis. 2017;37:119-127. [PubMed] [DOI] |
| 48. | Palacios-Macapagal D, Connor J, Mustelin T, Ramalingam TR, Wynn TA, Davidson TS. Cutting Edge: Eosinophils Undergo Caspase-1-Mediated Pyroptosis in Response to Necrotic Liver Cells. J Immunol. 2017;199:847-853. [PubMed] [DOI] |
| 49. | Chang W, Lin J, Dong J, Li D. Pyroptosis: an inflammatory cell death implicates in atherosclerosis. Med Hypotheses. 2013;81:484-486. [PubMed] [DOI] |