修回日期: 2016-11-28
接受日期: 2016-12-05
在线出版日期: 2017-01-28
为探讨肝硬化门静脉血栓形成(portal vein thrombosis, PVT)的危险因素而进行了Meta分析.
应用Meta分析的方法, 对有关肝硬化PVT的危险因素相关的9篇文献进行综合分析, 计算各个可疑危险因素的合并比值比或加权均数差值(weighted mean difference, WMD)及其95%可信区间(95% confidence interval, 95%CI). 计算机检索PubMed、CNKI、万方等数据库, 检索时间截止2015-08, 并辅以文献追溯等方法. 纳入有关肝硬化PVT危险因素的病例对照研究, 并进行文献质量评价. 采用Cochrane图书馆的RevMan5.0软件进行Meta分析.
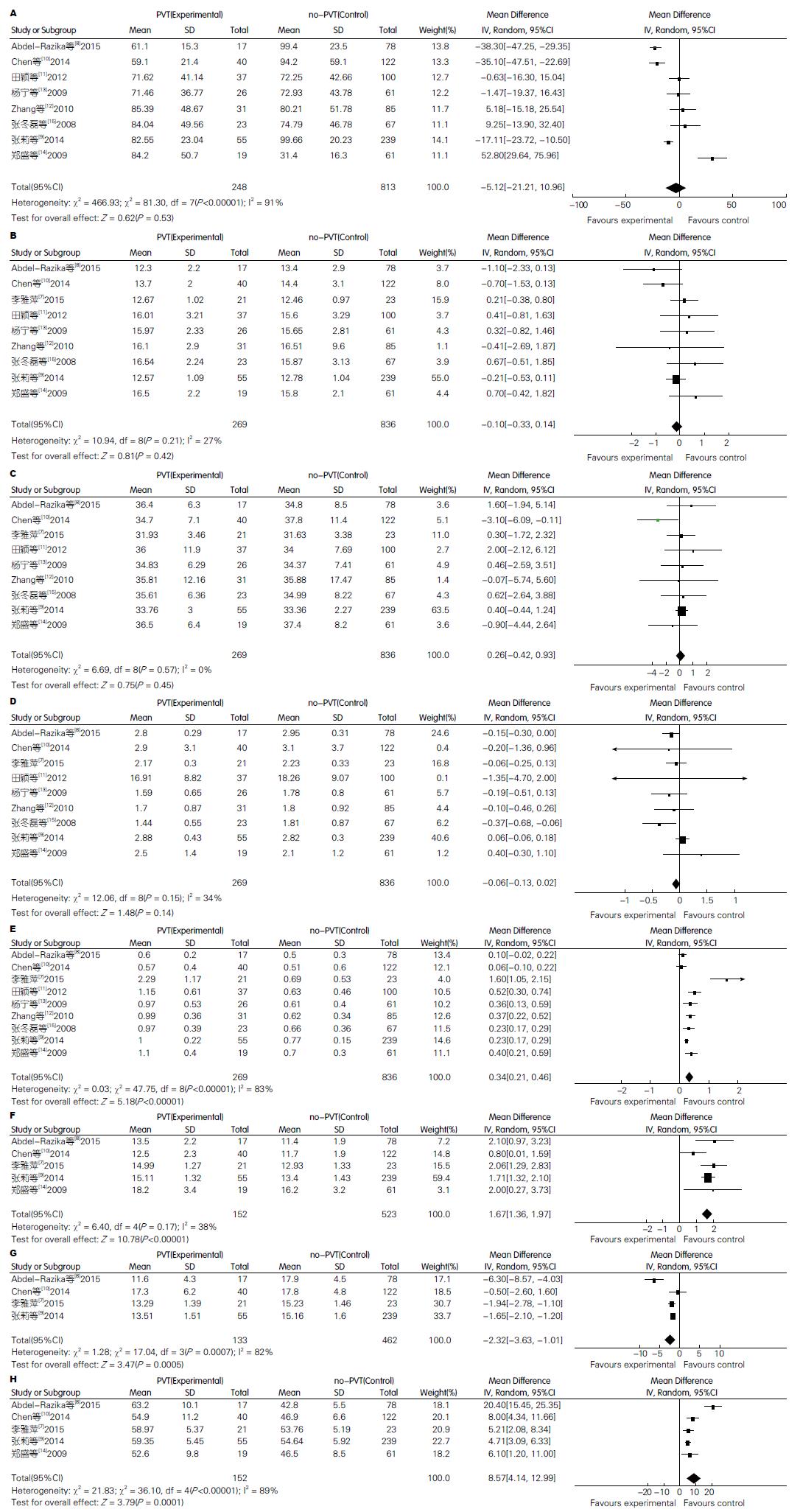
纳入9篇符合标准的病例对照研究, 病例数为1105例. 其中血栓组269例. Meta分析结果显示, 肝硬化PVT与D-二聚体(WMD = 0.34, 95%CI: 0.21-0.46)、门静脉直径(WMD = 1.67, 95%CI: 1.36-1.97)、门静脉血流速度[WMD = -2.32, 95%CI: -3.63-(-1.01)]及脾脏厚度(WMD = 8.57, 95%CI: 4.14-12.99)有关; 而与患者的性别、年龄、血小板计数(blood platelet, PLT)、凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)及纤维蛋白原(fibrinogen, FIB)无关.
肝硬化PVT的主要危险因素为D-二聚体、门静脉直径、门静脉血流速度及脾脏厚度, 与患者性别、年龄、PLT、PT、APTT、FIB无直接相关性.
核心提要: 门静脉血栓形成(portal vein thrombosis, PVT)是肝硬化患者较常见而严重的并发症. 本研究运用Meta分析方法对国内外相关文献进行统计分析, 旨在总结和探讨肝硬化PVT的危险因素, 为临床早诊早治提供科学依据.
引文著录: 李陈婕, 羊志辉, 施小六, 卢放根, 刘德良. 肝硬化门静脉血栓形成危险因素的Meta分析. 世界华人消化杂志 2017; 25(3): 241-251
Revised: November 28, 2016
Accepted: December 5, 2016
Published online: January 28, 2017
To identify the risk factors for portal vein thrombosis (PVT) in cirrhotic patients.
We searched the PubMed, CNKI and Wanfang Databases up to Aug 2015 to retrieve case-controlled studies about the risk factors for PVT in cirrhotic patients for meta-analysis. The odds ratio or weighted mean difference (WMD) of each risk factor was estimated and the 95% confidence interval (95%CI) was calculated. RevMan 5.0 software provided by the Library of Cochrane was used for meta-analysis.
Nine case-controlled studies were included. The risk factors for PVT included D-dimer (WMD = 0.34, 95%CI: 0.21-0.46), portal vein diameter (WMD = 1.67, 95%CI: 1.36-1.97), portal venous flow [WMD = -2.32, 95%CI: -3.63-(-1.01)], and splenic thickness (WMD = 8.57, 95%CI: 4.14-12.99). There were no significant differences between patients with and without PVT in terms of sex, age, platelet, prothrombin time, activated partial thromboplastin time, and fibrinogen.
The risk factors for PVT in cirrhotic patients include D-dimer, portal vein diameter, portal venous flow, and splenic thickness.
- Citation: Li CJ, Yang ZH, Shi XL, Lu FG, Liu DL. Risk factors for portal vein thrombosis in cirrhotic patients: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2017; 25(3): 241-251
- URL: https://www.wjgnet.com/1009-3079/full/v25/i3/241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i3.241
门静脉血栓形成(portal vein thrombosis, PVT)在肝硬化的自然病程中并不是一个不常见的并发症, 在肝硬化进展阶段更是经常发生. 主要是指在门静脉主干及其肝内门静脉分支形成血栓. 文献报道[1-3], 肝硬化患者PVT的发病率为0.6%-26.0%. 肝硬化PVT患者起病隐匿或症状无特异性. 目前, 研究认为PVT可能会进行性升高门静脉压力, 减少流入肝脏血液, 因此加重肝功能不全和门静脉高压症的严重程度, 从而增加患者食管静脉曲张破裂出血、肝性脑病、肝肾综合征等一系列严重并发症的发生率, 威胁生命. 目前对于肝硬化PVT的治疗没有指南或共识意见[4-6], 因此, 确定肝硬化患者发生PVT的危险因素具有重要的临床意义. 本文对肝硬化患者PVT形成的危险因素进行Meta分析, 希望筛选出可能预测PVT的因素, 进而能早期进行干预.
文献检索: 计算机检索PubMed、CNKI、万方等数据库, 检索时间截止2015-08, 并追溯最终符合标准研究的参考文献. 中文检索词包括: "肝硬化"、"门静脉血栓"、"危险因素"等; 英文检索词包括: "liver cirrhosis"、"portal vein thrombosis"、"risk factor"等. 最后, 为提高文献的查全率, 查阅所有入选文献所引用的参考文献.
1.2.1 纳入标准: (1)研究对象: 经影像学或病理确诊为肝硬化, 病例组为肝硬化PVT的患者, 对照组为未形成血栓的患者; (2)危险因素: 主要包括血小板计数(blood platelet, PLT)、凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(fibrinogen, FIB)、D-二聚体、门静脉主干直径、门静脉血流速度、脾脏厚度等; (3)研究类型: 纳入旨在探讨肝硬化PVT危险因素的病例对照研究, 前瞻性或回顾性均可; (4)文献均提供可以换算成合并加权均数差(weighted mean difference, WMD)及其95%可信区间(95% confidence interval, 95%CI)的原始数据; (5)文献语种仅限于中文或英文; (6)文献所涉及的危险因素种类相对齐全.
1.2.2 排除标准: 有以下1条者则纳入排除范围: (1)个案报道; (2)动物实验; (3)肝癌或其他恶性肿瘤; 布-加综合征; 非肝病继发的门静脉血栓; 胆汁淤积性肝病; 胰腺炎; 肝移植; 脾脏切除; TIPS术; 内镜下治疗; 使用抗凝或抗血小板药物; (4)对未给出均数及标准差的文献, 予以排除; (5)对文献质量太差、重复报告或无法利用数据的文献予以排除.
1.2.3 文献筛选及资料提取: 根据纳入排除标准, 对文献进行纳入排除, 对原始数据的收集也进行多次核对. 最终纳入9篇相关文献[7-15].
1.2.4 文献质量评价: 按照NOS(Newcastle-Ottawa Scale)量表对每篇纳入文献进行质量评价. 评价内容主要包括研究对象的选择、组间可比性及暴露因素测量等3大项目, 评价采用星级系统量化原则, 满分为9颗星, 即9分[16]. 文献质量评价结果如表1所示.
| 研究作者 | 年龄 | 性别(男/女, n) | 病例数 | NOS得分 | PLT(×109/L) | PT(s) | APTT(s) | FIB(g/L) | D-二聚体(mg/L) | 门静脉直径(mm) | 门静脉血流速(cm/s) | 脾脏厚度(mm) | ||||||||||
| 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | 血栓组 | 对照组 | |||
| 李雅萍[7]2015 | 56.7±11.2 | 55.8±10.7 | 17/4 | 18/5 | 44 | 7 | NA | NA | 12.67±1.02 | 12.46±0.97 | 31.93±3.46 | 31.63±3.38 | 2.17±0.30 | 2.23±0.33 | 2.29±1.17a | 0.69±0.53 | 14.99±1.27a | 12.93±1.33 | 13.29±1.39a | 15.23±1.46 | 58.97±5.37a | 53.76±5.19 |
| Abdel-Razik等[8]2015 | 59.5±10.7 | 60.4±11.2 | 12/5 | 55/23 | 95 | 9 | 61.1±15.3a | 99.4±23.5 | 12.3±2.2 | 13.4±2.9 | 36.4±6.3 | 34.8±8.5 | 2.80±0.29 | 2.95±0.31 | 6.00±2.00 | 5.00±3.00 | 13.5±2.2a | 11.4±1.9 | 11.6±4.3a | 17.9±4.5 | 63.2±10.1a | 42.8±5.5 |
| 张莉等[9]2014 | 52.3±10.8 | 54.4±12.0 | 39/16 | 178/61 | 294 | 7 | 82.55±23.04a | 99.66±20.23 | 12.57±1.09 | 12.78±1.04 | 33.76±3.00 | 33.36±2.27 | 2.88±0.43 | 2.82±0.30 | 1.00±0.22a | 0.77±0.15 | 15.11±1.32a | 13.40±1.43 | 13.51±1.51a | 15.16±1.60 | 59.35±5.45a | 54.64±5.92 |
| Chen等[10]2014 | 65.0±13.3 | 64.4 ± 14.2 | 26/14 | 94/28 | 162 | 9 | 59.1±21.4a | 94.2±59.1 | 13.7±2.0 | 14.4±3.1 | 34.7±7.1 | 37.8±11.4 | 2.9±3.1 | 3.1±3.7 | 0.57±0.4 | 0.51±0.6 | 12.5±2.3a | 11.7±1.9 | 17.3±6.2 | 17.8±4.8 | 54.9±11.2a | 46.9±6.6 |
| 田颖等[11]2012 | 57.7±11.0 | 55.9±11.9 | 28/9 | 78/22 | 137 | 6 | 71.62±41.14 | 72.25±42.66 | 16.01±3.21 | 15.60±3.29 | 36.00±11.90 | 34.00±7.69 | 16.91±8.82 | 18.26±9.07 | 1.15±0.61a | 0.63±0.46 | NA | NA | NA | NA | NA | NA |
| Zhang等[12]2010 | 58.09±10.46 | 58.76±11.02 | 25/6 | 60/25 | 116 | 8 | 85.39±48.67 | 80.21±51.78 | 16.10±2.90 | 16.51±9.60 | 35.81±12.16 | 35.88±17.47 | 1.70±0.87 | 1.80±0.92 | 0.99±0.36a | 0.62±0.34 | NA | NA | NA | NA | NA | NA |
| 杨宁等[13]2009 | 59.12±11.39 | 59.25±11.76 | 18/8 | 39/22 | 87 | 6 | 71.46±36.77 | 72.93±43.78 | 15.97±2.33 | 15.65±2.81 | 34.83±6.29 | 34.37±7.41 | 1.59±0.65 | 1.78±0.80 | 0.97±0.53a | 0.61±0.40 | NA | NA | NA | NA | NA | NA |
| 郑盛等[14]2009 | 56.2±5.6 | 58.1±9.6 | 12/7 | 45/16 | 80 | 7 | 84.2±50.7a | 31.4±16.3 | 16.5±2.2 | 15.8±2.1 | 36.5±6.4 | 37.4±8.2 | 2.5±1.4a | 2.1±1.2 | 1.1±0.4a | 0.7±0.3 | 18.2±3.4a | 16.2±3.2 | NA | NA | 52.6±9.8a | 46.5±8.5 |
| 张冬磊等[15]2008 | 56.7±10.0 | 57.2±11.3 | 20/3 | 53/14 | 90 | 7 | 84.04±49.56 | 74.79±46.78 | 16.54±2.24 | 15.87±3.13 | 35.61±6.36 | 34.99±8.22 | 1.44±0.55 | 1.81±0.87 | 0.97±0.39a | 0.66±0.36 | NA | NA | NA | NA | NA | NA |
统计学处理 遵循Meta分析步骤, 在完成文献检索、数据提取后, 利用Review Manager 5.0软件对数据进行统计学分析, 逐一对每个可疑危险因素相关的纳入文献进行异质性检验: 不同文献之间的异质性通过检查结果的P、I2来确定, 如果异质性检验结果为P>0.10, 且I2<50%, 认为多个研究同质, 采用固定效应模型计算合并统计量; 若P≤0.10, 且I2>50%认为多个研究异质, 进一步寻找异质性的原因, 采取剔除导致异质性的文献等方法去除文献异质性, 若仍然无法消除异质性, 则采用随机效应模型计算合并统计量. 合并效应量选用合并比值比(odds ratio, OR)或WMD及其95%CI. 合并效应量的检验根据Z检验得到统计量P, 若P≤0.05, 多个研究的合并效应量有统计学意义; 若P>0.05, 多个研究的合并效应量没有统计学意义.
通过检索策略, 根据制定的纳入和排除标准, 最终有9篇相关文献纳入, 其中中文6篇, 英文3篇, 均为病例对照研究的全文. 纳入研究的基线资料如表1, 这9项研究共包括1105例患者, 其中血栓组269例(男197例, 女72例), 对照组836例(男620例, 女216例). 血栓组与非血栓组患者性别比例差异无统计学意义(OR = 0.94, 95%CI: 0.68-1.28). 研究报道了两组患者年龄的均值及标准差, 各研究之间不存在统计学异质性(P = 0.93, I2 = 0%), 故采用固定效应模型. 分析显示, 血栓组与非血栓组患者年龄差异无统计学意义(WMD = -0.65, 95%CI: -2.12-0.8287). 纳入研究发表时间为2008-2015年. 采用NOS量表对纳入文献进行质量评价显示所有研究的最终得分均在6分及以上, 文献质量整体较好.
D-二聚体、门静脉直径、门静脉血流速度、脾脏厚度为肝硬化患者PVT的危险因素, 其中D-二聚体(WMD = 0.34, 95%CI: 0.21-0.46, Z = 5.18, P<0.00001)、门静脉直径(WMD = 1.67, 95%CI: 1.36-1.97, Z = 10.78, P<0.00001)、脾脏厚度(WMD = 8.57, 95%CI: 4.14-12.99, Z = 3.79, P = 0.0001)菱形位于垂直线的右侧, 表明血栓组D-二聚体、门静脉直径、脾脏厚度均高于非血栓组; 门静脉血流速度[WMD = -2.32, 95%CI: -3.63-(-1.01), Z = 3.47, P = 0.0005]菱形位于垂直线的左侧, 表明血栓组门静脉血流速度低于非血栓组. PLT、PT、APTT、FIB菱形与垂直线相交, 表明与肝硬化患者PVT关系不显著. Meta分析结果如图1.
中南大学湘雅二医院肝硬化合并PVT患者不少, 但多继发于内镜下手术、脾栓塞、脾切除及肝移植术, 从2012-01/2015-09符合纳入及排除标准的患者仅14例(表2). 从表中可以看出, 14例患者D-二聚体、门静脉内径、脾脏厚度的中位数均高于正常值; PLT、AT3的中位数低于正常值; 而PT、INR、APTT、TT、FIB、FDP的中位数均为正常.
| PLT(×109/L) | PT(s) | INR | APTT(s) | AT3(%) | TT(s) | FIB(g/L) | FDP(μg/mL) | D-二聚体(μg/mL) | 门静脉直径(mm) | 脾脏厚度(mm) | |
| 1 | 167 | 16.2 | 1.42 | 30.2 | 63.3 | 16.4 | 2.42 | 15.7 | 4.85 | 15 | 52 |
| 2 | 195 | 14.6 | 1.14 | 46.9 | 96 | 15.6 | 4.6 | 43.25 | 11.55 | NA | NA |
| 3 | 31 | 14.5 | 1.27 | 33.7 | 89 | 18.3 | 1.68 | 6.5 | 1.88 | 15 | 70 |
| 4 | 57 | 18.1 | 1.51 | 33.3 | NA | NA | 1.51 | NA | 24.76 | 10 | 72 |
| 5 | 77 | 15.3 | 1.21 | 39.6 | NA | NA | NA | NA | NA | 12.9 | 42 |
| 6 | 159 | 14.9 | 1.17 | 42.7 | 90 | 15.4 | 3.15 | 3.3 | 1.31 | 14 | 32 |
| 7 | 74 | 16.1 | 1.29 | 52.2 | 43 | 18.1 | 2.44 | 16.8 | 5.88 | 10 | 45 |
| 8 | 86 | 17.7 | 1.46 | 52.6 | NA | 16.8 | NA | NA | 1.73 | 15.3 | 65 |
| 9 | 81 | 15.4 | 1.22 | 52.8 | 50 | 17 | 1.84 | 2.7 | 1.18 | 14 | 65 |
| 10 | 42 | 47.2 | 5.22 | 125.7 | NA | 22.1 | 0.77 | NA | 3.63 | 11 | 60 |
| 11 | 89 | 18.3 | 1.54 | 57.4 | 58 | 17.4 | 3.18 | 25.2 | 5.78 | 13 | 46 |
| 12 | 33 | 15.2 | 1.25 | 53.7 | 59.7 | 17.3 | 1.08 | NA | 1.35 | NA | NA |
| 12 | 70 | 15.2 | 1.2 | 40.7 | 87 | 16 | 2.64 | 9.3 | 3.39 | 15 | 43 |
| 14 | 22 | 19.4 | 1.65 | 44.9 | 58 | 16.8 | 1.47 | 5.1 | 1.79 | 13 | 64 |
| 中位数 | 75.5 | 15.8 | 1.28 | 45.9 | 61.5 | 16.9 | 2.13 | 9.3 | 3.39 | 13.5 | 56 |
肝硬化PVT形成是肝硬化的一种严重并发症. 1868年Balfour和Stewart报道了首例肝硬化PVT形成, 患者表现为脾大、腹水和食道静脉曲张等严重并发症. PVT形成后将严重影响肝脏血流, 进一步提高门静脉压力, 并增加上消化道出血及肠梗死的风险, 对患者的预后及生存质量有明显的影响[17-20]. 肝硬化急性PVT常有腹痛症状, 尤其是合并肠系膜上静脉受累时. 严重者导致肠缺血, 甚至危及生命的肠梗死. 但肝硬化患者很少发生急性PVT, 其PVT的发生和进展多是一个渐进和缓慢的过程, 从而有侧枝循环建立, 并形成海绵状血管瘤. 因此常常没有腹痛等临床症状, 容易漏诊, 大部分患者都是影像学偶然发现. 当肝硬化患者出现不能解释的肝功能恶化、胃肠道出血以及顽固性腹水等失代偿期表现时, 应考虑是否合并PVT形成, 并进行进一步检查. 近年来随着临床医师对肝硬化PVT的认识逐渐加深, 以及影像学技术的发展, PVT的检出率也在升高. 然而, 对本病的病因及治疗没有大规模的前瞻性研究或共识意见. 因此寻找肝硬化PVT形成的危险因素, 有助于早期发现, 早期干预, 从而提高患者的生活质量, 延长患者的生存期.
目前的研究认为, 肝硬化患者具有多种PVT形成的危险因素, 包括血流动力学改变, 血液的高凝状态, 内毒素血症等. 此外, 较多文献报道, 肝硬化PVT既往史中的风险因素包括门静脉高压症的并发症及其为并发症所进行的手术(如既往静脉曲张出血, 内镜下治疗, 各种分流和断流手术). 肝细胞癌的存在(无大血管浸润)似乎是非肿瘤性PVT的一个危险因素. 为避免上述情况的影响, 本Meta分析确定排除标准时包括了上述情况, 因此符合纳入排除标准的文献数相对较少. 本Meta分析结果显示, 血栓组与非血栓组相比, D-二聚体、门静脉直径、门静脉血流速度、脾脏厚度等方面的差异具有统计学意义, 而不同组患者的性别、年龄、PLT、PT、APTT、FIB等方面无明显差异.
很多学者认为[21]术后PVT与PLT增加相关. 不可否认的是, 脾切除术后患者的PLT较术前出现明显的升高, 大约在术后2 wk左右达到高峰, 随后又逐渐恢复正常[22]. 然而, 本文研究的是非手术患者, 其PLT多低于正常. 合并效应量显示2组PLT差异无统计学意义.
D-二聚体是纤维蛋白溶解过程中产生的, 是纤维蛋白单体经活化因子X交联后, 经纤溶酶水解后所产生的一种特异性降解产物. 其水平升高表明体内纤维蛋白血栓形成和继发纤溶发生. D-二聚体对深静脉血栓形成和肺栓塞具有较高的阴性预测值和灵敏度[25]. 目前, 在临床实践中, 他已被广泛地用于疑似静脉血栓栓塞的诊断. 有证据表明, D-二聚体阴性可以有效地排除深静脉血栓和肺栓塞[26,27].
肝硬化患者在未进行手术时, D-二聚体浓度的增加与PVT的高风险相关联, 这可能表明, D-二聚体应该是肝硬化诊断标志物. 近年来很多学者[28,29]发现肝硬化PVT患者血浆D-二聚体水平升高, D-二聚体是PVT形成的危险因素. 因其有较高的阴性预测值, 故推断D-二聚体水平较低的肝硬化患者PVT形成的可能性较小, 可用于中重度肝硬化患者排除PVT[30]. 但是考虑到肝硬化时肝脏清除D-二聚体的功能下降, DIC或者感染或者出血也能导致D-二聚体水平升高等因素, D-二聚体在肝硬化患者中的特异性低于普通人群[31].
肝硬化患者失代偿期存在门脉高压, 门静脉系统向肝血流受阻, 血管直径变宽, 变化的先后次序为门静脉、脾静脉和肠系膜上静脉. 刘元水等[32]的研究表明, 肝硬化导致的门静脉高压与门静脉直径正相关. 朱为群等[33]的研究也表明门静脉直径与门静脉压有良好正相关, 门静脉直径是评价门脉高压的敏感指标. 门静脉直径增宽后, 门静脉血流迟缓、瘀滞、涡流形成, 血流缓慢后易形成血栓. 随着病情的进展, 门静脉阻力和侧支循环的增加, 门静脉血流速度较前降低, 有可能出现逆向血流. 门静脉高压导致门静脉血流动力学变化, 血流量有一个增多、瘀滞、减少到逆向的变化过程[34]. 血流动力学的变化使门静脉内膜受损, 胶原暴露, 启动凝血机制, 促进血栓形成. PVT形成后, 特别是血栓位于门静脉主干, 门静脉相对狭窄, 血流瘀滞导致门静脉压力进一步升高, 门静脉主干直径相应增宽, PVT易形成, 而PVT形成后又加重门静脉压力, 并形成恶性循环.
Zocco等[23]进行的一项前瞻性观察性研究中, 门静脉血流速度<15 cm/s的肝硬化患者PVT发生率比对照组高(OR = 44.9, 95%CI: 5.3-382.7, P<0.001), 因此认为门静脉血流速度降低是与PVT形成风险相关的唯一独立变量. Maruyama等[35]的研究也指出, 对于病毒性肝硬化, 侧支血管的发展减少了门静脉主干的血流速度, 是PVT发生的重要预测因素. 门静脉血流速度<15 cm/s被认为是PVT的独立危险因素. 然而, Chen等[10]的研究发现, 肝硬化无PVT和有PVT的两组患者中, 其门静脉血流速度均>15 cm/s, 两组的门静脉血流速度无明显统计学差异. 因此认为, 假如发生的唯一改变是门静脉血流速度, PVT可能不会发生.
脾脏肿大与门静脉高压症有关, 脾脏肿大越明显, 就越加剧门静脉高压症. 此外, 由于门静脉高压症加剧导致PVT进展过程中, 所得风险增加. 因此, 脾脏增厚可能有助于PVT的形成. 脾脏厚度反映门静脉高压状态, 有证据支持其与肝硬化患者PVT发生独立相关[36], 与本文研究结果一致.
本Meta分析共纳入符合标准的队列或病例对照研究9项. 所有纳入研究的NOS评分均≥6分, 文献质量较好. 中南大学湘雅二医院肝硬化合并PVT符合纳入及排除标准的患者仅14例, 14例患者D-二聚体、门静脉内径、脾脏厚度的中位数均高于正常值, 与Meta分析结果一致.
总之, D-二聚体、门静脉宽度、门静脉血流速度、脾脏厚度是肝硬化PVT形成的危险因素, D-二聚体越高、门静脉直径越大, 门静脉血流速度越慢、脾脏厚度越厚, PVT形成的风险越高. 临床工作中, 当发现肝硬化患者D-二聚体增高、门静脉直径增大, 门静脉血流速度减慢、脾脏厚度增加时, 应告知患者定期随访的必要性, 可行腹部门脉血管彩超、腹部CT门脉血管成像或血管造影, 早期发现PTV形成, 并进行早期治疗, 改善患者的预后.
门静脉血栓(portal vein thrombosis, PVT)是肝硬化患者常见并发症之一, 起病隐匿或症状无特异性, 预后较差, 病死率较高. 如何早期发现PVT并进行早期治疗, 从而降低肝硬化患者的病死率至关重要. 目前国内外关于肝硬化患者PVT的危险因素仍有不同的报道.
近年来, 国内外学者对肝硬化患者PVT发生的具体危险因素研究较多, 但研究结果仍存在争议.
张莉等在研究中指出肝硬化并发PVT与患者的D-二聚体、门静脉宽度、门静脉血流速度密切相关, 临床上应常规检查这些指标, 以提高肝硬化PVT患者早期诊断率, 并进行早期治疗, 从而延长肝硬化PVT患者的生存期.
本文应用Meta分析的方法, 对有关肝硬化患者PVT危险因素的文献进行了综合分析, 为临床的早诊早治提供科学依据. 同时, 文献报道, 各种内镜下治疗、介入及外科手术都是PVT的高危因素, 本文排除了此类患者, 真正反应了肝硬化患者自然病程中并发PVT的危险因素.
本研究结果表明, D-二聚体、门静脉宽度、门静脉血流速度、脾脏厚度是肝硬化PVT形成的危险因素. 临床中对肝硬化患者应注重以上指标, 定期随访, 早期发现PTV形成, 并进行早期治疗, 改善患者的预后.
门静脉血栓(PVT): 导致门静脉血栓的病因很多, 本文重点讨论肝硬化患者自然病程中并发的门静脉血栓, 主要是指在门静脉主干及其肝内门静脉分支形成血栓.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科; 王蓉, 主任医师, 上海市浦东新区光明中医医院消化内科; 姚登福, 教授, 南通大学附属医院
本文通过对9篇高质量的肝硬化PVT危险因素的文章进行检索及数据提取, 对肝硬化患者PVT形成的危险因素进行Meta分析, 方法严谨, 结论可靠, 有一定的临床价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Congly SE, Lee SS. Portal vein thrombosis: should anticoagulation be used? Curr Gastroenterol Rep. 2013;15:306. [PubMed] [DOI] |
| 2. | Ponziani FR, Zocco MA, Garcovich M, D'Aversa F, Roccarina D, Gasbarrini A. What we should know about portal vein thrombosis in cirrhotic patients: a changing perspective. World J Gastroenterol. 2012;18:5014-5020. [PubMed] [DOI] |
| 3. | Rodriguez-Castro KI, Simioni P, Burra P, Senzolo M. Anticoagulation for the treatment of thrombotic complications in patients with cirrhosis. Liver Int. 2012;32:1465-1476. [PubMed] [DOI] |
| 4. | Amitrano L, Guardascione MA, Scaglione M, Menchise A, Martino R, Manguso F, Lanza AG, Lampasi F. Splanchnic vein thrombosis and variceal rebleeding in patients with cirrhosis. Eur J Gastroenterol Hepatol. 2012;24:1381-1385. [PubMed] [DOI] |
| 5. | Rodríguez-Castro KI, Porte RJ, Nadal E, Germani G, Burra P, Senzolo M. Management of nonneoplastic portal vein thrombosis in the setting of liver transplantation: a systematic review. Transplantation. 2012;94:1145-1153. [PubMed] [DOI] |
| 6. | Senzolo M. Liver: PVT in cirrhosis, not always an innocent bystander. Nat Rev Gastroenterol Hepatol. 2015;12:11-13. [PubMed] [DOI] |
| 8. | Abdel-Razik A, Mousa N, Elhelaly R, Tawfik A. De-novo portal vein thrombosis in liver cirrhosis: risk factors and correlation with the Model for End-stage Liver Disease scoring system. Eur J Gastroenterol Hepatol. 2015;27:585-592. [PubMed] [DOI] |
| 10. | Chen H, Trilok G, Wang F, Qi X, Xiao J, Yang C. A single hospital study on portal vein thrombosis in cirrhotic patients - clinical characteristics & amp; risk factors. Indian J Med Res. 2014;139:260-266. [PubMed] |
| 12. | Zhang D, Hao J, Yang N. Protein C and D-dimer are related to portal vein thrombosis in patients with liver cirrhosis. J Gastroenterol Hepatol. 2010;25:116-121. [PubMed] [DOI] |
| 16. | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol. 2010;25:603-605. [PubMed] [DOI] |
| 17. | D'Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology. 2003;38:599-612. [PubMed] [DOI] |
| 18. | Girleanu I, Stanciu C, Cojocariu C, Boiculese L, Singeap AM, Trifan A. Natural course of nonmalignant partial portal vein thrombosis in cirrhotic patients. Saudi J Gastroenterol. 2014;20:288-292. [PubMed] [DOI] |
| 19. | Tsochatzis EA, Senzolo M, Germani G, Gatt A, Burroughs AK. Systematic review: portal vein thrombosis in cirrhosis. Aliment Pharmacol Ther. 2010;31:366-374. [PubMed] [DOI] |
| 20. | Qi X, Dai J, Yang M, Ren W, Jia J, Guo X. Association between Portal Vein Thrombosis and Survival in Non-Liver-Transplant Patients with Liver Cirrhosis: A Systematic Review of the Literature. Gastroenterol Res Pract. 2015;2015:480842. [PubMed] [DOI] |
| 21. | Kawanaka H, Akahoshi T, Kinjo N, Konishi K, Yoshida D, Anegawa G, Yamaguchi S, Uehara H, Hashimoto N, Tsutsumi N. Impact of antithrombin III concentrates on portal vein thrombosis after splenectomy in patients with liver cirrhosis and hypersplenism. Ann Surg. 2010;251:76-83. [PubMed] [DOI] |
| 23. | Zocco MA, Di Stasio E, De Cristofaro R, Novi M, Ainora ME, Ponziani F, Riccardi L, Lancellotti S, Santoliquido A, Flore R. Thrombotic risk factors in patients with liver cirrhosis: correlation with MELD scoring system and portal vein thrombosis development. J Hepatol. 2009;51:682-689. [PubMed] [DOI] |
| 24. | Rossetto V, Spiezia L, Senzolo M, Rodriguez K, Gavasso S, Woodhams B, Simioni P. Factor VIIa-antithrombin complexes in patients with non-neoplastic portal vein thrombosis with and without cirrhosis. Int J Lab Hematol. 2013;35:101-105. [PubMed] [DOI] |
| 25. | Di Nisio M, Squizzato A, Rutjes AW, Büller HR, Zwinderman AH, Bossuyt PM. Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism: a systematic review. J Thromb Haemost. 2007;5:296-304. [PubMed] [DOI] |
| 26. | Fancher TL, White RH, Kravitz RL. Combined use of rapid D-dimer testing and estimation of clinical probability in the diagnosis of deep vein thrombosis: systematic review. BMJ. 2004;329:821. [PubMed] [DOI] |
| 27. | van Belle A, Büller HR, Huisman MV, Huisman PM, Kaasjager K, Kamphuisen PW, Kramer MH, Kruip MJ, Kwakkel-van Erp JM, Leebeek FW. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. JAMA. 2006;295:172-179. [PubMed] [DOI] |
| 29. | Zhang DL, Hao JY, Yang N. Value of D-dimer and protein S for diagnosis of portal vein thrombosis in patients with liver cirrhosis. J Int Med Res. 2013;41:664-672. [PubMed] [DOI] |
| 30. | Fimognari FL, De Santis A, Piccheri C, Moscatelli R, Gigliotti F, Vestri A, Attili A, Violi F. Evaluation of D-dimer and factor VIII in cirrhotic patients with asymptomatic portal venous thrombosis. J Lab Clin Med. 2005;146:238-243. [PubMed] [DOI] |
| 31. | Li MX, Zhang XF, Liu ZW, Lv Y. Risk factors and clinical characteristics of portal vein thrombosis after splenectomy in patients with liver cirrhosis. Hepatobiliary Pancreat Dis Int. 2013;12:512-519. [PubMed] [DOI] |
| 33. | 朱 为群, 张 辉, 尹 炽标, 冼 建中, 李 玉娥, 邝 伟明, 张 舒眉. 肝硬化门静脉高压症患者门静脉最大血流速度、平均血流速度和门静脉直径与自由门静脉压力相关性的研究. 中华普通外科杂志. 2003;18:54-55. |
| 34. | Kawasaki T, Moriyasu F, Nishida O, Ban N, Nakamura T, Tamada T, Kimura T, Yamashita Y, Ono S, Uchino H. Analysis of hepatofugal flow in portal venous system using ultrasonic Doppler duplex system. Am J Gastroenterol. 1989;84:937-941. [PubMed] |
| 35. | Maruyama H, Okugawa H, Takahashi M, Yokosuka O. De novo portal vein thrombosis in virus-related cirrhosis: predictive factors and long-term outcomes. Am J Gastroenterol. 2013;108:568-574. [PubMed] [DOI] |
| 36. | Ogren M, Bergqvist D, Björck M, Acosta S, Eriksson H, Sternby NH. Portal vein thrombosis: prevalence, patient characteristics and lifetime risk: a population study based on 23,796 consecutive autopsies. World J Gastroenterol. 2006;12:2115-2119. [PubMed] [DOI] |