修回日期: 2016-11-11
接受日期: 2016-11-21
在线出版日期: 2017-01-28
了解诱骗受体3(decoy receptor 3, DcR3)在肝癌细胞中的表达水平, 探讨其对肝癌细胞增殖、凋亡的影响并探讨其分子机制.
采用real-time PCR、Western blot以及ELISA等方法检测肝癌细胞HepG2和Huh-7与正常肝细胞HL-7702和Chang liver中DcR3 mRNA和蛋白的表达以及分泌水平. 设计和构建DcR3小干扰RNA重组慢病毒(LV-shDcR3), 感染HepG2和Huh-7细胞, 同时以空病毒载体作为对照, Western blot验证沉默效果. 感染后通过CCK-8和平板克隆形成实验观察细胞增殖情况; 通过流式细胞术观察细胞凋亡情况; 通过Western blot检测凋亡相关蛋白如剪切型多聚腺苷二磷酸核糖聚合酶的表达情况. 通过Western blot方法检测转染前后FasL、LIGHT和TRAIL等死亡配体的表达情况. 组间比较采用单因素方差分析.
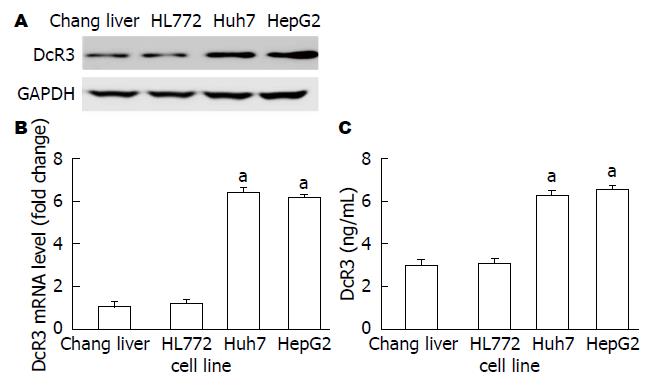
肝癌细胞HepG2和Huh-7中DcR3的mRNA和蛋白表达水平与正常肝细胞相比明显升高, 差异具有统计学意义. 细胞上清中DcR3的分泌水平也明显升高. 与空白组和感染对照组相比, 感染LV-shDcR3组, 肝癌细胞中DcR3的表达显著降低, 细胞生存率明显降低, 早期凋亡细胞比例明显升高, 凋亡相关蛋白表达水平明显升高. 与感染前相比, 肝癌细胞感染LV-shDcR3后, TRAIL和FasL的表达水平明显升高.
DcR3在肝癌细胞中高表达, 下调肝癌细胞中DcR3的表达可以抑制细胞的增殖, 促进细胞凋亡, 其机制可能与TRAIL和FasL凋亡通路有关.
核心提要: 本研究应用细胞和分子生物学手段, 发现诱骗受体3(decoy receptor 3, DcR3)在肝癌细胞中高表达, 下调DcR3可以有效地抑制肝癌细胞的增殖能力, 诱导肝癌细胞凋亡, 其机制可能与阻断FasL和TRAIL介导的细胞凋亡途径有关, 为临床治疗肝癌提供新的思路和靶点.
引文著录: 梁冬雨, 侯彦强, 娄晓丽. 沉默诱骗受体3的表达对肝癌细胞生物学特性的影响. 世界华人消化杂志 2017; 25(3): 234-240
Revised: November 11, 2016
Accepted: November 21, 2016
Published online: January 28, 2017
To detect the expression of decoy receptor 3 (DcR3) in hepatoma cells, and to investigate its role in the biological features of hepatoma cells.
Real-time PCR and Western blot were used to detect the expression of DcR3 mRNA and protein in human hepatoma cell lines HepG2 and Huh7 and normal hepatocytes (HL-7702 and Chang liver). ELISA was used to detect the level of DcR3 protein in the supernatant of these four cell lines. A lentiviral vector carrying shRNA against DcR3 (LV-shDcR3) was synthesized and used to infect HepG2 and Huh7 cells, with the empty lentiviral vector as a control. After infection, the interference effects were determined by Western blot, cell proliferation was assessed by CCK-8 assay and colony forming assay, cell apoptosis was examined by flow cytometry, and the expression of apoptosis related protein like PARP was detected by Western blot. The expression of TRAIL, FasL and LIGHT before and after infection was also detected by Western blot.
The expression of DcR3 was significantly increased in hepatoma cell lines HepG2 and Huh7 both at the mRNA and protein levels compared with normal hepatocytes. The levels of DcR3 in the supernatants of HepG2 and Huh7 cells were also increased. Compared with the mock group and empty lentiviral vector infected group, the LV-shDcR3 infected group showed reduced expression of DcR3, lower cell viability rate, and higher cell apoptosis rate. The expression of TRAIL and FasL was increased after infection with LV-shDcR3 in HepG2 and Huh7 cells.
The expression of DcR3 is elevated in hepatoma cells. Down-regulation of the expression of DcR3 inhibits cell proliferation and induces cell apoptosis in hepatoma cells, via mechanisms that may be related with the TRAIL and FasL apoptosis pathway.
- Citation: Liang DY, Hou YQ, Lou XL. Effect of silencing decoy receptor 3 on biological features of hepatoma cells. Shijie Huaren Xiaohua Zazhi 2017; 25(3): 234-240
- URL: https://www.wjgnet.com/1009-3079/full/v25/i3/234.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i3.234
诱骗受体3(decoy receptor 3, DcR3)是一种分泌性蛋白, 其通过竞争性结合FasL、LIGHT和TRAIL, 抑制FasL、LIGHT和TRAIL介导的细胞凋亡, 在肿瘤免疫逃逸以及免疫反应的调节中扮演重要的角色[1-3]. 近年来, DcR3在肿瘤中的研究逐渐受到重视[4-6]. 肝癌是临床上最常见的恶性肿瘤之一, 由于其恶性程度高, 发病隐匿, 临床发现时多已为晚期, 且治疗困难, 预后极差, 肝癌死亡率居肿瘤死亡率的第3位, 严重威胁着人类的健康[7,8]. 已有研究[9,10]表明, DcR3蛋白在肝癌患者组织和血清中表达升高, 但DcR3在肝癌中的作用及其相关机制研究鲜见报道. 本研究首先检测肝癌细胞中DcR3的表达水平, 观察通过DcR3小干扰RNA重组慢病毒技术下调肝癌细胞中DcR3的表达对细胞增殖、凋亡的影响, 通过比较干扰前后细胞内TRAIL、LIGHT和FasL的表达, 拟揭示DcR3对肝癌细胞生物学特性的影响及其相关机制.
肝癌细胞株HepG2和Huh7及人正常肝细胞株HL-7702和Chang liver均购自中国科学院上海细胞生物研究所; 脂质体Lipofectamine2000购自美国Invitrogen公司; DcR3、PARP、TRAIL、LIGHT、FasL、GAPDH一抗均购自美国Abcam公司. TRIzol(美国Invitrogen公司); 逆转录试剂盒(日本TakaRa公司); 荧光定量PCR试剂盒(日本TakaRa公司); CCK-8试剂盒(日本同仁株式会社); Annexin V-FITC Apoptosis Dection kit(Bection Dickinson, 美国).
1.2.1 细胞培养: 人肝癌细胞株HepG2和Huh7及人正常肝细胞株HL-7702和Chang liver均采用含10%胎牛血清, 100 μ/mL青霉素, 100 μ/mL链霉素的DMEM培养液, 常规培养于37 ℃、50 mL/L CO2恒温孵育箱中, 根据细胞生长情况, 2-3 d传代1次, 取对数生长期的细胞用于实验.
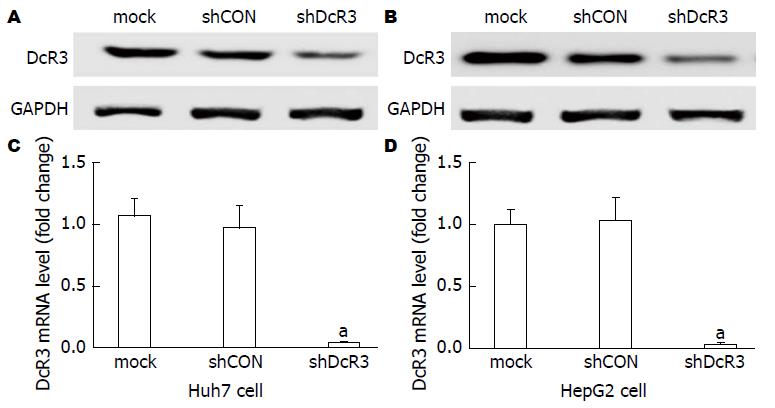
1.2.2 慢病毒感染细胞: 根据GenBank中DcR3的基因序列(NM_003823), 利用Invitrogen公司在线设计软件(Block-IT RNAi Designer), 按照RNAi设计原则, 设计针对DcR3的siRNA序列. siRNA序列为: 5'-CGCUGCAGCCUCUUGAUGGAGAUGUCC-3'. 针对靶向DcR3小干扰RNA重组慢病毒由上海和元生物有限公司包装和滴度测定. 将细胞悬液以5×104个接种于6孔板中, 感染前弃去培养基, 更换为新鲜培养基. 根据病毒滴度结果按MOI 50 U/cell 加入病毒上清, 37 ℃培养12 h后更换培养基, 72 h后观察感染效率. 同时用空载体病毒感染细胞作为阴性对照. 通过在荧光显微镜下观察GFP绿色荧光细胞判断转染效率. 可见在干扰实验组和阴性对照组转染率均>90%, 而空白对照组转染率接近0.
1.2.3 Real-time PCR检测mRNA表达水平: TRIzol法提取细胞总RNA, 采用逆转录试剂盒将总RNA的mRNA反转录成cDNA第一链, 以合成的cDNA为模板, 加入上下游引物, 按照荧光定量PCR试剂盒说明书进行操作, 最后在ABI7500仪器上进行基因扩增. PCR反应条件为: 95 ℃预变性30 s; 95 ℃变性5 s, 60 ℃退火并延伸34 s, 进行40个循环. 收集每个PCR延伸期的荧光, 反应产物经溶解曲线检测特异性, 经SDS2.2软件分析循环阈值(Ct)值. 以GAPDH作为内参, 采用2-△△Ct表示计算mRNA的表达, 其中△△Ct = △Ct实验组-△Ct对照组, △Ct = Ct靶基因-Ct内参基因.
1.2.4 Western blot检测细胞内蛋白的表达: RIPA裂解细胞, BCA蛋白定量试剂盒定量后, 取20 μg蛋白, 于100 ℃变形10 min后进行10%十二烷基硫酸钠/聚丙烯酰胺(SDS-PAGE)电泳, 转移至PVDF膜上. 5%脱脂蛋白室温封闭2 h, 加入适量的一抗, 4 ℃孵育过夜, 0.1%的PBST漂洗3次, 5 min/次. 加辣根过氧化物酶标记的二抗, 室温孵育1 h后, PBST洗3次, 5 min/次. 结果用ECL-Plus化学发光试剂盒检测, X光胶片曝光、显影、定影、观察结果.
1.2.5 CCK-8检测细胞活性: 应用CCK-8试剂盒检测细胞增殖情况, 细胞以5000个每孔的浓度铺于96孔板中, 培养24、48、72 h后, 每孔加入10 μL CCK-8溶液, 继续孵育2 h后用酶标仪测定450 nm波长处的吸光度值.
1.2.6 平板克隆形成实验: 细胞按实验要求处理24 h后, 胰酶消化吹打, 使形成单个细胞, 以每板约200个细胞的密度接种于6孔板中. 2-3 d换液1次, 直至出现肉眼可见的克隆时, 终止培养, PBS洗板3次, 甲醇固定15 min后结晶紫染色15 min, 然后用流水洗去多余的染液, 空气干燥, 拍照并计数克隆形成数. 实验结果取3组独立实验结果的平均值.
1.2.7 流式细胞术检测细胞凋亡: 各组细胞处理24 h后, 用不含乙二胺四乙酸胰酶消化收集细胞, 采用Annexin V-FITC Apoptosis Dection kit检测细胞凋亡率.
统计学处理 采用SPSS13.0统计软件进行统计学处理, 成正态分布的计量资料以means±SD表示, 组间比较用单因素方差分析, P<0.05表示差异具有统计学意义.
与正常肝细胞HL-7002和Chang liver相比, 肝癌细胞HepG2和Huh7中DcR3的mRNA和蛋白表达水平均明显增高, 差异均有统计学意义(P<0.05, 图1A, B). 肝癌细胞HepG2和Huh7上清中DcR3的分泌水平比正常肝细胞HL-7002和Chang liver也明显升高, 差异具有统计学意义(P<0.05, 图1C). HepG2和Huh7细胞感染LV-shDcR3后, DcR3蛋白表达显著下降(图2).
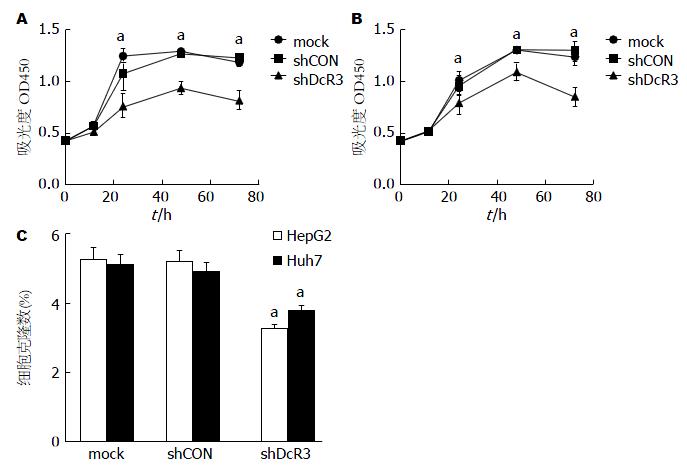
应用CCK-8法在不同时间点检测细胞生存情况, 结果显示, Huh7细胞感染LV-shDcR3组, 其细胞生存率在转染后24、48、72 h, 均低于空白组和感染对照组, 差异均有统计学意义(P<0.05, 图3A); HepG2细胞与Huh7细胞结果相似, 其感染LV-shDcR3后, 生存率显著低于空白组和感染对照组, 差异具有统计学意义(P<0.05, 图3B). 克隆形成实验结果显示, HepG2细胞中感染LV-shDcR3组的细胞克隆形成数为3.25%±0.12%, 明显低于空白组(5.24%±0.35%)和感染对照组(5.18%±0.33%), 差异具有统计学意义(P<0.05). Huh7细胞中感染LV-shDcR3组的细胞克隆形成数为3.76%±0.15%, 明显低于空白组(5.09%±0.31%)和感染对照组(4.89%±0.27%), 差异具有统计学意义(P<0.05, 图3C).
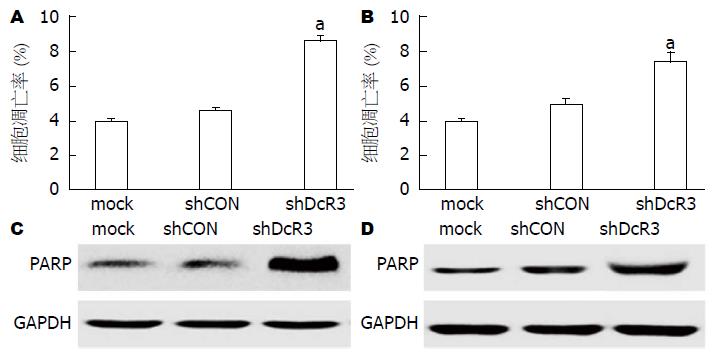
流式检测细胞早期凋亡情况, 结果显示, 与空白组和感染对照组相比, Huh7细胞感染LV-shDcR3组, 其早期凋亡细胞比列显著增多, 差异均有统计学意义(图4A); HepG2细胞与Huh7细胞结果相似, 其感染LV-shDcR3后, 早期凋亡细胞比例明显高于空白组和感染对照组(图4B). 在肝癌细胞HepG2和Huh7中, 与空白组和感染对照组相比, 感染LV-shDcR3组凋亡标志蛋白剪切型PARP表达明显增多, 差异具有统计学意义(图4C, D).
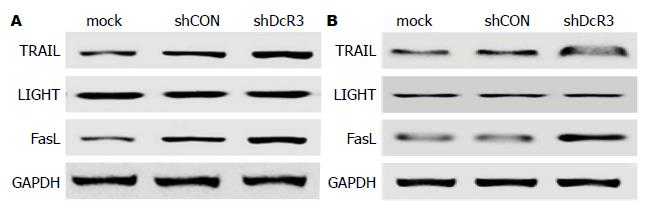
对细胞内死亡配体TRAIL、LIGHT和FasL的检测发现, HepG2和Huh7中感染LV-shDcR3组与空白组和感染对照组相比, TRAIL、FasL的表达上调, 差异具有统计学意义, LIGHT的表达无明显变化(图5).
DcR3是肿瘤坏死因子受体超家族的新成员, 定位于染色体20q13.3区. 人类DcR3分子编码一条由300个氨基酸组成的多肽链, 包括N端前一个由29个氨基酸残基构成的信号肽序列和随后的4个相对保守的半胱氨酸残基富集区. 由于缺乏明显的跨膜序列, DcR3是一个可溶性、分泌性蛋白, 其通过竞争性地与多种配体相结合, 参与调节能力代谢, 细胞周期, 凋亡等重要的细胞活动过程[11,12].
大量研究[13-15]证实, DcR3在多种肿瘤细胞中高表达, 其通过干扰相应配体的抗凋亡作用和免疫调节而在肿瘤免疫、自身免疫及移植免疫中发挥重要作用. 体外细胞实验发现DcR3能有力地阻断Fasl诱导的人类胰腺癌细胞和肺纤维母细胞的凋亡[16,17]. 对神经胶质细胞瘤患者及细胞系的体内体外研究[18,19]发现, 肿瘤细胞高表达DcR3可有效地阻断LIGHT介导的细胞凋亡. Chen等[9]通过对肝癌组织、癌旁组织和正常组织进行组织化学检测, 发现肝癌组织中DcR3的表达远远大于其他组织, 说明DcR3蛋白可能在肝癌的发生发展中起重要作用. DcR3基因在肝癌细胞中的表达和对肝癌细胞生物学活性的影响及其机制尚待进一步证实.
肝癌是一种发病隐匿却又高度恶性的肿瘤性疾病. 本研究通过检测正常肝细胞与肝癌细胞中DcR3的表达发现, DcR3在肝癌细胞中表达明显上调, 这提示DcR3可能作为一个癌基因参与肝癌的发生发展. 为进一步研究DcR3在肝癌中发生发展的作用及机制, 本研究构建靶向DcR3小干扰RNA重组慢病毒, 并将其感染肝癌细胞验证其干扰效果. 结果发现下调DcR3的表达可以抑制肝癌细胞株HepG2和Huh7细胞的增殖和克隆形成能力.
本研究通过流式细胞术以及Western blot检测凋亡标志蛋白剪切型PARP的表达情况发现, 下调DcR3的表达能够明显减少早期凋亡细胞比例, 增加凋亡标志蛋白的表达, 表明RNA干扰沉默DcR3基因表达可以促进细胞凋亡. 随着对肿瘤研究的不断深入, 人们逐渐认识到肿瘤的发生不仅与细胞增殖的增加有关, 也与肿瘤细胞凋亡减少密切相关[20,21]. 凋亡通路的紊乱/凋亡促进因子的抑制/凋亡抑制因子过表达以及凋亡基因表达失控都会导致肿瘤的发生、发展, 而且凋亡紊乱还导致肿瘤细胞对化疗药物的抵抗[22-25]. 死亡受体信号途径是诱导凋亡的外源性途径, 也是目前比较成熟的信号转导途径. TRAIL、LIGHT和FasL等死亡配体通过与相应受体结合后, 激活死亡受体信号通路, 进而诱导凋亡的发生[26-28]. 既往在胰腺癌的体内及体外实验显示, DcR3的过表达阻断FasL和TRAIL死亡受体结合介导的细胞凋亡, 导致肿瘤细胞的清除障碍[29,30]. 本研究通过检测干扰DcR3基因表达前后TRAIL、LIGHT和FasL等死亡配体的表达发现, 沉默DcR3基因表达能够明显抑制FasL和TRAIL的表达, 而LIGHT的表达无显著变化, 提示干扰肝癌细胞DcR3的表达, 抑制肝癌细胞凋亡的机制可能与阻断FasL和TRAIL介导的细胞凋亡途径有关.
总之, 本研究发现了DcR3在肝癌细胞中高表达, 下调DcR3可以有效地抑制肝癌细胞株HepG2和Huh7的增殖能力, 诱导肝癌细胞发生凋亡, 其机制可能与阻断FasL和TRAIL介导的细胞凋亡途径有关. 本研究揭示了DcR3基因在肝癌发生发展中的作用及其相关机制, 为临床靶向治疗肝癌提供新的思路.
诱骗受体3(decoy receptor 3, DcR3)作为分泌性蛋白, 可以竞争性结合FasL、LIGHT和TRAIL, 抑制FasL、LIGHT和TRAIL介导的细胞凋亡. 已有研究表明, DcR3蛋白在肝癌患者组织和血清中表达升高, 本研究进一步阐述DcR3在肝癌中的作用及其抗凋亡相关机制.
DcR3在多种肿瘤细胞中高表达, 其通过干扰FasL、LIGHT和TRAIL等配体而发挥抗凋亡作用, 目前主要在肿瘤免疫、自身免疫及移植免疫中研究较多. 但在不同肿瘤中发挥作用的具体机制仍亟待解决.
陈刚等通过对肝癌患者样本检测发现DcR3在肝癌组织和血清中表达升高, 提示DcR3可能在肝癌的发生发展中起重要作用. DcR3在胰腺癌的研究中较为深入, 体内体外均显示DcR3在胰腺癌中高表达, 且DcR3的过表达阻断FasL与介导的细胞凋亡.
本研究从细胞和分子生物学水平, 发现DcR3在肝癌细胞中高表达, 下调DcR3可以有效地抑制肝癌细胞的增殖能力, 诱导肝癌细胞凋亡, 其机制可能与阻断FasL和TRAIL介导的细胞凋亡途径有关.
本研究发现下调DcR3可以有效地抑制肝癌细胞的增殖能力, 诱导肝癌细胞凋亡, 且机制可能与阻断FasL和TRAIL介导的细胞凋亡途径有关.
可溶性受体: 是一种缺乏穿膜结构域的受体, 其可以游离在胞浆中, 竞争性结合FasL、LIGHT和TRAIL等配体, 抑制其与相应受体结合, 抑制相应死亡受体信号通路, 进而抑制凋亡的发生.
刘纯杰, 研究员, 军事医学科学院生物工程研究所; 钱福初, 副主任技师, 湖州市中心医院中心实验室
本文揭示了DcR3在肝癌细胞中的表达及抗凋亡作用, 其机制可能与阻断FasL和TRAIL介导的细胞凋亡途径有关, 为临床治疗肝癌提供新的思路和靶点.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Lin WW, Hsieh SL. Decoy receptor 3: a pleiotropic immunomodulator and biomarker for inflammatory diseases, autoimmune diseases and cancer. Biochem Pharmacol. 2011;81:838-847. [PubMed] [DOI] |
| 2. | Siakavellas SI, Sfikakis PP, Bamias G. The TL1A/DR3/DcR3 pathway in autoimmune rheumatic diseases. Semin Arthritis Rheum. 2015;45:1-8. [PubMed] [DOI] |
| 3. | Aiba Y, Nakamura M. The role of TL1A and DR3 in autoimmune and inflammatory diseases. Mediators Inflamm. 2013;2013:258164. [PubMed] [DOI] |
| 4. | Chen MH, Kan HT, Liu CY, Yu WK, Lee SS, Wang JH, Hsieh SL. Serum decoy receptor 3 is a biomarker for disease severity in nonatopic asthma patients. J Formos Med Assoc. 2016; Feb 22. [Epub ahead of print]. [PubMed] [DOI] |
| 5. | Ren Z, Zhu J, Gu H, Liu R, Chen S, Rong G, Sun B. Decoy receptor 3 polymorphisms are not associated with the risk of esophageal cancer in a Chinese population. Biomarkers. 2014;19:340-344. [PubMed] [DOI] |
| 6. | Zong L, Chen P, Wang DX. Death decoy receptor overexpression and increased malignancy risk in colorectal cancer. World J Gastroenterol. 2014;20:4440-4445. [PubMed] [DOI] |
| 7. | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-1255. [PubMed] [DOI] |
| 8. | Chacko S, Samanta S. "Hepatocellular carcinoma: A life-threatening disease". Biomed Pharmacother. 2016; Nov 4. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Chen G, Luo D. Expression of decoy receptor 3 in liver tissue microarrays. Natl Med J India. 2008;21:275-278. [PubMed] |
| 10. | Yang M, Chen G, Dang Y, Luo D. Significance of decoy receptor 3 in sera of hepatocellular carcinoma patients. Ups J Med Sci. 2010;115:232-237. [PubMed] [DOI] |
| 11. | Li J, Yin Q, Wu H. Structural basis of signal transduction in the TNF receptor superfamily. Adv Immunol. 2013;119:135-153. [PubMed] [DOI] |
| 12. | Fu Q, Fu TM, Cruz AC, Sengupta P, Thomas SK, Wang S, Siegel RM, Wu H, Chou JJ. Structural Basis and Functional Role of Intramembrane Trimerization of the Fas/CD95 Death Receptor. Mol Cell. 2016;61:602-613. [PubMed] [DOI] |
| 13. | Ge Z, Sanders AJ, Ye L, Jiang WG. Aberrant expression and function of death receptor-3 and death decoy receptor-3 in human cancer. Exp Ther Med. 2011;2:167-172. [PubMed] [DOI] |
| 14. | Tong J, Ao R, Wang Y, Chang B, Wang BY. Prognostic and clinicopathological differences of DcR3 in gastrointestinal cancer: evidence from meta-analysis. Int J Clin Exp Med. 2014;7:3096-3105. [PubMed] |
| 15. | Zhou J, Song S, Li D, He S, Zhang B, Wang Z, Zhu X. Decoy receptor 3 (DcR3) overexpression predicts the prognosis and pN2 in pancreatic head carcinoma. World J Surg Oncol. 2014;12:52. [PubMed] [DOI] |
| 16. | Zhang Y, Li D, Zhao X, Song S, Zhang L, Zhu D, Wang Z, Chen X, Zhou J. Decoy receptor 3 suppresses FasL-induced apoptosis via ERK1/2 activation in pancreatic cancer cells. Biochem Biophys Res Commun. 2015;463:1144-1151. [PubMed] [DOI] |
| 17. | Jiang M, Lin X, He R, Lin X, Liang L, Tang R, Xiong D, Wei K, Dang Y, Feng Z. Decoy Receptor 3 (DcR3) as a Biomarker of Tumor Deterioration in Female Reproductive Cancers: A Meta-Analysis. Med Sci Monit. 2016;22:1850-1857. [PubMed] [DOI] |
| 18. | Gill RM, Hunt JS. Soluble receptor (DcR3) and cellular inhibitor of apoptosis-2 (cIAP-2) protect human cytotrophoblast cells against LIGHT-mediated apoptosis. Am J Pathol. 2004;165:309-317. [PubMed] [DOI] |
| 19. | Hwang SL, Lin CL, Cheng CY, Lin FA, Lieu AS, Howng SL, Lee KS. Serum concentration of soluble decoy receptor 3 in glioma patients before and after surgery. Kaohsiung J Med Sci. 2004;20:124-127. [PubMed] [DOI] |
| 20. | Thompson CB. Apoptosis in pathogenesis and treatment of disease. Science. 1995;267:1465-1462. [PubMed] [DOI] |
| 21. | Ma DD, Yang WX. Engineered nanoparticles induce cell apoptosis: potential for cancer therapy. Oncotarget. 2016;7:40882-40903. [PubMed] [DOI] |
| 22. | Shi WY, Cao C, Liu L. Interferon α Induces the Apoptosis of Cervical Cancer HeLa Cells by Activating both the Intrinsic Mitochondrial Pathway and Endoplasmic Reticulum Stress-Induced Pathway. Int J Mol Sci. 2016;17:pii E1832. [PubMed] [DOI] |
| 23. | An HM, Tan YL, Shi J, Wang Z, Lv MH, Soares JC, Zhou D, Yang F, Zhang XY. Ginkgo biloba leaf extract and alpha-tocopherol attenuate haloperidol-induced orofacial dyskinesia in rats: Possible implication of antiapoptotic mechanisms by preventing Bcl-2 decrease and Bax elevation. Phytomedicine. 2016;23:1653-1660. [PubMed] [DOI] |
| 24. | Ahamed M, Akhtar MJ, Khan MA, Alhadlaq HA, Alshamsan A. Cobalt iron oxide nanoparticles induce cytotoxicity and regulate the apoptotic genes through ROS in human liver cells (HepG2). Colloids Surf B Biointerfaces. 2016;148:665-673. [PubMed] [DOI] |
| 25. | Abraha AM, Ketema EB. Apoptotic pathways as a therapeutic target for colorectal cancer treatment. World J Gastrointest Oncol. 2016;8:583-591. [PubMed] [DOI] |
| 26. | Gneo L, Ruggeri P, Cappabianca L, Farina AR, Di Ianni N, Mackay AR. TRAIL induces pro-apoptotic crosstalk between the TRAIL-receptor signaling pathway and TrkAIII in SH-SY5Y cells, unveiling a potential therapeutic "Achilles heel" for the TrkAIII oncoprotein in neuroblastoma. Oncotarget. 2016; Nov 4. [Epub ahead of print]. [PubMed] [DOI] |
| 27. | Zheng LL, Tan XW, Cui XZ, Yuan HJ, Li H, Jiao GZ, Ji CL, Tan JH. Preimplantation maternal stress impairs embryo development by inducing oviductal apoptosis with activation of the Fas system. Mol Hum Reprod. 2016;22:778-790. [PubMed] [DOI] |
| 28. | Voltan R, Secchiero P, Casciano F, Milani D, Zauli G, Tisato V. Redox signaling and oxidative stress: Cross talk with TNF-related apoptosis inducing ligand activity. Int J Biochem Cell Biol. 2016; Sep 26. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Zhang Y, Li D, Zhao X, Song S, Zhang L, Zhu D, Wang Z, Chen X, Zhou J. Decoy receptor 3 suppresses FasL-induced apoptosis via ERK1/2 activation in pancreatic cancer cells. Biochem Biophys Res Commun. 2015;463:1144-1151. [PubMed] [DOI] |