修回日期: 2016-11-27
接受日期: 2016-12-05
在线出版日期: 2017-01-28
研究KLF17基因转染对人结直肠癌细胞株SW480上皮-间质转化(epithelial-mesenchymal transition, EMT)和体外侵袭能力的影响.
将带有绿色荧光蛋白的重组KLF17表达质粒PIRES-EGFP-KLF17转染至SW480细胞中, 以未转染质粒的SW480细胞作为对照, 转染空载质粒的SW480细胞作为阴性对照. 荧光定量PCR和Western blot法检测转染前后KLF17 mRNA和蛋白表达水平. 采用QPCR和Western blot检测转染前后SW480细胞EMT上皮标志物E钙黏素(E-cadherin)和间质标志物波形蛋白(Vimentin)的表达变化. 用Transwell小室实验检测KLF17基因转染对SW480细胞的体外侵袭能力的影响.
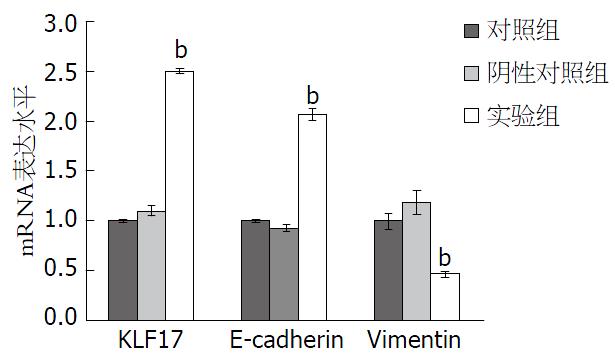
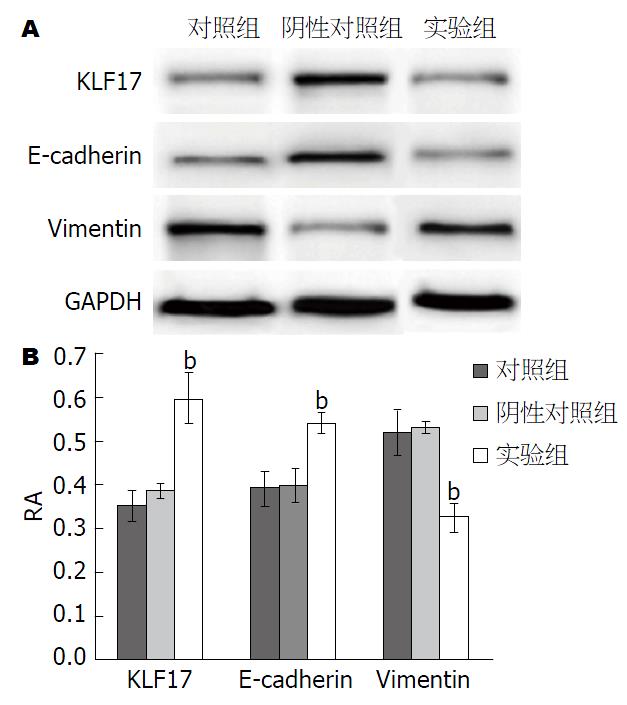
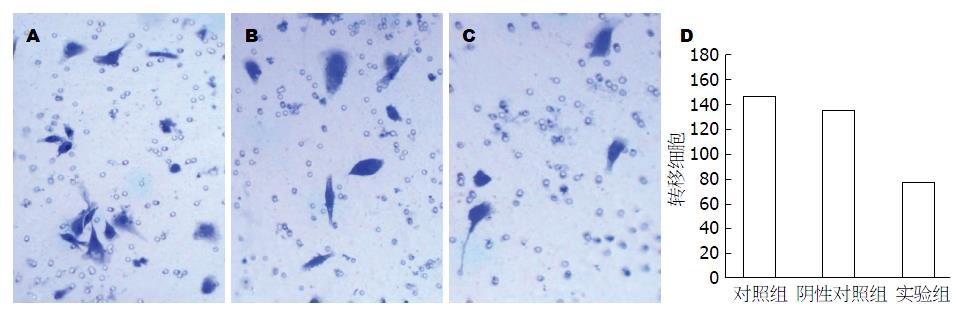
KLF17转染48 h后SW480细胞中KLF17 mRNA和蛋白表达水平(2.5087±0.0288; 0.6100±0.05790)均较对照组(1.0000±0.0198; 0.3543±0.0340)明显升高(均P<0.01); 转染KLF17基因后, SW480细胞中E-cadherin mRNA和蛋白的表达量(2.0704±0.0620; 0.5446±0.0245)较对照组均(1.0000±0.0106; 0.3952±0.0430)均显著升高(均P<0.01), Vimentin mRNA和蛋白的表达量(0.4622±0.0279; 0.3290±0.0367)较对照组(1.0000±0.0780; 0.5229±0.0496)均显著降低(均P<0.01); 转染KLF17基因后SW480细胞的体外侵袭能力(86.67个±10.97个)较对照组(145.30个±11.37个)及阴性对照组(135.33个±12.66个)均显著降低(均P<0.01).
KLF17基因可能通过抑制结直肠癌细胞EMT而降低其侵袭能力.
核心提要:KLF17作为可能的抑癌基因在结直肠癌侵袭转移中的作用及分子机制鲜有报道. 本实验发现初步证实KLF17过表达可能通过抑制上皮间质转化降低结直肠癌细胞的侵袭能力.
引文著录: 彭晶晶, 孟庆彬, 肖新波, 陈华涛, 赵春翔, 瞿紫微. 过表达KLF17对结直肠癌细胞SW480上皮-间质转化和体外侵袭能力的影响. 世界华人消化杂志 2017; 25(3): 220-226
Revised: November 27, 2016
Accepted: December 5, 2016
Published online: January 28, 2017
To assess the impact of KLF17 overexpression on the epithelial-mesenchymal transition (EMT) and invasive ability of SW480 colorectal cancer cells.
The recombinant KLF17 expression plasmid with EGFP was transfected into SW480 cells, and non-transfected SW480 cells and SW480 cells transfected with the empty vector were used as controls. The changes in KLF17 mRNA and protein expression were detected by real-time PCR and Western blot at 48 h after transfection with the recombinant KLF17 expression plasmid. The changes in the expression of epithelial and mesenchymal makers in SW480 cells were detected by real-time PCR and Western blot. Transwell chamber invasion assay was used to investigate the effect of KLF17 gene transfection on the invasive potential of SW480 cells.
The expression levels of KLF17 mRNA and protein in SW480 cells transfected with the recombinant plasmid (2.5087 ± 0.0288; 0.6100 ± 0.0579) were significantly increased compared with those in non-transfected SW480 cells (1.0000 ± 0.0198; 0.3543 ± 0.0340) (P < 0.01 for both). The expression levels of E-cadherin mRNA and protein in SW480 cells transfected with the recombinant plasmid (2.0704 ± 0.0620; 0.5446 ± 0.0245) were significantly higher than those in non-transfected SW480 cells (1.0000 ± 0.0106; 0.3952 ± 0.0430) (P < 0.01 for both), while the expression levels of vimentin mRNA and protein in SW480 cells transfected with the recombinant plasmid (0.4622 ± 0.0279; 0.3290 ± 0.0367) were significantly lower than those in non-transfected SW480 cells (1.0000 ± 0.0780; 0.5229 ± 0.0496) (P < 0.01 for both). After transfection with the recombination KLF17 expression plasmid, the invasive ability of SW480 cells (86.67 ± 10.97) was significantly lower than that of non-transfected SW480 cells (145.30 ± 11.37) and SW480 cells transfected with the empty vector (135.33 ± 12.66) (P < 0.01 for both).
KLF17 may inhibit SW480 cancer cell invasion by inhibiting EMT.
- Citation: Peng JJ, Meng QB, Xiao XB, Chen HT, Zhao CX, Qu ZW. Influence of KLF17 overexpression on epithelial-mesenchymal transition and invasion of SW480 colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2017; 25(3): 220-226
- URL: https://www.wjgnet.com/1009-3079/full/v25/i3/220.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i3.220
结直肠癌的复发和转移是影响其治疗效果的主要障碍[1-5], 而且至今癌细胞获得侵袭转移能力的机制尚未完全阐明[6-8]. 细胞上皮-间质转化(epithelial-mesenchymal transition, EMT), 是指在生理或者病理条件下正常的上皮细胞向间质性细胞转变的一种现象[9,10]. 研究[11-14]表明, 细胞发生EMT能够显著增强肿瘤细胞的侵袭转移能力, 并且已经在多种恶性肿瘤中得到证实. EMT的发生会引起细胞之间的黏附能力丧失, 进而导致细胞转移和侵袭能力增强[15]. 目前靶向抑制肿瘤细胞的侵袭转移已成为肿瘤疾病防治的重要环节. Krüppel样因子(Krüppel like factors, KLFs)是指一类在羧基端有3个C2H2锌指结构的转录因子, 在细胞增殖、分化和凋亡过程中具有广泛的调控作用[16,17]. KLF17与多种上皮性肿瘤的发展密切相关, 不仅参与肿瘤细胞的增殖与分化, 还参与调节肿瘤细胞的侵袭转移[18-22]. 研究[23,24]发现KLF17低表达与结直肠癌患者的预后密切相关.
本研究通过建立KLF17过表达质粒, 并将其转染至人的结直肠癌SW480细胞中, 检测EMT发生的标志性物质E钙黏素(E-cadherin)和波形蛋白(Vimentin)的mRNA以及蛋白表达水平变化及其对SW480细胞侵袭能力的影响, 以期揭示KLF17在结直肠癌细胞的侵袭转移中可能发挥的作用.
人结直肠癌细胞系SW480由本实验室保存. PIRES-EGFP质粒购自武汉华联科生物公司; 自行构建KLF17重组表达质粒PIRES-EGFP-KLF17. Tranwell小室购自Coring Coster公司; KLF17抗体购自Santa Cruz公司; E-cadherin和Vimentin抗体购自Thermo公司; RNA TRIzol提取试剂盒购、QPCR试剂盒和反转录试剂盒购自Takara公司.
1.2.1 细胞培养: 人结直肠癌细胞株SW480培养于含10%胎牛血清的杜尔伯科改良伊格尔(dulbecco's modified eagle medium, DMEM)培养液中, 37 ℃、50 mL/L CO2条件下培养; 0.3%胰酶消化和传代, 取对数生长期细胞备用.
1.2.2 基因转染实验: 使用电转法将KLF17重组表达质粒PIRES-EGFP-KLF17转入SW480细胞中. 转染24 h前将细胞进行分瓶传代, 然后用0.25%胰酶消化, PBS缓冲液冲洗3次, 显微镜下细胞计数并调节浓度为2×106/30 μL, 置于冰上备用. 将重组质粒和细胞悬液加入4 mm电转杯中, 混合均匀, 冰浴5-10 min. 电压450 V, 电容500 mu电转条件下进行电穿孔. 电转完毕后, 将电转杯取出并冰浴5-10 min, 然后将细胞转移到24孔细胞培养板中, 每孔加入含10%胎牛血清的DMEM培养液1 mL, 37 ℃、50 mL/L CO2条件下培养. 实验组为转染重组质粒PIRES-EGFP-KLF17的SW480细胞, 阴性对照组为转染空载质粒, 以未转染的SW480细胞作为对照.
1.2.3 QPCR和Western blot法检测KLF17的表达: 收集转染后48 h的细胞, 用TRIzol裂解细胞并提取细胞总RNA, 使用PrimeScriptTM II 1st Strand cDNA Synthesis Kit(Takara公司)进行cDNA合成反应. 采用Primer Premier 5.0软件设计引物并由武汉华联科生物公司合成, 引物序列如表1. 采用20 μL反应体系(2×SYBR Premix Ex TaqTM 9 μL, 上游引物0.5 μL, 下游引物0.5 μL, cDNA溶液1 μL, DEPC H2O 9 μL)进行QPCR反应, 95 ℃预变性30 s, 95 ℃ 20 s, 60 ℃ 15 s, 72 ℃ 20 s, 40个循环. 采用△△Ct法进行定量结果的处理. 各组细胞总蛋白的提取采用武汉华联科生物公司的蛋白提取试剂盒抽提, BCA法定量蛋白. 取细胞总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 检测各组中KLF17的蛋白含量.
| 基因 | 上游引物(5'-3') | 下游引物(5'-3') |
| KLF17 | TAGTAAAGGGGATGGTGCGA | CTCACACCCTAGCCAAAGCC |
| E-cadherin | TTGTGGAAGGAATGGAGGAGTC | ACCTGGAATTGGGCAAATGTG |
| Vimentin | AGATGGCCCTTGACATTGAG | TGGAAGAGGCAGAGAAATCC |
| GAPDH | CGACCACTTTGTCAAGCTCA | AGGGGTCTACATGGCAACTG |
1.2.4 转染前后细胞侵袭能力的检测: 实验前将Tranwell小室滤膜每孔加入50 μL按1:3比例混合Matrigel和无血清RPMI 1640培养基, 培养箱中聚合2 h. 取对数生长期细胞消化计数, 用1640培养基重悬细胞并调整浓度1×105个/mL后, 取10 μL细胞悬液接种于上室, 下室用常规培养基作趋化因子, 37 ℃培养24 h后取出滤膜, 擦去胶和上室细胞, 4%多聚甲醛固定、Gimsa染色, 显微镜下计数并拍照.
1.2.5 E-cadherin和Vimentin表达检测: QPCR和Western blot法检测细胞中EMT上皮及间质标志物E-cadherin和Vimentin的表达, 方法步骤同1.2.3. QPCR引物如表1.
统计学处理 采用SPSS18.0软件进行数据分析, 计量资料分析结果以mean±SD表示, QPCR、Western blot和侵袭实验结果采用单因素方差分析(one-way ANOVA)处理, P<0.05表示差异有统计学意义.
KLF17重组表达质粒PIRES-EGFP-KLF17经双酶切及测序鉴定证实序列完全正确, 说明KLF17表达载体构建成功. 如图1所示, 转染PIRES-EGFP-KLF17重组质粒的SW480细胞48 h后KLF17 mRNA表达水平(2.5087±0.0288)显著高于对照组(1.0±0.0198)和阴性对照组(1.1044±0.0517)(均P<0.01), 说明KLF17已经成功转染入SW480细胞中且能够在细胞中正常表达; 转染PIRES-EGFP-KLF17后, 实验组E-cadherin的mRNA表达水平(2.0704±0.0620)显著高于对照组(1.0±0.0106)及阴性对照组(0.9287±0.0337)(均P<0.01), 实验组Vimentin的mRNA表达水平(0.4622±0.0279)显著低于对照组(1.0±0.0780)及阴性对照组(1.1888±0.1207)(均P<0.01).
Western blot检测结果如图2所示, KLF17和E-cadherin在转染PIRES-EGFP-KLF17的SW480细胞中的蛋白表达水平(0.610±0.0579和0.5446±0.0245)显著高于对照组(0.3543±0.034和0.3952±0.043)(P<0.01), 阴性对照组(0.3856±0.018和0.4023±0.0391)与对照组相比无明显变化. 与对照组(0.5229±0.0496)和阴性对照组(0.5339±0.0134)相比, 实验组SW480细胞中Vimentin蛋白表达水平(0.329±0.0367)显著降低(P<0.01).
Transwell体外侵袭实验观察到, 48 h后各组细胞均有穿出微孔滤膜, 如图3所示. 对照组(图3A)、阴性对照组(图3B)和实验组(图3C)显微镜下计数穿膜细胞数分别为145.3个±11.37个、135.33个±12.66个和86.67个±10.97个, 结果表明PIRES-EGFP-KLF17转染后SW480细胞的体外侵袭转移能力显著低于对照组和阴性对照组(均P<0.05, 图3D).
KLF17属于特化蛋白/Krüppel样因子锌指蛋白家族, 具有各种不同功能的转录因子,他们可以通过结合不同的启动子或蛋白, 刺激或者抑制细胞的各种生命活动[16,21]. 近年来诸多研究显示, KLF17在正常组织中的表达水平显著高于在肿瘤细胞中的表达水平, 如肺癌[20]、肝癌[25,26]、乳腺癌[19,27]、胃癌[28]、食管癌[22]及结肠癌[23,24]等, 因此推测KLF17的表达上调具有抑制肿瘤发生的作用. Liu等[25]和Sun等[26]在对肝癌组织中KLF17的研究中还发现, KLF17对肿瘤细胞的侵袭和转移也有重要的调解作用. 但是, 目前关于KLF17在结直肠癌侵袭转移中的作用及分子机制研究较少.
本实验探讨了KLF17在结直肠癌细胞株SW480中过表达对细胞侵袭转移的影响. 将构建好的PIRES-EGFP-KLF17质粒转染至SW480细胞, 48 h后在基因水平和蛋白水平检测的KLF17表达. 发现转染组与两组对照组相比, KLF17蛋白水平表达上升. Transwell实验结果证实, 转染PIRES-EGFP-KLF17质粒48 h后穿透基底膜的SW480细胞个数显著低于两个对照组, 表明过表达KLF17蛋白后SW480细胞的侵袭能力受到显著抑制. KLF17在肺癌和肝癌等恶性肿瘤中表达也比较低, 且在肿瘤的分化、增殖和凋亡中发挥重要作用, 常被作为抑癌基因[20,25]. 许多研究[21]结果已经证实KLF17与肿瘤的转移及预后存在负相关. 在本实验中, 过表达KLF17组结直肠癌细胞转移能力降低, 我们推测诱导KLF17表达能够通过抑制结直肠癌细胞的侵袭抑制肿瘤的发展.
EMT是多种上皮来源肿瘤细胞发生迁徙和转移的重要分子机制之一[29]. E-cadherin是EMT发生过程中重要的上皮细胞样标志物. 肿瘤细胞发生转移和侵袭的主要原因是由于细胞黏附功能的丧失导致的, 抑制E-cadherin可以增加肿瘤细胞的浸润和转移[29,30]. Vimentin是构成细胞的骨架蛋白的主要成分, 在多种上皮性肿瘤细胞中表达[31]. E-cadherin和Vimentin的异常表达常被认为与EMT的发生密切相关, 在人类结直肠癌的侵袭转移中起着重要作用[32-34]. 研究[26,27,35]发现KLF17通过抑制EMT过程抑制多种人类肿瘤细胞侵袭及转移. 但目前关于KLF17在结直肠癌细胞上皮间质转化过程中的作用尚鲜有报道.
本研究通过Westerm blot和QPCR检测发现, 转染PIRES-EGFP-KLF17质粒的结直肠癌细胞组与对照组相比, EMT指示标志物E-cadherin的表达显著升高, Vimentin的表达显著下降. E-cadherin和Vimentin是EMT发生过程中重要的上皮细胞标志物和间质细胞标志物, 本实验结果表明KLF17表达上调可以干扰SW480细胞EMT现象的发生, 进一步证实了KLF17在结直肠癌细胞系中可以通过调控E-cadherin和Vimentin的表达水平介导结直肠癌细胞的转移.
总之, 在高表达KLF17的结直肠癌细胞中, 结直肠癌细胞的迁移和侵袭能力均受到抑制, 同时上皮细胞的标志物E-cadherin的表达显著上升, 间质细胞的标志物Vimentin表达显著下降. 我们推测, 过表达 KLF17可以通过调控E-cadherin和Vimentin的表达水平抑制肿瘤细胞发生EMT现象, 从而阻碍肿瘤细胞的侵袭和转移. 然而, KLF17对肿瘤侵袭能力影响的相关信号转导通路尚不清楚, 还需进一步深入探讨.
上皮-间质转化(epithelial-mesenchymal transition, EMT)是结直肠癌发生侵袭转移的重要机制之一, 其分子调控机制尚未阐明. KLF17作为可能的抑癌基因与多种上皮性肿瘤的上皮间质转化、增殖及侵袭转移密切相关. KLF17低表达与结直肠癌患者的预后密切相关. 但KLF17在结直肠癌细胞的侵袭转移中的作用及分子机制尚未阐明.
有关KLF17在结直肠肿瘤中的表达及作用是目前研究的热点及重点. 但是KLF17在结直肠肿瘤上皮间质转化及侵袭转移中的作用机制尚未阐明, 亟待研究.
本文发现KLF17低表达与结直肠癌患者的预后密切相关, 但其在结直肠癌转移中的作用及机制至今尚鲜有报道.
本研究初步发现KLF17过表达明显抑制EMT及肿瘤侵袭性, 目前国内外鲜有报道.
KLF17作为重要的抑癌基因在癌症治疗和预后判断方面均有非常重要的作用. 通过过表达KLF17基因, 研究其对胃癌细胞侵袭能力及上皮间质转化的影响, 为结直肠癌的治疗提供了一条思路.
上皮-间质转化(EMT): 是指上皮细胞在特定的生理和病理情况下向间质细胞转化的现象, 其主要特征是上皮细胞表型的缺失及间质特性的获得.
邓安梅, 教授, 主任医师, 第二军医大学长海医院实验诊断科; 韩安家, 教授, 主任医师, 中山大学附属第一医院病理科
本文题目简洁, 准确指出研究内容. 摘要内容具体, 实验设计合理, 方法正确.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Massalou D, Benizri E, Chevallier A, Duranton-Tanneur V, Pedeutour F, Benchimol D, Béréder JM. Peritoneal carcinomatosis of colorectal cancer: novel clinical and molecular outcomes. Am J Surg. 2016; Aug 5. [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Moriarity A, O'Sullivan J, Kennedy J, Mehigan B, McCormick P. Current targeted therapies in the treatment of advanced colorectal cancer: a review. Ther Adv Med Oncol. 2016;8:276-293. [PubMed] [DOI] |
| 3. | Takatsu Y, Fukunaga Y, Hamasaki S, Ogura A, Nagata J, Nagasaki T, Akiyoshi T, Konishi T, Fujimoto Y, Nagayama S. Recurrent colorectal cancer after endoscopic resection when additional surgery was recommended. World J Gastroenterol. 2016;22:2336-2341. [PubMed] [DOI] |
| 4. | Nordholm-Carstensen A. Pulmonary nodules and metastases in colorectal cancer. Dan Med J. 2016;63:B5190. [PubMed] |
| 5. | Saltz LB. Value in Colorectal Cancer Treatment: Where It Is Lacking, and Why. Cancer J. 2015;22:232-235. [PubMed] [DOI] |
| 6. | Markovic S, Dimitrijevic I, Zogovic B, Markovic V, Barisic G, Krivokapic Z. Current trends in clinical genetics of colorectal cancer. J BUON. 2016;21:1042-1049. [PubMed] |
| 7. | Müller MF, Ibrahim AE, Arends MJ. Molecular pathological classification of colorectal cancer. Virchows Arch. 2016;469:125-134. [PubMed] [DOI] |
| 8. | Obuch JC, Ahnen DJ. Colorectal Cancer: Genetics is Changing Everything. Gastroenterol Clin North Am. 2016;45:459-476. [PubMed] [DOI] |
| 9. | Zhu G, Li X, Guo B, Ke Q, Dong M, Li F. PAK5-mediated E47 phosphorylation promotes epithelial-mesenchymal transition and metastasis of colon cancer. Oncogene. 2016;35:1943-1954. [PubMed] [DOI] |
| 10. | Zhang J, Zhu L, Fang J, Ge Z, Li X. LRG1 modulates epithelial-mesenchymal transition and angiogenesis in colorectal cancer via HIF-1α activation. J Exp Clin Cancer Res. 2016;35:29. [PubMed] [DOI] |
| 11. | Nguyen L, Ager EI, Neo J, Christophi C. Regulation of colorectal cancer cell epithelial to mesenchymal transition by the renin angiotensin system. J Gastroenterol Hepatol. 2016;31:1773-1782. [PubMed] [DOI] |
| 12. | Wang H, Wang Y, Du Q, Lu P, Fan H, Lu J, Hu R. Inflammasome-independent NLRP3 is required for epithelial-mesenchymal transition in colon cancer cells. Exp Cell Res. 2016;342:184-192. [PubMed] [DOI] |
| 13. | Diepenbruck M, Christofori G. Epithelial-mesenchymal transition (EMT) and metastasis: yes, no, maybe? Curr Opin Cell Biol. 2016;43:7-13. [PubMed] [DOI] |
| 14. | Meng FD, Wei JC, Qu K, Wang ZX, Wu QF, Tai MH, Liu HC, Zhang RY, Liu C. FoxM1 overexpression promotes epithelial-mesenchymal transition and metastasis of hepatocellular carcinoma. World J Gastroenterol. 2015;21:196-213. [PubMed] [DOI] |
| 15. | Jayachandran A, Dhungel B, Steel JC. Epithelial-to-mesenchymal plasticity of cancer stem cells: therapeutic targets in hepatocellular carcinoma. J Hematol Oncol. 2016;9:74. [PubMed] [DOI] |
| 16. | van Vliet J, Crofts LA, Quinlan KG, Czolij R, Perkins AC, Crossley M. Human KLF17 is a new member of the Sp/KLF family of transcription factors. Genomics. 2006;87:474-482. [PubMed] [DOI] |
| 17. | Iwanicki MP, Brugge JS. Transcriptional regulation of metastatic [Id]entity by KLF17. Genome Biol. 2009;10:244. [PubMed] [DOI] |
| 18. | Ali A, Shah AS, Ahmad A. Gain-of-function of mutant p53: mutant p53 enhances cancer progression by inhibiting KLF17 expression in invasive breast carcinoma cells. Cancer Lett. 2014;354:87-96. [PubMed] [DOI] |
| 19. | Ismail IA, Kang HS, Lee HJ, Kim JK, Hong SH. DJ-1 upregulates breast cancer cell invasion by repressing KLF17 expression. Br J Cancer. 2014;110:1298-1306. [PubMed] [DOI] |
| 20. | Ali A, Bhatti MZ, Shah AS, Duong HQ, Alkreathy HM, Mohammad SF, Khan RA, Ahmad A. Tumor-suppressive p53 Signaling Empowers Metastatic Inhibitor KLF17-dependent Transcription to Overcome Tumorigenesis in Non-small Cell Lung Cancer. J Biol Chem. 2015;290:21336-21351. [PubMed] [DOI] |
| 21. | Ali A, Zhang P, Liangfang Y, Wenshe S, Wang H, Lin X, Dai Y, Feng XH, Moses R, Wang D. KLF17 empowers TGF-β/Smad signaling by targeting Smad3-dependent pathway to suppress tumor growth and metastasis during cancer progression. Cell Death Dis. 2015;6:e1681. [PubMed] [DOI] |
| 22. | Li S, Qin X, Cui A, Wu W, Ren L, Wang X. Low expression of KLF17 is associated with tumor invasion in esophageal carcinoma. Int J Clin Exp Pathol. 2015;8:11157-11163. [PubMed] |
| 23. | 孟 庆彬, 吴 彪, 肖 新波, 邵 永胜, 闵 凯, 瞿 紫微, 冯 燕, 王 静, 易 继林. 结直肠癌组织中Krüppel样因子17的表达及其与预后的关系. 肿瘤防治研究. 2015;42:256-260. |
| 25. | Liu FY, Deng YL, Li Y, Zeng D, Zhou ZZ, Tian DA, Liu M. Down-regulated KLF17 expression is associated with tumor invasion and poor prognosis in hepatocellular carcinoma. Med Oncol. 2013;30:425. [PubMed] [DOI] |
| 26. | Sun Z, Han Q, Zhou N, Wang S, Lu S, Bai C, Zhao RC. MicroRNA-9 enhances migration and invasion through KLF17 in hepatocellular carcinoma. Mol Oncol. 2013;7:884-894. [PubMed] [DOI] |
| 27. | Gumireddy K, Li A, Gimotty PA, Klein-Szanto AJ, Showe LC, Katsaros D, Coukos G, Zhang L, Huang Q. KLF17 is a negative regulator of epithelial-mesenchymal transition and metastasis in breast cancer. Nat Cell Biol. 2009;11:1297-1304. [PubMed] [DOI] |
| 28. | Peng JJ, Wu B, Xiao XB, Shao YS, Feng Y, Yin MX. Reduced Krüppel-like factor 17 (KLF17) expression correlates with poor survival in patients with gastric cancer. Arch Med Res. 2014;45:394-399. [PubMed] [DOI] |
| 29. | Gurzu S, Silveanu C, Fetyko A, Butiurca V, Kovacs Z, Jung I. Systematic review of the old and new concepts in the epithelial-mesenchymal transition of colorectal cancer. World J Gastroenterol. 2016;22:6764-6775. [PubMed] [DOI] |
| 30. | Coopman P, Djiane A. Adherens Junction and E-Cadherin complex regulation by epithelial polarity. Cell Mol Life Sci. 2016;73:3535-3553. [PubMed] [DOI] |
| 31. | Altobelli E, Angeletti PM, Latella G. Role of Urinary Biomarkers in the Diagnosis of Adenoma and Colorectal Cancer: A Systematic Review and Meta-Analysis. J Cancer. 2016;7:1984-2004. [PubMed] [DOI] |
| 32. | Li W, Zong S, Shi Q, Li H, Xu J, Hou F. Hypoxia-induced vasculogenic mimicry formation in human colorectal cancer cells: Involvement of HIF-1a, Claudin-4, and E-cadherin and Vimentin. Sci Rep. 2016;6:37534. [PubMed] [DOI] |
| 33. | Jaca A, Govender P, Locketz M, Naidoo R. The role of miRNA-21 and epithelial mesenchymal transition (EMT) process in colorectal cancer. J Clin Pathol. 2016; Sep 26. [Epub ahead of print]. [PubMed] [DOI] |
| 34. | Gao T, Wang M, Xu L, Wen T, Liu J, An G. DCLK1 is up-regulated and associated with metastasis and prognosis in colorectal cancer. J Cancer Res Clin Oncol. 2016;142:2131-2140. [PubMed] [DOI] |
| 35. | Dong P, Kaneuchi M, Xiong Y, Cao L, Cai M, Liu X, Guo SW, Ju J, Jia N, Konno Y. Identification of KLF17 as a novel epithelial to mesenchymal transition inducer via direct activation of TWIST1 in endometrioid endometrial cancer. Carcinogenesis. 2014;35:760-768. [PubMed] [DOI] |