修回日期: 2017-08-24
接受日期: 2017-08-29
在线出版日期: 2017-10-08
基于代谢组学方法研究应激性高血压大鼠尿液中的差异性代谢组份, 并通过差异性代谢组份探讨应激性高血压的发病机制, 为进一步进行应激性高血压大鼠的药物治疗提供实验依据.
♂Wistar大鼠20只分为正常对照组与应激性高血压模型组, 正常对照组未行任何处理, 应激性高血压模型组大鼠给予足底电刺激、制动、夹尾等刺激. 用大鼠尾动脉测压仪尾套法测各组大鼠尾动脉收缩压确定应激性高血压模型建立成功后, 收集各组大鼠尿液, 通过核磁共振氢谱法测出各组大鼠尿液中差异性代谢组份.
(1)通过足底电刺激足底电刺激、制动、夹尾等复合刺激方法可以建立应激性高血压模型; (2)与正常组相比, 应激性高血压模型组大鼠尿液中酪氨酸、苯丙氨酸、丙酮、1-甲基组氨酸、β-葡萄糖、乙酸-醋酸盐、甲酸、乙酰乙酸、丙二酸、柠檬酸、苹果酸、肌酸酐、肌酸、尿素的含量增加.
应激性高血压大鼠存在脂类、氨基酸、糖代谢异常.
核心提要: 作者在既往的造模方法的基础上, 用到了生理应激和心理应激合在一起的复合性应激, 而且利用代谢组学方法, 根据差异性代谢组份对应激性高血压的发病机制进行探讨, 为进一步进行应激性高血压的药物治疗奠定了一定的基础.
引文著录: 哈力旦·阿布都, 吴桂霞, 钟莉, 卡思木江·阿西木江, 张景萍, 黎佳, 楚岚鹏, 库热西·玉努斯. 基于NMR代谢组学方法研究应激性高血压大鼠尿液中的差异性代谢组份. 世界华人消化杂志 2017; 25(28): 2551-2558
Revised: August 24, 2017
Accepted: August 29, 2017
Published online: October 8, 2017
To identify differential urinary metabolites in rats with stress induced hypertension using a nuclear magnetic resonance (NMR)-based metabolomic approach to help clarify the pathogenesis of stress induced hypertension and provide experimental basis for its pharmaceutical treatment.
Twenty male Wistar rats were divided into a normal control group and a stress induced hypertension model group. The normal control group was not given any treatment, while hypertension was induced by stress in rats of the stress induced hypertension model group. After using a rat tail arteriometer to measure arterial systolic blood pressure to verify the successful induction of hypertension, urinary samples were collected from the rats to identify differential urinary metabolites using the NMR-based metabolomic method.
By measuring arterial systolic blood pressure using a rat tail arteriometer, it was confirmed that hypertension was successfully induced in rats. Compared with the normal control group, the contents of tyrosine, phenylalanine, acetone, 1-methyl histidine, β-glucose, acetate-acetic acid, formic acid, salt acetoacetate, malonic acid, citric acid, malic acid, and creatinine were increased in urine of rats of the stress induced hypertension model group.
Hypertensive rats present with abnormal lipid, amino acid, and glucose metabolism.
- Citation: Abudu H, Wu GX, Zhong L, Aximujiang K, Zhang JP, Li J, Chu LP, Yunusi K. Nuclear magnetic resonance-based metabolomic identification of differential urinary metabolites in rats with stress induced hypertension. Shijie Huaren Xiaohua Zazhi 2017; 25(28): 2551-2558
- URL: https://www.wjgnet.com/1009-3079/full/v25/i28/2551.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i28.2551
应激是加拿大生理学家Selye于20世纪30年代末提出的, 是指机体在受到各种内外环境因素及社会、心理因素刺激时所出现的非特异性全身性适应反应. 现代生活节奏的加快、工作压力的增加、人际关系复杂及对经济状况的担忧等因素均可使人处于应激状态[1,2]. 经过大量的研究[3-6], 人们发现应激状态下机体会发生体温、心血管系统、神经内分泌系统及免疫系统等多个组织脏器功能改变, 应激与机体神经内分泌免疫系统之间的密切关系也得到普遍认可. 一项约有3000人参与的研究报道[7]显示, 青年时期处于应激状态的人在15年后发生高血压的概率大于其他未经历应激状态的人. 另外因紧张的工作环境和工作内容本身的压力等应激因素导致的高血压的发病也越来越受到关注[8-11]. 应激性高血压在高血压病中所占据的比例日益增加[12,13]. 目前临床上治疗高血压的药物很多, 但是还尚未研制出专门针对应激性高血压的降压药. 因此, 明确应激性高血压的发病机制是当下治疗及防治应激性高血压的一项重要课题. 本实验首先建立了应激性高血压大鼠模型, 以基于核磁共振(nuclear magnetic resonance, NMR)的代谢组学方法拟探讨应激所致的代谢组份的变化在高血压发生发展中的作用, 为进一步研发治疗应激性高血压的药物提供实验依据.
(1)动物: 选择健康SPF级♂Wistar品系大鼠20只, 体质量200 g±30 g. 购自新疆医科大学动物实验中心; (2)仪器与试剂: Inova600型核磁共振波谱仪(美国Varian公司); BP-600A全自动大小鼠无创血压测量系统(成都泰盟公司); ZH-B6大鼠代谢笼(淮北正华生物仪器设备有限公司); 2,4-二硝基氯苯(天津市光复精细化工研究所); 重水(美国Sigma公司); 3-(甲基硅基)氘代丙酸钠(TSP)(美国Sigma公司); 磷酸氢二钠(NaH2PO4)(天津市光复精细化工研究所); 磷酸二氢钾(K2HPO4)(天津市光复精细化工研究所).
1.2.1 应激性高血压大鼠模型的建立: 应激性高血压模型组大鼠10只, 动物模型制备以足底电击结合噪声[14]以及制动、夹尾等基本手段作为应激条件. 将应激性高血压模型组大鼠随机2只为一起放入底部铺有铜栅的电击笼中, 电击笼大小为24 cm×24 cm×28 cm, 铜栅上通以短暂交流电, 电击电压从30 V开始每隔3 d增加5 V, 最高电压达75 V, 电击比为60%-70%, 电击时间为每日上午10-12点2个小时. 在电击的同时给予由蜂鸣器发出的强度为90-100 dB的噪声刺激. 刺激的间隔时间人工随机控制, 一般为5-20 s. 电击和噪声刺激结束后, 每只老鼠放入制动管内30 min, 制动结束前5 min用书夹夹住每只老鼠的尾部. 造成动物高度精神紧张及烦躁. 正常对照组(10只)在相对湿度60%-80%及(25 ℃±3 ℃)室温下用普通饲料饲养, 自由饮食水每天维持正常12 h光照, 整个实验过程中不给予任何应激刺激.
1.2.2 大鼠尾动脉收缩压测定: 正常对照组和应激性高血压模型组大鼠处于清醒状态下, 用大鼠尾动脉测压仪尾套法测各组大鼠尾动脉收缩压, 每次测量均在应激刺激停止2 h后进行.
1.2.3 鉴定标准: 大鼠血压在85-120 mmHg范围为正常血压, 血压较造模前升高20-25 mmHg及以上并超过135 mmHg者为造模成功, 血压无明显升高或死亡者为失败. 按照此标准鉴定应激性高血压模型是否建立成功.
1.2.4 尿液的收集与制备: 将正常对照组和应激性高血压模型组大鼠单只放入代谢笼, 禁食, 不禁水, 收集24 h的尿液, 4 ℃, 3000 r/min离心15 min后取上清2 mL分装于EP管中加入50 μL叠氮钠, 并放入-80 ℃冰箱保存, 备用. 上样前, 取缓慢解冻后的尿液400 μL, 再加入200 μL含0.05%TSP的重水配制的磷酸缓冲液(K2HPO4/NaH2PO4, 1.5 mol/L, PH = 7.4)中混合, 室温条件下置15 min, 以1000 r/min离心10 min后取上清液550 μL, 放入5 mm的核磁管中.
1.2.5 尿液核磁共振氢谱的(1HMR)测定: 使用Inova600型核磁共振波谱仪调用NOESYPRESAT-1D脉冲序列进行尿液氢谱测定. 以TSP作为内标, 其化学位移定为0 ppm. 在25 ℃的测试温度下采用预饱和方式抑制水峰, 饱和时间为2 s, 采样点数32 k, 扫描次数为128次, 谱宽为10000 Hz. 以解谱作为目的, 部分样品测试了J-分解谱, 1H-1H同核相关谱和质子全相关谱等核磁共振二维谱[15].
1.2.6 尿液1HNMR图谱处理和分析: 尿液样品1H核磁共振图谱(1HNMR图谱)进行基线和相位调整后以TSP作为化学位移0.00 ppm的质子信号标准进行定标, 在10.0-0.5 ppm范围内把谱图以每段为0.003 ppm分成2668段并摄取水峰信号范围5.20-4.66 ppm后用计算机进行自动积分. 用归一化的方法将每一段积分值除于所有积分值之和对积分值进行处理并用SIMCA-P+11(simple independent modeling of class analogy)软件进行偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)和正交偏最小10二乘判别分析(orthogonal PLS-DA, OPLS-DA)进行统计分析. 通过OPLS-DA获得的每一个积分段所代表的代谢物相关系数(r)来确定各组大鼠尿液中有差异性的代谢成分, 检验标准P定为0.05. 该研究中, 根据皮尔森相关系数显著性差异检测, 确定|r|>0.707(最少样品数为6)所代表的代谢物是统计学上有显著性差异即P<0.05的代谢物, 临界值|r|值越大表示差异性越大, 反之则越小.
1.2.7 颈总动脉压的测定: 处死前1 d禁食(不禁水), 处死当天用10%的水合氯醛100 g/0.3 mL的剂量腹腔注射麻醉实验动物, 将麻醉好的大鼠取仰卧位固定于手术板上, 切开颈部皮肤, 钝性分离覆盖于气管前的肌肉, 暴露颈总动脉, 在其下方置2根结扎线, 先结扎颈总动脉的远心端, 并用动脉夹在近心端处夹闭颈总动脉, 在结扎处的近心端0.3 cm处, 以45°斜角剪一斜切口再将动脉插管由该切口以向心方向插入股动脉, 并用事先置好的结扎线牢固固定, 防止动脉插管脱落. 插管前注意将动脉插管内充满肝素盐水, 并排尽插管内的气体. 最后将动脉插管与压力换能器联通, 利用SMUP.E型生物信号处理系统即可采集大鼠的血压、心率数据. 为了去除以上手术操作对血压、心率的影响, 大鼠血压通常以手术结束, 动物休息20-30 min后相对稳定的数值为准. 各组大鼠血压变化情况如表1.
统计学处理 应用SPSS18.0统计软件对数据进行统计处理以及分析. 以mean±SD表示各项数据, 各组间差异比较采用One-way ANOVA进行多组样本均数的比较, 显著性界值设定为0.05.
给予动物电击足底结合噪声的应激刺激时, 大鼠出现呼吸加深加快、烦躁、互相斗殴、尖叫、直立、试图逃避等一系列紧张表现. 与正常组血压相比, 给予应激刺激后试验组大鼠的收缩压明显升高(表1).
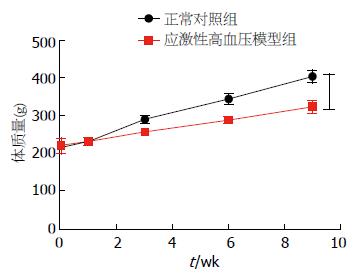
图1及表2均显示第0周(给予应激刺激前)2组大鼠的体质量无明显差异. 给予应激刺激后的前2 wk 2组大鼠的体质量均呈增长趋势, 但2组大鼠的体质量变化无统计学差异(P>0.05). 给予刺激后的第3周开始正常组和应激性高血压模型组大鼠体质量增长有差异且应激性高血压模型组大鼠的体质量增长明显低于正常组(P<0.05).
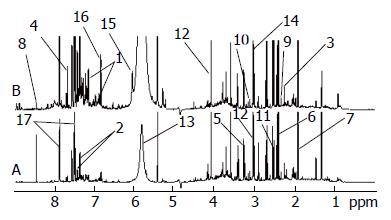
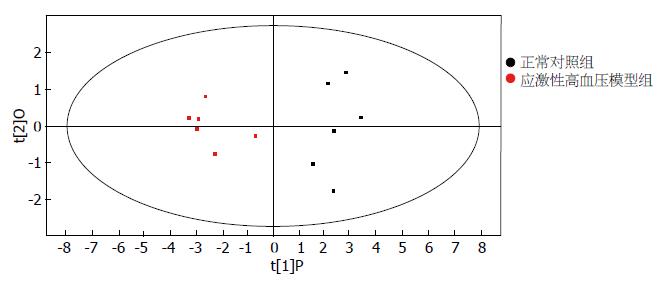
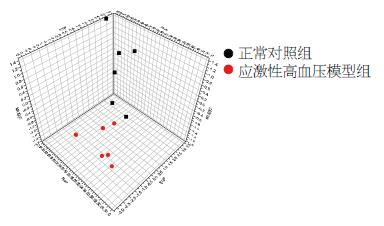
正常对照组、应激性高血压模型组尿液1HNMR谱(图2). 此次分析中, R2X = 0.55, R2Y = 0.94, Q2 = 0.62. 从图3可以看到, 各组的分布区域完全分开, 该图说明各组血清在代谢成分上有明显差异, 从图4OPLS-DA分析相关系数中得到每2组的差异性代谢组分的化学位移并与相关系数相结合确定差异程度, 根据以上信息及用1H-1H同核相关谱、质子全相关谱、J-分解谱等核磁共振二位谱技术确定了各组大鼠尿液中差异性代谢组份(表3). 2组尿液代谢组份有明显的差异, 差异性代谢组份中相关系数为正值的代谢物是在应激性高血压大鼠模型组中升高的代谢物, 相关系数为负值的代谢物是在应激性高血压大鼠模型组中降低的代谢物. 与正常组相比, 应激性高血压模型大鼠尿液中酪氨酸、苯丙氨酸、丙酮、1-甲基组氨酸、β-葡萄糖、乙酸-醋酸盐、甲酸、乙酰乙酸、丙二酸、柠檬酸、苹果酸、肌酸酐、肌酸、尿素的含量增加.
| 序号 | 代谢物 | 化学位移(mg/L) | 归属 | 相关系数 |
| 1 | 酪氨酸 | 3.94(dd), 6.89(d), 7.18(d) | α-CH, H3/H5, H2/H6 | 0.84 |
| 2 | 苯丙氨酸 | 7.32(m), 7.37(m), 7.42(m) | H2/H6, H4, H3/H5 | 0.83 |
| 3 | 丙酮 | 2.22(s) | CH3 | 0.81 |
| 4 | 1-甲基组氨酸 | 7.05(s), 7.78(s) | H4,H2 | 0.78 |
| 5 | β-葡萄糖 | 3.24(dd) | C-H2 | 0.71 |
| 6 | 苹果酸 | 2.41(s) | 0.83 | |
| 7 | 乙酸-醋酸盐 | 1.91(s) | CH3 | 0.82 |
| 8 | 甲酸 | 8.44(s) | CH | 0.73 |
| 9 | 乙酰乙酸 | 2.27(s) | CH3 | 0.72 |
| 10 | 丙二酸 | 3.12(s) | CH2 | 0.80 |
| 11 | 柠檬酸 | 2.54(d), 2.68(d) | CH2,CH2 | 0.78 |
| 12 | 肌酸酐 | 3.05(s), 4.06(s) | CH3,CH2 | 0.78 |
| 13 | 尿素 | 5.79(s) | 0.90 | |
| 14 | 肌酸 | 3.03(s), 3.93(s) | CH3CH2 | 0.91 |
近年来, 国内外诸多学者已经开始对高血压病进行代谢组学研究. 大量研究证实高血压病常与个体中多种代谢异常集结存在. Akira等[16]研究表明SHRSP和WKY鼠尿的样本经过常规处理, 经过1HNMR的检测, 发现尿液代谢谱图发生了显著性变化, 表明高血压与尿液代谢谱之间有一定的关系. 在本研究中我们首先通过复合应激刺激建立了应激性高血压的大鼠模型, 应用1HNMR检测正常组与应激性高血压模型组大鼠尿液中的差异代谢组份, 为应激性高血压的发病机制的研究奠定实验基础.
与正常组相比较应激性高血压模型组大鼠的尿液样品中主要有酪氨酸、苯丙氨酸、丙酮、乙酰乙酸、肌酸、肌酸酐、柠檬酸、苹果酸、β-葡萄糖、1-甲基组氨酸等的含量增加.
苯丙氨酸在机体主要代谢途径是, 由苯丙氨酸羟化酶催化下经羟化作用, 生成酪氨酸. 酪氨酸在肾上腺髓质和神经组织经酪氨酸羟化酶催化生成多巴, 多巴在多巴脱羧酶的作用下生成多巴胺. 在肾上腺髓质, 多巴胺侧链的β-碳原子再被羟化, 生成去甲肾上腺素, 后者甲基化生成肾上腺素. 多巴胺、肾上腺素、去甲肾上腺素统称为儿茶酚胺. 在应激状态下, 交感神经被激活, 通过交感-肾上腺髓质系统的参与, 交感神经末梢及肾上腺髓质释放大量儿茶酚胺, 以及神经肽Y、加压素, 再加上肾上腺皮质分泌大量糖皮质激素, 肾素-血管紧张素系统激活, 使心率增快, 心肌收缩力增强, 心输出量增加, 血压升高. 儿茶酚胺类在激动心肌细胞的β肾上腺素能受体后, 可通过cAMP转导通路, 激活细胞膜上的L型钙通道, 增加钙内流, 再通过钙触发钙释放机制促进细胞质内Ca2+浓度升高, 从而使心肌收缩能力增加, 心排出量增加使血压升高. 除此酪氨酸通过脱羧基生成的酪胺具有升高血压的作用.
在应激状态下, 机体所需要的能量有75%-95%来自脂肪分解代谢, 脂肪分解代谢加速, 使体内脂肪消耗增加, 体质量逐渐下降. 应激时由于肾上腺素、去甲肾上腺素、胰高血糖素等脂解激素增多, 脂肪的动员和分解代谢增强, 因而游离脂肪酸和酮体有不同程度的增强, 乙酰乙酸和丙酮均为酮体, 酮体是脂肪酸在肝细胞线粒体中进行分解代谢所生成的代谢产物, 本实验结果提示模型组大鼠尿液中酮体含量明显增高, 提示脂肪分解代谢旺盛. 本实验结果显示应激性高血压模型组大鼠体质量与正常组大鼠体质量增长明显低于正常组(P<0.05, 表2). 研究[17,18]表明, 慢性应激反应可导致认知、情绪、行为等缺陷, 如个体出现体质量减轻、活动减少或激越等抑郁、焦虑样表现. 应激刺激后体质量下降有很多因素, 其中应激会导致动物食欲下降[19]是原因之一, 皮质酮升高是另一重要原因. 陈平周等[20]研究表明束缚性应激当天大鼠进食量明显减少. 汪卫华等[21]研究发现体质量增长减慢与应激后血浆皮质酮浓度升高相关皮质酮影响三大代谢, 导致体质量增长缓慢.
与正常组比较模型组尿液中柠檬酸、苹果酸、肌酸、肌酸酐等含量增加. 柠檬酸、苹果酸是三羧酸循环的中间产物, 三羧酸循环不仅为机体直接提供腺嘌呤核苷三磷酸(adenosine triphosphate, ATP), 而且是联系糖、脂类、氨基酸代谢的重要枢纽. 参加三羧酸循环的氧化酶系主要在线粒体上. 当机体产生的ATP量高于机体需要量时, 肌酸在肌酸激酶催化下, 接受ATP的高能磷酸基形成磷酸肌酸来储存能量, 磷酸肌酸分子结构中具有P-N型高能磷酸键, 因此他能直接给细胞供应能量. 研究[22]发现磷酸肌酸具有3倍二磷酸果糖和1.5倍ATP的能量水平. 首先, 应激是一种高耗能状态, 其次在应激状态下, 线粒体膜发生去极化使膜电位下降, 线粒体膜通透性增加, 直接影响参加三羧酸循环氧化酶系的功能此时机体通过三羧酸循环产生的ATP远远不能满足机体需要量, 因此机体所需的能量主要来自磷酸肌酸. 从而产生过多的肌酸, 导致尿中肌酸酐的含量增加.
本实验结果提示, 模型组大鼠尿液中β-葡萄糖含量升高. 目前, 临床及实验资料[23]均证实11β羟化固醇脱氢酶2型(enzyme 11β-hydroxy steroid dehydrogenase type2, 11βHSD2)缺陷可导致机体血压升高, 而葡萄糖正是11βHSD2的抑制剂. 11βHSD2缺陷可以通过2条途径导致血压压升高[24,25]: 11βHSD是目前公认的糖皮质激素受体前调节的最重要的关键物质. 11βHSD2通过迅速催化皮质醇成为失去生物活性的代谢产物-皮质素从而确保醛固酮与其受体的特异性结合. 倘若11βHSD2功能受到抑制将致使皮质醇取代醛固酮占据盐皮质激素受体, 导致"假性醛固酮增多效应"产生容量扩张性高血压. 11βHSD2功能被抑制致使皮质醇增高, 与糖皮质激素受体结合增多, 通过"允许作用"使血压升高.
1-甲基组氨酸去甲基生成组氨酸, 组氨酸经组氨酸脱羧酶催化下转变为组胺(histamine, HA). 已有报道显示中枢HA能神经元主要通过激活交感肾上腺轴[26,27]以及分泌血管加压素[28-30]导致血压升高.
总之, 应激性高血压大鼠存在脂类、氨基酸、糖代谢及三羧酸循环的紊乱, 因此我们推测, 应激性高血压是一种代谢性疾病.
现代生活节奏的加快、工作压力的增加、人际关系复杂及对经济状况的担忧等因素均可使人处于应激状态. 经过大量的研究, 人们发现应激状态下机体会发生体温、心血管系统、神经内分泌系统及免疫系统等多个组织脏器功能改变, 应激与机体神经内分泌免疫系统之间的密切关系也得到普遍认可. 一项约有3000人参与的研究报道显示, 青年时期处于应激状态的人在15年后发生高血压的概率大于其他未经历应激状态的人.
目前国内外对应激性高血压的研究热点、重点主要是通过形态学方面, 免疫系统、神经系统方面研究应激性高血压发病机制. 亟待研究的问题主要是通过应激性高血压的发病机制研发专门针对治疗应激性高血压的药物.
原发性高血压是一种由遗传、环境与体液等因素相互作用所引起的威胁人类健康的头号慢性病, 随着医学模式的转变, 国内外研究者们日益认识到应激相关的社会心理行为因素在原发性高血压发生发展中的重要性. 大量的动物实验和多数流行病学研究证实应激是原发性高血压的重要危险因素, 但由于生活中的各种应激因素对原发性高血压的致病过程及机制的错综复杂, 其发病的机制目前尚不清楚.
本文在造模方法上通过使用心理、生理应激合在一起的复合性应激方法, 应用代谢组学方法探讨应激性高血压的发病机制.
本文主要对应激性高血压大鼠的尿液中的差异性代谢组份进行的探讨, 其原因主要由于机体的病理变化, 使得机体的代谢产物也会产生某种相应的变化. 对由疾病引起的代谢产物的变化进行分析, 能够帮助人们更好地理解病变过程以及在此病变过程机体内物质的代谢途径, 有助于疾病的生物标志物的发现和辅助临床诊断.
11βHSD2: 2型11β羟基脱氢酶, 糖皮质激素分泌过多时可通过肾脏中的2型11β羟基脱氢酶将皮质醇转换为无活性的肾上腺皮质酮, 以避免激活盐皮质激素受体.
蔡建春, 教授, 主任医师, 厦门大学附属中山医院胃肠外科; 蒋炜, 副教授, 复旦大学附属中山医院消化科; 王书奎, 教授, 主任技师, 博士生导师, 南京医科大学附属南京医院
本文利用代谢组学方法研究应激性高血压大鼠尿液中的差异性代谢组份, 并通过差异性代谢组份探讨应激性高血压的发病机制, 数据充分, 有一定的创新性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Taheri S. Orexin A immunoreactivity (orexin A-IR): Regional brain distribution in spontaneously hypertensive rats(SHR) and Wistar-Kyoto rats(WKY). Journal of Psychopharmocology. 2000;14:A71. |
| 2. | Rodgers RJ, Ishii Y, Halford JC, Blundell JE. Orexins and appetite regulation. Neuropeptides. 2002;36:303-325. [PubMed] [DOI] |
| 3. | Luine V, Martinez C, Villegas M, Magariños AM, McEwen BS. Restraint stress reversibly enhances spatial memory performance. Physiol Behav. 1996;59:27-32. [PubMed] [DOI] |
| 4. | Kumar KB, Karanth KS. Enhanced processing of an aversive memory following inescapable shock in rats. Biol Psychiatry. 1993;33:169-172. [PubMed] [DOI] |
| 5. | Roozendaal B. Stress and memory: opposing effects of glucocorticoids on memory consolidation and memory retrieval. Neurobiol Learn Mem. 2002;78:578-595. [PubMed] [DOI] |
| 6. | McIntosh AR. Mapping cognition to the brain through neural interactions. Memory. 1999;7:523-548. [PubMed] [DOI] |
| 7. | Shirasaka T, Takasaki M, Kannan H. Cardiovascular effects of leptin and orexins. Am J Physiol Regul Integr Comp Physiol. 2003;284:R639-R651. [PubMed] [DOI] |
| 8. | Ferguson AV, Samson WK. The orexin/hypocretin system: a critical regulator of neuroendocrine and autonomic function. Front Neuroendocrinol. 2003;24:141-150. [PubMed] [DOI] |
| 9. | Ehmke H, Just A. The orexins: linking circulatory control with behavior. Am J Physiol Regul Integr Comp Physiol. 2003;285:R519-R521. [PubMed] [DOI] |
| 10. | Tjen-A-Looi SC, Li P, Longhurst JC. Medullary substrate and differential cardiovascular responses during stimulation of specific acupoints. Am J Physiol Regul Integr Comp Physiol. 2004;287:R852-R862. [PubMed] [DOI] |
| 11. | Adamantidis A, de Lecea L. The hypocretins as sensors for metabolism and arousal. J Physiol. 2009;587:33-40. [PubMed] [DOI] |
| 12. | 奥 帕里尔. 高血压病学. 北京: 北京大学医学出版社 2008; 80. |
| 13. | Patel C. Stress management & hypertension. Acta Physiol Scand Suppl. 1997;640:155-157. [PubMed] |
| 14. | Zhu DN, Xue LM, Li P. Effect of central muscarine receptor blockade with DKJ-21 on the blood pressure and heart rate in stress-induced hypertensive rats. Blood Press. 1996;5:170-177. [PubMed] [DOI] |
| 16. | Akira K, Imachi M, Hashimoto T. Investigations into biochemical changes of genetic hypertensive rats using 1H nuclear magnetic resonance-based metabonomics. Hypertens Res. 2005;28:425-430. [PubMed] [DOI] |
| 17. | Bremner JD. Does stress damage the brain? Biol Psychiatry. 1999;45:797-805. [PubMed] [DOI] |
| 18. | Checkley S. The neuroendocrinology of depression and chronic stress. Br Med Bull. 1996;52:597-617. [PubMed] [DOI] |
| 21. | 汪 卫华, 吴 亚南, 汪 晓东, 王 俊, 翟 灵伟, 郑 丽, 屈 晓燕, 冯 琴妹, 孙 伟, 马 东. 常州市0-6岁儿童智力残疾的流行病学调查. 中国组织工程研究. 2002;6:3330-3331. |
| 22. | Tang LH, Xia ZY, Zhao B, Wei XD, Luo T, Meng QT. Phosphocreatine preconditioning attenuates apoptosis in ischemia-reperfusion injury of rat brain. J Biomed Biotechnol. 2011;2011:107091. [PubMed] [DOI] |
| 23. | Riddle MC, McDaniel PA. Acute reduction of renal 11 beta-hydroxysteroid dehydrogenase activity by several antinatriuretic stimuli. Metabolism. 1993;42:1370-1374. [PubMed] [DOI] |
| 24. | 张 永生, 吴 平生, 刘 伊丽. 11β羟化固醇脱氢酶缺陷与高血压. 国外医学心血管疾病分册. 1998;25:7-9. |
| 25. | Zhang YS, Wu PS, Liu YL, Wang X, Li X. Changes in plasaa total bile acid level of patients with essential hypertension and of spontaneous hypertensive rats and the correlation with systolic and diastolic blood pressure. J Med Coll PLA. 1998;13: 276-279. |
| 26. | Akins VF, Bealer SL. Central nervous system histamine regulates peripheral sympathetic activity. Am J Physiol. 1991;260:H218-H224. [PubMed] |
| 27. | Akins VF, Bealer SL. Hypothalamic histamine release, neuroendocrine and cardiovascular responses during tuberomammillary nucleus stimulation in the conscious rat. Neuroendocrinology. 1993;57:849-855. [PubMed] [DOI] |
| 28. | Gatti PJ, Gertner SB. The effect of a vasopressin antagonist on the pressor response to histamine administered centrally. Neuropharmacology. 1983;22:895-902. [PubMed] [DOI] |
| 29. | Bealer SL, Abell SO. Paraventricular nucleus histamine increases blood pressure by adrenoreceptor stimulation of vasopressin release. Am J Physiol. 1995;269:H80-H85. [PubMed] |
| 30. | Knigge U, Willems E, Kjaer A, Jørgensen H, Warberg J. Histaminergic and catecholaminergic interactions in the central regulation of vasopressin and oxytocin secretion. Endocrinology. 1999;140:3713-3719. [PubMed] [DOI] |