修回日期: 2017-08-05
接受日期: 2017-08-16
在线出版日期: 2017-09-08
胃癌是消化道常见的恶性肿瘤, 行根治性手术是其重要的治疗手段之一. 由于早期诊断率低, 行根治性手术后仍有40%-90%患者发生局部或区域性淋巴转移, 发生转移常见有腹膜、肝脏、卵巢等部位, 发生皮肤转移的临床病例较少, 仅占2.7%-5.3%. 有部分患者是以皮肤肿物为首发症状就诊, 容易造成误诊和漏诊, 延误治疗时机. 本文报道兰州大学第二医院收治的1例胃癌术后皮肤转移病例.
核心提要: 胃癌皮肤转移通常发生在胃癌术后或确诊胃癌数月或数年内, 是肿瘤发展至晚期的征象, 预后不良. 本病例是行胃癌根治术后10 mo发现全身皮肤多发肿物, 伴有破溃、坏死, 质硬, 活动度差, 并有压痛. 取肿物活组织检查并行免疫组织化学染色, 结合患者既往胃癌病史, 最后诊断为胃癌皮肤转移.
引文著录: 彭为, 朱军民, 王亚运, 张勇, 王龙, 郑鹏飞, 陈刚, 程志斌. 胃癌皮肤转移1例. 世界华人消化杂志 2017; 25(25): 2310-2314
Revised: August 5, 2017
Accepted: August 16, 2017
Published online: September 8, 2017
Gastric cancer is the most common malignant tumor of the digestive tract, and radical surgery is one of the important treatment methods for this malignancy. Because the early diagnosis rate is relatively low, 40%-90% of the patients who have undergone radical surgery will suffer from regional lymphatic metastasis or distant metastasis frequently in the peritoneum, liver and ovary. However, there are fewer clinical cases of cutaneous metastasis, which accounts for only 2.7%-5.3% of the total clinical metastatic cases. Some patients seek medical treatment with cutaneous tumors as the initial symptoms. Consequently, it is likely to cause misdiagnosis or missed diagnosis and delay the optimum time for treatment. The present paper reports a case of cutaneous metastasis of gastric cancer treated at the Second Hospital of Lanzhou University.
- Citation: Peng W, Zhu JM, Wang YY, Zhang Y, Wang L, Zheng PF, Chen G, Cheng ZB. Cutaneous metastasis of gastric cancer: A case report. Shijie Huaren Xiaohua Zazhi 2017; 25(25): 2310-2314
- URL: https://www.wjgnet.com/1009-3079/full/v25/i25/2310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i25.2310
胃癌皮肤转移病例在临床中较少见, 有部分患者是以皮肤肿物为首发症状而就诊, 首诊医师一定要仔细询问病史, 有胃癌病史时应考虑有无皮肤转移的可能. 胃癌皮肤转移需与神经内分泌肿瘤作鉴别诊断, 其诊断依赖病理检查和免疫组织化学染色. 本文通过对1例胃癌皮肤转移病例的报道, 进一步提高对该病的认识和诊断.
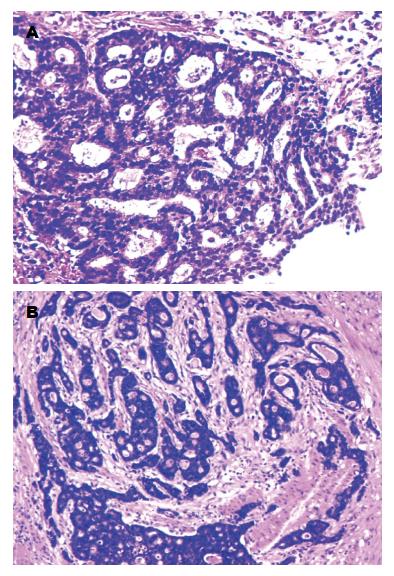
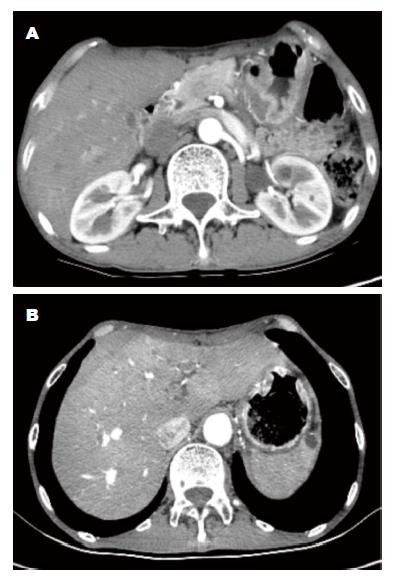
患者, 男性, 57岁, 于2016-05因"行远端胃癌根治术后10 mo, 发现全身皮肤多发肿物1 mo"入院. 患者此次入院前10 mo于兰州大学第二医院明确诊断为胃癌并行远端胃癌根治术, 术前胃镜检查提示胃窦近小弯侧可见一巨大溃疡浸润性病变, 活检报告为中分化腺癌, 免疫组织化学染色: C-erbB-2(0)(图1A); 行胸部、腹部增强计算机断层扫描(computed tomography, CT)检查未发现远处转移病灶(图2A); 肿瘤标志物提示: 糖类抗原199(CA199)>1000 U/mL, 癌胚抗原(carcino-embryonic antigen, CEA): 379.9 ng/mL, 甲胎蛋白(α-fetoprotein, AFP)及糖类抗原125(carbohydrate antigen, CA125)结果正常. 术前分期为T3N0M0, ⅡA期. 明确无手术禁忌后在2015-06-08在全麻下行远端胃癌根治术, 清扫淋巴结范围包括NO.1、NO.3、NO.4sb、NO.4d、NO.5、NO.6、NO.7、NO.8a、NO.9、NO.11p、NO.12a、NO.13.
术中见肿瘤约6 cm×5 cm大小, 溃疡型, 质硬; 侵及胃壁全层, 向后突破浆膜层侵及胰腺钩突部; 胃周多个淋巴结肿大, 并融合; 网膜未见异常. 手术过程: 在横结肠上缘离断胃结肠韧带, 向上游离胰腺被摸直至胰腺上缘. 游离胃网膜右动脉, 在胰十二指肠动脉根部将其离断并双重结扎, 清扫周围淋巴结. 将肿瘤与从胰腺钩突部剜除, 使用PROLENE缝线修补胰腺组织, 在术中观察无胰漏及出血. 在肝缘下切开小网膜, 解剖并离断胃右动脉, 断端双重结扎, 清扫周围淋巴结. 在幽门环下2 cm处离断十二指肠, 断端间断缝闭, 残端包埋, 浆肌层加固, 网膜覆盖, 胃近端残口缝扎闭合. 沿胃大弯向上游离胃近端, 在距癌灶边缘5 cm切除远端胃. 以100 mm闭合器闭合近端胃断端, 以31 mm管状吻合器行胃后壁与屈氏韧带下15 cm空肠侧侧逆蠕动吻合, 浆肌层加固, 吻合口约3 cm. 将胃管放置至空肠输入袢10 cm处以胃肠减压. 术中清扫淋巴结33枚. 术后病检结果: (1)肿瘤约8 cm×6 cm×1.5 cm, 溃疡型中分化腺癌, 部分为黏液腺癌(Lauren分型: 肠型为主)(图1B), 侵及胃壁全层并于网膜中形成瘤结节, 侵犯胰腺组织, 侵犯脉管、神经. 共16枚淋巴结转移: 小弯网膜淋巴结(7/10)、大弯网膜淋巴结(6/18)、第6组淋巴结(3/3)见癌转移; (2)免疫组织化学染色: CK8/18(+++), Syn(-), GST-π(++), P-gp(-), TOPOⅡα(-), TS(-), Tubulinβ-3(+), P53>70%+, Ki67>80%+, C-erbB-2(0). 术后病理分期为T4bN3bM0, ⅢC期.
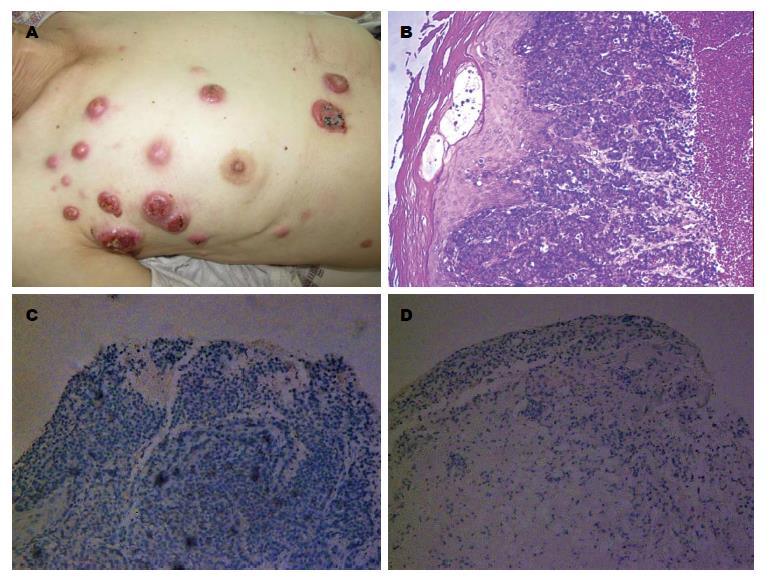
术后1-5 mo行规范DCF方案(多西他赛+奥沙利铂+替加氟+亚叶酸钙)化疗6次, 21 d为1个化疗周期, 化疗期间无严重药物不良反应. 术后3 mo复查胸、腹部增强CT未见远处转移(图2B), 复查胃镜未见肿瘤复发. 肿瘤标志物: CA199>1000 U/mL, CEA: 625.6 ng/mL, CA125及AFP结果正常. 术后8 mo时复查胸、腹部增强CT未见远处转移, 肿瘤标志物: CA199>1000 U/mL, CEA: 172.2 ng/mL, CA125及AFP结果正常, 给予规范DCF方案化疗1次. 术后10 mo时因发现皮肤肿物1 mo就诊于普外一科. 入院查体: 双侧腋窝可扪及2-3枚花生豆大小淋巴结, 质硬, 活动度可, 无压痛. 全身皮肤多发肿物, 主要集中在右前胸壁、右侧腋下、右上腹部, 最大者位于右侧腋窝下, 约3.2 cm×2.4 cm, 伴有破溃、坏死, 无渗液, 质硬, 活动度差, 并有压痛(图3A). 其他系统检查无异常. 实验室及辅助检查: 血、尿、大便常规及肝、肾功能正常, CA199>1000 U/mL, CA125 39.31 U/mL, CEA 133.5 ng/mL, AFP结果正常. 胸、腹部CT检查结果: (1)吻合口未见明显异常; 双侧腋窝及纵膈多发淋巴结肿大, 胸骨下段及前胸壁多发软组织结节; (2)双肺未见明显异常. 取右上腹皮肤肿物活检, 病理学检查结果: 表皮下见大量异性上皮组织浸润性生长, 细胞排列呈条索状、实团状结构, 胞核增大、深染, 核异型性明显, 符合胃低分化腺癌转移(图3B), 免疫组织化学染色: CD56(-), syn(-)(图3C, D). 诊断: 胃癌皮肤转移.
胃癌是消化系最常见的恶性肿瘤之一, 在全球为第四大高发恶性肿瘤, 在我国为第二大高发恶性肿瘤. 由于未普及胃镜检查及早期缺乏特异性症状, 多数患者就诊时已发生局部或远处转移. 胃癌发生转移的方式主要有直接蔓延浸润转移、淋巴转移、腹膜种植转移和血行转移, 发生皮肤转移较为少见, 有文献报道[1]发生率约为2.7%-5.3%. 通常发生在胃癌术后或确诊胃癌数月或数年内, 是肿瘤发展至晚期的征象, 提示预后不良, 生存期平均为11.4 wk[2], 但也有研究[3,4]表明, 恶性肿瘤发生皮肤转移的预后很大程度上基于原发肿瘤的部位.
胃癌皮肤转移最常见的转移部位为腹壁, 表现为脐周坚实的斑块或小结节, 称为Sister Mary Joseph结节, 又称脐周皮肤转移性结节[5], 也可转移至背部、颈部、腋窝、胸壁、头面部、腹股沟区等部位, 可为单发或多发, 呈无痛性结节样改变[6]. 本例报告患者肿瘤转移发生在前胸壁、腋下及上腹部, 多集中在前胸壁, 患者自述疼痛明显. 胃癌发生皮肤转移的机制尚不清楚. Paget[7]最先提出了"土壤和种子"假说: 肿瘤细胞(种子)最先转移至适合肿瘤细胞生长环境(土壤)的部位, 可能的机制是肿瘤细胞和上皮细胞分泌的某种趋化因子和受体在肿瘤的转移中起重要作用, 还与机体免疫力低下或者肿瘤细胞表面的MHCⅠ类分子表达降低有关. 后来Abate等[8]又提出癌细胞进入血液循环是转移的前提条件, 但进入循环系统中大部分肿瘤细胞被机体的免疫细胞攻击或被血流的冲击力破坏, 仅有0.05%的孤立肿瘤细胞能存活下来, 这些癌细胞在短时间内集中才有可能形成微小转移灶. 一般微小转移灶多在肝脏、肺等血流较丰富的器官形成, 但部分患者可无重要器官转移, 直接在皮肤形成转移病灶.
胃癌皮肤转移的诊断主要依赖于转移灶病理学组织检查和免疫组织化学结果. 可根据结果来判断肿瘤的来源, 如CK7阳性可判断其来源于腺上皮, CK20阳性多见于胃癌等肿瘤[9]. 肿瘤标志物对其诊断也有一定作用, 如CA72-4、CEA等增高可能提示消化系肿瘤, 但由于肿瘤标志物的影响因素较多, 可进一步通过胃、肠镜, CT检查明确诊断. 胃癌皮肤转移早期诊断相对比较困难, 部分患者是以皮肤肿物为首发症状而就诊, 容易造成误诊或漏诊, 因此临床医生一定要详细询问病史, 当就诊患者有胃癌病史伴皮肤肿物时, 应考虑皮肤转移的可能.
胃癌皮肤转移的治疗方法有局部肿物切除、放疗、化疗, 其方法的选择取决于患者的一般状况、原发肿瘤的大小、是否伴有其他脏器的转移、皮肤转移病灶的大小等因素. 有文献报道[10-13]治疗方法主要是化疗联合放疗后再行局部肿物的切除. 对于合并其他脏器转移通常选择全身化疗, 联合化疗方案(依托泊甙+阿霉素+顺铂, 依托泊甙+丝裂霉素C+优福定+顺铂)较单药化疗更有效, 且不良反应小[14,15]. 我们普外一科收治的本例患者接受了2 mo的联合化疗(依托泊甙+阿霉素+顺铂)和格拉诺赛特联合治疗后, 复查CA199: 623 U/mL, CA125: 21.2 U/mL, CEA: 58.6 ng/mL, 病灶较前变小. 但由于患者个人经济原因, 未进行后续治疗, 现在普外一科门诊随诊中.
胃癌皮肤转移在临床上较少见, 确诊依赖于病理检查和免疫组织化学染色检查, 并需结合患者既往病史, 如果既往有胃癌病史, 应考虑皮肤转移. 该病的治疗方法有局部肿物切除、放疗、化疗, 但至今尚无更好的治疗方案. 发生皮肤转移是肿瘤发展至晚期的征象, 生存期平均为11.4 wk. 通过对本病例的报道, 有助于大家进一步认识该病, 减少误诊和漏诊.
胃癌发生皮肤转移目前其发病机制尚不清楚. 治疗方法有局部肿物切除、放疗、化疗, 但无明确的治疗方案, 如: (1)至今尚无规范、统一的化疗方案; (2)患者先进行放化疗后再手术切除转移病灶还是先手术切除转移病灶后再进行放化疗, 没有一个定论, 且治疗效果不清楚. 需要深入的研究其发病机制, 寻找更为有效的治疗方法.
Krathen等和Hashiro对皮肤转移癌病例进行汇总、分析, 得出胃癌皮肤转移发生率约为2.7%-5.3%, 其生存期平均为11.4 wk. Qiao等、Endo等、Kawai等和Chu等报道了胃癌皮肤转移治疗方法是化疗联合放疗后再行局部肿物的切除. van Vliet等和国内学者报道了对于合并其他脏器转移通常选择全身化疗, 联合化疗方案较单药化疗更有效, 且不良反应小.
本文通过患者既往胃癌病史, 结合转移灶病理检查和免疫组织化学染色结果[CD56(-), syn(-)], 与神经内分泌肿瘤作出鉴别, 最终诊断胃癌皮肤转移. 通过对本病例的报告, 系统的学习了该疾病的流行病学特点、临床表现、诊断依据和治疗方案及预后, 有助于提高对该病的认识和诊断.
本文可给临床医师对胃癌皮肤转移患者的诊治提供一定的参考, 对于以皮肤肿物为首发症状就诊的患者, 需结合其既往病史, 完善胃镜、胸腹部增强计算机断层扫描, 同时需借助于病理检查和免疫组织化学染色, 以免在临床中造成漏诊和误诊.
Sister Mary Joseph结节: 又称脐周皮肤转移性结节, 是腹、盆腔内恶性肿瘤的脐部转移性结节, 表现为脐周坚实的斑块或小结节. 在脐转移癌中75%为腺癌, 大多数可明确原发肿瘤, 其中胃癌占20%-30%, 卵巢癌占10%-12%, 结肠癌占10%-14%, 胰腺癌占7%-11%, 其他比较少见的有乳腺癌、宫颈癌、子宫内膜癌和前列腺癌.
李云龙, 副教授, 哈尔滨医科大学附属二院普通外科; 牛伟新, 教授, 主任医师, 复旦大学附属中山医院普外科; 宋武, 教授, 主任医师, 中山大学附属第一医院胃肠外科
本文报道了胃癌皮肤转移1例, 临床中较少见, 对于临床医师对该病的认识和诊断有一定的参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 甘肃省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Krathen RA, Orengo IF, Rosen T. Cutaneous metastasis: a meta-analysis of data. South Med J. 2003;96:164-167. [PubMed] [DOI] |
| 2. | Park MK, Son IP, Park KY, Seo SJ. Metastatic gastric adenocarcinoma presenting as a solitary plaque on the palm. Ann Dermatol. 2011;23:S205-S207. [PubMed] [DOI] |
| 3. | Lookingbill DP, Spangler N, Helm KF. Cutaneous metastases in patients with metastatic carcinoma: a retrospective study of 4020 patients. J Am Acad Dermatol. 1993;29:228-236. [PubMed] [DOI] |
| 4. | Schoenlaub P, Sarraux A, Grosshans E, Heid E, Cribier B. Survival after cutaneous metastasis: a study of 200 cases. Ann Dermatol Venereol. 2001;128:1310-1315. [PubMed] |
| 5. | Tso S, Brockley J, Recica H, Ilchyshyn A. Sister Mary Joseph's nodule: an unusual but important physical finding characteristic of widespread internal malignancy. Br J Gen Pract. 2013;63:551-552. [PubMed] [DOI] |
| 6. | Sim JH, Kim JE, Lee SH, Cho MK, Lee JS, Lee SY. Vulvar skin metastasis of lung squamous cell carcinoma. Ann Dermatol. 2011;23:S179-S181. [PubMed] [DOI] |
| 7. | Paget S. The distribution of secondary growths in cancer of the breast. 1889. Cancer Metastasis Rev. 1989;8:98-101. [PubMed] |
| 8. | Abati A, Liotta LA. Looking forward in diagnostic pathology: the molecular superhighway. Cancer. 1996;78:1-3. [PubMed] [DOI] |
| 9. | Misago N, Satoh T, Narisawa Y. Basal cell carcinoma with tricholemmal (at the lower portion) differentiation within seborrheic keratosis. J Cutan Pathol. 2003;30:196-201. [PubMed] [DOI] |
| 11. | Endo Y, Matsumoto R, Taki R, Toda K. Cutaneous metastasis of gastric adenocarcinoma presenting as carcinoma "en cuirasse". Eur J Dermatol. 2013;23:287-288. [PubMed] [DOI] |
| 12. | Kawai S, Nishida T, Hayashi Y, Ezaki H, Yamada T, Shinzaki S, Miyazaki M, Nakai K, Yakushijin T, Watabe K. Choroidal and cutaneous metastasis from gastric adenocarcinoma. World J Gastroenterol. 2013;19:1485-1488. [PubMed] [DOI] |
| 13. | Chu LY, Hsia TC, Hsieh TC, Yen KY, Kao CH. Rare cutaneous metastases from gastric cancer. Am J Med Sci. 2012;344:406. [PubMed] [DOI] |
| 14. | 陶 瑞雨, 余 稳稳, 李 正凯, 张 轶, 李 三党, 于 建平, 许 威, 韩 晓鹏, 李 洪涛, 刘 宏斌. 胃癌皮肤转移2例. 中国现代普通外科进展. 2016;4:334-336. |
| 15. | van Vliet EP, Steyerberg EW, Eijkemans MJ, Kuipers EJ, Siersema PD. Detection of distant metastases in patients with oesophageal or gastric cardia cancer: a diagnostic decision analysis. Br J Cancer. 2007;97:868-876. [PubMed] [DOI] |