修回日期: 2017-07-14
接受日期: 2017-07-17
在线出版日期: 2017-08-18
探讨血清钙离子(serum calcium Ca2+)在急性胰腺炎(acute pancreatitis, AP)持续性器官功能衰竭(persistent organ failure, POF)中的临床意义.
选取2012-01/2016-12温州市龙湾区第一人民医院及温州医科大学附属第二医院进行治疗的AP患者165例, 收集患者在症状发作72 h内的临床资料及实验室数据, 分为AP非持续性器官功能衰竭(non persistent organ failure, NO-POF)127例和POF 38例两组, 多因素Logistic回归分析用于评价血清Ca2+的预测能力, 采用工作特征曲线(receiver operator characteristic curve, ROC)分析计算血清Ca2+的截断值.
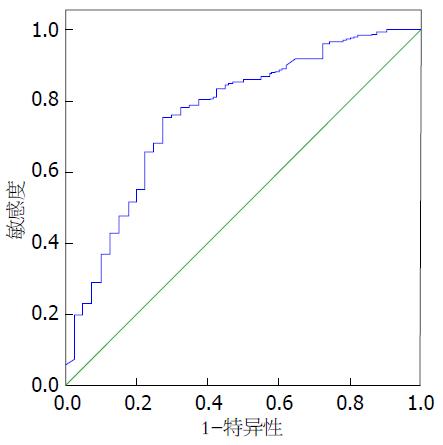
经急性胰腺炎NO-POF 127例和POF 38例临床资料及实验室数据比较, 血清Ca2+ POF组明显低于NO-POF组, 差异有统计学意义(P<0.001); 多因素Logistic回归分析, 血清Ca2+是急性胰腺炎POF的独立危险因素(OR = 0.30, 95%CI: 0.12-0.76); ROC分析结果显示: 血清Ca2+预测急性胰腺炎POF的曲线下面积为0.764(95%CI: 0.27-0.58, P<0.001), 其最佳预测截点1.84 mmol/L, 预测POF的敏感性为75.4%, 特异性为72.5%.
入院患者血清Ca2+与急性胰腺炎POF独立相关, 可作为一个潜在的预后因素.
核心提要: 血清钙离子是一种测量简便、便宜且应用广泛的生化指标, 对急性胰腺炎持续性器官功能衰竭早期预测具有较好的临床应用价值. 对评估病情的严重程度有重要意义, 从而指导临床治疗策略.
引文著录: 王国胜, 余玲玲, 刘玲玲, 金明石. 血清钙离子对急性胰腺炎持续性器官功能衰竭的预测价值. 世界华人消化杂志 2017; 25(23): 2117-2122
Revised: July 14, 2017
Accepted: July 17, 2017
Published online: August 18, 2017
To analyze the clinical significance of serum calcium (Ca2+) in persistent organ failure (POF) associated with acute pancreatitis.
We conducted a retrospective study of 165 patients with acute pancreatitis admitted to Wenzhou Longwan First People's Hospital and the Second Affiliated Hospital of Wenzhou Medical University between January 2012 and December 2016. Within 72 h of the onset of symptoms, the clinical data and laboratory data were collected. The patients were divided into two groups: 127 cases without POF (NO-POF) and 38 cases with POF. Multivariate Logistic regression analysis was used to evaluate the predictive ability of serum calcium for POF, and the operating characteristic curve (ROC) analysis was performed to obtain the cut-off value of serum calcium.
Serum level of Ca2+ was significantly lower in the POF group than in the NO-POF group. Multivariate Logistic regression analysis showed that serum calcium was an independent risk factor for POF (OR = 0.30, 95%CI: 0.12-0.76). ROC curve analysis showed an under curve area of 0.764 (95%CI: 0.27-0.58, P < 0.001) for serum calcium (Ca2+) to predict POF. With the optimal cut-off value of 1.84 mmol/L, serum calcium had a sensitivity of 75.4% and a specificity of 72.5% for predicting POF.
Serum calcium (Ca2+) was independently associated with acute pancreatitis-associated POF and can be used as a potential prognostic factor.
- Citation: Wang GS, Yu LL, Liu LL, Jin MS. Prognostic value of serum calcium in persistent organ failure associated with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2017; 25(23): 2117-2122
- URL: https://www.wjgnet.com/1009-3079/full/v25/i23/2117.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i23.2117
急性胰腺炎(acute pancreatitis, AP)是临床常见的急腹症, 病程以局部及全身免疫反应为特点, 可导致全身炎症反应综合征器官衰竭(organ failure, OF)死亡[1,2]. AP患者大多数为轻症AP, 病情稳定, 呈一过性, 预后良好; 15%-30%发展为重症AP(severe acute pancreatitis, SAP), 病情凶险, 进展快, 死亡率达20%-50%[3]. 根据2012修订的亚特兰大为AP分类以及中国胰腺炎诊治指南(2013上海)[4-6], SAP已经被重新定义为AP持续性器官衰竭(持续48 h). AP的发病机制是一个复杂的、多因素参与的病理及生理过程, 其发病机制至今尚未完全阐明[7]. 目前研究[8]发现Ca2+作为细胞内的重要信使, 对胰腺炎的发生及发展有重要的作用, 不仅参与胰腺腺泡细胞内重要信号的传递, 还参与腺泡细胞内蛋白酶原的活化, 导致低钙血症更容易出现在SAP中. 研究[9]表明, 细胞内Ca2+的增加主要来自于内质网和酸性池, 内质网主要位于细胞基底部, 酸性池主要位于细胞顶部. 危重患者, 为维持Ca2+的稳态, 通常导致循环Ca2+水平的降低. 因此本研究探讨住院患者血清Ca2+在急性胰腺炎POF中的相关性及其预测价值, 为SAP的及时发现, 早期干预, 提供临床依据.
2012-01/2016-12于温州市龙湾区第一人民医院及温州医科大学附属第二医院进行治疗的AP患者165例. 男/女比值为1.35(95/70), 中位年龄为48.5岁. 38例患者进展为POF, 其中22例为单一器官衰竭(20例为呼吸功能衰竭、2例为肾功能衰竭), 16例为多器官衰竭(9例为呼吸+肾功能衰竭、4例为呼吸+循环衰竭、3例为呼吸+肾+循环衰竭), 13例急性胰腺炎POF(34.2%)患者住院期间死亡. NO-POF组未出现死亡病例, 如表1. 所有实验性指标均为患者入院后第1天收集, 常规生化指标: 血常规、肝肾功能电解质、血清淀粉酶等检查结果于温州市龙湾区第一人民医院及温州医科大学附属第二医院检验科完成检测. 患者的基本个人信息、电子病历信息、实验室数据、疾病严重程度由同一个医师进行统计. 本研究遵循赫尔辛基宣言的原则, 医院伦理委员会批准.
| 器官衰竭 | POF(n = 38) | 死亡(n = 13) |
| 单个器官衰竭 | 22 | 5(22.7) |
| 呼吸功能衰竭 | 20(90.9) | 5(25.0) |
| 肾功能衰竭 | 2(9.1) | 0(0) |
| 循环衰竭 | 0(0) | 0(0) |
| 多器官衰竭 | 16 | 8(50) |
| 呼吸+肾功能衰竭 | 9(56.2) | 3(33.3) |
| 呼吸+循环衰竭 | 4(18.8) | 2(50) |
| 呼吸+肾+循环衰竭 | 3(25.0) | 3(100) |
1.2.1 诊断与排除标准: 诊断标准: 符合中国胰腺炎诊治指南(2013上海)[6], 以下3项临床特征中至少出现2项: (1)AP特征性腹痛; (2)血清淀粉酶和/或脂肪酶升高≥正常上限值的3倍; (3)增强计算机断层扫面(computed tomography, CT)磁共振(magnetic resonance imaging, MRI)腹部超声符合AP的影像学改变; 排除标准: (1)腹痛发作入院≥72 h; (2)年龄<18岁; (3)有复发胰腺炎或慢性胰腺炎病史; (4)慢性心肺或肾脏疾病史; (5)有创伤或妊娠诱发的胰腺炎.
1.2.2 试验分组: 纳入研究对象165例AP患者, 分为NO-POF与POF两组. 根据修订后的2012亚特兰大分类确定疾病的严重程度[4,5]. OF诊断标准: (1)呼吸衰竭: PaO2/FiO2≤300 mmHg; (2)肾功能衰竭: 血肌酐≥170 μmol/L; (3)循环衰竭: 收缩压≤90 mmHg, 且补液不能纠正. POF定义为OF持续时间>48 h.
1.2.3 临床资料收集: 详细收集患者的临床资料, 比较两组临床指标, 包括年龄、性别、饮酒、吸烟、病因、各项实验室检查、BISAP评分[10]、结局. 多因素Logistic回归分析用于评价急性胰腺炎POF的危险因素, 采用工作特征曲线(receiver operator characteristic curve, ROC)分析计算血清Ca2+的截断值.
统计学处理 采用SPSS19.0统计软件进行分析, 计数资料采用χ2检验, 计量资料用mean±SD表示, 组间比较用t检验; 非正态分布定量指标采用秩和检验, 定性指标采用χ2检验; 采用多因素Logistic回归分析急性胰腺炎POF的危险因素, 并以ROC曲线来描述血清Ca2+对急性胰腺炎POF的预测价值. P<0.05为差异具有统计学意义.
比较两组临床指标, 白细胞、血糖、白蛋白、血尿素、血肌酐、血钙、BISAP评分、ICU>7 d、死亡均有统计学意义(P<0.05), 而年龄、性别、饮酒、吸烟、病因、红细胞压积、血小板、总胆红素, 谷草转氨酶均无统计学意义(P>0.05, 表2).
| 临床指标 | NO-POF(n = 127) | POF(n = 38) | P值 |
| 年龄(岁) | 47.35±14.63 | 50.16±16.27 | 0.313 |
| 性别 | 0.964 | ||
| 男 | 73(57.2) | 22(56.4) | |
| 女 | 54(42.8) | 16(43.6) | |
| 饮酒 | 0.614 | ||
| 是 | 56(43.8) | 15(39.2) | |
| 否 | 71(56.2) | 23(60.8) | |
| 吸烟 | 0.156 | ||
| 是 | 60(47.7) | 13(34.2) | |
| 否 | 67(52.3) | 25(65.8) | |
| 病因 | 0.926 | ||
| 胆道疾病 | 82(64.5) | 26(68.4) | |
| 饮酒 | 28(22.1) | 7(18.4) | |
| 高脂血症 | 15(11.8) | 4(10.6) | |
| 特发性 | 2(1.6) | 1(2.6) | |
| 实验室检查 | |||
| 白细胞(×109/L) | 13.26±4.51 | 15.22±5.28 | 0.025 |
| 红细胞压积(%) | 41.25±4.36 | 42.37±5.12 | 0.184 |
| 血小板(×109/L) | 189.53±78.62 | 179.34±87.83 | 0.496 |
| 血糖(mmol/L) | 8.18±2.84 | 10.26±5.43 | 0.002 |
| 总胆红素(μmol/L) | 27.89±23.42 | 35.21±25.33 | 0.099 |
| 谷草转氨酶(U/L) | 98.63±96.17 | 105.78±92.57 | 0.685 |
| 白蛋白(g/L) | 37.25±4.68 | 31.27±6.75 | <0.001 |
| 血尿素(mmol/L) | 4.57±2.41 | 9.87±5.79 | <0.001 |
| 血肌酐(μmol/L) | 59.87±22.56 | 138.92±98.77 | <0.001 |
| 血钙(mmol/L) | 2.06±0.69 | 1.61±0.45 | <0.001 |
| BISAP评分(分) | 1.65±0.58 | 2.96±1.17 | <0.001 |
| 结局n(%) | |||
| ICU>7 d | 46(36.2) | 38(100) | <0.001 |
| 死亡 | 0(0) | 13(34.2) | <0.001 |
对患者的临床指标: 白细胞、血糖、白蛋白、血尿素、血肌酐、血钙、BISAP评分、ICU>7 d vs ≤7 d变量进行多因素Logistic回归分析, 结果显示: 白蛋白(OR = 0.84, 95%CI: 0.83-0.96, P<0.01)血尿素(OR = 1.67, 95%CI: 1.16-2.46, P<0.01)血钙(OR = 0.30, 95%CI: 0.12-0.76, P = 0.011)BISAP评分(OR = 1.80, 95%CI: 1.09-2.98, P = 0.022)ICU>7 d vs ≤7 d(OR = 2.10, 95%CI: 1.38-3.22, P<0.001)是急性胰腺炎POF的独立危险因素(表3).
| 变量 | β | SE | Wald | P值 | OR | 95%CI |
| 白细胞(×109/L) | 0.63 | 0.38 | 2.74 | 0.097 | 1.87 | 0.89-3.96 |
| 血糖(mmol/L) | 0.20 | 0.16 | 1.50 | 0.219 | 1.22 | 0.89-1.68 |
| 白蛋白(g/L) | -0.19 | 0.07 | 7.11 | 0.008 | 0.84 | 0.83-0.96 |
| 血尿素(mol/L) | 0.52 | 0.19 | 7.32 | 0.007 | 1.67 | 1.16-2.46 |
| 血肌酐(mol/L) | 1.33 | 0.75 | 3.14 | 0.07 | 3.81 | 0.87-16.75 |
| 血钙(mmol/L) | -1.20 | 0.47 | 6.54 | 0.011 | 0.30 | 0.12-0.76 |
| BISAP评分 | 0.59 | 0.26 | 5.25 | 0.022 | 1.80 | 1.09-2.98 |
| ICU>7 d vs ≤7 d | 0.74 | 0.22 | 11.78 | <0.001 | 2.10 | 1.38-3.22 |
采用ROC曲线分析结果显示, 血清Ca2+预测急性胰腺炎POF的曲线下面积为0.764(95%CI: 0.27-0.58, P<0.001), 预测POF的最佳截点1.84 mmol/L, 其敏感性为75.4%, 特异性为72.5%(图1).
SAP已经被重新定义为AP持续性器官衰竭(持续48 h)[4,5], 是由多种致病因子导致胰酶异常激活和释放, 激活单核巨噬细胞和中性粒细胞, 激活细胞因子及炎症介质大量释放, 形成"瀑布样效应"过程, 引起全身炎症反应综合征, 导致器官衰竭[11]. 目前国内外学者对AP的始动因素进行了大量研究, 钙稳态失调、胰酶活化机制、胰腺泡细胞内信号传导紊乱成为研究的热点[7,12]. Ca2+作为第二信使, 在胰腺泡细胞的生理及病理过程起重要作用, 在AP过程中, 产生大量促炎因子以及放大炎症反应, 导致病情进一步恶化[13]. 由此可见, 细胞因子及炎症介质在AP特别是SAP的发生及发展中, 发挥重要作用. 因此, 寻找监测炎症水平的生化指标, 对评估病情的严重程度有重要意义, 从而指导临床治疗策略. 本研究基于此目的, 探讨住院患者血清Ca2+在急性胰腺炎POF中的相关性及其预测价值.
急性胰腺炎POF, 造成患者死亡主要在住院2 wk内出现, 死亡率为20%-50%[3], 本研究中患者死亡率为34.2%; 主要特点为病情凶险, 进展快. 早期评估AP患者发展为持续性器官功能衰竭的能力是非常有意义的, 能给予临床早期治疗和干预. 本研究中, 患者NO-POF组及POF组比较, 白细胞、血糖、白蛋白、血尿素、血肌酐、血钙、BISAP评分、ICU>7 d、死亡均有统计学意义(P<0.05), 结果证实, 入院时POF组血清Ca2+明显低于NO-POF组. 进一步用多因素Logistic回归分析, 结果证实: 低血清Ca2+血钙(OR = 0.30, 95%CI: 0.12-0.76, P = 0.011)为急性胰腺炎POF的独立危险因素. 白蛋白、血糖、血尿素、BISAP评分、ICU住院时间也是急性胰腺炎POF的独立危险因素, 这与相关研究结果一致[14-16]. 结果表明, 血清Ca2+对急性胰腺炎POF有预测价值. Ca2+信号通路在生物机体的病理生理过程普遍存在, 在AP的发病机制研究中, 胆囊收缩素、非氧化酒精代谢物乙酯脂肪算、胆盐均能诱导胞内Ca2+的持续升高, 造成钙超载, 导致腺泡细胞受损, 同时诱导氧自由基的释放、激活Capase通路、活化核因子-κB, 产生促炎因子以及促进胰酶提前活化[17,18]. 然而通过阻断Ca2+通道降低钙超载, 从而减少腺泡细胞的凋亡, 在小鼠动物模式实验中, 阻断钙释放激活钙通道, 减少了胰腺炎进展的风险, 保护细胞器免受损害, 呈现良好的细胞器官保护作用[19,20]. 以上研究表明: Ca2+信号在AP发生发展中的重要作用, 但血清Ca2+与急性胰腺炎POF的相关性, 尚无报道. 本研究结果表明: 低血清Ca2+血钙为急性胰腺炎POF的独立危险因素, 同时ROC曲线分析, 预测POF的最佳截点1.84 mmol/L, 具有较好的敏感性及特异性.
总之, 血清Ca2+是一种测量简便、便宜且应用广泛的生化指标, 对急性胰腺炎POF早期预测具有较好的临床应用价值. 但本研究也存在局限性, 样本量较少, 其结论尚需多中心大样本的研究来进一步验证. 本研究初步探讨了血清Ca2+对胰腺癌预后的判断价值, 为下一步的研究提供了重要的依据.
重症急性胰腺炎(severe acute pancreatitis, SAP)病情凶险, 进展快, 死亡率达20%-50%. 目前研究发现Ca2+作为细胞内的重要信使, 对胰腺炎的发生及发展有重要的作用, 不仅参与胰腺腺泡细胞内重要信号的传递, 还参与腺泡细胞内蛋白酶原的活化. 因此本研究探讨住院患者血清Ca2+在急性胰腺炎持续性器官功能衰竭(persistent organ failure, POF)中的相关性及其预测价值.
目前国内外学者对急性胰腺炎(acute pancreatitis, AP)的始动因素进行了大量研究, 钙稳态失调、胰酶活化机制、胰腺泡细胞内信号传导紊乱成为研究的热点.
Ca2+信号通路在生物机体的病理生理过程普遍存在, 在AP的发病机制研究中, 胆囊收缩素、非氧化酒精代谢物乙酯脂肪算、胆盐均能诱导胞内Ca2+的持续升高, 造成钙超载, 导致腺泡细胞受损, 同时诱导氧自由基的释放、激活Capase通路、活化核因子-κB, 产生促炎因子以及促进胰酶提前活化.
以往研究表明, Ca2+信号在AP发生发展中的重要作用, 但血清Ca2+与急性胰腺炎POF的相关性, 尚无报道. 本研究结果表明: 低血清Ca2+血钙为急性胰腺炎POF的独立危险因素.
入院患者血清Ca2+与急性胰腺炎POF独立相关, 可作为一个潜在的预后因素. 对急性胰腺炎进行早期预测, 早期干预, 早期强化治疗, 改善预后.
重症急性胰腺炎(SAP): 已经被重新定义为AP持续性器官衰竭(持续48 h), 是由多种致病因子导致胰酶异常激活和释放, 激活单核巨噬细胞和中性粒细胞, 激活细胞因子及炎症介质大量释放, 形成"瀑布样效应"过程, 引起全身炎症反应综合征及局部并发症, 导致器官衰竭.
吴建胜, 主任医师, 温州医科大学附属第一医院消化内科
本文构思完善, 统计方法无误, 文章条理较清楚, 具有一定的参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Yang CJ, Chen J, Phillips AR, Windsor JA, Petrov MS. Predictors of severe and critical acute pancreatitis: a systematic review. Dig Liver Dis. 2014;46:446-451. [PubMed] [DOI] |
| 2. | Gao E, Jiang Y, Li Z, Xue D, Zhang W. Association between high mobility group box1 protein expression and cell death in acute pancreatitis. Mol Med Rep. 2017;15:4021-4026. [PubMed] [DOI] |
| 3. | Bruennler T, Hamer OW, Lang S, Gruene S, Wrede CE, Zorger N, Herold T, Siebig S, Rockmann F, Salzberger B. Outcome in a large unselected series of patients with acute pancreatitis. Hepatogastroenterology. 2009;56:871-876. [PubMed] |
| 4. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS; Acute Pancreatitis Classification Working Group. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 5. | Nawaz H, Mounzer R, Yadav D, Yabes JG, Slivka A, Whitcomb DC, Papachristou GI. Revised Atlanta and determinant-based classification: application in a prospective cohort of acute pancreatitis patients. Am J Gastroenterol. 2013;108:1911-1917. [PubMed] [DOI] |
| 8. | Huang W, Cane MC, Mukherjee R, Szatmary P, Zhang X, Elliott V, Ouyang Y, Chvanov M, Latawiec D, Wen L. Caffeine protects against experimental acute pancreatitis by inhibition of inositol 1,4,5-trisphosphate receptor-mediated Ca2+ release. Gut. 2017;66:301-313. [PubMed] [DOI] |
| 9. | Zhang Z, Xu X, Ni H, Deng H. Predictive value of ionized calcium in critically ill patients: an analysis of a large clinical database MIMIC II. PLoS One. 2014;9:e95204. [PubMed] [DOI] |
| 11. | Portelli M, Jones CD. Severe acute pancreatitis: pathogenesis, diagnosis and surgical management. Hepatobiliary Pancreat Dis Int. 2017;16:155-159. [PubMed] [DOI] |
| 12. | Greenberg JA, Hsu J, Bawazeer M, Marshall J, Friedrich JO, Nathens A, Coburn N, May GR, Pearsall E, McLeod RS. Clinical practice guideline: management of acute pancreatitis. Can J Surg. 2016;59:128-140. [PubMed] [DOI] |
| 13. | Criddle DN. Reactive oxygen species, Ca(2+) stores and acute pancreatitis; a step closer to therapy? Cell Calcium. 2016;60:180-189. [PubMed] [DOI] |
| 14. | Jin Z, Xu L, Wang X, Yang D. Risk Factors for Worsening of Acute Pancreatitis in Patients Admitted with Mild Acute Pancreatitis. Med Sci Monit. 2017;23:1026-1032. [PubMed] [DOI] |
| 15. | Cui J, Xiong J, Zhang Y, Peng T, Huang M, Lin Y, Guo Y, Wu H, Wang C. Serum lactate dehydrogenase is predictive of persistent organ failure in acute pancreatitis. J Crit Care. 2017;41:161-165. [PubMed] [DOI] |
| 16. | Wang Q, Wang G, Qiu Z, He X, Liu C. Elevated Serum Triglycerides in the Prognostic Assessment of Acute Pancreatitis: A Systematic Review and Meta-Analysis of Observational Studies. J Clin Gastroenterol. 2017;51:586-593. [PubMed] [DOI] |
| 17. | Gukovskaya AS, Gukovsky I. Which way to die: the regulation of acinar cell death in pancreatitis by mitochondria, calcium, and reactive oxygen species. Gastroenterology. 2011;140:1876-1880. [PubMed] [DOI] |
| 18. | Tripathi A, Chaube SK. High cytosolic free calcium level signals apoptosis through mitochondria-caspase mediated pathway in rat eggs cultured in vitro. Apoptosis. 2012;17:439-448. [PubMed] [DOI] |
| 19. | Rahimian R, Zirak MR, Seyedabadi M, Keshavarz M, Rashidian A, Kazmi S, Jafarian AH, Karimi G, Mousavizadeh K. Protective effects of tropisetron on cerulein-induced acute pancreatitis in mice. Biomed Pharmacother. 2017;93:589-595. [PubMed] [DOI] |
| 20. | Gerasimenko JV, Gryshchenko O, Ferdek PE, Stapleton E, Hébert TO, Bychkova S, Peng S, Begg M, Gerasimenko OV, Petersen OH. Ca2+ release-activated Ca2+ channel blockade as a potential tool in antipancreatitis therapy. Proc Natl Acad Sci USA. 2013;110:13186-13191. [PubMed] [DOI] |