修回日期: 2017-06-28
接受日期: 2017-07-03
在线出版日期: 2017-08-08
从分子水平探讨"健脾和胃祛湿方"对药物代谢酶CYP450的作用.
采用液质联用分析、Western blot及RT-PCR方法测定大鼠肝微粒体及肝脏组织中CYP450酶系6种亚型(CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4)的活性、蛋白及mRNA表达水平的影响.
"健脾和胃祛湿方"对CYP450亚型CYP2C19、CYP2C9、CYP2D6、CYP2E1和CYP3A4的酶活性, 蛋白及mRNA表达水平没有显著性影响; 而呈剂量依赖性地降低CYP1A2酶活性, 蛋白及mRNA表达水平.
"健脾和胃祛湿方"作用于药物代谢酶CYP450亚型CYP1A2酶活性、蛋白及mRNA表达水平, 对CYP450酶其他亚型没有影响.
核心提要: 从分子水平探讨"健脾和胃祛湿方"对药物代谢酶CYP450的作用, 发现"健脾和胃祛湿方"作用于药物代谢酶CYP450亚型CYP1A2酶活性、蛋白及mRNA表达水平, 对CYP450酶其他亚型没有影响.
引文著录: 吕雪幼, 郭利华. "健脾和胃祛湿方"对大鼠肝组织CYP450酶作用和初步机制. 世界华人消化杂志 2017; 25(22): 2022-2027
Revised: June 28, 2017
Accepted: July 3, 2017
Published online: August 8, 2017
To investigate the effect of Jianpi Hewei Qushi Fang (JPHWQSF), a traditional Chinese medicine recipe, on the activity and expression of CYP450 enzymes in liver tissue of rats.
The activity and protein and mRNA expression of CYP450 enzyme subtypes (CYP1A2, CYP2C9, CYP2C19, CYP2C6, CYP2E1, CYP3A4) in liver tissue of rats were determined by liquid chromatography-mass spectrometry, Western blot and RT-PCR, respectively.
JPHWQSF treatment had on significant effect on the activity and protein and mRNA expression of CYP2C9, CYP2C19, CYP2C6, CYP2E1, and CYP3A4 in liver tissue of rats, but significantly decreased the activity and protein and mRNA expression of CYP1A2 in a dose-dependent manner.
JPHWQSF treatment alters the activity and protein and mRNA expression of CYP1A2, but has no effect on other subtypes of CYP450.
- Citation: Lv XY, Guo LH. Effect of Jianpi Hewei Qushi Fang on activity and expression of CYP450 enzymes in liver tissue of rats. Shijie Huaren Xiaohua Zazhi 2017; 25(22): 2022-2027
- URL: https://www.wjgnet.com/1009-3079/full/v25/i22/2022.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i22.2022
许多中药的活性成分对药物代谢酶CYP450具有影响, 产生代谢性药物相互作用. 代谢性药物相互作用是指两种或两种以上的药物在同时或前后序贯用药时, 在代谢环节产生作用的干扰, 结果使疗效增强或者产生不良反应, 或疗效减弱甚至治疗失败[1]. "健脾和胃祛湿方"常作为肿瘤化/放疗间期治疗胃肠道和造血系统不良反应的辅助药物使用[1,2], 且能增加与其他抗肿瘤药物续贯用药. 研究"健脾和胃祛湿方"对药物代谢酶CYP450影响, 有助于了解药物代谢性药物相互作用和增加与其他抗肿瘤药物续贯用药的机制. 本研究采用"Cocktail"探针模型, 选择大鼠肝微粒体CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4 6种亚型的特异性底物非那西丁、甲苯磺丁脲、奥美拉唑、右美沙芬、氯唑沙宗和硝苯地平作为探针药物, 以扑热息痛, 羟基甲苯磺丁脲, 羟基奥美拉唑, 氧去甲基右美沙芬, 羟基氯唑沙宗和氢化硝苯地平等代谢产物的活性代表上述6种亚型的活性, 研究"健脾和胃祛湿方"对这6种亚型活性的影响. 同时应用Western blot、RT-PCR法测定该组方对大鼠肝脏上述6种亚型蛋白及基因表达水平的作用.
"健脾和胃祛湿方"由《古今医鉴》记载古方基础上加减并适当修改, 组成: 党参10 g, 白术10 g, 茯苓10 g, 黄芪30 g, 陈皮6 g, 法半夏9 g, 佛手10 g, 鸡内金10 g, 麦芽30 g, 布渣叶10 g, 山楂10 g, 甘草 6 g组成. 药材均购自大连药材集团公司. 水煎剂制成浓浸膏, 参照人体用量, 按系数折算出大鼠用量, 加蒸馏水稀释成灌胃溶液(含生药0.21 g/mL). SD大鼠购自南京君科生物工程公司; CYP1A2、CYP2E1抗体购自美国Santa cruz公司, CYP3A4、CYP2D6、CYP2C9、CYP2C19抗体购自美国Abcam公司; 其余试剂均为国产分析纯.
1.2.1 大鼠给药: SD大鼠分为空白对照组、药物高剂量组、药物中剂量组、药物低剂量组、苯巴比妥阳性对照组, 共5组, 每组10只大鼠. 空白对照组: 灌胃生理盐水20 mL/(kg•d); 药物高、中、低剂量组: 分别灌胃"健脾和胃祛湿方"溶液20、10、5 mL/(kg•d); 苯巴比妥阳性对照组: 腹腔注射苯巴比妥注射液50 mg/(kg•d). 实验第7天处死大鼠, 摘取肝脏组织.
1.2.2 Cocktail法测定大鼠肝微粒体CYP450的酶活性: (1)肝脏于4 ℃冰浴中剪碎, 用冰冷的蔗糖溶液洗涤数次至没有血色后按1:2体积比制成匀浆, 在16000 g, 4 ℃离心20 min; (2)取上清液, 105g, 4 ℃离心60 min; 取沉淀用焦磷酸钾溶液洗涤1次, 混悬均匀, 再次105g, 4 ℃离心60 min. 弃上清, 沉淀用2倍的含20%甘油的Tris-HCl缓冲液重悬, 加入适量磷酸盐缓冲液, 建立孵育体系. 按表1所列的混合探针底物浓度, 置于10 mL具塞棕色离心管中, 37 ℃水浴预孵育5 min, 加入还原型辅酶Ⅱ(1 mmol/L)启动反应, 20 min后, 加冰乙酸乙酯2 mL终止反应, 同时加入内标工作液10 μL. 旋涡振荡2 min, 静置10 min, 3500 r/min离心10 min, 转移上层有机相至另一棕色离心管中, 于真空干燥器中挥干, 残渣用甲醇:超纯水(80:20, v/v)500 mL复溶, 涡旋混合1 min, 15000 r/min离心5 min, 取上清, 进样10 μL, 平行操作3次.
| 亚型 | 探针 | 浓度(μmol/L) |
| CYP1A2 | 非那西丁 | 10 |
| CYP2C9 | 甲苯磺丁脲 | 100 |
| CYP2C19 | 奥美拉唑 | 5 |
| CYP2D6 | 右美沙芬 | 2.5 |
| CYP2E1 | 氯唑沙宗 | 20 |
| CYP3A4 | 硝苯地平 | 5 |
1.2.3 色谱条件: Agilent 6540 Q-TOF液相色谱-质谱联用仪, 色谱柱Hypersil ODS(C18)(4.6 mm×250 mm, 5 μm); 流动相正离子: 甲醇/1%甲酸水溶液 = 70/30(v/v); 负离子: 甲醇/0.1%甲酸水溶液 = 90/10(v/v); 流速: 0.3 mL/min. 电喷雾离子源: 正、负离子模式分开扫描, 除羟基氯唑沙宗用负离子方式扫描, 其余为正离子方式. 离子源电压: 4500 V和-3000 V, 离子源温度: 450 ℃.
1.2.4 Western blot法测定肝组织中CYP450的蛋白表达: 提取肝脏组织蛋白, 取少量做蛋白定量后, 调整蛋白量作Western blot蛋白质检测. 取适量裂解产物, 加入1/4体积5×上样缓冲液进行SDS-PAGE电泳. 完成电泳后, 将蛋白转移至PVDF膜, 使用脱脂牛奶封闭1 h, 加入一抗孵育1 h或者过夜, 4 ℃, TBST液洗涤3次, 加入相对应的二抗室温孵育1 h, TBST液洗涤3次, 进行荧光显色10 min.
1.2.5 RT-PCR测定肝细胞中CYP450的mRNA表达: 取适量肝脏组织, 按照TRIzol使用说明书提取大鼠肝组织的总RNA, 通过测定各组RNA样品的A260 nm和A280 nm值进行定量. 建立逆转录反应, 用0.1%DEPC-dd H2O补足总体积25 μL, 70 ℃水浴3 min, 立即置于冰上, 加MMLV逆转录酶(200 U/μL) 1 μL, 37 ℃水浴60 min; 95 ℃灭活5 min. 按下列反应参数进行PCR扩增: 变性94 ℃ 30 s, 退火63 ℃ 30 s, 延伸72 ℃ 1 min, 共30个循环, 各亚型引物如表2. 各组取5 μL扩增产物, 加1 μL 6×上样缓冲液, 进行1%琼脂糖凝胶80 V电压电泳30 min, 于凝胶成像系统上自动成像. 应用凝胶成像系统进行定量分析. 将所得目的基因的cDNA A值与内参PXR的A值进行比较, 所得比值即是目的基因mRNA表达的相对值.
| 亚型名称 | 引物(5'-3') |
| CYP1A2 | 上游: 5'-CTTTGACAAGAACAGTGTCCG-3' |
| 下游: 5'-AGTGTCCAGCTCCTTCTGGAT-3' | |
| CYP2C9 | 上游: 5'-GGACAGAGACGACAAGCACA-3' |
| 下游: 5'-AGTGAAAGATGGATAATGCCCC-3' | |
| CYP2C19 | 上游: 5'-TACCTCATTCCCAAGGGCAC-3' |
| 下游: 5'-GATAGTGAAATTTGGACCAGAGGA-3' | |
| CYP2D6 | 上游: 5'-TGATGAGAACCTGCGCATAG-3' |
| 下游: 5'-ACCGATGACAGGTTGGTGAT-3' | |
| CYP2E1 | 上游: 5'-AAACAGGGTAATGAGGCCCG-3' |
| 下游: 5'-TCATGCACCACAGCATCCAT-3' | |
| CYP3A4 | 上游: 5'-CCGGGCTTCTGGGGTGTTCC-3' |
| 下游: 5'-GGCGAGGTGATGGCGAGGTAGC-3' | |
| β-actin | 上游: 5'-TCCGGAAAGATCTGTGCTCT-3' |
| 下游: 5'-AGGGAGATCTGGTCCTCGAT-3' |
统计学处理 采用SPSS19.0软件包进行统计, 各实验结果以mean±SD表示. 数据采用方差分析, 组内数据两两比较采用矫正Bonferoni-t法进行比较, P<0.05为差异具有统计学意义.
采用"Cocktail"体外探针通过液质联用分析大鼠肝微粒体CYP450各亚型的酶活性, 结果显示, "健脾和胃祛湿方"对CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4酶活性没有显著性影响, 但剂量依赖性抑制CYP1A2酶活性, 其低剂量已经能明显抑制CYP1A2酶活性, 与空白组比较具有统计学差异(P<0.05, 表3).
| 分组 | CYP1A2 | CYP2C9 | CYP2C19 | CYP2D6 | CYP2E1 | CYP3A4 |
| 空白组 | 9.768±0.12 | 99.862±5.03 | 4.869±0.56 | 2.467±0.02 | 19.798±2.98 | 4.893±0.51 |
| 中药组(高) | 5.243±0.91b | 97.452±2.35 | 4.872±0.36 | 2.032±0.11 | 18.365±3.51 | 4.654±0.24 |
| 中药组(中) | 6.661±0.89b | 98.528±1.36 | 4.798±0.42 | 2.124±0.23 | 18.698±2.52 | 4.963±0.69 |
| 中药组(低) | 8.231±0.88a | 98.823±1.68 | 4.920±0.13 | 2.212±0.32 | 18.823±2.92 | 4.698±0.10 |
| 苯巴比妥组 | 4.755±0.46b | 44.987±2.21b | 2.15±0.09b | 1.267±0.17b | 8.965±0.75b | 2.086±0.21b |
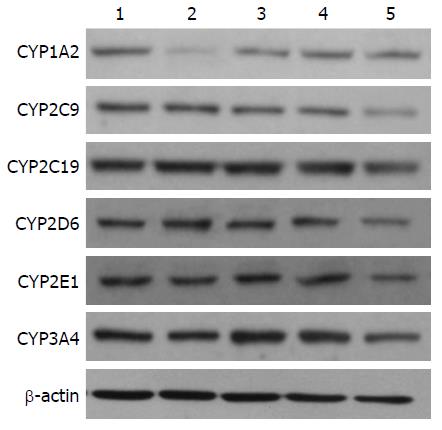
Western blotting结果显示, 分别对大鼠胃部灌注高、中、低剂量"健脾和胃祛湿方"后, CYP450亚型CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4的蛋白表达水平与空白组相比没有显著性差异; 而"健脾和胃祛湿方"则呈剂量依赖性地抑制亚型CYP1A2的蛋白表达水平(图1, 表4).
| 分组 | CYP1A2 | CYP2C9 | CYP2C19 | CYP2D6 | CYP2E1 | CYP3A4 |
| 空白组 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| 中药组(高) | 0.34±0.03b | 1.02±0.15 | 1.04±0.06 | 0.92±0.11 | 1.05±0.11 | 1.04±0.10 |
| 中药组(中) | 0.51±0.09b | 1.10±0.12 | 0.96±0.04 | 1.09±0.13 | 0.98±0.12 | 1.08±0.09 |
| 中药组(低) | 0.84±0.12a | 0.93±0.08 | 0.97±0.13 | 0.92±1.02 | 0.94±0.07 | 0.99±0.11 |
| 苯巴比妥组 | 0.41±0.06b | 0.46±0.07b | 0.68±0.09b | 0.41±0.03b | 0.51±0.08b | 0.61±0.07b |
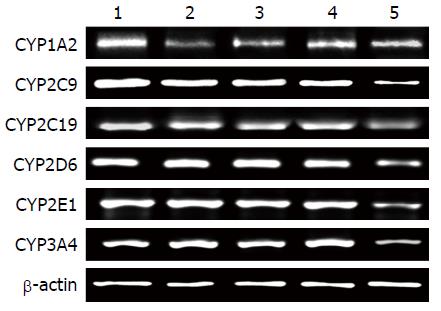
"健脾和胃祛湿方"高、中、低剂量对CYP450亚型CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4的mRNA水平均没有显著影响, 而呈剂量依赖性地降低亚型CYP1A2的mRNA水平(图2, 表5).
| 分组 | CYP1A2 | CYP2C9 | CYP2C19 | CYP2D6 | CYP2E1 | CYP3A4 |
| 空白组 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| 中药组(高) | 0.24±0.11b | 0.92±0.05 | 0.92±0.06 | 0.92±0.11 | 0.95±0.08 | 0.94±0.04 |
| 中药组(中) | 0.31±0.09b | 0.95±0.06 | 0.98±0.02 | 0.94±0.03 | 0.98±0.02 | 0.93±0.09 |
| 中药组(低) | 0.51±0.08b | 0.93±0.08 | 0.96±0.07 | 0.92±0.02 | 0.92±0.12 | 0.98±0.01 |
| 苯巴比妥组 | 0.39±0.06b | 0.42±0.07b | 0.49±0.09b | 0.59±0.10b | 0.64±0.09b | 0.24±0.03b |
"健脾和胃祛湿方"作为肿瘤在化/放疗间期长期使用的辅助用药, 增加了与其他抗肿瘤药物同时或续贯用药, 能够缓解肿瘤患者在接受化放疗治疗后脾胃受损、气血不足(胃肠道和造血系统不良反应)现象. 研究"健脾和胃祛湿方"对药物代谢酶CYP450影响, 有助于了解药物代谢性药物相互作用. 而CYP450为药物代谢过程中的关键酶, 两种或两种以上的药物在同时或前后序贯用药时, CYP450发挥着重要作用. 并且大部分的抗肿瘤药物经过体内CYP450代谢[3], CYP450活性的改变可以通过影响抗肿瘤药物在机体的清除从而影响其体内药物浓度. 由于抗肿瘤药物多属细胞内毒性药物, 具有治疗指数窄、剂量-效应曲线陡峭的药效学特征[4,5], 这类药物的临床疗效极易受体内药物浓度变化的影响. Chang等[6]通过临床研究发现合用抗惊厥类药物苯妥英钠、苯巴比妥后患者对紫杉类药物的最大耐受剂量增加, 同时不良事件的发生降低, 这是由于抗惊厥药物通过诱导CYP3A增加紫衫类药物的体内清除率, 从而降低其体内药物浓度.
"健脾和胃祛湿方"组方包括"黄芪、党参、白术、茯苓、陈皮、甘草"等十三味中药, 所含化学组分非常复杂, 包括黄酮类、萜类、异黄酮类、香豆素类、生物碱、多糖类、有机酸、内酯类、氨基酸等[7,8]. 文献报道[9,10]这些中药活性成分对CYP450有诱导或抑制的作用. 如: 甘草的主要成分甘草酸可以显著诱导肝脏代谢酶CYP3A、CYP2B与CYP1A2等亚型, 导致经上述酶代谢的药物与甘草合用后体内的代谢增加, 从而使其体内药物浓度下降、疗效降低[11-13]; Mu等[14]研究发现甘草可以通过诱导CYP450酶降低华法林的疗效; 此外, 构成"健脾和胃祛湿方"组方的其他味药物也含有已报道的对CYP酶产生影响的中药活性成分, 具体如下: 党参中含有黄酮类化合物汉黄芩素, 可以抑制肝脏代谢酶CYP3A、CYP2C、CYP2B、CYP1A与CYP2E[15]; 黄芪中含槲皮素, 可以降低CYP1A、2B、3A[5]; 黄芪中还含有异鼠李素, 可以抑制CYP1A、1B、3A[16]. 本研究中采用"Cocktail"体外探针, 结合Western blot、RT-PCR技术系统地研究探讨中药组方"健脾和胃祛湿方"对CYP450各亚型的活性、蛋白表达及基因表达的影响. 研究发现"健脾和胃祛湿方"对亚型CYP2C19、CYP2C9、CYP2D6、CYP2E1和CYP3A4的蛋白表达和基因表达没有显著性影响, 而对亚型CYP1A2则有较显著的抑制作用.
"健脾和胃祛湿方"与抗肿瘤药物合用的现象不可避免. 因此, 我们推测, "健脾和胃祛湿方"中所含的中药活性抑制CYP450亚型CYP1A2的活性, 因此当与抗肿瘤药物合用的时候, 应避免与经由CYP1A2代谢的肿瘤药物合用, 以免影响患者的临床疗效.
代谢性药物相互作用是指两种或两种以上的药物在同时或前后序贯用药时, 在代谢环节产生作用的干扰, 结果使疗效增强或者产生不良反应, 或疗效减弱甚至治疗失败. "健脾和胃祛湿方"常作为肿瘤化/放疗间期治疗胃肠道和造血系统不良反应的抗肿瘤药物续贯用药的辅助药物使用. 研究"健脾和胃祛湿方"对药物代谢酶CYP450影响, 有助于了解药物代谢性药物相互作用.
CYP450为药物代谢过程中的关键酶, 两种或两种以上的药物在同时或前后序贯用药时, CYP450发挥着重要作用. 本文通过研究"健脾和胃祛湿方"对CYP4506种亚型的影响, 有助于了解"健脾和胃祛湿方"在序贯用药的作用.
许多中药的活性成分对药物代谢酶CYP450具有影响, 产生代谢性药物相互作用. 而代谢性药物相互作用影响药物的同时或者前后序贯用药.
本研究采用"Cocktail"探针模型研究"健脾和胃祛湿方"对大鼠肝微粒体CYP1A2、CYP2C9、CY-P2C19、CYP-2D6、CYP2E1、CYP3A4活性的影响; 同时应用Western blot, RT-PCR法测定组方对大鼠肝脏中上述六种亚型蛋白及基因表达水平的作用.
"健脾和胃祛湿方"中所含的中药活性抑制CYP450亚型CYP1A2的活性, 因此当与抗肿瘤药物合用的时候, 应避免与经由CYP1A2代谢的肿瘤药物合用, 以免影响患者的临床疗效.
药物代谢酶(CYP450): 为一类亚铁血红素-硫醇盐蛋白的超家族, 主要分布在内质网和线粒体内膜上, 是一种药物代谢过程中的关键酶, 他参与内源性物质和包括药物、环境化合物在内的外源性物质的代谢.
黄培, 副主任医师, 江苏省无锡市第二人民医院中医科; 谭周进, 教授, 湖南中医药大学医学院; 吴焕淦, 教授, 上海市针灸经络研究所中医针灸
本文通过给大鼠不同剂量"健脾和胃祛湿方", 采用液质联用分析、免疫印迹杂交及逆转录聚合酶链反应方法测定大鼠肝微粒体及肝脏组织中CYP450酶系6种亚型的活性、蛋白及mRNA表达水平的影响, 具有较高的创新性, 行文结构规范.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 4. | Beijnen JH, Schellens JH. Drug interactions in oncology. Lancet Oncol. 2004;5:489-496. [PubMed] [DOI] |
| 5. | Fujita T, Kawase A, Niwa T, Tomohiro N, Masuda M, Matsuda H, Iwaki M. Comparative evaluation of 12 immature citrus fruit extracts for the inhibition of cytochrome P450 isoform activities. Biol Pharm Bull. 2008;31:925-930. [PubMed] [DOI] |
| 6. | Chang SM, Kuhn JG, Robins HI, Schold SC Jr, Spence AM, Berger MS, Mehta M, Pollack IF, Rankin C, Prados MD. A Phase II study of paclitaxel in patients with recurrent malignant glioma using different doses depending upon the concomitant use of anticonvulsants: a North American Brain Tumor Consortium report. Cancer. 2001;91:417-422. [PubMed] [DOI] |
| 9. | 修 琳琳, 于 雪, 刘 殿娜, 王 思睿, 柳 海艳, 陈 绍红, 陈 丰, 高 洁, 李 娜, 张 晨. 含反药组合的海藻玉壶汤中海藻不同品种与甘草加减应用对甲状腺肿大大鼠肝脏CYP450酶基因与蛋白表达的影响. 中华中医药杂志. 2017;19:329-334. |
| 11. | Zhou SF, Zhou ZW, Li CG, Chen X, Yu X, Xue CC, Herington A. Identification of drugs that interact with herbs in drug development. Drug Discov Today. 2007;12:664-673. [PubMed] [DOI] |
| 14. | Mu Y, Zhang J, Zhang S, Zhou HH, Toma D, Ren S, Huang L, Yaramus M, Baum A, Venkataramanan R. Traditional Chinese medicines Wu Wei Zi (Schisandra chinensis Baill) and Gan Cao (Glycyrrhiza uralensis Fisch) activate pregnane X receptor and increase warfarin clearance in rats. J Pharmacol Exp Ther. 2006;316:1369-1377. [PubMed] [DOI] |