修回日期: 2017-05-19
接受日期: 2017-05-22
在线出版日期: 2017-07-08
免疫球蛋白A(immunoglobulin A, IgA)在黏膜的免疫功能中起关键作用, 是维持肠道黏膜稳态的重要物质. 分泌型IgA(secretory IgA, SIgA)的分泌组分保护免疫球蛋白不被蛋白水解酶降解, SIgA在肠道内各种免疫因子、免疫细胞以及其他免疫球蛋白的参与下完成肠道内的免疫监视、免疫自稳、免疫调控. 本文主要就肠道中SIgA的结构、合成转运、分泌调节、作用和其相关临床疾病的研究进展作一综述.
核心提要: 分泌型IgA(secretory IgA, SIgA)是肠道中重要的免疫调节蛋白, 本文基于肠道中SIgA的特殊的双"Y"结构、合成转运、多途径分泌调节、作用的最新研究, 尤其是在胃肠感染等疾病的病理生理机制的联系作用, SIgA成为了一个肠道"卫士"的角色, 在协调肠道固有免疫和参与机体免疫调节的研究进展进行了总结.
引文著录: 韩渤, 刘玥宏, 仇志强, 张子卿, 王雪, 徐敬东. SIgA表达功能及其在肠道疾病的作用. 世界华人消化杂志 2017; 25(19): 1757-1763
Revised: May 19, 2017
Accepted: May 22, 2017
Published online: July 8, 2017
Immunoglobulin A (IgA) plays an important role in the mucosal immune function and is an important factor to maintain intestinal mucosal homeostasis. Substances secreted by secretory IgA (SIgA) protect immunoglobulins from degradation by protolytic enzymes. SIgA, together with various immune factors, immune cells, and other immunoglobulins in the intestine, participates in intestinal immunological surveillance, immunological homeostasis, and immune regulation. In this paper, we review the structure, synthesis, transport, and secretory regulation of SIgA as well as the relevant clinical diseases.
- Citation: Han B, Liu YH, Qiu ZQ, Zhang ZQ, Wang X, Xu JD. Secretory immunoglobulin A and intestinal diseases. Shijie Huaren Xiaohua Zazhi 2017; 25(19): 1757-1763
- URL: https://www.wjgnet.com/1009-3079/full/v25/i19/1757.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i19.1757
肠道是机体与外界接触最密切的部位之一, 其富集大量的淋巴组织、淋巴细胞和细胞因子来抵抗侵入肠道内的细菌、病毒、寄生虫以及毒素等有害物质. 肠道具有机体最为复杂免疫系统, 而免疫球蛋白发挥不可替代的作用. 免疫球蛋白A(immunoglobulin A, IgA)在黏膜的免疫功能中起关键作用, IgA存在于各种黏液分泌物中. 肠道中有大量的蛋白水解酶, 而分泌型IgA(secretory IgA, SIgA)的分泌组分能够保护免疫球蛋白不被蛋白水解酶降解, 因此, SIgA在复杂的胃肠道环境中对肠道有重要的保护作用. 本文基于肠道中SIgA的结构、合成转运、分泌调节、作用的最新研究, 尤其是胃肠感染等疾病的病理生理机制的联系予以综述.
IgA是高度糖基化的蛋白质, 主要由IgA1和IgA2两种形式存在. 超过80%的血清IgA属于IgA1, 外分泌液中IgA1占总IgA的50%-74%; IgA2在分泌性肠相关淋巴组织(gut-associated lymphoid tissue, GALT)的产生量大于非分泌淋巴样器官(脾和外周淋巴结)产生的量, 并可耐受部分相应蛋白酶的分解作用[1]. 由于IgA的产生部位和体内分布的特点, 又将IgA分成血清型IgA和SIgA[2]. 大多数IgA跨膜分泌, 其血清中浓度较低, 在肠腔中的SIgA结合在共生菌表面, 以保持肠道环境的稳态, 其又可结合口服入体内的病原体和毒素, 抑制肠道组织非炎症反应的过程[3,4]. 因此, SIgA在肠道免疫中发挥重要的作用, 而其有着特殊的合成、转运、调节过程.
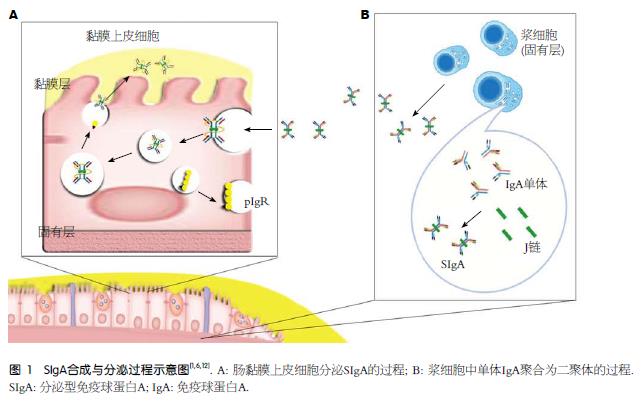
SIgA主要位于黏膜下相关淋巴组织, 黏膜相关淋巴组织(mucosal-associated lymphoid tissue, MALT)是由GALT、气管相关淋巴组织(bronchus-associated lymphoid tissue, BALT)、Peyer's patch(PP)、肠系膜淋巴结(mesenteric lymph node, MLN)、阑尾、泪腺、腮腺、扁桃体和乳腺等相互连接形成的一个免疫应答网络, 又称共同黏膜免疫系统(common mucosal immune system, CMIS)[5], 他主要由器官性黏膜相关淋巴组织(organized mucosal-associated lymphoid tissue, O-MALT)和弥散性黏膜相关淋巴组织(diffuselymphoidtissue-mucosal-associated lymphoid tissue, D-MALT)组成[6]. 肠壁内有上皮内淋巴细胞(intestine intraepithelial lymphocyte, iIEL)、固有层浆细胞、淋巴细胞和集合淋巴小结等大量淋巴组织, 这些分泌性抗体是保护肠道上皮细胞防御病原微生物和毒素的第一道防线[7]. 研究[8]证明少量M细胞存在于肠道的滤泡相关上皮(follicle associated epithelium, FAE), 摄取黏膜抗原后通过胞吞转运的方式将其递呈给抗原呈递细胞(antigen-presenting cell, APC), T细胞活化后和黏膜B细胞同型转换后, 产生大量的SIgA并释放到肠道内, 发挥相应作用[9].
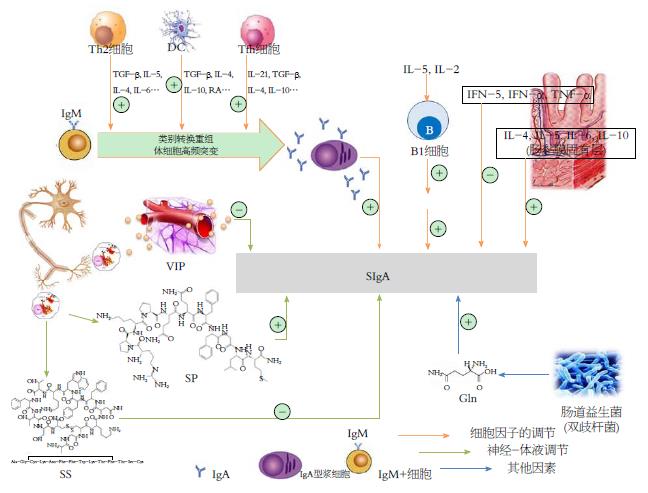
迄今为止, 发现固有层淋巴细胞(lamina propria lymphocyte, LPL)主要由SIgA浆细胞和CD4+ Th2组成. 前者能分泌大量SIgA; 后者能促进IgA+ B细胞向IgA浆细胞分化和成熟. O-MALT主要由IgA+细胞、T细胞、APC组成, 当抗原刺激MALT或淋巴滤泡、初始B细胞后, 经M细胞触发巨噬细胞活动增强发挥作用, 其后被固定于肠集合淋巴细胞形成免疫复合物[10]; B细胞可在抗原的刺激下不断分裂、分化[11], 并经淋巴液从胸导管和外周血归巢至黏膜发挥效应. 其中含富IgA的浆细胞在免疫应答时可分泌大量的SIgA. 肠道在各种抗原刺激和黏膜T细胞产生的细胞因子诱导下, 可加快B细胞类别转换至IgA型细胞. Th2细胞分化过程大致如下: T细胞分泌的TGF-β、IL-4诱导IgM型B细胞类别转换重组、高频突变为SIgA型B细胞; 也可通过分泌IL-5和IL-6使SIgA型B细胞加快分化成浆细胞产生抗体[12].
肠道抗原识别不仅可以诱导产生抗体, 同时还能促进免疫复合物与M细胞有效结合, 其在结合抗原之后会发生空间构象改变, 可能是因为SIgA重链的互补决定区通过变构作用对不同的抗原加以识别[13]. 人体内大部分SIgA是dIgA与pIgR结合并通过pIgR转运后进行跨细胞膜转运进入肠腔; 小部分则以pIgA通过淋巴液进入血液循环[14].
两个IgA通过J链相连形成二聚体, 而其在肠道内主要以SIgA的形式存在, SIgA是其二聚体与分泌片段(secretory component, SC)、J链相互结合形成[15]. SC是主要分布于上皮细胞基底侧膜及游离腔面的胞浆内分子量为83000的糖蛋白, 是从细胞膜上脱落下来的多聚体免疫球蛋白受体(polymeric immunoglobulin receptor, pIgR)的一部分. J链是由淋巴细胞和浆细胞产生相对分子质量为15600的特殊结构. 如图1B所示, SIgA特殊的结构SC、J链的结构与其功能有关: J链在SIgA的合成中起聚合作用, 促使IgA形成双聚体; J链通过二硫键(Cys13:Cys101和Cys109:Cys134)增大pIgA与SC的亲和力[16]. SC是SIgA合成、分泌和转运的特殊成分, 能防止SIgA水解并增加SIgA的稳定性. 如图1A所示穿膜SC/ pIgR与J链是"锁与钥匙"关系, 穿膜SC/pIgR与含J链的SIgA紧密结合. SC为细菌黏附提供了很多结合位点, SIgA通过SC的糖类残基与黏膜抗体附着, 从而清除细菌[17]. 研究证明SC在减少肠道毒素毒性上有重要作用, 其机制可能同毒素结合后降低黏附能力有关, 有实验证实[18]SIgA的重链和SC能与蓖麻子蛋白相连, 减少十二指肠固有层上蓖麻子蛋白的黏附作用, 可以减少蓖麻子的肠道毒性作用.
SIgA通过物理保护和免疫反应两种方式发挥保护黏膜作用. 其主要作用是通过减少肠道黏膜与病原体的直接接触[21]. SIgA参与肠道生物屏障的构成, 其与病原体结合后通过促进肠道蠕动、绒毛运动、肠道疏松黏液层流动等物理方式抵抗病原体的侵袭; 或通过化学中和作用与肠道内的酶、肠毒素等相互中和, 在空间时间上双重阻碍病原体与黏膜接触; 另外, SIgA激活巨噬细胞通过APC介导的抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediatedcytotoxicity, ADCC)机制杀灭肠道病原体[22].
SIgA保护黏膜免受病原体侵袭的另一个重要机制是保持黏膜表面内环境动态平衡[23], 使肠道共生菌达到相对稳定的状态. 有研究[24]表明定向敲除SIgA相关基因-J链基因、多聚免疫球蛋白受体基因和IgA重链恒定区基因的片段的动物实验, 动物肠道稳态破坏. 树突细胞(dendritic cell, DC)胞吞的肠道微生物局限于肠系膜淋巴结, 并激活局部特异性免疫应答[25,26]. SIgA的应答可以调节肠道内环境, 这为研究SIgA与肠道共生菌的关系提供了有效的依据[27]; 同时SIgA参与过敏反应的调控, 研究[28]显示潘氏小结在结合过敏原后可使SIgA产量增多, 其具有较强的中和作用, 起到抑制过敏反应的效果[29], 降低肠道的易感性, 这或许是肠道的一个重要的自我保护机制.
SIgA是一种多效能的抗体, 其含量相对稳定. 当其量发生明显的变化时, 提示可能与肠道的某些疾病的发生相关.
肠道对食物蛋白的局部黏膜免疫应与SIgA有关[30]. 研究[31]证实正常儿童肠道中SIgA抗体反应能力较高, 可以抵抗食物致敏原对肠黏膜的侵入, 通过SIgA减轻由病原菌引起的炎症, 激活产生SIgA的B细胞群; 通过SIgA与食物抗原结合也可以促进集合淋巴小结捕获抗原, 增强肠道的免疫屏障功能. 食物过敏儿童体内IgE升高的同时, SIgA介导的免疫级联反应降低. 当肠道双歧杆菌以及乳酸杆菌等肠道益生菌减少[32], 致使肠道黏膜分泌SIgA的水平下降, 使肠道黏膜屏障不能有效地阻止食物性抗原的入侵, 导致患者血清中出现抗食物蛋白的IgE易诱发肠道超敏反应[33]. 由此可见, 肠道益生菌对SIgA的作用不可小觑.
SIgA和共生菌构成的复合物存在于肠道中[34], 可以协助肠上皮细胞识别共生菌和病原体[35]. 与病原体相比, 包被SIgA的共生菌可识别、感测和激活不同的上皮细胞和DC, 发挥抗原呈递功能, 有助于宿主辨别有害细菌的侵袭与危害. 这表明适当水平的SIgA可以抑制细菌长期刺激引发GALT中黏膜B细胞过度分化与增殖, 以确保调节的持续性, 避免不适当的过度生长[36,37].
应激是机体受到一定强度刺激时出现的全身性非特异性适应反应. 应激性溃疡是一种典型的应激性疾病, 严重应激后往往出现胃肠黏膜糜烂、浅溃疡、渗血等病理学改变. 应激反应是生存所必需的复杂网络机制, 由外来神经递质、肽类激素和肠神经系统(enteric nervous system, ENS)的内分泌激素介导的, ENS可直接或间接影响IL的产生, IL参与肠道免疫调节功能[38]. 从免疫学的角度来看, IL-4、IL-5、IL-6等免疫因子可以调节SIgA的分泌, 其过程包括IgM+到IgA+ B细胞的激活和类别转换重组, 其中后者通过T细胞依赖性或T细胞非依赖性途径促进IgA合成[39]. SIgA阻止肠道内的抗原与黏膜上皮黏附, 这是在应激条件下肠道的功能保持完整的重要因素. 相反, 如果机体无法抵抗这些抗原, 其能够引起细胞源性的炎症因子的释放, 可以增强黏膜细胞通透性并破坏肠的功能完整性[9]. 此外, 研究[40]表明直肠切除术后的应激状态, 肠道存在严重的菌群失调, 各种肠道菌群均减少, 同时, 细菌易位可用于评估肠道抵抗微生物的能力, 细菌易位率在切除术后也出现下降, 进一步影响肠道稳态[41,42].
非甾体类抗炎药(non-steroidal antiinflammatory drugs, NSAIDs)肠病由于NSAIDs的广泛使用, 使得肠道的通透性改变、蛋白丢失、黏膜炎症及出血[43]. 黏膜通透性增加是NSAIDs造成肠道黏膜损害的重要因素, 肠道的黏膜免疫更进一步促进了病情发展[44]. 研究[45]显示, SIgA在NSAIDs肠病时肠黏膜中的含量降低, 而且其合成、分泌减少, 获得性体液免疫受到损害[46], 抵御肠腔内病毒、细菌及中和肠道毒素的功能减弱, 肠腔内抗原物质与效应细胞接触引起局部炎症细胞分泌多种细胞因子如IL-1、IL-8, 进一步加重了肠道炎症[47].
SIgA在肠道病原体感染时调节应答的细胞和分子机制成为研究肠道免疫和肠道健康的热点. 肠道的SIgA与肠道内其他免疫因子通过多途径参与肠道内的免疫监视、免疫自稳、免疫调控, 从而保证肠道正常生理功能; SIgA在新生儿胃肠病、应激性溃疡等发生、发展和转归过程中是重要的抗体蛋白. 由此可见, SIgA为人体肠道名副其实的有力"保护者", 然而, SIgA的合成、分泌及免疫调节功能当中的更多细节问题还有待发现、研究和探讨.
分泌型免疫球蛋白A(secretory immunoglobulin A, SIgA)主要分布在唾液、泪液、肠胃液、乳汁以及呼吸道分泌液, 在肠道黏膜免疫当中起到关键作用. 作为肠黏膜上的主要免疫球蛋白, 他组成了肠道黏膜上的第一道免疫屏障, 对各种内源共生菌及外源入侵的病原体都有抵抗作用. 肠道内其量发生明显的变化时与肠道的某些疾病的发生息息相关.
大量研究证实SIgA是肠道防止肠道细菌入侵的第一道防线中主要组成成分之一. 人的肠道内寄生着大量的细菌和各种病原体, 当这些抗原进入血液循环就会带来潜在危害. 而SIgA能够与肠道黏液构成一道生物屏障来抵御这些有害物质. SIgA可聚集潜在和入侵的病原体通过蠕动和黏液纤毛运动将其清除; SIgA免疫复合体可与肠Peyer's patch(PP)中的M细胞结合被转运入PP内, 与一定数量的PP细胞如DC、T和B淋巴细胞选择性交联, 对局部免疫调节作用导致黏膜中抗炎细胞因子生成. SIgA还可维持肠道屏障的完整, 目前其细节问题包括分子机制成为临床研究和治疗肠道过敏性发病机制和治疗方法的新视觉.
IgA是机体重要的免疫物质之一, 其主要功能在于抵御外界抗原如微生物, 对人体黏膜表面的侵袭. SIgA是60年代初Chodircker和Tomasi等首先在外分泌液中发现的一种主要存在于乳汁、胃肠液、呼吸道等外分泌液中的IgA抗体, 是呼吸道、消化道、泌尿生殖道等抵御病原体及有害物质入侵的第一道免疫屏障, 是人体黏膜免疫的最重要抗体. SIgA以多聚体形式存在, 可以直接阻止相应病原黏附于上皮, 达到局部抗感染作用. 同时, 最新的研究表明当机体在应急状态时SIgA显着增加, 这一重要发现发表于2017年的Stress Health期刊上, 这些研究揭示SIgA与机体状态的关系, 从而有望为与SIgA相关疾病的研究和治疗带来新的思路.
本文从肠道中SIgA的结构、合成转运、分泌调节、功能以及对胃肠感染、应激性溃疡, 非甾体类抗炎药(non-steroidal antiinflammatory drugs, NSAIDs), 肠病重症急性胰腺炎、旋毛虫感染的影响等方面做出了较为完整的叙述; 配图并重点阐述了SIgA作为肠道的"卫士"在消化道临床疾病重点作用, 并与SIgA的研究作一综述.
胃肠感染、应激性溃疡、NSAIDs肠病重症急性胰腺炎、旋毛虫感染、慢性乙型肝炎病毒感染合并胃黏膜病变是临床常见病、多发病, 在其检查与诊治过程中, 可以考虑SIgA的重要提示作用, 帮助诊断和判断转归.
SIgA: 分泌型免疫球蛋白A, 在肠道黏膜免疫当中起到关键作用, 作为肠黏膜上的主要免疫球蛋白, 他是肠道黏膜上的第一道防线, 对各种内源共生菌及外源入侵的病原体都有抵抗作用. SIgA主要分布在唾液、泪液、肠胃液、乳汁以及呼吸道分泌液.
高泽立, 副教授, 上海交通大学医学院九院周浦分院; 庹必光, 教授, 遵义医学院附属医院消化科; 唐勇, 研究员, 成都中医药大学针灸与时间生物学四川省重点实验室
本文从不同的角度叙述了肠道中SIgA的结构、合成转运、分泌调节、作用; 描述了SIgA与肠道疾患的关系. 从新的角度阐明SIgA分泌的调节特性, 特别提出SIgA和共生菌构成的复合物在肠道免疫中相关性以及与临床相关疾病的联系是肠道健康的作用不容小觑, 值得广大临床医师及基础研究者阅读.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Salerno-Goncalves R, Safavie F, Fasano A, Sztein MB. Free and complexed-secretory immunoglobulin A triggers distinct intestinal epithelial cell responses. Clin Exp Immunol. 2016;185:338-347. [PubMed] [DOI] |
| 3. | Corthésy B. Roundtrip ticket for secretory IgA: role in mucosal homeostasis? J Immunol. 2007;178:27-32. [PubMed] [DOI] |
| 4. | Mantis NJ, Rol N, Corthésy B. Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut. Mucosal Immunol. 2011;4:603-611. [PubMed] [DOI] |
| 5. | Fukatsu K. Impact of the feeding route on gut mucosal immunity. Curr Opin Clin Nutr Metab Care. 2014;17:164-170. [PubMed] [DOI] |
| 6. | 罗 治彬. 肠道黏膜SIgA免疫系统的研究进展. 细胞与分子免疫学杂志. 2001;13:40-43. |
| 9. | Brandtzaeg P. Mucosal immunity: induction, dissemination, and effector functions. Scand J Immunol. 2009;70:505-515. [PubMed] [DOI] |
| 10. | Cerutti A, Rescigno M. The biology of intestinal immunoglobulin A responses. Immunity. 2008;28:740-750. [PubMed] [DOI] |
| 12. | Boullier S, Tanguy M, Kadaoui KA, Caubet C, Sansonetti P, Corthésy B, Phalipon A. Secretory IgA-mediated neutralization of Shigella flexneri prevents intestinal tissue destruction by down-regulating inflammatory circuits. J Immunol. 2009;183:5879-5885. [PubMed] [DOI] |
| 13. | Phalipon A, Cardona A, Kraehenbuhl JP, Edelman L, Sansonetti PJ, Corthésy B. Secretory component: a new role in secretory IgA-mediated immune exclusion in vivo. Immunity. 2002;17:107-115. [PubMed] [DOI] |
| 14. | Macpherson AJ, Köller Y, McCoy KD. The bilateral responsiveness between intestinal microbes and IgA. Trends Immunol. 2015;36:460-470. [PubMed] [DOI] |
| 15. | Xiong N, Hu S. Regulation of intestinal IgA responses. Cell Mol Life Sci. 2015;72:2645-2655. [PubMed] [DOI] |
| 16. | Johansen FE, Braathen R, Brandtzaeg P. Role of J chain in secretory immunoglobulin formation. Scand J Immunol. 2000;52:240-248. [PubMed] [DOI] |
| 17. | Royle L, Roos A, Harvey DJ, Wormald MR, van Gijlswijk-Janssen D, Redwan el-RM, Wilson IA, Daha MR, Dwek RA, Rudd PM. Secretory IgA N- and O-glycans provide a link between the innate and adaptive immune systems. J Biol Chem. 2003;278:20140-20153. [PubMed] [DOI] |
| 18. | Mantis NJ, Farrant SA, Mehta S. Oligosaccharide side chains on human secretory IgA serve as receptors for ricin. J Immunol. 2004;172:6838-6845. [PubMed] [DOI] |
| 19. | Suzuki K, Nakajima A. New aspects of IgA synthesis in the gut. Int Immunol. 2014;26:489-494. [PubMed] [DOI] |
| 20. | Cao AT, Yao S, Gong B, Elson CO, Cong Y. Th17 cells upregulate polymeric Ig receptor and intestinal IgA and contribute to intestinal homeostasis. J Immunol. 2012;189:4666-4673. [PubMed] [DOI] |
| 21. | Diehl GE, Longman RS, Zhang JX, Breart B, Galan C, Cuesta A, Schwab SR, Littman DR. Microbiota restricts trafficking of bacteria to mesenteric lymph nodes by CX(3)CR1(hi) cells. Nature. 2013;494:116-120. [PubMed] [DOI] |
| 22. | Macpherson AJ, Hunziker L, McCoy K, Lamarre A. IgA responses in the intestinal mucosa against pathogenic and non-pathogenic microorganisms. Microbes Infect. 2001;3:1021-1035. [PubMed] [DOI] |
| 23. | Kato LM, Kawamoto S, Maruya M, Fagarasan S. Gut TFH and IgA: key players for regulation of bacterial communities and immune homeostasis. Immunol Cell Biol. 2014;92:49-56. [PubMed] [DOI] |
| 24. | Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Physiol Rev. 2010;90:859-904. [PubMed] [DOI] |
| 25. | Alarcón P, González M, Castro É. [The role of gut microbiota in the regulation of the immune response]. Rev Med Chil. 2016;144:910-916. [PubMed] [DOI] |
| 26. | Hapfelmeier S, Lawson MA, Slack E, Kirundi JK, Stoel M, Heikenwalder M, Cahenzli J, Velykoredko Y, Balmer ML, Endt K. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 2010;328:1705-1709. [PubMed] [DOI] |
| 28. | Roth-Walter F, Berin MC, Arnaboldi P, Escalante CR, Dahan S, Rauch J, Jensen-Jarolim E, Mayer L. Pasteurization of milk proteins promotes allergic sensitization by enhancing uptake through Peyer's patches. Allergy. 2008;63:882-890. [PubMed] [DOI] |
| 29. | Smits HH, Gloudemans AK, van Nimwegen M, Willart MA, Soullié T, Muskens F, de Jong EC, Boon L, Pilette C, Johansen FE. Cholera toxin B suppresses allergic inflammation through induction of secretory IgA. Mucosal Immunol. 2009;2:331-339. [PubMed] [DOI] |
| 31. | Yang X, Twitchell E, Li G, Wen K, Weiss M, Kocher J, Lei S, Ramesh A, Ryan EP, Yuan L. High protective efficacy of rice bran against human rotavirus diarrhea via enhancing probiotic growth, gut barrier function, and innate immunity. Sci Rep. 2015;5:15004. [PubMed] [DOI] |
| 32. | Olivares M, Castillejo G, Varea V, Sanz Y. Double-blind, randomised, placebo-controlled intervention trial to evaluate the effects of Bifidobacterium longum CECT 7347 in children with newly diagnosed coeliac disease. Br J Nutr. 2014;112:30-40. [PubMed] [DOI] |
| 34. | Lindner C, Wahl B, Föhse L, Suerbaum S, Macpherson AJ, Prinz I, Pabst O. Age, microbiota, and T cells shape diverse individual IgA repertoires in the intestine. J Exp Med. 2012;209:365-377. [PubMed] [DOI] |
| 35. | Sansonetti PJ. To be or not to be a pathogen: that is the mucosally relevant question. Mucosal Immunol. 2011;4:8-14. [PubMed] [DOI] |
| 36. | Sun Q, Shang Y, She R, Jiang T, Wang D, Ding Y, Yin J. Detection of intestinal intraepithelial lymphocytes, goblet cells and secretory IgA in the intestinal mucosa during Newcastle disease virus infection. Avian Pathol. 2013;42:541-545. [PubMed] [DOI] |
| 37. | Corthésy B. Role of secretory IgA in infection and maintenance of homeostasis. Autoimmun Rev. 2013;12:661-665. [PubMed] [DOI] |
| 38. | de Jonge WJ. The Gut's Little Brain in Control of Intestinal Immunity. ISRN Gastroenterol. 2013;2013:630159. [PubMed] [DOI] |
| 39. | Cerutti A. The regulation of IgA class switching. Nat Rev Immunol. 2008;8:421-434. [PubMed] [DOI] |
| 40. | 楼 翔. 直肠癌切除术后肠道菌群及SIgA含量的变化研究. 中国中西医结合消化杂志. 2015;23:40-43. |
| 41. | Liu D, Jiang XY, Zhou LS, Song JH, Zhang X. Effects of Probiotics on Intestinal Mucosa Barrier in Patients With Colorectal Cancer after Operation: Meta-Analysis of Randomized Controlled Trials. Medicine (Baltimore). 2016;95:e3342. [PubMed] [DOI] |
| 43. | Xun W, Shi L, Zhou H, Hou G, Cao T, Zhao C. Effects of curcumin on growth performance, jejunal mucosal membrane integrity, morphology and immune status in weaned piglets challenged with enterotoxigenic Escherichia coli. Int Immunopharmacol. 2015;27:46-52. [PubMed] [DOI] |
| 44. | Dai YC, Zheng L, Zhang YL, Chen X, Chen DL, Tang ZP. Effects of Jianpi Qingchang decoction on the quality of life of patients with ulcerative colitis: A randomized controlled trial. Medicine (Baltimore). 2017;96:e6651. [PubMed] [DOI] |
| 45. | 肖 源, 车 筑平, 程 华, 杨 红静, 谭 庆华. NSAIDs肠病大鼠回肠SIgA、IL-1β、IL-8、IL-10水平及树突状细胞数的变化. 贵州医科大学学报. 2016;41:1064-1067. |
| 49. | 郑 晓博, 邹 洪, 伍 松, 唐 均成, 文 艺, 冯 梨, 陈 振宇, 张 少华, 汤 礼军. 重症急性胰腺炎大鼠肠黏膜免疫屏障功能损伤及早期腹腔引流对其影响的实验研究. 世界科技研究与发展. 2013;35:739-744. |
| 50. | Wang L, Wang X, Bi K, Sun X, Yang J, Gu Y, Huang J, Zhan B, Zhu X. Oral Vaccination with Attenuated Salmonella typhimurium-Delivered TsPmy DNA Vaccine Elicits Protective Immunity against Trichinella spiralis in BALB/c Mice. PLoS Negl Trop Dis. 2016;10:e0004952. [PubMed] [DOI] |