修回日期: 2017-04-13
接受日期: 2017-05-02
在线出版日期: 2017-05-28
观察壳寡糖(chitosan oligosaccharide, COS)对2,4,6一三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)/乙醇法诱导的小鼠溃疡性结肠炎(ulcerative colitis, UC)的改善作用, 探讨其治疗UC的作用机制.
采用TNBS/乙醇法制备UC小鼠模型, 小鼠随机分3组: 正常组、模型组、COS组. 造模成功后给予干预治疗, 分别在12、24 h处死全部小鼠, 进行一般状态、形态及组织学观察(肉眼观察、显微镜观察); 应用Western blot检测COS组小鼠于COS处理0、12、24 h后对核因子-κB(nuclear factor-κB, NF-κB)表达的影响.
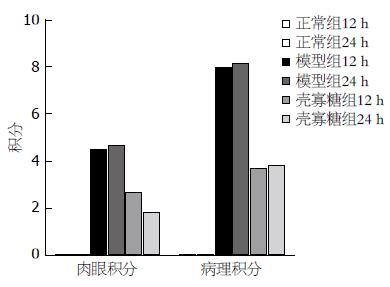
COS组小鼠一般状态较模型组好转. 模型组小鼠结肠黏膜组织损伤肉眼观积分较正常组明显增高(12 h组: 4.5±0.5 vs 0; 24 h组: 4.67±0.47 vs 0), 差异有统计学意义(P<0.05). COS组肉眼积分较模型组明显下降(12 h组: 2.67±0.47 vs 4.5±0.5; 24 h组: 1.83±0.69 vs 4.67±0.47), 差异有统计学意义(P<0.05). COS 12 h组肉眼积分较24 h组差异不显著(2.67±0.47 vs 1.83±0.69), 无统计学意义(P>0.05). 模型组小鼠结肠黏膜组织病理积分较正常组明显升高(12 h组: 8.00±0.63 vs 0; 24 h组: 8.17±0.75 vs 0), 差异有统计学意义(P<0.05). COS组小鼠结肠组织病理积分较模型组明显下降(12 h组: 3.67±0.52 vs 8.00±0.63; 24 h组: 3.83±0.41 vs 8.17±0.75), 差异有统计学意义(P<0.05). COS 12 h组小鼠结肠组织病理积分与COS 24 h组比较差异不显著(3.67±0.52 vs 3.83±0.41), 无统计学意义(P>0.05). COS组小鼠于COS处理12、24 h后NF-κB表达下调, 表明COS抑制NF-κB表达.
COS通过抑制NF-κB的表达对TNBS/乙醇法诱导的UC小鼠有改善作用.
核心提要: 应用Western blot验证了核因子-κB(nuclear factor-κB, NF-κB)参与了溃疡性结肠炎(ulcerative colitis, UC)的发生、发展, 并且观察到壳寡糖(chitosan oligosaccharide, COS)对TNBS/乙醇法诱导的UC小鼠的一般状态、形态及组织学方面具有改善作用, 从而验证COS可通过抑制NF-κB的表达对TNBS/乙醇法诱导的UC小鼠有改善作用.
引文著录: 刘海平, 姜曼, 陈朝旭, 李彦, 侯中英, 李温静, 战淑慧. 壳寡糖改善TNBS/乙醇法诱导的小鼠溃疡性结肠炎. 世界华人消化杂志 2017; 25(15): 1352-1359
Revised: April 13, 2017
Accepted: May 2, 2017
Published online: May 28, 2017
To observe the anti-inflammatory effect of chitosan oligosaccharide (COS) in mice with experimental ulcerative colitis (UC) and to explore the underlying mechanism.
A mouse model of UC was established by 2,4,6-trinitrobenzene sulfonic acid (TNBS)/ethanol enema. Mice were randomly divided into three groups: a normal group, a model group, and a COS group. After treatment, the general state, the gross morphology score, and the pathology score were compared among the three groups.
The general state of mice in the COS group was better than that of the model group. The gross morphology score for colon mucosal injury significantly increased in the model group compared with the normal group (12 h: 4.5 ± 0.5 vs 0; 24 h: 4.67 ± 0.47 vs 0; P < 0.05). The gross morphology score for colon mucosal injury declined significantly in the COS group compared with the model group (12 h: 2.67 ± 0.47 vs 4.5 ± 0.5; 24 h: 1.83 ± 0.69 vs 4.67 ± 0.47; P < 0.05). There was no significant difference in the gross morphology score for colon mucosal injury between 12 h and 24 h in the COS group (2.67 ± 0.47 vs 1.83 ± 0.69, P > 0.05). The pathology score increased significantly in the model group compared with the normal group (12 h: 8.00 ± 0.63 vs 0; 24 h: 8.17 ± 0.75 vs 0; P < 0.05). The pathology score declined significantly in the COS group compared with the model group (12 h: 3.67 ± 0.52 vs 8.00 ± 0.63; 24 h: 3.83 ± 0.41 vs 8.17 ± 0.75; P < 0.05). There was no significant difference in the pathology score between 12 h and 24 h in the COS group (3.67 ± 0.52 vs 3.83 ± 0.41, P > 0.05). After treatment with COS, the expression of nuclear factor-κB (NF-κB) declined significantly, suggesting that COS can inhibit the expression of NF-κB.
COS may exert anti-inflammatory effect on TNBS-induced UC in mice by inhibiting the expression of NF-κB.
- Citation: Liu HP, Jiang M, Chen ZX, Li Y, Hou ZY, Li WJ, Zhan SH. Chitosan oligosaccharide attenuates TNBS/ethanol-induced ulcerative colitis in mice. Shijie Huaren Xiaohua Zazhi 2017; 25(15): 1352-1359
- URL: https://www.wjgnet.com/1009-3079/full/v25/i15/1352.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i15.1352
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚未完全明确的结直肠慢性非特异性炎症性疾病, 主要侵及结直肠黏膜层和黏膜下层. 活动期病理学表现为肠黏膜充血、水肿, 固有膜内弥漫性炎症细胞(中性粒细胞、淋巴细胞、浆细胞、嗜酸性粒细胞等)浸润, 形成隐窝脓肿, 隐窝结构改变, 黏膜糜烂、溃疡. 目前尚无明确根治措施, 临床用药目的在于诱导并维持临床缓解及黏膜愈合, 防治并发症, 改善患者生存质量[1]. 但目前临床常用的治疗UC的药物如氨基水杨酸制剂、激素、免疫抑制剂等不良反应大, 不宜长期使用, 且停药后易复发, 治疗效果并不理想. 而生物制剂(如英夫利西单抗)仍价格昂贵, 限制了其临床应用. 壳寡糖(chitosan oligosaccharide, COS)是N-乙酰氨基葡萄糖(GIeNAe)和氨基葡萄糖(GleN)以β-1, 4-糖苷键连接而成的低聚糖, 大量实验研究发现其具有抑菌、抗肿瘤、调节免疫等多种生理功能. 本实验旨在观察COS对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)/乙醇法诱导的小鼠UC的改善作用, 并探讨其治疗UC的作用机制.
Balb/c小鼠42只, 健康、雌雄各半、分笼饲养, 体质量20-50 g, 购自青岛大学医学院. TNBS, 购自上海铭睿生物科技有限公司; COS购自青岛博智汇力生物科技有限公司; 二甲苯、无水乙醇、BCA蛋白质定量试剂盒、酶标仪、丙烯酰胺、双丙烯酰胺、20% SDS(w/v)、Tris-Cl 1.0 mol/L pH 8.8、Tris-Cl 1.0M pH 6.8、10% APS、TEMED、甘油、β巯基乙醇、溴酚蓝、10X电泳缓冲液、电泳仪Tris碱、甘氨酸、甲醇、磁力搅拌器、脱色摇床、反应容器、三羟甲基氨基甲烷缓冲盐水(tris buffered saline, TBS)/T: 1×TBS, 0.1%吐温-20%、5%牛血清白蛋白(bovine serum albumin, BSA)溶液、一级抗体、辣根过氧化物酶(horseradish peroxidase, HRP)结合的二级抗体、扫描仪、图像分析软件、化学发光试剂盒、显影液、定影液、X光胶片购自广试; 蛋白酶K, 购自Sagon; Tunel试剂盒, 购自Roche: 11684817910; DAB显色试剂盒, 购自Roche: 11718096001; 恒温摇床, 购自上海博迅实业公司; 微量移液枪, 购自Thermo fisher.
1.2.1 造模与处理: Balb/c小鼠42只, 适应性喂养7 d, 正常进食、进水, 保持饲养环境适宜. 确定小鼠健康后, 全部禁食、不禁饮水24 h. 随机分为: 对照组(14只), 造模组(28只). 10%水合氯醛(0.2 mL/100 g)腹腔注射麻醉, 固定. 造模组和对照组分别用0.25 mL的TNBS/乙醇液和生理盐水灌肠. 3 d后, 随机抽取4只造模组小鼠和2只对照组小鼠, 腹腔注射10%水合氯醛(0.2 mL/100 g)将小鼠麻醉, 剖开腹腔剪取直肠和结肠组织, 清洗后肉眼观察结肠组织, 并取肠段(10%甲醛溶液中固定)作组织切片以确定造模是否成功, 并选取造模成功小鼠病变肠段Western blot检测核因子-κB(nuclear factor-κB, NF-κB)表达. 将造模成功的24只Balb/c小鼠, 随机分为模型组、COS组(治疗组), 每组12只; 正常组小鼠12只. 在造模成功后, 正常组和模型组用生理盐水3 mL灌胃; COS组用15 mg/kg COS水溶液[2]3 mL灌胃. 各组再随机分2组, 每组6只, 每组用相应试剂分别处理12、24 h. 腹腔注射10%水合氯醛(0.2 mL/100 g)将各组小鼠麻醉, 切开腹腔, 从肛门以上2 cm处, 向上截取小鼠结肠组织6-8 cm, 沿小鼠肠系膜缘纵向剖开肠腔, 用生理盐水冲洗干净, 置于4%多聚甲醛溶液中, 肉眼观察结肠组织. 将截取的结肠组织固定、脱水后, 经石蜡包埋做组织切片, 经Tunel染色后, 光学显微镜下观察结肠组织炎性变化. Western blot检测12 h和24 h NF-κB表达.
1.2.2 NF-κB表达的检测: 采用Western blot法, 提取并检测平培养细胞蛋白, 根据蛋白测定试剂盒说明书测定样本中总蛋白含量. 电泳、蛋白质转移, 5%BSA溶液室温孵育1 h行膜封闭, 洗涤后加入NF-κB单克隆抗体孵育, 洗涤后加入HRP标记的二抗孵育, 洗涤后的膜置于化学发光试剂盒中孵育, 将膜以X线胶片曝光, 图片扫描保存为电脑文件, 并用分析软件将图片上每个特异条带灰度值数字化.
1.2.3 观察指标: 一般状态: 观察各组小鼠的食欲、活动情况、精神状态、大便性状、体质量等. 形态及组织学观察: 肉眼观察结肠黏膜充血、水肿、溃疡的数目与面积评估结肠黏膜损伤状况, 采用结肠黏膜损伤的肉眼观评分标准[3]; 光学显微镜观察结肠黏膜炎症程度、病变深度与范围以及隐窝破坏状况评估结肠黏膜组织病理变化, 采用结肠组织病理评分标准[3].
统计学处理 实验所得数据采用SPSS17.0统计学软件进行分析, 数据描述均以mean±SD表示, 采用单因素方差分析, 组间差异采用q检验, 以P<0.05为差异具有统计学意义.
正常组: 正常12、24 h组小鼠均食欲良好, 食量较多, 喜欢活动, 活动敏捷, 精神状态良好, 大便成形, 体质量增加. 模型组: 造模3 d后, 模型12、24 h组小鼠均出现食欲减退, 食量减少, 聚堆懒动, 精神萎靡, 大便稀溏带黏液、脓血, 体质量减轻. COS组: 经COS溶液灌胃给药12 h组小鼠较造模组小鼠食欲好转, 饭量增加, 活动量增加, 精神状态好转, 大便渐成形, 黏液、脓血便逐渐减少. 经COS水溶液灌胃给药24 h组小鼠上述症状均有显著改善, 黏液、脓血便明显减少, 但与正常组比较, 上述症状仍然略差.
正常组: 正常12、24 h组小鼠结肠黏膜组织颜色淡红, 黏膜表面光滑整齐, 结肠壁薄厚均匀, 未见出血点、糜烂以及溃疡. 模型组: 模型12 h组小鼠结肠黏膜皱襞广泛充血水肿、边缘不清晰, 可见粗大紊乱或增生隆起的结肠组织, 结肠壁增厚, 肠腔变窄, 可见到多发糜烂和多个散在溃疡, 溃疡直径多<1 cm, 溃疡周围环行黏膜充血水肿. 模型24 h组小鼠结肠黏膜可见直径>1 cm的多发溃疡. COS组: COS 12 h组小鼠结肠黏膜组织表面可见数个糜烂面, 其周围黏膜组织充血、水肿明显, 无明显溃疡或偶有单个溃疡. COS 24 h组小鼠结肠黏膜组织表面无明显溃疡, 偶见局限糜烂面, 其周围黏膜组织充血水肿明显. 结果显示: 模型组小鼠结肠黏膜组织损伤肉眼观积分较正常组明显增高(12 h组: 4.50±0.50 vs 0; 24 h组: 4.67±0.47 vs 0), 差异有统计学意义(P<0.05). COS组肉眼积分较模型组明显下降(12 h组: 2.67±0.47 vs 4.50±0.50; 24 h组: 1.83±0.69 vs 4.67±0.47), 差异有统计学意义(P<0.05). COS 12 h组肉眼观积分与COS 24 h组比较差异不显著(2.67±0.47 vs 1.83±0.69), 差异无统计学意义(P>0.05, 表1, 图1).
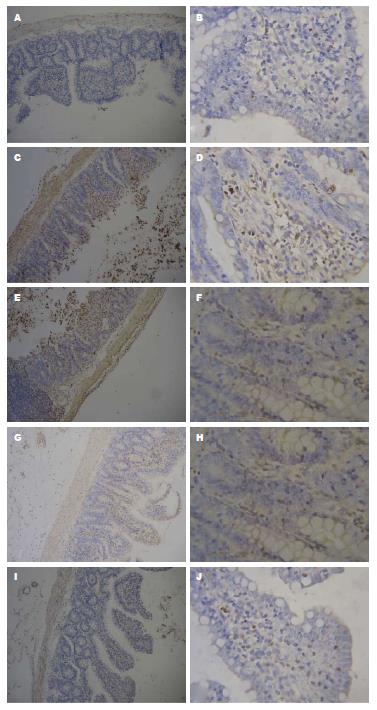
各组小鼠结肠组织显微镜下表现如图2. 正常组: 小鼠结肠黏膜组织表面光滑整齐, 黏膜上皮结构清晰完整, 固有腺体排列整齐, 细胞间连接紧密, 无溃疡形成、无隐窝脓肿; 黏膜间质无充血水肿、无炎性细胞浸润, 血管形态清晰、结构正常; 黏膜下层宽窄适度; 结肠肠壁未见增厚, 肌层整齐连续. 模型组: 黏膜表层有大量上皮细胞脱落, 黏膜间质水肿、充血, 呈明显非特异性炎症, 腺体组织结构破坏, 杯状细胞消失, 水肿, 黏膜层及黏膜下层坏死灶, 内见大量的炎性细胞浸润. COS 12 h组: 结肠组织基本恢复正常, 黏膜间质炎性细胞显著减少, 充血、水肿明显减轻, 溃疡处结肠黏膜组织上皮覆盖不全, 局部区域黏膜较薄, 可见溃疡修复处有新生上皮和腺体形成. COS 24 h组: 溃疡处结肠黏膜组织上皮覆盖不全, 炎细胞浸润减少, 腺体杯状细胞恢复明显, 局部区域黏膜较厚, 可见修复的大小不一腺体. 结果显示: 模型组小鼠结肠黏膜组织病理积分较正常组明显升高(12 h组: 8.00±0.63 vs 0; 24 h组: 8.17±0.75 vs 0), 差异有统计学意义(P<0.05). COS组小鼠结肠组织病理积分较模型组明显下降(12 h组: 3.67±0.52 vs 8.00±0.63; 24 h组: 3.83±0.41 vs 8.17±0.75), 差异有统计学意义(P<0.05). COS 12 h组小鼠结肠组织病理积分与COS 24 h组比较差异不显著(3.67±0.52 vs 3.83±0.41), 无统计学意义(P>0.05, 表1, 图1).
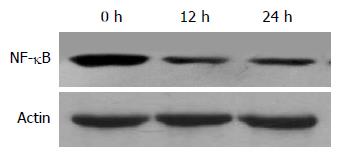
COS组小鼠于COS处理12 h(灰度值324)、24 h(灰度值437)后NF-κB表达较处理前(灰度值745)明显降低, 表明COS有效抑制NF-κB表达(图3).
UC是一种病因尚未完全明确的结直肠慢性非特异性炎症性疾病, 主要侵及结直肠黏膜层和黏膜下层. UC病因和发病机制尚未完全阐明, 治疗缺乏特异性, 临床用药目的在于诱导并维持临床缓解及黏膜愈合, 防治并发症, 改善患者生存质量[1]. 常用的药物有氨基水杨酸制剂、激素、免疫抑制剂、生物制剂(如英夫利西单抗). 但目前常用药物只能暂时控制和缓解症状, 不能从根本上治愈该病, 且长期用药不良反应发生率增加, 停药后易复发, 病程迁延, 并发症发生率增加. 重度UC死亡率仍较高, 严重影响患者生存质量. 因此, 临床上亟需一种可控制UC病情且不良反应少, 适合长期服用的药物来解除患者的痛苦.
海洋药物是从海洋生物中提取的具有多种药理作用的新型药物, 具有来源丰富、作用广泛、不良反应少等特点. 近年作为新型药物研发的热点, 海洋类药物在恶性肿瘤、心脑血管疾病、炎症等疾病的预防和治疗方面取得了令人瞩目的成绩. COS是甲壳类生物外壳的重要组分, 是由N-乙酰氨基葡萄糖(GIeNAe)和氨基葡萄糖(GleN)以β-1, 4-糖苷键连接而成的低聚糖, 其水溶性高, 安全无毒, 易被人体肠道吸收[4-6], 并且大量研究[5-13]表明具有抑菌、抗炎、抗肿瘤、调血糖、调血脂、预防肥胖、抗氧化、调节免疫等多种生理功能. 众所周知, UC的发生与细菌感染、肠屏障破坏、肠道免疫异常等因素相关[14-16]. 而目前, 有关COS在UC中的应用的研究还非常有限. 本实验通过COS对TNBS/乙醇法诱导的UC小鼠一般状态、形态及组织学观察(肉眼观察、显微镜观察)验证了COS对UC具有改善作用, 并应用Western blot验证了NF-κB参与了肠道炎症的发生, 并且COS可以有效抑制肠炎中NF-κB的表达. NF-κB是一种与机体炎症、免疫、组织损伤和修复等有着密切联系的核转录因子, 在静息状态下, 不具有生物学活性, 在受到细胞因子、内毒素等因素刺激下, 启动靶基因的转录[17]. 近年来, 国内外大量研究[5,18-31]显示NF-κB参与了UC的发生、发展. 陈吉等[18]研究发现, 活动期UC患者肠黏膜高表达NF-κB p65, 而健康对照者肠黏膜则低表达或不表达. Koh等[19]研究发现, NF-κB在DSS诱导的小鼠肠炎中过度表达, 并且非索非那定可以直接抑制NF-κB信号通路的激活从而减轻小鼠肠炎. Chun等[20]研究发现, 熊果酸也是通过抑制NF-κB信号通路的激活缓解肠道炎症. Sun等[21]研究发现汉黄芩甙可以下调NF-κB信号通路的活化及抑制NLRP3的活化, 从而对DSS诱导的小鼠肠炎起到缓解作用, 与Cui等[31]研究结果一致. Yousef等[2]研究发现COS可与肠上皮细胞的LPS受体结合, 抑制LPS诱导的NF-κB活化; 并且COS可以直接抑制NF-κB的活化, 减少炎症因子的产生, 从而对肠炎起到治疗作用, 与本研究结果一致. 总之, NF-κB在UC的发生、发展中居于重要地位, 抑制NF-κB信号通路的活化有助于控制和缓解肠道炎症. COS作为一种新型海洋药物, 在UC动物模型中表现出了良好的治疗作用, 加之其本身的理化特性, 我们相信COS在UC治疗方面有很好的应用前景. 有关COS在UC的临床应用效果还有待进一步研究.
溃疡性结肠炎(ulcerative colitis, UC)病因和发病机制尚未完全阐明, 治疗缺乏特异性, 目前临床常用药物只能暂时控制和缓解症状, 长期用药不良反应发生率增加, 停药后易复发, 病程迁延, 并发症发生率增加. 壳寡糖(chitosan oligosaccharide, COS)作为一种新兴海洋药物, 具有良好的理化特性和多种生理功能, 本研究试探讨COS对UC的治疗作用及其机制.
近年来, 国内外大量研究显示核因子-κB(nuclear factor-κB, NF-κB)参与了UC的发生、发展. 抑制NF-κB的活化对于控制UC具有重要作用. COS作为一种新型海洋药物, 具有良好的理化特性和多种生理功能, 而目前, 有关COS在UC中应用的研究还非常有限. 本研究试探讨COS对UC的治疗作用及其机制.
陈吉等研究发现, 活动期UC患者肠黏膜高表达NF-κB p65, 而健康对照者肠黏膜则低表达或不表达, 表明NF-κB参与了UC的发生、发展. 为治疗UC的进一步研究提供了依据.
本研究应用Western blot验证了NF-κB参与了UC的发生、发展, 并且观察到COS对2,4,6一三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)/乙醇法诱导的UC小鼠的一般状态、形态及组织学方面具有改善作用, 从而验证COS可通过抑制NF-κB的表达对TNBS/乙醇法诱导的UC小鼠有改善作用.
壳寡糖(COS): 甲壳类生物外壳的重要组分, 是由N-乙酰氨基葡萄糖(GIeNAe)和氨基葡萄糖(GleN)以β-1,4-糖苷键连接而成的低聚糖, 其水溶性高, 安全无毒, 易被人体肠道吸收, 并且大量研究表明具有抑菌、抗炎、抗肿瘤、调血糖、调血脂、预防肥胖、抗氧化、调节免疫等多种生理功能.
刘杰民, 主任医师, 贵州省人民医院消化内镜科
本研究观察COS对TNBS/乙醇法诱导的小鼠UC的改善作用, 探讨其治疗UC的作用机制. 研究结果发现COS作为一种新型海洋药物, 在UC动物模型中表现出了良好的治疗作用, 加之其本身的理化特性, 有待进一步深入研究, 以期COS在UC治疗方面有很好的应用前景.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 2. | Yousef M, Pichyangkura R, Soodvilai S, Chatsudthipong V, Muanprasat C. Chitosan oligosaccharide as potential therapy of inflammatory bowel disease: therapeutic efficacy and possible mechanisms of action. Pharmacol Res. 2012;66:66-79. [PubMed] [DOI] |
| 3. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] [DOI] |
| 4. | Fang IM, Yang CM, Yang CH. Chitosan oligosaccharides prevented retinal ischemia and reperfusion injury via reduced oxidative stress and inflammation in rats. Exp Eye Res. 2015;130:38-50. [PubMed] [DOI] |
| 5. | Muanprasat C, Chatsudthipong V. Chitosan oligosaccharide: Biological activities and potential therapeutic applications. Pharmacol Ther. 2017;170:80-97. [PubMed] [DOI] |
| 6. | Mattaveewong T, Wongkrasant P, Chanchai S, Pichyangkura R, Chatsudthipong V, Muanprasat C. Chitosan oligosaccharide suppresses tumor progression in a mouse model of colitis-associated colorectal cancer through AMPK activation and suppression of NF-κB and mTOR signaling. Carbohydr Polym. 2016;145:30-36. [PubMed] [DOI] |
| 7. | Huang L, Chen J, Cao P, Pan H, Ding C, Xiao T, Zhang P, Guo J, Su Z. Anti-obese effect of glucosamine and chitosan oligosaccharide in high-fat diet-induced obese rats. Mar Drugs. 2015;13:2732-2756. [PubMed] [DOI] |
| 8. | Kunanusornchai W, Witoonpanich B, Tawonsawatruk T, Pichyangkura R, Chatsudthipong V, Muanprasat C. Chitosan oligosaccharide suppresses synovial inflammation via AMPK activation: An in vitro and in vivo study. Pharmacol Res. 2016;113:458-467. [PubMed] [DOI] |
| 9. | Kim JG, Jo SH, Ha KS, Kim SC, Kim YC, Apostolidis E, Kwon YI. Effect of long-term supplementation of low molecular weight chitosan oligosaccharide (GO2KA1) on fasting blood glucose and HbA1c in db/db mice model and elucidation of mechanism of action. BMC Complement Altern Med. 2014;14:272. [PubMed] [DOI] |
| 10. | Yu SY, Kwon YI, Lee C, Apostolidis E, Kim YC. Antidiabetic effect of chitosan oligosaccharide (GO2KA1) is mediated via inhibition of intestinal alpha-glucosidase and glucose transporters and PPARγ expression. Biofactors. 2017;43:90-99. [PubMed] [DOI] |
| 11. | Abdel-Rahman RM, Hrdina R, Abdel-Mohsen AM, Fouda MM, Soliman AY, Mohamed FK, Mohsin K, Pinto TD. Chitin and chitosan from Brazilian Atlantic Coast: Isolation, characterization and antibacterial activity. Int J Biol Macromol. 2015;80:107-120. [PubMed] [DOI] |
| 12. | Gibot L, Chabaud S, Bouhout S, Bolduc S, Auger FA, Moulin VJ. Anticancer properties of chitosan on human melanoma are cell line dependent. Int J Biol Macromol. 2015;72:370-379. [PubMed] [DOI] |
| 13. | Zhang W, Xia W. Effect of media milling on lipid-lowering and antioxidant activities of chitosan. Int J Biol Macromol. 2015;72:1402-1405. [PubMed] [DOI] |
| 14. | Geremia A, Biancheri P, Allan P, Corazza GR, Di Sabatino A. Innate and adaptive immunity in inflammatory bowel disease. Autoimmun Rev. 2014;13:3-10. [PubMed] [DOI] |
| 15. | Antoni L, Nuding S, Wehkamp J, Stange EF. Intestinal barrier in inflammatory bowel disease. World J Gastroenterol. 2014;20:1165-1179. [PubMed] [DOI] |
| 16. | Wallace KL, Zheng LB, Kanazawa Y, Shih DQ. Immunopathology of inflammatory bowel disease. World J Gastroenterol. 2014;20:6-21. [PubMed] [DOI] |
| 17. | Varfolomeev E, Goncharov T, Maecker H, Zobel K, Kömüves LG, Deshayes K, Vucic D. Cellular inhibitors of apoptosis are global regulators of NF-κB and MAPK activation by members of the TNF family of receptors. Sci Signal. 2012;5:ra22. [PubMed] [DOI] |
| 19. | Koh SJ, Kim JW, Kim BG, Lee KL, Chun J, Kim JS. Fexofenadine regulates nuclear factor-κB signaling and endoplasmic reticulum stress in intestinal epithelial cells and ameliorates acute and chronic colitis in mice. J Pharmacol Exp Ther. 2015;352:455-461. [PubMed] [DOI] |
| 20. | Chun J, Lee C, Hwang SW, Im JP, Kim JS. Ursolic acid inhibits nuclear factor-κB signaling in intestinal epithelial cells and macrophages, and attenuates experimental colitis in mice. Life Sci. 2014;110:23-34. [PubMed] [DOI] |
| 21. | Sun Y, Zhao Y, Yao J, Zhao L, Wu Z, Wang Y, Pan D, Miao H, Guo Q, Lu N. Wogonoside protects against dextran sulfate sodium-induced experimental colitis in mice by inhibiting NF-κB and NLRP3 inflammasome activation. Biochem Pharmacol. 2015;94:142-154. [PubMed] [DOI] |
| 22. | V VP, C G. Protective effect of marine mangrove Rhizophora apiculata on acetic acid induced experimental colitis by regulating anti-oxidant enzymes, inflammatory mediators and nuclear factor-kappa B subunits. Int Immunopharmacol. 2014;18:124-134. [PubMed] [DOI] |
| 23. | Sakthivel KM, Guruvayoorappan C. Protective effect of Acacia ferruginea against ulcerative colitis via modulating inflammatory mediators, cytokine profile and NF-κB signal transduction pathways. J Environ Pathol Toxicol Oncol. 2014;33:83-98. [PubMed] [DOI] |
| 24. | Tsang SW, Ip SP, Wu JC, Ng SC, Yung KK, Bian ZX. A Chinese medicinal formulation ameliorates dextran sulfate sodium-induced experimental colitis by suppressing the activity of nuclear factor-kappaB signaling. J Ethnopharmacol. 2015;162:20-30. [PubMed] [DOI] |
| 25. | Niu X, Zhang H, Li W, Wang Y, Mu Q, Wang X, He Z, Yao H. Protective effect of cavidine on acetic acid-induced murine colitis via regulating antioxidant, cytokine profile and NF-κB signal transduction pathways. Chem Biol Interact. 2015;239:34-45. [PubMed] [DOI] |
| 26. | Soubh AA, Abdallah DM, El-Abhar HS. Geraniol ameliorates TNBS-induced colitis: Involvement of Wnt/β-catenin, p38MAPK, NFκB, and PPARγ signaling pathways. Life Sci. 2015;136:142-150. [PubMed] [DOI] |
| 27. | Zhang H, Deng A, Zhang Z, Yu Z, Liu Y, Peng S, Wu L, Qin H, Wang W. The protective effect of epicatechin on experimental ulcerative colitis in mice is mediated by increasing antioxidation and by the inhibition of NF-κB pathway. Pharmacol Rep. 2016;68:514-520. [PubMed] [DOI] |
| 28. | Pandurangan AK, Mohebali N, Hasanpourghadi M, Looi CY, Mustafa MR, Mohd Esa N. Boldine suppresses dextran sulfate sodium-induced mouse experimental colitis: NF-κB and IL-6/STAT3 as potential targets. Biofactors. 2016;42:247-258. [PubMed] |
| 29. | Li R, Chen Y, Shi M, Xu X, Zhao Y, Wu X, Zhang Y. Gegen Qinlian decoction alleviates experimental colitis via suppressing TLR4/NF-κB signaling and enhancing antioxidant effect. Phytomedicine. 2016;23:1012-1020. [PubMed] [DOI] |
| 30. | Huang YF, Zhou JT, Qu C, Dou YX, Huang QH, Lin ZX, Xian YF, Xie JH, Xie YL, Lai XP. Anti-inflammatory effects of Brucea javanica oil emulsion by suppressing NF-κB activation on dextran sulfate sodium-induced ulcerative colitis in mice. J Ethnopharmacol. 2017;198:389-398. [PubMed] [DOI] |
| 31. | Cui L, Feng L, Zhang ZH, Jia XB. The anti-inflammation effect of baicalin on experimental colitis through inhibiting TLR4/NF-κB pathway activation. Int Immunopharmacol. 2014;23:294-303. [PubMed] [DOI] |