修回日期: 2017-03-30
接受日期: 2017-04-11
在线出版日期: 2017-05-08
研究骨形成蛋白2(bone morphogenetic protein 2, BMP-2)在肝细胞癌(hepatocellular carcinoma, HCC)组织的表达情况及与肿瘤血管生成的关系.
应用免疫组织化学方法检测BMP-2在40例HCC组织及40例癌旁组织的表达, 分析其与临床病理特征之间的关系, CD34染色标记肿瘤微血管密度(microvascular density, MVD).
免疫组织化学显示, HCC组织中的BMP-2和血管内皮生长因子(vascular endothelial growth factor, VEGF)表达与癌旁组织中比较, 阳性率显著增加(75% vs 40%; 80.0% vs 42.5%, P<0.05), 并且BMP-2与VEGF蛋白表达与HCC包膜完整、结节、门静脉癌栓、TNM分期、细胞分化有关, 而与患者的年龄、性别、血清AFP、肝硬化无关. 根据Spearman相关性分析, BMP-2与VEGF蛋白表达呈正相关(r = 7.316, P = 0.0068), 提示BMP-2参与到肿瘤血管生成过程. HCC组织血管生成活跃(55% vs 15%, P <0.05), 血管生成与BMP-2表达有关.
HCC中BMP-2高表达在肿瘤血管生成中有重要的作用.
核心提要: 肝细胞癌(hepatocellular carcinoma, HCC)是富含血管的恶性肿瘤, 容易通过新生血管发生侵袭和转移. 而血管生成是恶性肿瘤的表型特征, 不仅为肿瘤细胞增殖提供养分, 而且是肿瘤细胞侵袭和转移的基础, 从血管生成角度出发, 寻找治疗HCC的有效治疗.
引文著录: 王玉霞, 刘贵秋, 刘辉, 张传山. BMP-2在肝细胞癌中表达及与肿瘤血管生成的关系. 世界华人消化杂志 2017; 25(13): 1150-1158
Revised: March 30, 2017
Accepted: April 11, 2017
Published online: May 8, 2017
To detect the expression of bone morphogenetic protein 2 (BMP-2) in hepatocellular carcinoma (HCC) and analyze its correlation with tumor angiogenesis.
Immunohistochemical (IHC) method was used to detect the expression of BMP-2 in 40 cases of HCC and matched tumor-adjacent specimens. The relationship between BMP-2 expression and clinicopathologic features was analyzed. Microvascular density was determined by labeling vascular endothelial cells with CD34, and the correlation of BMP-2 expression with tumor angiogenesis was analyzed.
IHC data showed that the positive rates of BMP-2 and vascular endothelial growth factor (VEGF) expression in HCC were significantly higher than those in tumor-adjacent tissues (75% vs 40%; 80.0% vs 42.5%, P < 0.05 for both). Expression of BMP-2 and VEGF was positively associated with intact tumor capsule, nodules, portal venous tumor emboli, TNM stage, and tumor cell differentiation, but not with patient's age, sex, serum AFP, or live cirrhosis. Tumor angiogenesis was related with BMP-2 expression in HCC. Spearman correlation analysis showed that there was a positive correlation between BMP-2 and VEGF expression (r = 7.316, P = 0.0068). Active angiogenesis was detected more frequently in HCC compared to tumor-adjacent tissues (55% vs 15%, P < 0.05).
High expression of BMP-2 in HCC plays an important role in tumor angiogenesis.
- Citation: Wang YX, Liu GQ, Liu H, Zhang CS. Correlation between BMP-2 expression and tumor angiogenesis in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(13): 1150-1158
- URL: https://www.wjgnet.com/1009-3079/full/v25/i13/1150.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i13.1150
原发性肝癌是一种恶性程度高, 进展快, 侵袭性强, 预后差的肿瘤. 尤其是在高发地区, 他严重影响人们的身心健康[1]. 肝癌是富含血管的恶性肿瘤, 容易通过新生血管发生侵袭和转移. 而血管生成是恶性肿瘤的主要表型特征, 新生血管不仅为肿瘤细胞增殖提供养分, 而且是肿瘤细胞进一步侵袭和转移的基础. 骨化形成蛋白(bone morphogenetic proteins, BMPs)是在1960年提取出来的[2]. 他是转化生长因子-β(transforming growth factor beta, TGF-β)相关生长因子大家族成员之一, 使用相似的信号转导途径, 包括跨膜丝氨酸苏氨酸激酶受体和Smad蛋白质[3]. 在胚胎发展时期, BMPs参与血管生成的调控[4]. 在BMPs中, BMP-2因是自然骨形成蛋白提取的主要形式而引起广泛注意[5], 在肺癌[6]的血管生成中高表达. VEGF是一种高度特异性的有丝分裂原, 能直接刺激新生血管的形成, 被认为是最重要和最强的促血管生成因子. 已有报道[7]指出, BMP-2在似成骨样细胞通过VEGF-A分泌促进细胞分化和血管生成. 关于BMP-2在肝细胞癌(hepatocellular carcinoma, HCC)组织表达及与肿瘤新生血管形成关系的相关研究报道在国内很少. 因此, 本研究采用免疫组织化学方法检测BMP-2、VEGF在肝细胞肝癌中的表达, 分析BMP-2、VEGF蛋白在HCC中表达与肝癌各项临床指标之间的关系以及分析BMP-2与肝癌肿瘤血管生成之间的关系.
1.1.1 标本来源: 收集天津市第三中心医院病理科2015-06/2016-06经手术切除40例肝细胞肝癌患者肝癌及癌旁组织. 其中, 男性33例, 女性7例, 年龄在44-84岁之间, 中位年龄60.5岁. 患者均为第一次手术切除, HE染色明确病理诊断与分级, 均经病理诊断为肝细胞肝癌, 术前均未接受放疗, 化疗等针对肿瘤的相关治疗. 其中, 临床分期为: Ⅰ期2例, Ⅱ期14例, Ⅲ期15例, Ⅳ期9例.
1.1.2 试剂: 鼠抗人VEGF单克隆抗体(广州深达生物制品技术有限公司, 工作液产品编号AM0232)小鼠抗人BMP-2单克隆抗体(abcam公司, 产品编号ab6285最佳稀释浓度1:200 产品编号ab6285)小鼠抗人CD34单克隆抗体(上海杰浩生物技术有限公司, 工作液产品编号CM-0271)通用型二步法检测试剂盒 PV-9000、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司.
1.2.1 石蜡标本制备: 来自天津市第三中心医院病理科标本库的40例石蜡包埋标本, 切片4 μm, 连续切片3张, 将切片摊与温水面上, 拨去多余的蜡, 将载玻片沉于切片下面, 然后将切片从水中捞出, 放在72 ℃烘片机上烘干.
1.2.2 免疫组织化学步骤: 免疫组织化学染色, 用厂家推荐的阳性对照部位作为阳性对照片. 切片经常规的二甲苯脱蜡, EDTA(pH = 9)抗原修复、3%的过氧化物氢去内源性过氧化物酶的特异性染色, 每个标本滴加50 μL左右的CD34、VEGF、BMP-2一抗, 温箱37 ℃孵育40 min, PBS冲洗2次, 每次4 min, 滴加通用型二抗50 μL酒精分化, 氨水返蓝, 梯度酒精脱水, 透明, 封片.
1.2.3 结果判定: 用半定量积分法对阳性表达结果进行判定, 在400倍光镜下随机选取至少观察5个不重叠的肿瘤细胞视野, 计数阳性细胞总数/细胞总数, 按阳性细胞所占百分比计分: (1)≤5%, 0分; (2)6%-25%, 1分; (3)26%-50%, 2分; (4)51%-75%, 3分; (5)>75%, 4分. 按染色强弱程度计分: (1)无着色: 0分; (2)淡黄色: 1分; (3)棕黄色: 2分; (4)棕褐色: 3分. 判断结果: 以上二者观察评分乘积, 将≥4分记为阳性. 用CD34阳性标记的微血管呈短小的裂隙及狭长的分支状, 分布弥漫而均匀, 管腔狭窄, 管壁纤细, 癌旁肝硬化组织的血窦为(-)[8]. 采用Weidner[9]方法计数MVD: 先用100倍光镜扫描整个切片, 寻找5个高血管密度区("热区"), 再用200倍光镜计数"热区"寻找CD34抗体染成棕黄色的血管数目, 计算5个视野中血管数值的总数, 取其平均值作为MVD结果.
统计学处理 分析采用SPSS21统计软件包分析, 计数资料采用χ2检验, 计量资料采用配对t检验. BMP-2蛋白和VEGF蛋白癌组织和癌旁组织的差异采用配对设计下χ2检验. 微血管密度采用mean±SD, 相关性分析采用Spearman相关检验. 以P<0.05为差异有统计学意义.
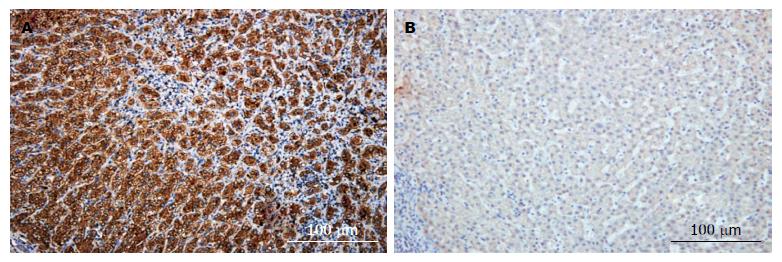
免疫组织化学结果显示: 肝癌组织中BMP-2蛋白表达位于HCC胞浆, 呈棕黄色或黄色颗粒状, 肿瘤间质不表达, 癌旁组织较弱表达(图1). 40例标本中, 肝癌组织中BMP-2阳性有30例(75%), 阴性10例(25%); 癌旁组织中阳性16例(40%), 阴性24例(60%), 肝癌组织和癌旁组织采用两组独立样本χ2; 检验(χ2 = 10.03, P = 0.0015), 差异有统计学意义.
BMP-2在肝细胞癌中高表达, 与肝癌细胞包膜不完整、多发结节、门静脉癌栓、TNMⅢ+Ⅳ分期、细胞低分化有关(P<0.05), 差异有统计学意义(表1).
| 临床病理特征 | n | BMP-2蛋白表达 | χ2值 | P值 | |
| 阳性(n) | 阴性(n) | ||||
| 年龄(岁) | 2.016 | 0.1556 | |||
| ≥50 | 31 | 27 | 4 | ||
| <50 | 9 | 6 | 3 | ||
| 性别 | 0.1794 | 0.6719 | |||
| 男 | 33 | 26 | 7 | ||
| 女 | 7 | 5 | 2 | ||
| 血清AFP(ng/mL) | 0.0205 | 0.8862 | |||
| ≥400 | 9 | 8 | 1 | ||
| <400 | 31 | 27 | 4 | ||
| HBsAg | 1.497 | 0.2211 | |||
| 阳性 | 34 | 27 | 7 | ||
| 阴性 | 6 | 6 | 0 | ||
| 肝硬化 | 0.008 | 0.9276 | |||
| 有 | 28 | 23 | 5 | ||
| 无 | 12 | 10 | 2 | ||
| 肿瘤大小(cm) | 1.823 | 0.1769 | |||
| ≥5 | 13 | 12 | 1 | ||
| <5 | 27 | 20 | 7 | ||
| 肿瘤包膜 | 4.167 | 0.04121 | |||
| 完整 | 25 | 23 | 2 | ||
| 不完整 | 15 | 10 | 5 | ||
| 肿瘤结节 | 4.800 | 0.02851 | |||
| 单发 | 20 | 18 | 2 | ||
| 多发 | 20 | 12 | 8 | ||
| 门静脉癌栓 | 4.224 | 0.03991 | |||
| 无 | 35 | 18 | 17 | ||
| 有 | 5 | 5 | 0 | ||
| TNM分期 | 5.225 | 0.02231 | |||
| Ⅰ+Ⅱ | 15 | 14 | 1 | ||
| Ⅲ+Ⅳ | 25 | 15 | 10 | ||
| 分化程度 | 6.935 | 0.00851 | |||
| 高、中 | 33 | 7 | 26 | ||
| 低 | 7 | 5 | 2 | ||
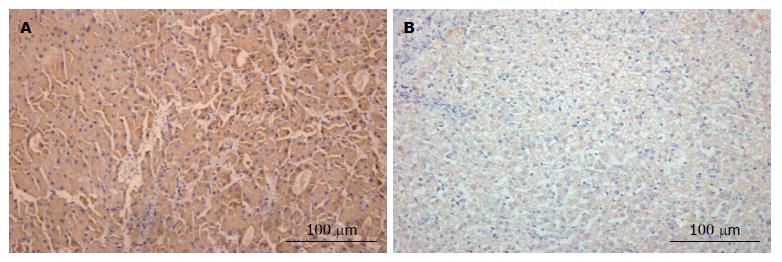
VEGF主要表达在肝癌细胞的胞浆, 呈棕黄色或黄色颗粒状染色, 部分肿瘤间质可见弱阳性表达, 癌旁组织弱表达(图2). 40例标本中, VEGF在肝癌组织阳性例数32例(80%), 阴性8例(20%);肝癌癌旁组织中阳性例数17例(42.5%), 阴性23例(57.5%), 肝癌组织和癌旁组织表达的差异采用两组独立样本χ2检验(χ2 = 11.85, P = 0.0006), VEGF在肝癌和癌旁组织表达有差异, 有统计学意义.
VEGF在HCC中高表达, 与肝癌细胞包膜不完整、多发结节、门静脉癌栓、TNMⅢ+Ⅳ分期、细胞低分化有关(P<0.05), 差异有统计学意义(表2).
| 临床病理参数 | n | VEGF蛋白表达 | χ2值 | P值 | |
| 阳性(n) | 阴性(n) | ||||
| 年龄(岁) | 2.016 | 0.1556 | |||
| ≥50 | 31 | 27 | 4 | ||
| <50 | 9 | 6 | 3 | ||
| 性别 | 1.226 | 0.2682 | |||
| 男 | 33 | 29 | 4 | ||
| 女 | 7 | 5 | 2 | ||
| 血清AFP(ng/mL) | 0.0358 | 0.8498 | |||
| ≥400 | 9 | 7 | 2 | ||
| <400 | 31 | 25 | 6 | ||
| HBsAg | 1.226 | 0.2682 | |||
| 阳性 | 34 | 29 | 5 | ||
| 阴性 | 6 | 4 | 2 | ||
| 肝硬化 | 0.668 | 0.4140 | |||
| 有 | 28 | 24 | 4 | ||
| 无 | 12 | 9 | 3 | ||
| 肿瘤大小(cm) | 0.4159 | 0.5190 | |||
| ≥5 | 13 | 12 | 1 | ||
| <5 | 27 | 21 | 6 | ||
| 肿瘤包膜 | 4.167 | 0.04121 | |||
| 不完整 | 15 | 10 | 5 | ||
| 完整 | 25 | 23 | 2 | ||
| 肿瘤结节 | 4.800 | 0.02851 | |||
| 单发 | 20 | 17 | 3 | ||
| 多发 | 20 | 16 | 4 | ||
| 门静脉癌栓 | 4.404 | 0.03591 | |||
| 无 | 35 | 11 | 24 | ||
| 有 | 5 | 4 | 1 | ||
| TNM分期 | 9.689 | 0.00191 | |||
| Ⅰ+Ⅱ | 16 | 1 | 15 | ||
| Ⅲ+Ⅳ | 24 | 13 | 11 | ||
| 分化程度 | 5.164 | 0.02311 | |||
| 高、中 | 33 | 27 | 6 | ||
| 低 | 7 | 5 | 2 | ||
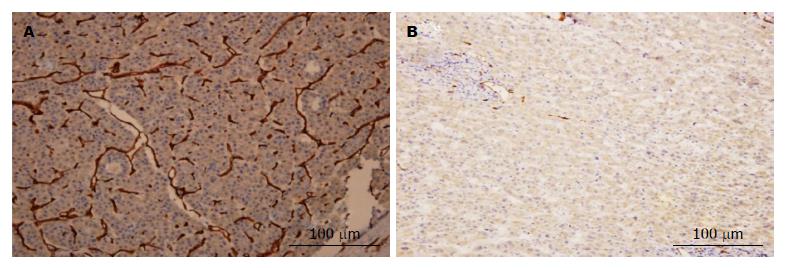
CD34在肝癌组织呈阳性表达, 形成条状或环状, 呈弥漫性分布. 癌旁肝血窦内皮细胞也见表达, 但染色多较浅, 癌旁组织呈阴性表达(P<0.05), 肝癌组织与癌旁组织比较差异有统计学意义(P<0.05). 40例肝癌组织及癌旁组织MVD值分别为(34.4±8.2)/200倍视野(图3)和(23.7±12.5)/200倍视野, 癌组织中MVD 值明显高于癌旁肝组织织(均P<0.05). 肿瘤组织免疫组织化学染色结果, 微血管密度为12-51(平均34.4±8.2), 以均数34.4为界, 将他们分为多血管组(微血管密度≥34.4)和少血管组(微血管密度<34.4). 结果显示: 肿瘤新生血管生成与BMP-2高表达相关(图3, 表3).
| 分组 | 多血管组(n) | 少血管组(n) | 阳性率(%) | χ2值 | P值 |
| 癌旁组织 | 6 | 34 | 15 | 14.07 | 0.0002 |
| 肿瘤组织 | 22 | 18 | 55 |
33例BMP-2阳性表达中CD34标记的MVD 值为36.90±5.25, 7例阴性表达者MVD值为32.14±6.64, 差异有统计学意义(t = 2.086, P = 0.044); 32例VEGF表达阳性者的MVD为37.90±5.23, 8例表达阴性者MVD值32.38±4.31, 差异有统计学意义(t = 2.757, P = 0.009).
Spearman等级相关分析显示BMP-2和VEGF在肝癌中的表达呈正相关: BMP-2和VEGF均阳性共29例, BMP-2阳性和VEGF阴性4例, BMP-2阴性同时VEGF阳性有3例, BMP-2阴性同时VEGF阴性4例(r = 7.316, P = 0.0068).
肝癌的发生、发展、浸润、转移与肿瘤新生血管密切相关, 而且肿瘤新生血管肿瘤赖以生存的物质基础, 是影响肿瘤生物学行为的重要因素之一[10]. 血管内皮细胞以发芽的形式形成新血管, 这个过程就是肿瘤血管生成[11]. 这是一个复杂生物学过程, 多种生长因子、胞外基质成分、蛋白水解酶和细胞黏附分子等等参与此过程[12]. 从肿瘤的生物学行为来看,恶性肿瘤生长和转移依赖新生血管的形成,而且血管生成是血行转移至关重要的步骤,也使肿瘤细胞从原发病灶扩散到远处器官提供了保障[13]. 恶性肿瘤发生侵袭和转移是肿瘤治疗失败的主要原因, 肿瘤血管生成在其转移的全过程发挥着重要作用. 因此, 抑制肿瘤血管生成是一个有潜力价值的治疗HCC的途径,在现实中治疗HCC的一部分药物就是源于抗血管生成理念研发的[14-16]. 所以, 如何抑制早期血管生成、破坏已形成肿瘤血管成为肿瘤治疗研究的热点和突破口[10]. 有研究[17,18]表明, 干预肿瘤组织中的血管, 阻断诱导血管生成通路, 可以有效地抑制肿瘤增殖和生长. 众所周知, 血管生成[19]是包括HCC在内的实体瘤生长和转移的关键因素.
BMPs是一种分泌性多功能蛋白不仅调节骨骼和软骨的形成, 而且调控肿瘤细胞生长、增殖和迁移、在血管生成中发挥了至关重要的作用[20]. 他是TGF-B相关生长因子大家族成员之一[21]. BMP-2作BMPs的一个分支, 在胚胎发育时期, 参与血管内皮细胞和血管平滑肌细胞形成[22,23], 是近几年研究肿瘤血管形成的热点.
有研究[24]指出BMP-2 mRNA在肝癌组织高于癌旁组织, 其表达与肿瘤的分期明显相关, 提示在肝癌的发生发展中有一定的促进肿瘤生成的作用. 蛋白印迹检测显示随着肝癌转移程度的增加, BMP-2蛋白表达明显上调, 提示BMP-2作为肿瘤转移促进基因在肝癌的浸润和转移中起重要的作用. 另有研究[25]指出, BMP-2在不同分化程度的肝癌细胞中表达; 可能通过激活MAP和ERK信号通路, 上调BMP-2和基质金属蛋白酶(matrix metalloproteinase 9, MMP-9)和下调E-cadherin促进肝癌细胞的增殖和侵袭. 也有研究[26]证明, 随着BMP-2浓度增加和作用时间延长, 肝癌细胞SMMC7721 MMP-2 mRNA水平和蛋白水平的表达明显上升, 细胞培养上清液MMP-2、9释放水平也逐渐显著上升, 相关数据提示在肝细胞SMMC7721中, BMP-2的干预与MMP-2、9表达呈正相关, 说明BMP-2可能通过上调MMP-2、9的表达促进肝细胞SMMC7721的迁移和侵袭. 我们研究中的BMP-2在HCC表达高于癌旁, 并与肝癌组织的肝癌细胞包膜不完整、多发结节、门静脉癌栓、TNMⅢ+Ⅳ分期、细胞低分化有关, 差异有统计学意义. 有包膜、多发结节、门静脉癌栓的组织中, BMP-2的表达强度越强, 并且在不同的临床分期, 处于Ⅲ+Ⅳ期肝癌组织中BMP-2表达率明显高于处于Ⅰ+Ⅱ期肝癌中的表达, 这些结果提示肝癌中BMP-2的表达与癌的侵袭力有关, 其可能与HCC的发生、发展及侵袭相关. 这与本文的研究结果大致相同. 已有研究证明BMP-2具有促进肿瘤新生血管形成, 从而诱发侵袭转移作用. 其中BMP-2和肝癌肿瘤新生血管形成的关系尚未见报道.
VEGF在正常组织中呈低水平表达, 在大多数恶性肿瘤中表达增加. VEGF是肿瘤组织中最主要的血管生成因子, 参与HCC的肿瘤血管发生、发展, 并与浸润、转移有关[27]. VEGF通过内皮细胞上的特异性受体, 直接刺激内皮细胞增殖, 产生纤维蛋白溶酶原激活剂和胶原酶等, 增加血管通透性[28]. 有研究[27]证明, VEGF表达于肝癌组织, 而癌旁组织则不表达或表达量少; VEGF表达阳性的肝癌组织MVD明显高于VEGF阴性表达的肝癌组织, 这说明肝癌细胞可合成VEGF蛋白并促进肿瘤血管形成. 另有研究[29]证明, 在HCC中, VEGF的表达增加与肿瘤血管生成的关系密切. 我们的研究表明, VEGF在肝癌组织的表达高于癌旁, 差异有统计学意义. 在临床病理指标方面, VEGF蛋白表达水平与患者的年龄、性别、AFP水平、HBSAg、肝硬化状态及肿瘤大小无关(P>0.05), 而与包膜不完整、多发结节、门静脉癌栓、TNM分期、肿瘤分化有关(P<0.05), VEGF表达阳性的肝癌组织MVD明显高于VEGF阴性表达的肝癌组织, 这些临床指标与肿瘤的侵袭转移有关, 说明VEGF高表达可能与肝癌的通过血管发生转移有关, 与本文的研究结果一致.
CD34作为肿瘤新生血管标志物, 是血管内皮细胞的特异性标志分子, 在肝癌组织内呈强阳性相对弥散, 而在正常肝窦内为阴性[30]与肿瘤新生血管有关, 所以他可以作为观察肝癌新生血管的一个标志物. 目前, MVD是评估血管生成的常用指标, 具有直观、敏感的特点, 且已被认为是预测肿瘤转移复发和预后的重要指标[31]. 在本研究中, 肝癌组织中的微血管密度高于癌旁, 差异有统计学意义, 表明CD34标记的MVD参与到肝癌的形成过程中.
HCC属于血供丰富的恶性肿瘤, HCC发生侵袭转移的基础就是依赖新血管的形成. BMP-2和VEGF阳性表达组MVD值均显著高于阴性表达组(P<0.05), 说明BMP-2和VEGF均与HCC的血管新生有关. BMP-2在肿瘤血管形成过程中起着重要作用, 但其具体机制不清. Zuo等[32]指出, BMP-2蛋白在肝脏恶性肿瘤中呈高表达, BMP-2通过Akt/m-TOR和P38, ERK通路诱导VEGF表达, 从而促进肝癌细胞的增殖、转移和血管生成, 达到促进肿瘤生长、浸润和转移的目的. 在本研究中HCC组织中BMP-2、VEGF蛋白与MVD作Pearson相关性分析, BMP-2、VEGF分别与肿瘤MVD之间差异有统计学意义, 提示BMP-2、VEGF均参与了HCC肿瘤血管的形成. 将HCC组织中BMP-2与VEGF作Pearson相关性检验, 显示BMP-2与VEGF二者之间呈正相关(r = 7.316, P = 0.0068), 表明HCC组织中BMP-2和VEGF在HCC发生、发展和血管生成过程中有一定的关系, 提示BMP-2、VEGF可能通过某种方式共同参与肿瘤血管生成, 因此认为BMP-2在HCC的侵袭和转移中发挥重要作用, BMP-2可以促进肿瘤血管形成以及HCC的侵袭和转移; 可以通过BMP-2的表达强度判断HCC的预后.
BMP-2促进肿瘤组织血管生成的可能机制为以下几个方面: (1)BMP-2增加内皮细胞的Id1表达和p38磷酸化刺激相应的血管生成. Id转录因子在血管生成扮演一个重要角色, 是BMP信号通路的一个目标. 在胚胎发展和血管生成中, Id1在血管生成异常表达; (2)体外研究显示BMP-2刺激Smad 1/5、Erk 1/2和I d1表达, 从而激活内皮细胞, 增加血管形成; (3)BMP-2除了直接刺激内皮细胞促进血管生成的机制以外, BMP-2、BMP-4 、BMP-6、BMP-7在成骨细胞诱导VEGF表达; (4)BMP-2可能刺激肿瘤细胞或者周围实质细胞VEGF的表达, 均有助于血管生成反应; (5)BMP-2可能作为单核细胞的趋化因子提高血管生成单核细胞存在肺部肿瘤, 分泌产生促血管生成反应的细胞因子, 从而促进血管生成.
总之, BMP-2在肝脏恶性肿瘤中表达高于癌旁组织, 并与VEGF共同参与到肿瘤血管生成过程, 肝癌和癌旁中BMP-2的表达与肿瘤血管生成有统计学意义, 表明其可能在促进HCC的发生、发展及转移过程中起着重要作用. 因此, BMP-2有可能成为HCC及其他富含血供等恶性肿瘤抗血管治疗的一个新的方法.
原发性肝癌是恶性程度高, 进展快, 预后差, 死亡率高, 病死率排在癌症第3位的最常见的恶性肿瘤之一. 多数患者就诊时, 已到中晚期, 疗效差, 可能与肿瘤生长、侵袭和转移有关. 骨化形成蛋白2(bone morphogenetic protein 2, BMP-2)是一种调控肿瘤细胞生长、增殖和迁移、在血管生成中发挥了重要作用的功能蛋白, 能通过多种信号通路参与肿瘤血管生成, 增加肿瘤细胞的生长、浸润和侵袭能力, 促进肿瘤生长、浸润和转移.
肿瘤新生血管的生成是肿瘤细胞生长、增殖的基础, 同时也是肿瘤发生远处转移、进一步浸润和转移的因素. BMP-2通过多种血管通路参与肿瘤血管生成, 从而促进肿瘤生长、增殖、凋亡和分化.检测BMP-2在组织中的表达, 为临床上治疗肝细胞癌治疗以及预后判断提供参考的依据, 为解决肿瘤细胞在血管生成条件下产生耐受性提供理论依据.
吴建兵等对BMP-2在肝细胞癌的血清和组织的表达做了分析, Zheng等从信号通路角度解释BMP-2对肿瘤细胞迁移和侵袭做了详尽的描述.
本文是从肝细胞癌的组织方面, 检测BMP-2在肝细胞癌中和肝癌癌旁组织中的表达, 以及与临床病理指标之间的关系作了分析, 探讨与血管生成的关系的初步研究.
对BMP-2表达的检测, 可进一步研究肝癌发生发展的分子机制, 并将为临床上开展肝癌治疗方案的选择以及预后的判断提供依据, 为解决肿瘤细胞在血管生成条件下产生的放化疗耐受性问题提供了依据. 进一步可设想如何通过BMP-2参与的信号通路, 使其成为肿瘤基因治疗新的切入点.
肿瘤血管生成: 在原有血管的基础上, 内皮细胞以发芽的形式形成新血管的过程, 肝细胞癌是富含血管的恶性肿瘤, 血供丰富, 是肿瘤细胞发生浸润和转移的基础.
鞠少卿, 教授, 南通大学附属医院检验医学中心, 南通大学附属医院外科综合实验室; 朱小三, 主治医师, 厦门大学附属成功医院消化内科
本文研究BMP-2在肝细胞癌组织的表达情况及与肿瘤血管生成的关系, 研究发现肝细胞癌中BMP-2高表达在肿瘤血管生成中有重要的作用, 具有一定的临床价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Pascual S, Herrera I, Irurzun J. New advances in hepatocellular carcinoma. World J Hepatol. 2016;8:421-438. [PubMed] [DOI] |
| 3. | Raida M, Clement JH, Leek RD, Ameri K, Bicknell R, Niederwieser D, Harris AL. Bone morphogenetic protein 2 (BMP-2) and induction of tumor angiogenesis. J Cancer Res Clin Oncol. 2005;131:741-750. [PubMed] [DOI] |
| 4. | Hogan BL. Bone morphogenetic proteins: multifunctional regulators of vertebrate development. Genes Dev. 1996;10:1580-1594. [PubMed] [DOI] |
| 5. | Wozney JM, Rosen V. Bone morphogenetic protein and bone morphogenetic protein gene family in bone formation and repair. Clin Orthop Relat Res. 1998;26-37. [PubMed] [DOI] |
| 6. | Langenfeld EM, Langenfeld J. Bone morphogenetic protein-2 stimulates angiogenesis in developing tumors. Mol Cancer Res. 2004;2:141-149. [PubMed] |
| 7. | Deckers MM, van Bezooijen RL, van der Horst G, Hoogendam J, van der Bent C, Papapoulos SE, Lo Wik CW. Bone Morphogenetic Proteins Stimulate Angiogenesis through Osteoblast-Derived Vascular Endothelial Growth Factor A. Endocrinology. 2002;143:1545-1553. [PubMed] [DOI] |
| 9. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 12. | Yance DR, Sagar SM. Targeting angiogenesis with integrative cancer therapies. Integr Cancer Ther. 2006;5:9-29. [PubMed] [DOI] |
| 13. | Onishi M, Ichikawa T, Kurozumi K, Date I. Angiogenesis and invasion in glioma. Brain Tumor Pathol. 2011;28:13-24. [PubMed] [DOI] |
| 14. | Folkman J. Angiogenesis: an organizing principle for drug discovery? Nat Rev Drug Discov. 2007;6:273-286. [PubMed] [DOI] |
| 15. | Zhu AX, Duda DG, Sahani DV, Jain RK. HCC and angiogenesis: possible targets and future directions. Nat Rev Clin Oncol. 2011;8:292-301. [PubMed] [DOI] |
| 16. | Wu SD, Ma YS, Fang Y, Liu LL, Fu D, Shen XZ. Role of the microenvironment in hepatocellular carcinoma development and progression. Cancer Treat Rev. 2012;38:218-225. [PubMed] [DOI] |
| 17. | Chen JC, Uang BJ, Lyu PC, Chang JY, Liu KJ, Kuo CC, Hsieh HP, Wang HC, Cheng CS, Chang YH. Design and synthesis of alpha-ketoamides as cathepsin S inhibitors with potential applications against tumor invasion and angiogenesis. J Med Chem. 2010;53:4545-4549. [PubMed] [DOI] |
| 18. | Manikandan P, Murugan RS, Priyadarsini RV, Vinothini G, Nagini S. Eugenol induces apoptosis and inhibits invasion and angiogenesis in a rat model of gastric carcinogenesis induced by MNNG. Life Sci. 2010;86:936-941. [PubMed] [DOI] |
| 19. | Blagosklonny MV. Antiangiogenic therapy and tumor progression. Cancer Cell. 2004;5:13-17. [PubMed] [DOI] |
| 21. | Xu GJ, Cai S, Wu JB. Effect of insulin-like growth factor-1 on bone morphogenetic protein-2 expression in hepatic carcinoma SMMC7721 cells through the p38 MAPK signaling pathway. Asian Pac J Cancer Prev. 2012;13:1183-1186. [PubMed] [DOI] |
| 22. | Willette RN, Gu JL, Lysko PG, Anderson KM, Minehart H, Yue T. BMP-2 gene expression and effects on human vascular smooth muscle cells. J Vasc Res. 1999;36:120-125. [PubMed] [DOI] |
| 23. | Glienke J, Schmitt AO, Pilarsky C, Hinzmann B, Weiss B, Rosenthal A, Thierauch KH. Differential gene expression by endothelial cells in distinct angiogenic states. Eur J Biochem. 2000;267:2820-2830. [PubMed] [DOI] |
| 25. | Wu JB, Fu HQ, Huang LZ, Liu AW, Zhang JX. Effects of siRNA-targeting BMP-2 on the abilities of migration and invasion of human liver cancer SMMC7721 cells and its mechanism. Cancer Gene Ther. 2011;18:20-25. [PubMed] [DOI] |
| 28. | Borovikova LV, Ivanova S, Zhang M, Yang H, Botchkina GI, Watkins LR, Wang H, Abumrad N, Eaton JW, Tracey KJ. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature. 2000;405:458-462. [PubMed] [DOI] |
| 29. | Carbajo-Pescador S, Ordoñez R, Benet M, Jover R, García-Palomo A, Mauriz JL, González-Gallego J. Inhibition of VEGF expression through blockade of Hif1α and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells. Br J Cancer. 2013;109:83-91. [PubMed] [DOI] |