修回日期: 2017-03-05
接受日期: 2017-03-20
在线出版日期: 2017-04-28
急性间歇性卟啉病是因血红素合成路径中第3个酶胆色素原脱氨酶(porphobilinogen deaminase, PBGD), 也称为羟甲基胆素合成酶(hydroxymethylbilane synthase, HMBS)的缺乏导致卟啉类化合物代谢紊乱而发生的一种常染色体显性遗传疾病. 中南大学湘雅二医院于2015-10诊治了1例以反复腹痛2年为主诉的女性. 通过基因测序发现患者HMBS基因3号外显子的3782位点胞嘧啶C突变为胸腺嘧啶T的杂合无义突变, 从而导致氨基酸结构由谷氨酰胺变为终止密码(Q34*). 此突变通过降低PBGD的活性导致疾病的发生.
核心提要: 急性间歇性卟啉病是临床上罕见疾病, 由于其累计多个系统, 临床表现多样性, 常常出现误诊, 本文报告了1例以反复腹痛为首发症状的急性间歇性卟啉病, 该病实属罕见, 并且后期可累及神经系统导致呼吸机麻痹而死亡, 值得消化科医生关注.
引文著录: 雷利静, 郭永红, 杨媛. 以反复腹痛为主要临床表现的急性间歇性卟啉病1例及文献复习. 世界华人消化杂志 2017; 25(12): 1128-1134
Revised: March 5, 2017
Accepted: March 20, 2017
Published online: April 28, 2017
Acute intermittent porphyria (AIP), an autosomal dominant disorder, is caused by a partial deficiency of porphobilinogen deaminase (PBGD), which is also named hydroxymethylbilane synthase (HMBS), the third enzyme in the heme biosynthetic pathway. In October 2015, a women presented with recurrent abdominal pain for 2 years. Using direct sequencing, we identified a hererozygous nonsense mutation, C to T, in exon 3 of HMBS at position 3782, resulting in a change of glutamine codon to termination codon (Q34*) in this patient. This mutation can lead to a decrease in the activity of heme biosynthetic enzyme PBGD, which is related to AIP.
- Citation: Lei LJ, Guo YH, Yang Y. Recurrent abdominal pain as principal clinical manifestation of acute intermittent porphyria: A case report and literature review. Shijie Huaren Xiaohua Zazhi 2017; 25(12): 1128-1134
- URL: https://www.wjgnet.com/1009-3079/full/v25/i12/1128.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i12.1128
急性间歇性卟啉病(acute intermittent porphyria, AIP)是卟啉病中最常见的类型, 由胆色素原脱氨酶活性降低所致[1]. 胆色素原脱氨酶(porphobilinogen deaminase, PBGD)又称羟甲基胆素合成酶(hydroxymethylbilane synthase, HMBS). 该病病变主要累及三大系统: 胃肠系统, 神经系统, 精神系统[2]. 其临床症状主要由于血色素的缺乏及血色素合成代谢途径中间产物δ-氨基-γ-酮戊酸(δ-aminol evulinic acid, ALA)及卟胆原(porphobilinogen, PBG)的蓄积而导致[3]. 绝大部分有典型症状的患者为成年女性[4]. 此病通常起病急骤, 可以由药物、酒精、激素、压力、感染或低热量食物的摄入而诱发[5], 经静脉应用血红素对急性发作症状有特异性作用[6]. 由于急性间歇性卟啉病症状的多样性, 常易于和其他疾病相混淆而导致了高误诊率(在中国约为68%), 延误了有效的治疗[7]. 急性间歇性卟啉病的诊断主要基于临床症状和常规生化检查[3], 而常规生化检查对症状不明显的潜在患者诊断存在局限性, 对于这些潜在患者基因检测则显得尤为重要[8]. 现将中南大学湘雅二医院1例以反复腹痛为主要表现的急性间歇性卟啉病患者的病例报告以及相关文献进行报道, 报道如下.
患者, 陈某, 女, 27岁, 湖南湘潭人, 因"反复腹痛2年, 再发加重20 d"于2015-10-03再次入住中南大学湘雅二医院急诊科. 患者2年前于月经期出现上腹痛, 呈烧灼样疼痛, 无放射痛, 伴进食后呕吐, 呕吐物为胃内容物, 无畏寒发热、腹泻黑便、四肢乏力等症状, 于当地医院治疗后症状缓解出院(具体不详). 后腹痛反复, 未予规律治疗. 此次入院前20 d患者于劳累后突发腹痛, 性质大致同前, 但程度明显加重. 于当地医院治疗4 d后腹痛无明显缓解, 遂至中南大学湘雅二医院急诊就诊. 急诊查胃镜提示"慢性非萎缩性胃炎伴糜烂", 腹部平片示"不完全性肠梗阻", 予解痉、止痛、护胃、营养支持治疗后症状稍缓解. 治疗期间患者频发头痛, 曾出现一过性意识丧失伴抽搐, 持续1-2 min后可自行缓解. 患者病情好转后转回当地医院, 2 d后患者再次出现头痛, 自觉明显乏力, 乏力由四肢末梢向躯体逐渐进展, 并伴有指端末梢麻木、吞咽困难、眼睑下垂, 无抽搐, 偶有发作性意识丧失, 持续数分钟后缓解, 予以营养神经护脑治疗后症状无明显缓解, 腹痛及乏力均较前明显加重, 期间有出现大小便失禁, 遂再次于中南大学湘雅二医院就诊. 自起病以来, 患者精神睡眠欠佳, 胃纳差, 小便色偏红, 体质量无明显减轻.
呼吸、脉搏、血压、体温均正常, 发育正常, 营养可, 急性面容, 神清, 精神欠佳, 自动体位, 查体合作. 心肺无异常, 腹部平软, 上腹部按压痛, 全腹无肌紧张及反跳痛, 肠鸣音正常, 双下肢不肿双上肢肌力0级, 双下肢肌力1级, 双下肢浅深感觉亢进, 双上肢深浅感觉存在. 病理征阴性.
1.2.1 入院心电图: 心电图示: 窦性心动过速; 血常规: 红细胞压积:33.5%↓, 平均红细胞体积: 76.7 fL↓, 平均红细胞血红蛋白浓度: 376 g/L↑; 小便常规: 尿酮体1.0 mmol/L(+), 尿胆原: 70 μmol/L (++); 凝血功能: 国际标准化比值: 0.80↓, 凝血酶原时间百分活性度: 148.00%↑, D二聚体定量: 0.68 μg/mL FEU↑; 血沉: 29 mm/h↑; 血脂: 总胆固醇: 5.44 mmol/L↑; 同型半胱氨酸: 15.8 μmol/L↑. 肝功能: 谷丙转氨酶: 125.0 U/L↑, 谷草转氨酶: 75.3 U/L↑, 总蛋白: 62.1 g/L↓, 白蛋白: 35.6 g/L↓;肾功能: 肌酐: 35.0 μmol/L↓; 电解质: 钠: 133.5 mmol/L↓, 镁: 0.76 mmol/L↓; 心肌酶: 肌酸激酶: 206.1 U/L↑, 肌酸激酶同工酶: 38.8 U/L↑; 脑脊液常规示: 无色, 透明度清亮, 细胞总数6×106/L, 白细胞: 0×106/L, 潘迪氏实验阳性(+); 脑脊液生化示: 氯化物: 110.7 mmol/L↓, 革兰氏染色、墨汁染色均未见明显异常.
大便常规、抗ENA抗体、血管炎三项、抗核抗体、C反应蛋白、人类免疫缺陷病毒、总蛋白、肝炎全套、脑脊液抗酸染色、糖化血红蛋白、全腹CT、头颅MRI平扫+增强均未见异常.
入院后患者初步诊断主要考虑为"腹性癫痫"和"格林-巴利综合征", 完善相关检查后予以鼠神经生长因子等营养神经, 奥美拉唑护胃及免疫球蛋白对症处理后, 腹痛症状稍缓解, 但神经症状无改善, 且出现呼吸困难和顽固性低钠血症, 请神经内科和内分泌科会诊后考虑"急性间歇性卟啉病"可能性大, 予以10%葡萄糖溶液500 mL bid静脉输注后症状逐渐缓解.
急性间歇性卟啉病的总体发病率大约为50-500/1000000[4]. 是一种常染色体显性遗传疾病, 往往存在家族史, 且急性发作时往往与月经周期[9]劳累等因素相关. 急性间歇性卟啉病的确切病理机制尚不完全清楚, 多年来学者也提出了各种假说, 且这些假说之间并不矛盾[10]. 有些假说强调与内源性类固醇激素的相关性, 尤其是孕激素[9].
不过多数人接受的还是由肝脏产生的过量的ALA和PBG所带来的毒性作用的假说[10]. 一些研究[11-14]均证实了ALA对神经的毒性作用, 此外他们还证实了ALA可促进自由基的生成而导致氧化应激及DNA的损伤. Meyer等[15]于1998年建立了HMBS基因缺陷的小鼠模型来研究急性间歇性卟啉病的神经系统症状的发病机制, 其体外实验表明ALA可能通过激动突触前γ-氨基丁酸(γ aminobutyric acid, GABA)受体来抑制GABA从神经末梢释放, 从而引起AIP患者出现一系列中枢神经系统功能障碍症状. 同时ALA和PBG还可直接刺激胃肠道平滑肌引起痉挛疼痛.
诱发或加重此病症状的因素有许多, 如药物、酒精、饥饿、感染、内分泌因素或过度的压力等, 他们通过直接或间接的途径激活肝脏的ALA合成酶, 使组织中和血液循环中累及大量的卟啉前体ALA和PBG[16,17]. 急性间歇性卟啉病的三大临床症状主要表现为: 急性腹痛、神经精神症状和红色尿三联征[18]. 腹部症状以腹痛为主, 急性剧烈腹痛是最常见的临床症状, 可伴有恶心、呕吐、便秘等消化系统症状[1]. Bonkovsky等[19]在美国对108例AIP患者的临床研究中数据显示74%的患者有腹痛恶心或呕吐, 63%的患者有表现无力气、虚弱, 60%的患者出现便秘, 约29%的患者出现腹泻症状. 临床上还有一部分患者可表现为"不完全性肠梗阻"症状.
精神异常可以是急性间歇性卟啉病患者唯一的首发症状[20]. 部分患者在神经症状初期会随着腹痛症状的消失而被医生误认为症状得到了缓解. 在急性发病期间, 一些患者往往会出现行为改变和精神错乱, 并伴随躁动和幻觉等, 严重者可发生抽搐伴意识丧失、大小便失禁甚至昏迷. 而在一些反复急性发作的患者当中, 会伴随有足下垂和腕下垂. 除了常见的焦虑症状外, 暂时还没有证据表明卟啉病会出现慢性精神疾病. 有些患者可出现肌无力甚至迟缓性瘫痪, 肌无力由双下肢开始, 逐渐进展至双上肢, 进一步加重可出现吞咽困难, 甚至呼吸肌无力导致呼吸困难危及生命, 易误诊为轴索型格林-巴利综合征. 自主神经功能紊乱可表现为低热、出汗、脱水、电解质失衡、血压升高或体位性低血压、心动过速、低血钠等[16,21,22]. 心动过速可能由交感神经过度激活、血儿茶酚胺增多引起, 而低钠血症则可能与下丘脑功能受累、抗利尿激素分泌异常、呕吐、钠摄入不足及肾脏排钠增多有关[23].
同时, 有许多患者的新鲜尿液表现为暴露在空气阳光或加热后从红色逐渐加深变暗红色或葡萄酒色[19], 有文献报道国内做了很多相应实验, 如协和医院张宁等[24]留取急性间歇性卟啉病患者的随机尿液在阳光下暴晒4 h后尿色逐渐加深变成了红色, 一旦有这样的表现亦可有助于诊断此病.
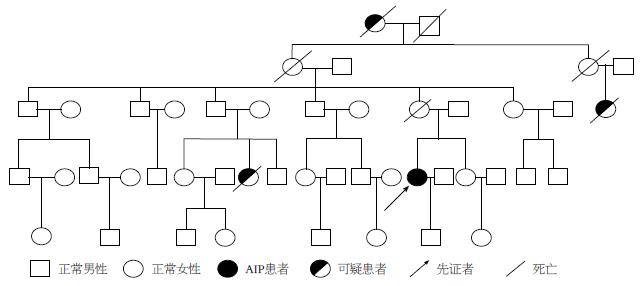
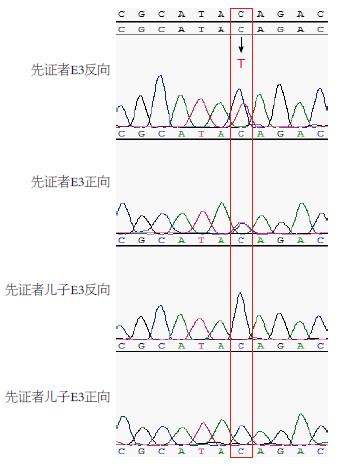
反复追问患者病史. 2年前患者第1次腹痛时与月经周期有明显关系, 而这次发作则与劳累有明显关系. 虽然患者的妹妹、母亲及儿子均未出现过上述类似症状, 但家族同辈里面有一表妹(舅舅的女儿)因类似症状急性发作而去世, 患者外婆的母亲及妹妹也均出现过类似症状 (如图1), 说明该疾病有着明确家族史. 根据临床资料, 虽然患者腹痛在中南大学湘雅二医院急诊检查提示有"慢性非萎缩性胃炎伴糜烂"及"不完全性肠梗阻", 急诊予解痉、止痛、护胃、营养支持治疗后腹痛症状的确稍有缓解, 但后期仍旧反复, 并出现了明显的神经系统症状, 头部MRI和腹部CT均未见明显异常, 排除了头部和腹部器质性病变引起的症状, 且患者尿液暴露在空气阳光等条件下颜色由红色逐渐变暗红色. 因此综合患者现病史、既往史、家族史、体查及辅助检查, 考虑患者为急性间歇性卟啉病可能性大, 由于该疾病是一种常染色体显性遗传疾病, 为了进一步明确诊断, 请医学遗传科会诊后, 我们分别采集了患者及患者儿子的外周血(因各种原因未能采集到其他家系成员的外周血), 并提取DNA, 设计相应HMBS基因外显子的引物, 通过聚合酶链式反应获得产物送测序, 根据测序回报的数据及使用相应DNA测序结果分析软件Seqman, 我们发现患者HMBS基因3号外显子的3782位点发生胞嘧啶(C)突变为胸腺嘧啶(T)的杂合无义突变(如图2, HMBS基因第3号外显子(E3)突变检测测序峰图), 通过基因突变预测网站Mutation Taster(http://www.mutationtaster.org)预测此突变导致氨基酸结构由谷氨酰胺变为终止密码(Q34*), 该网站给出的预测结果为"Prediction disease causing", 即预测该突变为致病原因(如图3 C→T的突变在Mutation Taster的预测结果), 我们检测了患者儿子的HMBS基因3号外显子, 未发现此突变. 查询人类基因突变数据库网站(http://www.hgmd.cf.ac.uk), 此突变已于1995年在荷兰被报道, 但在国内尚未见报道. 而人类第一次报道与急性间歇性卟啉病相关的HMBS基因突变是在1989年, 目前为止发现的与该疾病相关总突变类型已经达到379个, 其中在中国也有部分报道[25].
由于急性间歇性卟啉病的发病机制尚不完全明确, 目前亦无特效药物治疗, 主要是对症治疗及预防复发. 一旦确诊, 应在实施控制感染、控制心率、纠正水电解质平衡紊乱如低钠血症等对症治疗的基础上[26], 避免应用加重病情的药物, 以免诱发癫痫[27]. 同时也要避免压力、饥饿、重疾、感染、手术、吸烟、酗酒和月经周期或怀孕期间性激素改变等诱发因素.
急性发作时高糖饮食或输注高渗性葡萄糖(300-500 g/d), 可抑制ALA合成酶活性, 能够迅速缓解症状[1]. 也有文献[16]报道静脉输注葡萄糖只适用于轻度急性发作(比如只有轻度腹痛, 没有轻瘫、癫痫或低钠血症的患者). 对于重症患者比如出现严重运动神经病变患者, 甚至是呼吸机麻痹时, 只有及时使用血红素才是抢救患者的有效方法, 每天通过大静脉通路按3-4 mg/kg剂量用生理盐水稀释后持续使用3-4 d, 可作为控制患者病情的首选治疗[28-31]. 其机制是血红素通过其负反馈作用快速降低血浆中卟啉前体ALA及PBG的浓度, 终止急性发作, 但此药为进口药物, 价格昂贵, 在国内暂时还没有正式上市使用. 故本例患者在考虑为急性间歇性卟啉病后予以静脉输注10%葡萄糖溶液后症状可逐渐缓解. 患者病情好转出院时我们对其进行宣教, 避免劳累、感染、酒精等诱发或加重疾病的因素. 出院后予以电话回访, 目前患者病情尚稳定.
由于急性间歇性卟啉病属于罕见疾病, 发病率低, 缺乏特异性临床表现, 许多医生由于临床经验缺乏, 对此疾病的认识不足而常常误诊为急腹症、格林-巴利综合征、颅内病变、电解质紊乱或其他类型的血卟啉病等. 一般情况下此病的预后转归良好, 但是对于那些出现严重神经系统症状的患者则预后不良, 患者可死于呼吸机麻痹[32]. 因此掌握本病的临床特点, 早期发现, 正确诊断, 尽早治疗, 避免各种诱发因素是诊断该病及改善疾病预后的一个重要原则.
急性间歇性卟啉病是卟啉病中最常见的类型, 由胆色素原脱氨酶活性降低所致, 该病病变主要累及三大系统: 胃肠系统、神经系统、精神系统. 急性间歇性卟啉病的确切病理机制尚不完全清楚, 可能是与肝脏产生的过量的δ-氨基-γ-酮戊酸和卟胆原所带来的毒性作用有关.
急性间歇性卟啉病目前的金标准诊断是建立在基因诊断上, 随着基因技术的进一步发展, 新一代基因测序技术的发展与应用会大大提高此病的诊断效率和准确性.
急性间歇性卟啉病是罕见疾病, 由于诊断技术的要求, 目前国内大部分医院都无法从基因诊断水平去明确诊断, 很多都是基于临床表现和血液及尿液的生化检查而疑诊为此病, 同时也出现很多误诊的病例报告.
急性间歇性卟啉病是一种常染色体显性遗传疾病, 往往存在家族史, 随着基因技术在临床上的推广及应用, 大大提高了诊断的正确性, 从而可以给予患者及时精准的治疗, 并给出患者相应的预防诊治意见. 此文中同时对患者的儿子也进行了基因筛查, 从而做到对高危家系成员的筛查. 同时也可以给出患者相应的遗传咨询.
本文着重给广大临床医生普及急性间歇性卟啉病的相关知识, 避免在临床上出现误诊而耽误及时正确的治疗. 同时让临床医生认识到基因技术在此病诊断中的应用价值和可行性.
无义突变: 编码某一氨基酸的三联体密码子经碱基替换后, 变成不编码任何一种氨基酸的终止密码UAA、UAG或UGA, 使翻译过程提前终止. 终止密码子不能和与之相应的tRNA的反密码子配对, 但能被终止因子或释放因子识别, 终止肽键的合成, 使蛋白质合成终止, 因而生成不完整和没有功能的蛋白质.
沙杰, 副主任医师, 江苏省靖江市人民医院消化科; 许庆文, 主任医师, 广东医学院附属医院普通外科; 许钟, 副主任医师, 贵州省人民医院消化内科
本文介绍了急性间歇性卟啉病的发病机制、临床特点及治疗原则, 对临床医生的日常诊疗有一定的参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Anderson KE, Bloomer JR, Bonkovsky HL, Kushner JP, Pierach CA, Pimstone NR, Desnick RJ. Recommendations for the diagnosis and treatment of the acute porphyrias. Ann Intern Med. 2005;142:439-450. [PubMed] [DOI] |
| 2. | Li Y, Qu H, Wang H, Deng H, Liu Z. Novel A219P mutation of hydroxymethylbilane synthase identified in a Chinese woman with acute intermittent porphyria and syndrome of inappropriate antidiuretic hormone. Ann Hum Genet. 2015;79:310-312. [PubMed] [DOI] |
| 3. | Anyaegbu E, Goodman M, Ahn SY, Thangarajh M, Wong M, Shinawi M. Acute intermittent porphyria: a diagnostic challenge. J Child Neurol. 2012;27:917-921. [PubMed] [DOI] |
| 4. | Yuan T, Li YH, Wang X, Gong FY, Wu XY, Fu Y, Zhao WG. Acute Intermittent Porphyria: A Diagnostic Challenge for Endocrinologist. Chin Med J (Engl). 2015;128:1980-1981. [PubMed] [DOI] |
| 5. | Handschin C, Lin J, Rhee J, Peyer AK, Chin S, Wu PH, Meyer UA, Spiegelman BM. Nutritional regulation of hepatic heme biosynthesis and porphyria through PGC-1alpha. Cell. 2005;122:505-515. [PubMed] [DOI] |
| 6. | Bonkowsky HL, Tschudy DP, Collins A, Doherty J, Bossenmaier I, Cardinal R, Watson CJ. Repression of the overproduction of porphyrin precursors in acute intermittent porphyria by intravenous infusions of hematin. Proc Natl Acad Sci USA. 1971;68:2725-2729. [PubMed] [DOI] |
| 7. | Feng JC, Deng F, Ge YP. Hepatic porphyria accompanied by neural and psychic symptoms (732 cases analysis) [in Chinese]. J Apoplexy Nerv Dis. 2003;20:242-245. |
| 8. | Whatley SD, Badminton MN. Role of genetic testing in the management of patients with inherited porphyria and their families. Ann Clin Biochem. 2013;50:204-216. [PubMed] [DOI] |
| 9. | Besur S, Hou W, Schmeltzer P, Bonkovsky HL. Clinically important features of porphyrin and heme metabolism and the porphyrias. Metabolites. 2014;4:977-1006. [PubMed] [DOI] |
| 10. | Karim Z, Lyoumi S, Nicolas G, Deybach JC, Gouya L, Puy H. Porphyrias: A 2015 update. Clin Res Hepatol Gastroenterol. 2015;39:412-425. [PubMed] [DOI] |
| 11. | Yeung Laiwah AC, Moore MR, Goldberg A. Pathogenesis of acute porphyria. Q J Med. 1987;63:377-392. [PubMed] |
| 12. | Helson L, Braverman S, Mangiardi J. delta-Aminolevulinic acid effects on neuronal and glial tumor cell lines. Neurochem Res. 1993;18:1255-1258. [PubMed] [DOI] |
| 13. | Monteiro HP, Bechara EJ, Abdalla DS. Free radicals involvement in neurological porphyrias and lead poisoning. Mol Cell Biochem. 1991;103:73-83. [PubMed] |
| 14. | Onuki J, Chen Y, Teixeira PC, Schumacher RI, Medeiros MH, Van Houten B, Di Mascio P. Mitochondrial and nuclear DNA damage induced by 5-aminolevulinic acid. Arch Biochem Biophys. 2004;432:178-187. [PubMed] [DOI] |
| 15. | Meyer UA, Schuurmans MM, Lindberg RL. Acute porphyrias: pathogenesis of neurological manifestations. Semin Liver Dis. 1998;18:43-52. [PubMed] [DOI] |
| 16. | Pischik E, Kauppinen R. An update of clinical management of acute intermittent porphyria. Appl Clin Genet. 2015;8:201-214. [PubMed] [DOI] |
| 17. | Ahangari A, Bäckström T, Innala E, Andersson C, Turkmen S. Acute intermittent porphyria symptoms during the menstrual cycle. Intern Med J. 2015;45:725-731. [PubMed] [DOI] |
| 18. | 陈 晖, 罗 娜, 孙 晓芳. 急性间歇性卟啉病伴糖尿病酮症一例报道并文献复习. 中华临床医师杂志(电子版). 2015;9:3471-3473. |
| 19. | Bonkovsky HL, Maddukuri VC, Yazici C, Anderson KE, Bissell DM, Bloomer JR, Phillips JD, Naik H, Peter I, Baillargeon G. Acute porphyrias in the USA: features of 108 subjects from porphyrias consortium. Am J Med. 2014;127:1233-1241. [PubMed] [DOI] |
| 20. | Kumar B. Acute intermittent porphyria presenting solely with psychosis: a case report and discussion. Psychosomatics. 2012;53:494-498. [PubMed] [DOI] |
| 21. | Elder GH, Hift RJ, Meissner PN. The acute porphyrias. Lancet. 1997;349:1613-1617. [PubMed] [DOI] |
| 22. | Patience DA, Blackwood DH, McColl KE, Moore MR. Acute intermittent porphyria and mental illness--a family study. Acta Psychiatr Scand. 1994;89:262-267. [PubMed] [DOI] |
| 23. | Goldman L, Schafer AI. Goldman's cecil medicine. 24th ed. Philadelphia: Elsevier/Saunders 2012; . |
| 25. | Grandchamp B, Picat C, Mignotte V, Wilson JH, Te Velde K, Sandkuyl L, Roméo PH, Goossens M, Nordmann Y. Tissue-specific splicing mutation in acute intermittent porphyria. Proc Natl Acad Sci USA. 1989;86:661-664. [PubMed] [DOI] |
| 26. | Thunell S, Harper P, Brock A, Petersen NE. Porphyrins, porphyrin metabolism and porphyrias. II. Diagnosis and monitoring in the acute porphyrias. Scand J Clin Lab Invest. 2000;60:541-559. [PubMed] [DOI] |
| 27. | Lin CS, Lee MJ, Park SB, Kiernan MC. Purple pigments: the pathophysiology of acute porphyric neuropathy. Clin Neurophysiol. 2011;122:2336-2344. [PubMed] [DOI] |
| 28. | Mustajoki P, Nordmann Y. Early administration of heme arginate for acute porphyric attacks. Arch Intern Med. 1993;153:2004-2008. [PubMed] [DOI] |
| 29. | Anderson KE, Collins S. Open-label study of hemin for acute porphyria: clinical practice implications. Am J Med. 2006;119:801.e19-801.e24. [PubMed] [DOI] |
| 30. | Pischik E, Bulyanitsa A, Kazakov V, Kauppinen R. Clinical features predictive of a poor prognosis in acute porphyria. J Neurol. 2004;251:1538-1541. [PubMed] [DOI] |
| 31. | Kong XF, Han Y, Li XH, Gao DY, Zhang XX, Gong QM. Recurrent porphyria attacks in a Chinese patient with a heterozygous PBGD mutation. Gene. 2013;524:401-402. [PubMed] [DOI] |
| 32. | 沈 稚舟. 血卟啉病. 陈灏珠. 实用内科学. 11版. 北京: 人民卫生出版社 2001; 1009-1014. |