修回日期: 2017-01-14
接受日期: 2017-03-13
在线出版日期: 2017-04-18
验证痛泻要方对功能性消化不良(functional dyspepsia, FD)大鼠胃肠动力障碍的调节作用; 观察痛泻要方对FD大鼠胃、肠Cajal间质细胞超微结构及缝隙连接蛋白Cx43表达的影响.
通过夹尾刺激法制备FD大鼠模型, 以痛泻要方高、中、低不同剂量灌胃为干预手段, 多潘立酮为阳性对照, 观察并记录实验大鼠食量、体质量、胃排空率及小肠推进率的变化; 透射电镜下观察实验大鼠胃、肠Cajal间质细胞超微结构的变化, 免疫组织化学法检测胃、肠组织中缝隙连接蛋白Cx43的表达.
造模结束后, 模型组大鼠精神萎靡, 少动, 皮毛色泽黯淡、枯燥, 粪便稀溏或时干时稀, 食量、体质量与正常组大鼠相比均明显偏低(P<0.01), 胃排空率及小肠推进率延缓, 提示造模成功. 药物干预后, 痛泻要方高剂量大鼠食量、体质量与模型组大鼠相比均明显升高(P<0.05), 胃排空率及小肠推进率恢复至正常水平, 而痛泻要方低, 中剂量组相对模型无显著统计学差异. 电镜下, 模型组大鼠胃、肠Cajal间质细胞细胞质内细胞器减少, 粗面内质网脱颗粒, 可见液化、空泡, Cajal间质细胞间及其与周围细胞间的缝隙连接较少; 痛泻要方高剂量组与模型组相比, Cajal间质细胞的超微结构及其与周围细胞间的缝隙连接明显改善. 免疫组织化学结果显示, 模型组大鼠胃肠组织中缝隙连接蛋白的表达明显较少, 而痛泻要方高剂量组大鼠胃肠组织中缝隙链接蛋白的表达与模型组相比明显增高(P<0.01).
痛泻要方对FD大鼠胃肠动力障碍具有调节作用, 其调节FD胃肠动力障碍的作用机制可能与胃、肠Cajal间质细胞及其缝隙链接蛋白Cx43的表达有关.
核心提要: 功能性消化不良为临床常见疾病, 其病发病机制与Cajal间质细胞数量减少、分布异常、Cajal间质细胞网络缺失关系密切. 而痛泻要方具有修复缝隙连接蛋白, 调节Cajal间质细胞运动, 促进功能性消化不良(functional dyspepsia, FD)胃肠运动恢复, 改善FD引起的一系列症状.
引文著录: 刘琼, 贲定严, 陈威, 文维农, 陈苇, 刘霞, 常小荣, 张国山, 袁振仪. 痛泻要方对FD大鼠胃、肠Cajal间质细胞超微结构及缝隙连接蛋白Cx43表达的影响. 世界华人消化杂志 2017; 25(11): 974-982
Revised: January 14, 2017
Accepted: March 13, 2017
Published online: April 18, 2017
To evaluate the effect of Tongxie Yaofang on gastrointestinal motility, the ultrastructure of interstitial cells of Cajal (ICC) and connexin 43 (Cx43) expression in functional dyspepsia (FD) rats.
FD was induced in rats by stimulating the rat tail using sponge forceps. FD rats were then treated with different doses of Tongxie Yaofang, with domperidone as a positive control. After treatment, rat appetite and weight were recorded. The rats were then sacrificed, and gastric emptying and intestinal transit were recorded. Transmission electron microscopy was used to observe the ultrastructure of ICC, and immunohistochemistry was used to detect the expression of Cx43 in gastrointestinal tissues of FD rats.
After rats were stimulated using sponge forceps, they developed symptoms compatible with those of FD. The appetite and weight of FD rats were lower than those of normal controls, and the gastric emptying rate and intestinal transit rate were also significantly lower (p < 0.05 for both). After treatment with high-dose Tongxie Yaofang (3.412 g/kg) or domperidone, rat body weight, appetite, the gastric emptying rate and intestinal transit rate recovered to normal levels, although these were not fully achieved in rats treated with low- or medium dose Tongxie Yaofang (0.853 g/kg and 1.706 g/kg, respectively). Moreover, the altered ultrastructure of ICC and the decreased expression of Cx43 in the stomach and small intestine of FD rats were back to normal after treatment with high-dose Tongxie Yaofang (3.412 g/kg) or domperidone.
Tongxie Yaofang (3.412 g/kg) has a positive effect on gastrointestinal motility in FD rats, and the underlying mechanism may be related to the modulation of ICC and Cx43 expression in gastrointestinal tissues.
- Citation: Liu Q, Bi DY, Chen W, Wen WN, Chen W, Liu X, Chang XR, Zhang GS, Yuan ZY. Effect of Tongxie Yaofang on gastrointestinal motility, ultrastructure of interstitial cells of cajal and connexin 43 expression in rats with functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2017; 25(11): 974-982
- URL: https://www.wjgnet.com/1009-3079/full/v25/i11/974.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i11.974
功能性消化不良(functional dyspepsia, FD)是常见消化系统疾病, 以餐后饱胀不适、上腹部疼痛、上腹烧灼感、早饱、恶心、呕吐等症状为临床表现. 目前, FD发病率呈逐年上升趋势, 占消化系统疾病的20%-40%[1]; 我国的流行病学调查亦显示, 普通人群中有消化不良症状者达18.9%[2]. 现代医学主要采取促胃肠动力、抗幽门螺杆菌、抗焦虑和抗抑郁等药物进行治疗, 虽有一定的疗效, 但长期使用不良反应较多且易反复[3,4]. 近年来大量研究[5-7]证明中医药治疗FD优势明显, 无论是分型治疗, 还是专方专药均取得较好的疗效; 但是其相关机制尚不十分明确, 本课题组前期研究发现痛泻要方具有明显改善FD的作用, 而FD症状的出现主要与胃肠动力障碍相关, 其中Cajal间质细胞在胃肠动力方面扮演着重要角色, 因此本实验着重形态学基础, 从胃肠Cajal间质细胞结构及功能出发, 探索痛泻要方改善胃肠动力障碍的相关机制.
1.1.1 动物与分组: 健康Wistar大鼠72只, 湖南中医药大学动物实验中心提供(SPF级). 体质量200-250 g, 雌雄各半. 动物合格证号: SCXK(湘) 2009-0012. 实验过程中对动物的处置按照国家科技部颁发的《关于善待实验动物的指导性意见》中动物伦理学标准. 适应性喂养1 wk, 自有饮水、饮食. 实验室通风、采光良好, 温度20-25 ℃, 湿度50%-70%. 将大鼠按照随机数字表法分为空白组、模型组、痛泻要方高剂量组、痛泻要方中剂量组、痛泻要方低剂量组、多潘立酮组, 每组12只, 雌雄分笼饲养.
1.1.2 主要试剂及仪器: 多潘立酮(西安杨森制药有限公司, 批号H10910003); 20%乌拉坦(上海化学试剂公司); 营养性半固体糊: 取10 g羧甲基纤维素钠, 溶于250 mL蒸馏水中, 分别加入16 g奶粉, 8 g糖, 8 g淀粉和2 g活性炭末, 搅拌均匀, 配制成300 mL约300 g的黑色半固体糊状物, 冰箱冷藏, 用时恢复至室温; 2%(φ)PBS缓冲液; 3%戊二醛、2%(φ)锇酸、环氧树脂、乙醇、丙酮、硝酸铅、醋酸铀(均由湘雅生物医学电镜实验室提供); 免疫组织化学检测盒: (丹麦DAKO公司); 羊抗鼠IgG-HRP(美国Pierce); Anti-connexin 43(D-7)antibody(Santa Cruz sc-13558).
ER-182 A型电子天平(日本AND公司)UCT型超薄切片机(德国LEICA公司); JEM-1200 EX型透射电镜(日本JEOL公司); HM550型冷切片机(德国Microm公司); 光学显微镜(日本Olympus公司)显微摄像系统(MoticB5, 麦克奥迪实业集团公司); 图像分析软件(image pro plus); -80 ℃冰箱(日本SANYO公司); 恒温箱(上海跃进医疗仪器厂); 注射器、灌胃针头、长海绵钳等.
1.2.1 造模方法: 依据中医理论和FD病因学理论模拟FD动物模型, 按文献介绍的方法[8]造模大鼠每5只放进同一只笼中, 用长海绵钳(注: 长海绵钳的尖端用薄海绵包裹并用胶布缠紧, 以免夹伤大鼠尾端)夹大鼠尾巴远端1/3处, 以不破皮为度, 令其暴怒、寻衅并与其他大鼠厮打, 以激怒全笼大鼠. 每天8:30、10:30、14:00、16:00各刺激一次, 每次持续刺激30 min, 连续刺激7 d. 造模时正常组大鼠做禁食禁水处理.
1.2.2 给药途径及方法: 白术、白芍、陈皮、防风, 用药比例分别为15:12:6:8. 用8倍量水浸泡1 h, 煮沸30 min, 过滤, 残渣再加水煮沸30 min过滤, 合并滤液, 加热浓缩至每毫升约含生药1 g, 低温保存备用. 按人体用药量换算成大鼠等效剂量作为大鼠用药量, 痛泻要方低、中、高剂量组给药量分别为0.853 g/kg•d、1.706 g/kg•d、3.412 g/kg•d, 灌胃容积均为1 mL/100 g体质量.
多潘立酮购于西安杨森制药有限公司, 批号H10910003, 成人用量为30 mg/d. 按动物药量 = 成人剂量×0.018(200 g大鼠与70 kg成人体表面积比), 每只大鼠每天灌服多潘立酮为0.27 mg/100 g. 将多潘立酮片研成细粉末, 配置含药浓度为0.27 mg/mL多潘立酮悬浊液, 用时充分摇匀, 灌胃容积为1 mL/100 g体质量, 1次/d, 连续给药10 d.
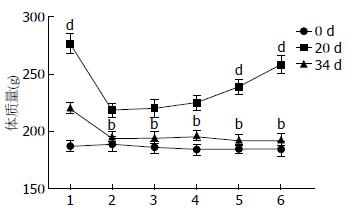
1.2.3 观察指标及检测方法: 一般状态观察: 每日观察大鼠的精神状态、姿势、皮毛色泽、活动度、对束缚的反应性、眼裂黏膜色泽、耳郭色泽以及粪便等全身情况. 大鼠体质量增长情况测量: 实验开始后隔日上午7:00用电子秤称量大鼠体质量, 并根据体质量调整给药量. 计算第1、20、34天各组大鼠体质量增长情况并进行比较.
第14天干预结束后, 各组大鼠禁食不禁水24 h, 然后给予半固体营养糊1 mL/100 g灌胃. 30 min后, 用20%乌拉坦10 mL/kg腹腔注射麻醉. 开腹, 结扎胃贲门和幽门, 取胃, 用滤纸吸干后称全重, 然后沿胃大弯剪开胃体, 洗去胃内容物后用滤纸吸干上面的水分, 称净重. 以胃全重和胃净重之差为胃内残留物重量. 同时迅速取出小肠, 轻轻剥离后直铺于白纸上, 测量幽门至回盲肠部全长及幽门至黑色半固体糊前沿的距离.
胃内残留率 = (胃全重-胃净重)/所灌半固体糊的重量×100%.
小肠推进率 = 幽门至黑色半固体糊前沿的距离/幽门至回盲部全长×100%.
1.2.4 透射电镜下观察各组大鼠Cajal间质细胞形状、突触连接、细胞缝隙、网络连接: 第14天干预结束禁食不禁水24 h后, 20%乌拉坦10 mL/kg腹腔注射麻醉, 开腹, 摘取距幽门1 cm的胃窦壁和距幽门2 cm的上段小肠组织. 在装有凉Krebs液的容器内, 沿系膜缘剖开胃及小肠, 除去内容物, 然后用滤纸吸干上面的液体, 将其装入3%戊二醛固定液中室温下固定待检. 从3%戊二醛固定液中取出待检样本, 用2% PBS缓冲液冲洗, 2% 锇酸固定1 h, 然后2% PBS缓冲液冲洗, 乙醇、丙酮梯度脱水, 环氧树脂浸透包埋, 精确定位, 超薄切片, 硝酸铅、醋酸铀染色.
1.2.5 免疫组织化学法检测缝隙连接蛋白Cx43表达: 第14天干预结束禁食不禁水24 h后, 20%乌拉坦10 mL/kg腹腔注射麻醉, 开腹, 摘取距幽门1 cm的胃窦壁和距幽门2 cm的上段小肠组织. 然后沿系膜缘剖开胃及小肠, 用冷生理盐水冲洗内容物, 并用滤纸吸干上面的液体, 将其装入0.l mol/L磷酸盐缓冲液(含4%多聚甲醛、0.05%戊二醛和15%饱和苦味酸, pH 7.4)中室温下固定待检.
常规石蜡包埋后连续切片, 二甲苯脱蜡, 无水乙醇、95%、80%、70%系列乙醇脱水, 蒸馏水冲洗, PBS缓冲液(pH 6.0)冲洗5 min, 蒸馏水冲洗, PBS缓冲液冲洗3次, 微波炉中抗原修复, 滴加一抗Cx43, 37 ℃下孵育60 min, 湿盒中4 ℃过夜, PBS缓冲液冲洗3次, 滴加二抗, 37 ℃孵育40 min, PBS缓冲液冲洗3次, DAB显色液显色3 min, 蒸馏水冲洗, 终止反应, 苏木素复染核, 乙醇脱水, 二甲苯透明, 中性树胶封片, 观察. 显微镜下观察以黄褐色区域为阳性反应, 从每张切片中选取5个高倍镜视野(400×), 采用image pro plus图像分析系统, 计算积分光密度值.
统计学处理 所有数据均使用SPSS20.0统计软件进行统计学分析. 计量资料以mean±SD表示, 首先进行正态性、方差齐性检验. 满足正态性者, 组间比较采用单因素方差分析(One-Way ANOVA), 方差齐时选择LSD法, 方差不齐时选择Dunnett T3法; 不满足正态性时选择秩和检验. 以P<0.05为差别有统计学意义.
造模20 d后, 与正常组相比, 模型组大鼠精神萎靡, 喜欢蜷缩在角落, 少动, 皮毛色泽黯淡、枯燥, 粪便稀溏或时干时稀; 药物干预14 d后, 与模型组相比, 痛泻药方低、中剂量组大鼠症状无明显改变, 而痛泻要方高剂量组和多潘立酮组大鼠经治疗后上述症状均有所好转, 且两组大鼠之间无明显差别.
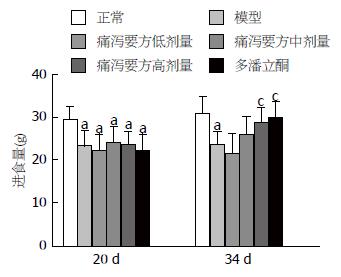
造模20 d后, 模型组、痛泻要方高、中、低剂量组和多潘立酮组大鼠的平均食量均低于正常组(P<0.05); 药物干预2 wk后, 模型组大鼠的平均食量仍低于正常组(P<0.05), 而痛泻要方高剂量组和多潘立酮组大鼠的平均食量则逐渐趋于正常, 均高于模型组(P<0.05)(图1).
造模前各组大鼠的初始体质量基本一致, 无显著性差异. 造模结束后, 模型组、痛泻要方组和多潘立酮组大鼠的平均体质量明显低于正常组(P<0.01). 药物干预2 wk后, 模型组大鼠的平均体质量仍低于正常组(P<0.01), 而痛泻要方组和多潘立酮组大鼠的平均体质量则趋于正常, 高于模型组(P<0.01), 且多潘立酮组大鼠的平均体质量高于痛泻要方组(P<0.01)(图2).
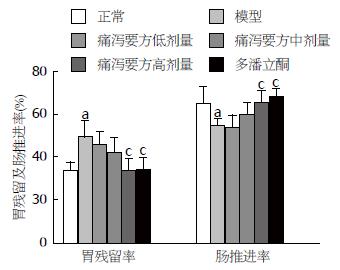
与正常组相比, 模型组大鼠的胃内残留率升高(P<0.05)而小肠推进率明显下降(P<0.05); 与模型组相比, 痛泻要方高剂量组和多潘立酮组大鼠的胃内残留率和小肠推进率均增高(P<0.05), 且痛泻要方高剂量组和多潘立酮组大鼠的胃内残留率和小肠推进率相比均无显著性差异(图3).
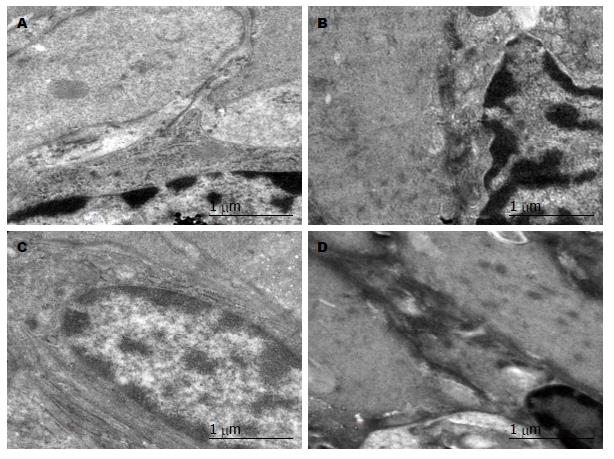
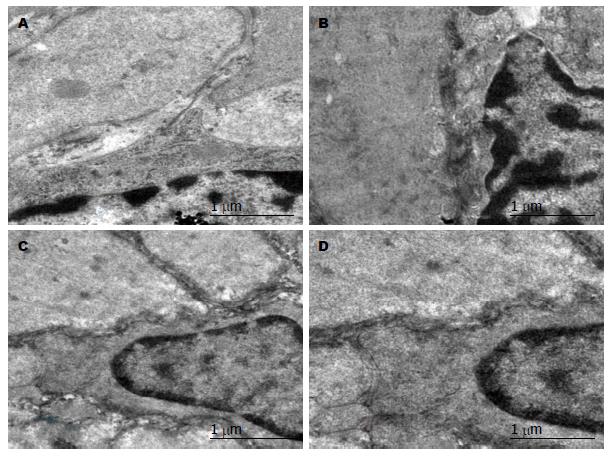
大鼠胃窦与小肠Cajal间质细胞超微结构的比较; 由图4A、图5A可以看出, 正常组Cajal间质细胞呈梭形或不规则多边形, 与周围细胞间有大量的突出样连接. 细胞核大, 呈高密度影, 细胞质内细胞器丰富, 含较多的粗面内质网. 图4B、图5B可以看出模型组Cajal间质细胞呈梭形或不规则多边形, 与周围细胞间的突出样连接较少. Cajal细胞质内细胞器减少, 粗面内质网脱颗粒. 由图4(C, D)、图5(C, D)可以看出, 痛泻要方高剂量组和多潘立酮组Cajal间质细胞呈梭形或不规则多边形, 与周围细胞间有较多的突出样连接. 细胞质内细胞器丰富, 含较多的粗面内质网(图4, 5).
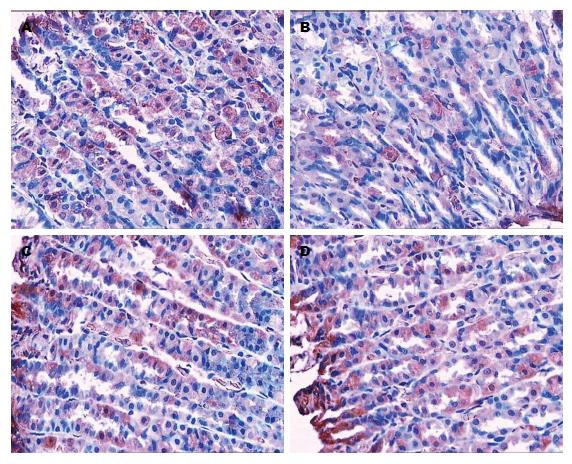
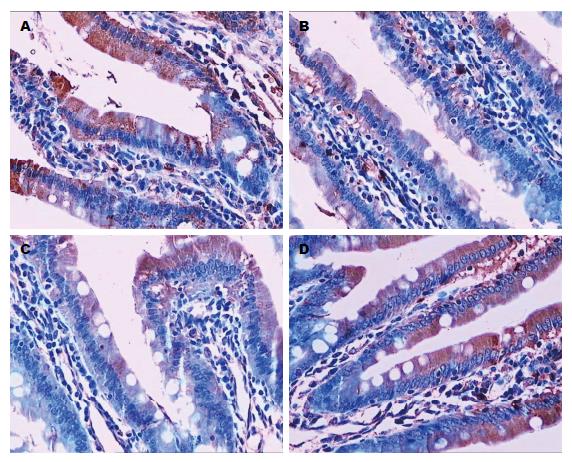
大鼠胃窦组织与小肠组织中缝隙连接蛋白Cx43的表达, 由图6A、图7A可以看出, 正常组大鼠在胃窦组织和小肠组织中缝隙连接蛋白Cx43呈强阳性表达, 分布广泛, 相邻细胞通过缝隙连接蛋白Cx43相互连接紧密. 由图6B、图7B可以看出, 模型组大鼠在胃窦组织和小肠组织中缝缝隙连接蛋白Cx43表达较弱, 部分相邻细胞之间缺乏表达, 相邻细胞之间联系不够紧密. 由图6(C, D)、图7(C, D)可以看出, 痛泻要方高剂量组和多潘立酮组大鼠分别在胃窦组织和小肠组织中缝隙连接蛋白Cx43呈强阳性表达, 分布广泛, 相邻细胞通过缝隙连接蛋白Cx43相互连接紧密(图6, 7).
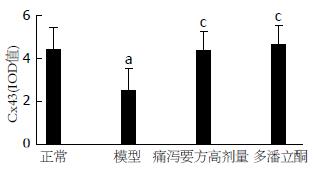
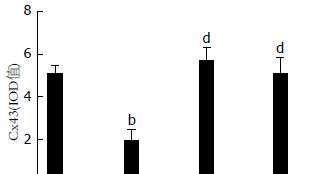
大鼠胃窦组织及小肠组织中缝隙连接蛋白Cx43表达的比较; 与正常组比较, 模型组大鼠胃窦组织的缝隙连接蛋白Cx43积分光密度较低(P<0.05); 与模型组比较, 痛泻要方高剂量组、多潘立酮组胃窦组织的缝隙连接蛋白Cx43积分光密度明显升高(P<0.05). 与正常组比较, 模型组大鼠小肠组织的缝隙连接蛋白Cx43积分光密度较低(P<0.01); 与模型组比较, 痛泻要方高剂量组、多潘立酮组胃窦组织的缝隙连接蛋白Cx43积分光密度明显升高(P<0.001, P<0.01)(图8, 9).
FD是一组表现为餐后上腹部饱胀不适、早饱感、上腹部疼痛或烧灼感的症候群, 可伴嗳气、恶心或呕吐等, 但缺乏能够解释这些症状的任何器质性、系统性或代谢性疾病[9,10]. 属于中医学"痞满"、"胃脘痛"等范畴, 根据其病位病机临证特点又恰属痛泻要方主治范围, 近年来大量临床及实验报到证明痛泻要方用于FD的治疗具有较好疗效[11,12]. 雷兆明等[13]运用痛泻要方加味治疗FD患者, 总治愈率达到87.3%, 疗效明显. 旺健伟等[14]通过观察痛泻要方对小鼠不同机能状态胃肠运动的影响, 发现对小鼠腹泻模型胃肠运动有一定抑制作用, 相反对小鼠便秘模型有促进作用, 证实痛泻要方对胃肠运动的双向调节作用.
本研究通过夹尾刺激法制备FD大鼠模型, 以痛泻要方高、中、低不同剂量灌胃为干预手段, 多潘立酮为阳性对照, 观察并记录实验大鼠食量、体质量、胃排空率及小肠推进率的变化; 造模结束后, 模型组大鼠精神萎靡, 少动, 皮毛色泽黯淡、枯燥, 粪便稀溏或时干时稀, 食量、体质量与正常组大鼠相比均明显偏低(P<0.01), 胃排空率及小肠推进率延缓, 提示造模成功. 夹尾刺激法是目前被广泛运用的较为成熟的制备FD模型的方法, 大鼠的精神状态, 活动程度, 毛发、粪便状态以及食量、体质量等是衡量制备FD模型是否成功的重要指标[15]. 课题组前期已经运用夹尾刺激法成功制备大鼠FD模型[16,17], 我们的实验结果也表明通过20 d的夹尾刺激法成功的制备了大鼠FD模型.
药物干预后, 痛泻要方高剂量组大鼠精神状态变好, 活动度增加, 毛发、粪便状态趋于正常, 食量、体质量与模型组大鼠相比均明显升高(P<0.05), 胃排空率及小肠推进率恢复至正常水平, 表明痛泻要方具有改善FD模型大鼠症状的作用. 同时, 阳性对照药多潘立酮也发挥了类似痛泻要方高剂量的作用, 进一步佐证了大鼠FD模型制备的成功和明确了痛泻要方高剂量对FD大鼠的疗效[18].
Cajal间质细胞最早由西班牙神经解剖学家Cajal发现并描述[19], 被认为是胃肠道运动的起搏细[20]. 人类很多种胃肠道动力病发病机制与Cajal间质细胞数量减少、分布异常、Cajal间质细胞网络缺失有关, 大约2/3FD患者伴随慢波传导和偶联损伤[21,22]. Cajal间质细胞的发育分化障碍、结构或分布异常、Cajal间质细胞病理损害、衰老时的凋亡或退行性改变都可能是胃肠动力障碍性疾病发生的关键性器官组织学病理机制[23,24]. 缝隙连接(Gap-Junction, GJ)是参与相邻细胞间信息、能量和物质交换, 以及协调细胞间化学和电信号的传递通道[25]. 在胃肠运动活动中, 缝隙连接介导Cajal间质细胞和胃肠平滑肌细胞间电化学信息交流, 使得Cajal间质细胞之间、Cajal间质细胞和平滑肌细胞之间、平滑肌细胞之间形成信号偶联, 为起搏信号传入平滑肌细胞提供了低电阻通道, 保证胃肠平滑肌活动的协调性和同步性. 细胞间缝隙连接通道的基本结构和功能蛋白称缝隙隙连接蛋白. 其中, 缝隙连接蛋白Cx43是膜通道的重要物质基础[26]. 缝隙连接蛋白Cx43的减少或缺失则会抑制电活动的传播, 从而抑制平滑肌细胞的兴奋性, 进而影响胃肠收缩活动[27]. 现有研究[28]发现, 缝隙连接蛋白Cx43与胃肠运动障碍性疾病关系密切, 如糖尿病胃轻瘫大鼠胃体和胃窦、先天性巨结肠病在无神经节分布的先天性巨结肠肠段及其移行区段, 均有缝隙连接蛋白Cx43表达明显减少或缺失. 说明缝隙连接蛋白Cx43是胃肠道网络的重要功能型缝隙连接通道蛋白, 是胃肠运动功能活动整合协调的主要结构之一.
本研究发现模型组胃窦组织和小肠Cx43缝隙蛋白表达较正常组明显降低, 而痛泻要方组和多潘立酮组胃窦组织和小肠组织中的缝隙连接蛋白Cx43积分光密度明显升高, 接近正常组水平, 说明痛泻要方和多潘立酮均能够修复缝隙连接蛋白Cx43, 提高缝隙连接蛋白Cx43的阳性表达. 缝隙连接蛋白Cx43具有介导Cajal间质细胞运动的作用, 为Cajal间质细胞传入平滑肌细胞提供了低电阻通道; 而Cajal间质细胞参与胃肠运动, 当其缺失或异常都能导致胃肠运动障碍.
综上, 我们认为痛泻要方和多潘立酮是通过修复缝隙连接蛋白Cx43, 调节Cajal间质细胞运动来促进FD大鼠胃肠运动功能恢复, 改善FD引起的系列症状.
痛泻要方始处于《丹溪心法》"治痛泻", 现在临床常用于治疗肠易激综合征, 慢性结肠炎、溃疡性结肠炎及FD等治疗[28,29]. 本文从痛泻要方对FD大鼠胃肠动力障碍具有调节作用, 探讨了痛泻要方调节FD大鼠胃肠动力障碍的可能机制, 为临床用药提供了相关理论依据, 且药物干预中痛泻要方分高、中、低不同剂量进行试验, 并采用多潘立酮为阳性对照, 对临床用药有一定参考价值.
感谢钟欢、舒文娜在本试验中给予的大力帮助.
功能性消化不良(functional dyspepsia, FD)属于中医学"胃痞"、"胃脘痛"的范畴. 中医认为肝主疏泄, 条畅气机, 若情志不畅则肝失调达, 久则横逆犯脾, 肝木脾土失调则表现为胃脘部症状. 痛泻要方为和解剂, 具有调和肝脾, 补脾柔肝, 祛湿止泻之功效, 临床常用于治疗胃肠病变. 但是由于作用机制研究较少, 使得临床推广应用受到极大限制. 因此, 探讨痛泻要方治疗FD作用机制, 为临床推广应用提供有力的依据显得十分重要.
Cajal间质细胞最早由西班牙神经解剖学家Cajal发现并描述, 被认为是胃肠道运动的起搏细胞. 人类很多种胃肠道动力病发病机制与Cajal间质细胞数量减少、分布异常、Cajal间质细胞网络缺失有关. 而Cajal间质细胞和胃肠平滑肌细胞间电化学信息交流则由缝隙连接蛋白Cx43所介导.
雷兆明运用痛泻要方加味治疗FD患者, 总治愈率达到87.3%, 疗效明显. 旺健伟通过观察痛泻要方对小鼠不同机能状态胃肠运动的影响, 发现对小鼠腹泻模型胃肠运动有一定抑制作用, 相反对小鼠便秘模型有促进作用, 证实痛泻要方对胃肠运动的双向调节作用.
本文提出痛泻要方治疗FD的作用机制可能是直接调节了胃、肠Cajal间质细胞超微结构及缝隙连接蛋白Cx43表达, 从而达到改善胃肠动力障碍的作用.
该文通过对痛泻要方治疗FD的机制探讨, 可以为临床扩大应用痛泻要方治疗FD提供理论依据.
Cajal间质细胞: 最早由西班牙神经解剖学家Cajal发现并描述, 被认为是胃肠道运动的起搏细胞. 人类很多种胃肠道动力病发病机制与Cajal间质细胞数量减少、分布异常、Cajal间质细胞网络缺失有关, 大约2/3FD患者伴随慢波传导和偶联损伤.
王春荣, 副主任技师, 济南市疾病预防控制中心; 王俊平, 教授, 山西省人民医院消化科
试验设计的思路正确, 采取的方法具有一定的科学性. 论文验证了痛泻要方对FD大鼠胃肠动力障碍具有调节作用, 探讨了痛泻要方调节FD大鼠胃肠动力障碍的可能机制, 具有一定新颖性. 造模中痛泻要方分高、中、低不同剂量进行试验, 并采用多潘立酮为阳性对照, 对临床用药有一定参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Ghoshal UC, Singh R, Chang FY, Hou X, Wong BC, Kachintorn U. Epidemiology of uninvestigated and functional dyspepsia in Asia: facts and fiction. J Neurogastroenterol Motil. 2011;17:235-244. [PubMed] [DOI] |
| 7. | 赵 瑞丽. 自拟健脾温中汤治疗功能性消化不良的临床观察. 中国中西医结合消化杂志. 2016;24:545-547. |
| 8. | 郭 海军, 李 国成, 陶 秀良. 功能性消化不良的动物模型研究. 中国中西医结合消化杂志. 2001;9:141-142. |
| 9. | Tack J, Talley NJ, Camilleri M, Holtmann G, Hu P, Malagelada JR, Stanghellini V. Functional gastroduodenal disorders. Gastroenterology. 2006;130:1466-1479. [PubMed] [DOI] |
| 10. | Vanheel H, Carbone F, Valvekens L, Simren M, Tornblom H, Vanuytsel T, Van Oudenhove L, Tack J. Pathophysiological Abnormalities in Functional Dyspepsia Subgroups According to the Rome III Criteria. Am J Gastroenterol. 2017;112:132-140. [PubMed] [DOI] |
| 11. | 李 晓玲, 张 声生, 杨 成, 汪 正芳, 吴 震雨, 储 益平, 张 恒钰. 仁术健脾理气方对功能性消化不良大鼠胃平滑肌收缩反应及GHSR蛋白表达的影响. 中华中医药杂志. 2015;30:1039-1042. |
| 12. | 尚 莹莹, 吴 晓华, 郭 召平, 黄 天生, 杨 伟, 陈 利清. 中药离子导入联合中药内服治疗功能性消化不良餐后不适综合征(肝胃不和证)临床研究. 辽宁中医杂志. 2016;43:1416-1419. |
| 15. | 钟 欢, 郁 保生, 邹 旭峰, 戴 维, 刘 未艾, 葛 君芸, 刘 密, 常 小荣. 小柴胡汤对肝郁脾虚型FD大鼠Ghrelin和胃排空的影响. 世界华人消化杂志. 2015;23:4542-4547. [DOI] |
| 16. | 张 月, 张 国山, 刘 雨儿, 胡 薇, 谢 慎, 刘 密, 常 小荣. 电针足三里对功能性消化不良大鼠胃电节律的影响. 世界华人消化杂志. 2014;22:3953-3957. [DOI] |
| 17. | 张 国山, 刘 密, 邱 冉冉, 钟 欢, 呙 安林, 王 厚莲, 常 小荣, 袁 振仪. 艾灸与针刺调节功能性消化不良大鼠胃肠动力障碍的对比研究. 时珍国医国药. 2016;27:2796-2798. |
| 19. | Choi S, Choi JJ, Jun JY, Koh JW, Kim SH, Kim DH, Pyo MY, Choi S, Son JP, Lee I. Induction of pacemaker currents by DA-9701, a prokinetic agent, in interstitial cells of Cajal from murine small intestine. Mol Cells. 2009;27:307-312. [PubMed] [DOI] |
| 20. | Rumessen JJ. Ultrastructure of interstitial cells of Cajal at the colonic submuscular border in patients with ulcerative colitis. Gastroenterology. 1996;111:1447-1455. [PubMed] |
| 21. | Zhang H, Xu X, Wang Z, Li C, Ke M. Correlation between gastric myoelectrical activity recorded by multi-channel electrogastrography and gastric emptying in patients with functional dyspepsia. Scand J Gastroenterol. 2006;41:797-804. [PubMed] [DOI] |
| 22. | 刘 宁, 李 平, 张 建英, 楚 更五. Cajal间质细胞研究进展. 中国中西医结合消化杂志. 2011;19:418-419. |
| 23. | Koh SD, Ward SM, Sanders KM. Ionic conductances regulating the excitability of colonic smooth muscles. Neurogastroenterol Motil. 2012;24:705-718. [PubMed] [DOI] |
| 24. | Dickens EJ, Edwards FR, Hirst GD. Selective knockout of intramuscular interstitial cells reveals their role in the generation of slow waves in mouse stomach. J Physiol. 2001;531:827-833. [PubMed] |
| 27. | Bloor DJ, Wilson Y, Kibschull M, Traub O, Leese HJ, Winterhager E, Kimber SJ. Expression of connexins in human preimplantation embryos in vitro. Reprod Biol Endocrinol. 2004;2:25. [PubMed] [DOI] |
| 28. | Kostin S. Zonula occludens-1 and connexin 43 expression in the failing human heart. J Cell Mol Med. 2007;11:892-895. [PubMed] [DOI] |