修回日期: 2016-01-19
接受日期: 2016-01-23
在线出版日期: 2016-03-28
目的: 探讨幽门螺杆菌(Helicobacter pylori, H. pylori)感染对敲除核因子-κB(nuclear factor-κB, NF-κB)通路上IKKβ、p65基因后过表达Fas相关因子1(Fas-associated factor 1, FAF1)胃癌细胞的影响, 进一步明确H. pylori致癌的相关机制.
方法: 构建针对IKKβ、p65的siRNA慢病毒载体(LV-IKKβ-RNAi、LV-p65-RNAi), 转染过表达FAF1的HGC-27细胞, 实时定量聚合酶链反应(RT-PCR)和蛋白质印迹(Western blot)法检测转染前后IKKβ、p65、FAF1 mRNA和蛋白表达. 应用CCK8法检测转染后细胞增殖能力的变化. 用H. pylori培养滤液感染基因敲除细胞, 用RT-PCR和Western blot法检测H. pylori感染前后IKKβ、p65、FAF1 mRNA和蛋白表达.
结果: 成功将LV-IKKβ-RNAi、LV-p65-RNAi和阴性对照(LV-NC-RNAi)转染入过表达FAF1胃癌细胞, 转染后72 h, LV-IKKβ-RNAi和LV-p65-RNAi组IKKβ和p65 mRNA和蛋白表达显著低于LV-NC-RNAi组和未转染组(均P<0.01); 转染前后各组间FAF1 mRNA和蛋白表达无显著差异(P>0.05). LV-IKKβ-RNAi组和LV-p65-RNAi组细胞增殖能力升高(P<0.01). H. pylori感染后LV-IKKβ-RNAi组和LV-p65-RNAi组IKKβ、p65 mRNA和蛋白表达与感染前相比无显著差异(P>0.05), 而LV-NC-RNAi组和未转染组IKKβ、p65 mRNA和蛋白表达都显著高于感染前(P<0.01). H. pylori感染后LV-IKKβ-RNAi组和LV-p65-RNAi组FAF1 mRNA和蛋白表达与感染前相比无显著差异(P>0.05), 而LV-NC-RNAi组和未转染组FAF1 mRNA和蛋白表达显著低于感染前(P<0.01).
结论: H. pylori感染可能通过介导NF-κB信号通路下调抑癌因子FAF1的表达, 进而导致胃癌的发生.
核心提示: 幽门螺杆菌(Helicobacter pylori, H. pylori)感染能下调胃癌变过程中Fas相关因子1(Fas-associated factor 1, FAF1)表达, 且FAF1的表达与胃癌的分化程度及浸润转移密切相关, H. pylori感染所引起的凋亡基因调控失衡可能是胃癌变的机制之一. H. pylori感染对FAF1基因调控过程中, 核因子-κB(nuclear factor-κB)信号通路可能在其中发挥了至关重要的作用.
引文著录: 陈小妮, 刘爱群, 葛莲英. 幽门螺杆菌感染通过核因子κB信号通路调控Fas相关因子1表达的相关机制. 世界华人消化杂志 2016; 24(9): 1405-1411
Revised: January 19, 2016
Accepted: January 23, 2016
Published online: March 28, 2016
AIM: To explore the influence of Helicobacter pylori (H. pylori) infection on human gastric cancer cells overexpressing Fas-associated factor 1 (FAF1) after knockout of IKKβ or p65 of the nuclear factor-κB (NF-κB) pathway, in order to further clarify the mechanism of H. pylori in gastric carcinogenesis.
METHODS: Lentivirus vectors carrying siRNA targeting IKKβ or p65 were constructed (LV-IKKβ-RNAi, LV-p65-RNAi) and used to transfecting human gastric cancer cells HGC-27 overexpressing FAF1. IKKβ, p65, and FAF1 mRNA and protein expression was detected by real-time PCR and Western blot before and after transfection. CCK8 assay was applied to detect cell proliferation after transfection. The transfected cells were infected with H. pylori culture filtrate, and real-time PCR and Western blot were applied to detect IKKβ, p65 and FAF1 expression before and after H. pylori infection.
RESULTS: LV-IKKβ-RNAi, LV-p65-RNAi and negative control (LV-NC-RNAi) were transfected into HGC-27 cells overexpressing FAF1 successfully. After transfection for 72 h, the expression of IKKβ and p65 mRNA and protein in the LV-IKKβ-RNAi group and LV-p65-RNAi group were significantly lower than that in the LV-NC-RNAi group and untransfected group (P < 0.01). There was no statistically significant difference in the expression of FAF1 mRNA and protein in the four groups (P > 0.05). The proliferation of cells in the LV-IKKβ-RNAi group and LV-p65-RNAi group increased. H. pylori culture filtrate was used to infect different groups of cells. There was no statistically significant difference in the expression of IKKβ and p65 mRNA and protein in the LV-IKKβ-RNAi group and LV-p65-RNAi group before and after H. pylori infection (P > 0.05), but the expression of IKKβ and p65 mRNA and protein in the LV-NC-RNAi group and untransfected group after H. pylori infection was significantly higher than that before H. pylori infection (P < 0.01). There was no statistically significant difference in the expression of FAF1 mRNA and protein in the LV-IKKβ-RNAi group and LV-p65-RNAi group before and after H. pylori infection (P > 0.05), but the expression of FAF1 mRNA and protein in the LV-NC-RNAi group and untransfected group after H. pylori infection was significantly lower than that before H. pylori infection (P < 0.01).
CONCLUSION: H. pylori infection might regulate FAF1 expression through the NF-κB signaling pathway, and downregulation of FAF1 could lead to gastric carcinogenesis.
- Citation: Chen XN, Liu AQ, Ge LY. Mechanism for Helicobacter pylori infection to regulate Fas-associated factor 1 expression through nuclear factor-κB signaling pathway. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1405-1411
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1405.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1405
胃癌是最常见的消化系肿瘤之一, 其发病率居恶性肿瘤第4位, 死亡率居恶性肿瘤第2位[1]. 幽门螺杆菌(Helicobacter pylori, H. pylori)感染是胃癌的重要致病因素之一, H. pylori能否根除直接影响到胃癌的化疗效果[2]. 我们课题组在前期研究中发现: 在H. pylori感染所致癌变过程中, 新抑癌基因Fas相关因子1(Fas associated factor 1, FAF1)在胃癌的发生发展过程中可能起到一个关键性的作用[3,4], 但H. pylori感染如何调控FAF1的表达机制尚不明确. 核因子-κB(nuclear factor-κB, NF-κB)是一类与肿瘤发生发展密切相关的信号转导通路, H. pylori感染后常常引起NF-κB通路的活化[5], H. pylori感染是否通过该信号通路进一步调控FAF1表达而发挥致癌作用? IKKβ、p65是NF-κB通路上两个关键基因, 我们拟利用前期筛选出的稳定表达FAF1的HGC-27胃癌细胞株(Lenti-FAF1/HGC-27)[6], H. pylori感染敲除NF-κB通路上IKKβ、p65基因的该细胞株, 探讨H. pylori感染对阻断该通路后过表达FAF1胃癌细胞的影响, 进一步明确H. pylori感染致癌的相关机制.
人胃癌细胞株HGC-27购自中国科学院上海细胞研究所. H. pylori菌株NCTC11637购自美国标准生物品收藏中心. 293T细胞株、大肠杆菌菌株DH5α购自上海吉凯基因化学技术有限公司. Lipofectamine 2000和TRIzol购自美国Invitrogen公司, 引物和SYBR Master Mixture购自Takara公司, 逆转录试剂盒购自美国Thermo公司. RPMI 1640培养基购自美国Hyclone公司, 胎牛血清购自美国Corning公司. IKKβ、p65、β-actin一抗和兔二抗均购自美国Cell signaling technology公司, FAF1一抗购自美国GeneTex公司.
1.2.1 H. pylori培养滤液的制备: 将H. pylori菌株接种到哥伦比亚血琼脂培养基上, 在37 ℃的微需氧环境下培养3 d, 然后挑取单个菌落, 转移到布氏肉汤培养基中, 37 ℃微需氧环境下, 130 r/min震荡培养. 当H. pylori浓度达到1×108 cfu/mL时, 12000 r/min离心20 min, 上清液经0.22 μm微孔滤膜过滤除菌, 冷冻浓缩后置于-80 ℃保存.
1.2.2 siRNA的设计与慢病毒载体构建: 靶基因序列由上海吉凯公司设计, 有效敲除IKKβ的序列为: GAACGGATGATGGCTCTG(上游), CCCTTGCTTGCTCCTCTA(下游), 扩增片段大小为103 bp; 有效敲除p65的序列为: GACTACGACCTGAATGCTGTG(上游), ACCTCAATGTCCTCTTTCTGC(下游), 扩增片段大小为227 bp. 将合成的干扰序列双链两端酶切位点与酶切后的GV113载体相连接, 转化大肠杆菌DH5α. 然后挑取阳性克隆, 进行鉴定和测序.
1.2.3 慢病毒转染过表达FAF1的HGC-27细胞: 转染前1 d, 将待转染细胞用胰酶消化并接种到6孔板中, 密度为5×105个/mL, 放入培养箱中培养, 待细胞融合度达到85%-90%时开始转染. 实验分组如下: 未转染组(过表达FAF1的HGC-27胃癌细胞株), LV-NC-RNAi组(敲除无关序列), LV-IKKβ-RNAi和LV-p65-RNAi组. 转染时加入合适浓度的慢病毒, 并加入Polybrene和Eni.s提高病毒对细胞的感染能力, 8-12 h后弃去上清, 更换为完全培养基后继续培养. 24-72 h后观察细胞形态变化及荧光表达情况, 评估转染效率.
1.2.4 RT-PCR法检测细胞IKKβ、p65、FAF1 mRNA表达: 用TRIzol法分别提取上述各组细胞总RNA, 并逆转录为cDNA. 引物如下: IKKβ上游引物5'-GGCAAACCGTACTCCAAGCAC-3', 下游引物5'-CCTTGTCTGCACACTGGAGGTC-3', 扩增片段长度为131 bp; p65上游引物5'-GGGAAGGAACGCTGTCAGAG-3', 下游引物5'-TAGCCTCAGGGTACTCCATCA-3', 扩增片段长度为204 bp; FAF1上游引物5'-CTTGCTGAATCAGGGCTCTC-3', 下游引物5'-TCCACCCCAAATTCTGTAGC-3', 扩增片段长度为204 bp; β-actin上游引物5'-ACCGAGCGCGGCTACAGC-3', 下游引物5'-CTCATTGCCAATGGTGAT-3', 扩增片段长度为180 bp. PCR反应条件为95 ℃ 30 s预变性, 95 ℃ 5 s变性, 60 ℃ 34 s退火及延伸, 40个循环. 最后以β-actin作为标准参照计算样本相对表达量, 计算公式为: 相对mRNA表达量 = 2-△△Ct, △△Ct值 = (待测组目的基因Ct值-待测组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值). 实验组设3个复孔, 重复测量3次.
1.2.5 Western blot法检测细胞IKKβ、p65、FAF1蛋白表达: 用细胞裂解液提取上述各组细胞总蛋白, 蛋白质定量试剂盒(BCA法)检测蛋白浓度, 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 恒定电压作用2 h后将蛋白转移到PVDF膜上恒定电流作用2 h, 再用封闭液封闭1 h, TBST洗膜3次后分别孵育IKKβ、p65、FAF1和β-actin一抗(均为1:1000), 4 ℃过夜. 次日洗膜3次后孵育二抗(1:2000)1 h, 再次洗膜3次后用ECL化学发光试剂盒进行显色. 以β-actin为内参, 采用Quantity one软件对条带进行灰度分析. 实验组设3个复孔, 重复测量3次.
1.2.6 CCK8法检测细胞增殖能力: 细胞转染后继续连续培养5 d, 每天向每孔中加入CCK8溶液10 μL, 继续培养2 h后, 在酶标仪上450 nm波长处检测各孔的吸光度值(A值). 每组设3个复孔, 并设只加培养液不加细胞的孔用于调零.
1.2.7 H. pylori培养滤液感染细胞并检测IKKβ、p65、FAF1 mRNA和蛋白表达: 用制备好的H. pylori培养滤液感染以上各组细胞, 24 h后分别按上述操作用RT-PCR和Western blot法检测IKKβ、p65、FAF1 mRNA和蛋白表达. 实验组设3个复孔, 重复测量3次.
统计学处理 数据以mean±SD表示, 应用SPSS16.0进行统计分析. 采用单因素方差分析(One-way ANOVA), 组间两两比较采用LSD法, P<0.05表示差异有统计学意义.
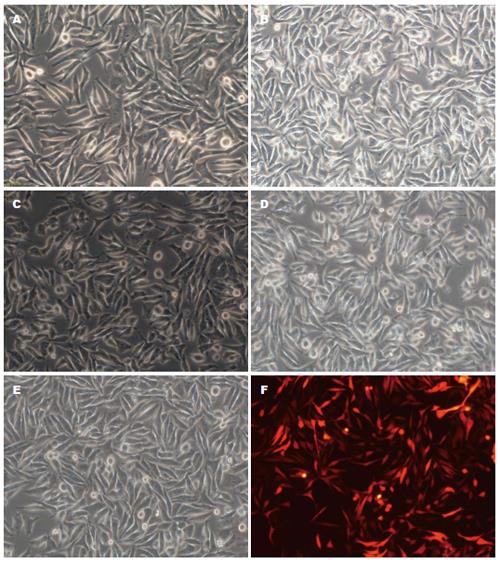
转染IKKβ siRNA和p65 siRNA慢病毒后, 细胞核皱缩, 核内空泡增多, 原有的梭形形态变成不规则形, 而空载转染组对细胞形态影响较小(图1A-D). 转染后72 h, 荧光显微镜下观察转染效率达到90%(图1E, F). 说明慢病毒转染成功, 可进行下一步试验.
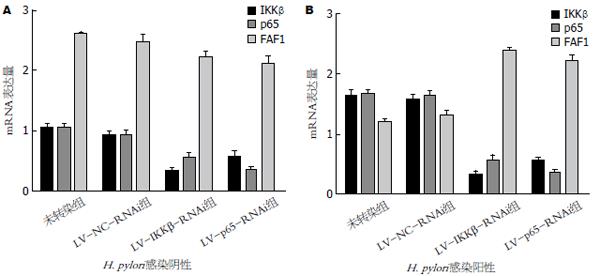
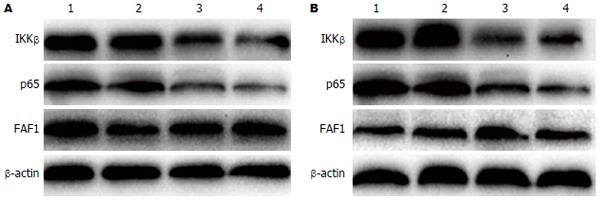
细胞分别转染IKKβ和p65 siRNA后, LV-IKKβ-RNAi组IKKβ mRNA表达(0.390±0.091)显著低于LV-NC-RNAi组(0.943±0.321)和未转染组(1.001±0.052)(F = 91.603, P<0.01); LV-p65-RNAi组p65 mRNA表达(0.327±0.025)显著低于LV-NC-RNAi组(0.930±0.062)和未转染组(1.010±0.125)(F = 216.592, P<0.01, 图2). 与LV-NC-RNAi组和未转染组相比, LV-IKKβ-RNAi组IKKβ蛋白表达和LV-p65-RNAi组p65蛋白表达都明显降低(P<0.01, 图3). LV-NC-RNAi组与未转染组IKKβ、p65 mRNA和蛋白表达差异均无统计学意义(P>0.05). 转染后, 各组间FAF1 mRNA和蛋白表达无显著差异(P>0.05, 图2, 3). 表明siRNA慢病毒成功敲除了IKKβ、p65基因, 但是敲除前后FAF1的表达并未受影响.
H. pylori感染后24 h LV-NC-RNAi组和未转染组IKKβ、p65 mRNA和蛋白表达都显著高于感染前(P<0.01), 而FAF1 mRNA和蛋白表达显著低于感染前(P<0.01); H. pylori感染后LV-IKKβ-RNAi组和LV-p65-RNAi组IKKβ、p65、FAF1 mRNA和蛋白表达与感染前相比无显著差异(P>0.05, 图2, 3). 表明H. pylori感染能够活化NF-κB通路, 增加IKKβ和p65的表达, 并且基因敲除后能够抑制H. pylori对FAF1的下调作用.
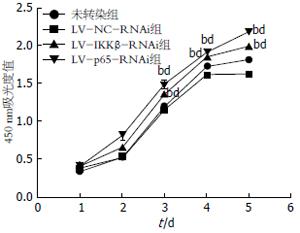
CCK8细胞增殖实验结果表明, 与LV-NC-RNAi组和未转染组相比, LV-IKKβ-RNAi组和LV-p65-RNAi组细胞增殖水平明显升高(P<0.01), LV-NC-RNAi组和未转染组细胞增殖水平无显著差异(P>0.05, 图4). 说明敲除IKKβ、p65基因能够影响过表达FAF1胃癌细胞的增殖.
FAF1是Fas相关死亡结构域蛋白的成员之一, 他能够增强Fas介导的细胞凋亡. FAF1具有多种生物学功能, FAF1表达下调可以导致肿瘤的发生. 本课题组前期的研究结果已经证实FAF1在胃癌中低表达[3,7,8], 且H. pylori感染下调FAF1表达, 并筛选出多种与H. pylori感染相关胃癌的差异蛋白[9], 因此胃癌的发生与H. pylori相关的FAF1表达失衡有关. NF-κB是一类重要的核转录因子, 他与肿瘤的发生、增殖、凋亡、侵袭和转移密切相关. 研究表明: 胃癌的发生与NF-κB通路激活有关[10-12], FAF1能够通过与IKKβ[13]和p65[14]作用而抑制NF-κB的活性, 促进细胞凋亡, FAF1能够负向调节NF-κB信号转导. NF-κB活化是H. pylori感染后胃癌变的重要一步. 因此, 在胃癌变过程中, FAF1与H. pylori感染及NF-κB之间或许有着密切的关系.
H. pylori感染后, 能够激活多条信号通路参与胃黏膜上皮细胞内外的信号传递, 使细胞发生一系列的病理生理改变, 其中最重要的一条是NF-κB信号通路[5]. 据报道, 活化的NF-κB能够调节靶基因的转录和表达, 参与细胞增殖与凋亡的调控及细胞转化[15,16], 在胃癌发生中发挥作用, 因此 NF-κB通路可能是肿瘤治疗的一个重要靶点. H. pylori感染是否通过NF-κB通路实现对FAF1表达的调控呢? 我们推测有三种可能: (1)H. pylori感染作为细胞外信号→激活NF-κB途径→FAF1基因表达下调→异型细胞凋亡减少→肿瘤发生; (2)H. pylori感染→FAF1表达减少→抑制NF-κB活力减弱→TNF-α、IL-1β表达↑→H. pylori相关性胃炎乃至胃癌的形成; (3)FAF1基因的表达和NF-κB途径之间存在着反馈抑制作用, 而这种作用是介于H. pylori感染基础上.
为了深入研究H. pylori感染对胃癌变过程中FAF1表达的影响及相关的信号调控机制, 本研究中我们构建了针对NF-κB信号通路的IKKβ和p65基因的siRNA慢病毒载体, 并成功转染入前期本实验室构建的过表达FAF1的HGC-27胃癌细胞中. 研究结果表明, 敲除了IKKβ和p65基因的细胞核皱缩, 核内空泡增多, 原有的梭形形态变成不规则形. 本研究采用荧光定量PCR和Western blot法分别对敲除NF-κB信号通路的IKKβ和p65基因蛋白表达进行检测, 结果显示靶向作用于该通路的siRNA慢病毒有效敲除了IKKβ和p65基因; 但对敲除前后FAF1的表达并未受影响. NF-κB通路IKKβ和p65基因敲除后细胞增殖水平明显升高, 这说明沉默NF-κB通路上的关键基因可影响过表达FAF1胃癌细胞的增殖. 为进一步探讨H. pylori感染通过NF-κB信号通路对FAF1的调控及相关机制: 我们采用H. pylori培养滤液感染IKKβ和p65基因敲除后的Lenti-FAF1/HGC-27细胞株, 并检测了H. pylori感染前后IKKβ、p65、FAF1 mRNA和蛋白表达, 结果显示: H. pylori感染后LV-IKKβ-RNAi组和LV-p65-RNAi组IKKβ、p65表达未受影响, 而LV-NC-RNAi组和未转染组IKKβ、p65表达增加, 表明H. pylori感染激活了NF-κB信号通路. H. pylori感染后LV-IKKβ-RNAi组和LV-p65-RNAi组FAF1表达未受影响, 而LV-NC-RNAi组和未转染组FAF1表达减少, 表明H. pylori感染能够下调FAF1表达, 而阻断NF-κB通路能够抑制H. pylori对FAF1的下调. H. pylori感染可能通过NF-κB通路调控FAF1表达, FAF1表达减少可导致胃癌发生.
总之, 本研究首次对H. pylori感染通过NF-κB通路调控过表达FAF1胃癌细胞的机制进行了探讨. 研究结果表明: 通过RNAi技术沉默NF-κB通路上的IKKβ和p65基因, 能够影响过表达FAF1胃癌细胞的增殖, 并抑制H. pylori感染引起的FAF1表达下调及IKKβ、p65表达上调, 胃癌变过程中H. pylori感染引发的FAF1下调可能受NF-κB信号通路调节, 这可能为H. pylori致癌机制之一.
胃癌是最常见的消化系肿瘤之一, 其死亡率居恶性肿瘤第2位. 幽门螺杆菌(Helicobacter pylori, H. pylori)感染是胃癌的重要致病因素之一. Fas相关因子1(Fas associated factor 1, FAF1)在H. pylori相关胃癌的发生中可能起到关键作用. 核因子-κB(nuclear factor-κB, NF-κB)是一类与肿瘤发生发展密切相关的信号转导通路, H. pylori感染后常常引起NF-κB通路的活化. 在胃癌变过程中, FAF1与H. pylori感染及NF-κB之间或许有着密切的关系.
吕农华, 教授, 主任医师, 南昌大学第一附属医院
FAF1是新近发现的一种抑癌基因, 国内对该基因研究很少. 我们课题组首次对FAF1在胃癌中的低表达进行了深入研究, 本研究在前期基础上进一步探讨H. pylori引起胃癌中FAF1低表达的具体机制.
H. pylori引起胃癌中FAF1低表达已经被证实, NF-κB通路在H. pylori感染致胃癌变过程中发挥着关键作用.
虽然国内外对NF-κB信号通路已经进行了广泛的研究, 但是国内对胃癌细胞中H. pylori感染与FAF1低表达及NF-κB通路关系的研究并不多见. 本研究首次利用RNA干扰技术探讨H. pylori感染胃癌变过程中NF-κB信号通路对FAF1表达的调控作用, 进一步明确了H. pylori的致癌机制.
本文应用慢病毒介导的siRNA成功敲除NF-κB通路上的IKKβ和p65基因, 为进一步研究胃癌的具体发病机制奠定了基础, 同时也证明了RNA干扰技术在基因研究中的高效性.
本文探讨了H. pylori致胃黏膜病变的的可能机制, 提示幽门螺杆菌感染可能通过调控宿主细胞NF-κB信号而下调Fas-1的表达, 从而导致胃黏膜癌变, 为研究胃癌的具体发病机制进一步奠定了基础.
编辑: 郭鹏 电编:都珍珍
| 1. | Xia JT, Chen LZ, Jian WH, Wang KB, Yang YZ, He WL, He YL, Chen D, Li W. MicroRNA-362 induces cell proliferation and apoptosis resistance in gastric cancer by activation of NF-κB signaling. J Transl Med. 2014;12:33. [PubMed] [DOI] |
| 3. | Liu AQ, Ge LY, Ye XQ, Luo XL, Luo Y. Reduced FAF1 Expression and Helicobacter Infection: Correlations with Clinicopathological Features in Gastric Cancer. Gastroenterol Res Pract. 2012;2012:153219. [PubMed] [DOI] |
| 4. | 刘 爱群, 葛 莲英, 罗 小玲, 罗 元, 林 思彤. FAF1 mRNA在胃癌组织中的表达及其与幽门螺杆菌感染的相关性. 世界华人消化杂志. 2010;18:2422-2426. [DOI] |
| 5. | Shigematsu Y, Niwa T, Rehnberg E, Toyoda T, Yoshida S, Mori A, Wakabayashi M, Iwakura Y, Ichinose M, Kim YJ. Interleukin-1β induced by Helicobacter pylori infection enhances mouse gastric carcinogenesis. Cancer Lett. 2013;340:141-147. [PubMed] [DOI] |
| 7. | 冯 洁, 袁 燕玲, 刘 爱群, 葛 莲英. 幽门螺杆菌感染对人胃癌细胞HGC-27和人胃黏膜上皮细胞GES-1FAS相关因子1表达的影响. 中华实验外科杂志. 2014;31:511-513. |
| 10. | Hsieh YY, Shen CH, Huang WS, Chin CC, Kuo YH, Hsieh MC, Yu HR, Chang TS, Lin TH, Chiu YW. Resistin-induced stromal cell-derived factor-1 expression through Toll-like receptor 4 and activation of p38 MAPK/ NFκB signaling pathway in gastric cancer cells. J Biomed Sci. 2014;21:59. [PubMed] [DOI] |
| 11. | Zhang L, Ding Y, Yuan Z, Liu J, Sun J, Lei F, Wu S, Li S, Zhang D. MicroRNA-500 sustains nuclear factor-κB activation and induces gastric cancer cell proliferation and resistance to apoptosis. Oncotarget. 2015;6:2483-2495. [PubMed] |
| 12. | Hao NB, Tang B, Wang GZ, Xie R, Hu CJ, Wang SM, Wu YY, Liu E, Xie X, Yang SM. Hepatocyte growth factor (HGF) upregulates heparanase expression via the PI3K/Akt/NF-κB signaling pathway for gastric cancer metastasis. Cancer Lett. 2015;361:57-66. [PubMed] [DOI] |
| 13. | Sul JW, Park MY, Shin J, Kim YR, Yoo SE, Kong YY, Kwon KS, Lee YH, Kim E. Accumulation of the parkin substrate, FAF1, plays a key role in the dopaminergic neurodegeneration. Hum Mol Genet. 2013;22:1558-1573. [PubMed] [DOI] |
| 14. | Hyland PL, Lin SW, Hu N, Zhang H, Wang L, Su H, Wang C, Ding T, Tang ZZ, Fan JH. Genetic variants in fas signaling pathway genes and risk of gastric cancer. Int J Cancer. 2014;134:822-831. [PubMed] [DOI] |
| 15. | Perrais M, Rousseaux C, Ducourouble MP, Courcol R, Vincent P, Jonckheere N, Van Seuningen I. Helicobacter pylori urease and flagellin alter mucin gene expression in human gastric cancer cells. Gastric Cancer. 2014;17:235-246. [PubMed] [DOI] |
| 16. | Zhu BS, Xing CG, Lin F, Fan XQ, Zhao K, Qin ZH. Blocking NF-κB nuclear translocation leads to p53-related autophagy activation and cell apoptosis. World J Gastroenterol. 2011;17:478-487. [PubMed] [DOI] |