修回日期: 2016-01-03
接受日期: 2016-01-11
在线出版日期: 2016-03-28
目的: 探讨姜黄素和胃泌素受体不全拮抗剂氯丙胺对体外培养的人结肠癌肿瘤样干细胞生长增殖的抑制作用及作用机制.
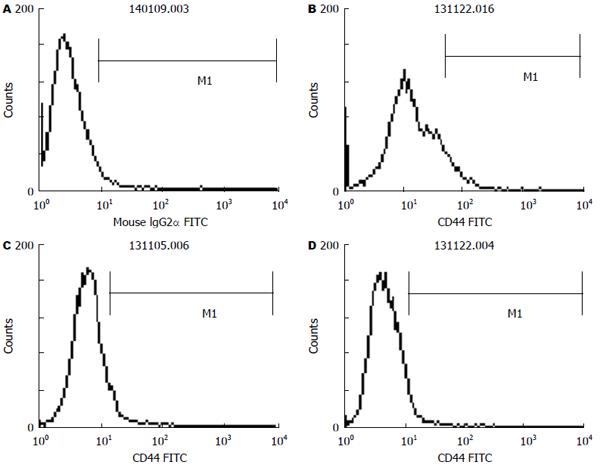
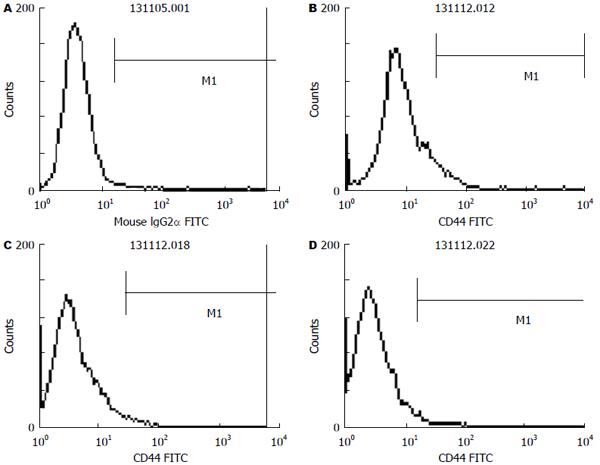
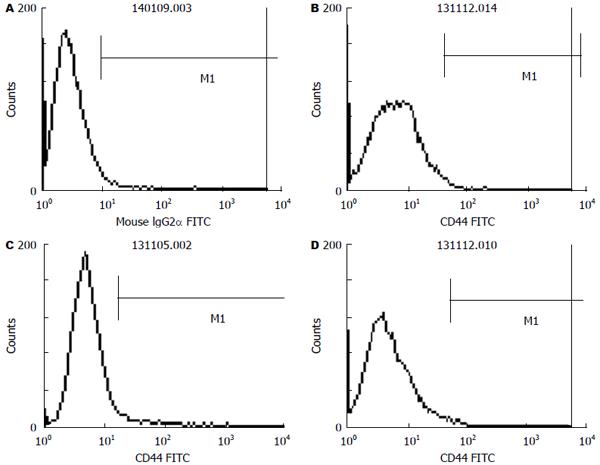
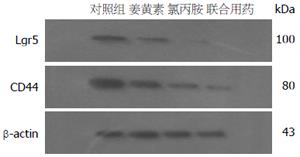
方法: 取对数生长期的结肠癌SW480细胞用10%的完全培养基继续培养48 h后, 换用无血清培养基进行同步化培养24 h, 然后进行分组: 姜黄素组、氯丙胺组、联合用药组, 每一种药物组又分为对照组、低浓度组、中浓度组、高浓度组, 联合用药组的浓度梯度依次为两药浓度的对应叠加, 继续培养48 h, 加入FITC标记的小鼠抗人CD44单克隆抗体20 μL, 同时在对照组细胞中加入同型对照抗体IgG2b 20 μL, 4 ℃避光放置30 min, 然后使用目筛网滤过, 上流式细胞仪进行检测CD44的表达变化. 采用Western blot检测Lgr5在3种不同药物浓度作用下在细胞中的蛋白表达差异.
结果: 姜黄素和氯丙胺均呈时间和剂量依赖性抑制SW480细胞的生长增殖, 且二者具有协同抑制作用; 单独应用姜黄素和氯丙胺干预时, SW480细胞增殖逐渐减慢, 数量减少, 细胞逐渐变形, 并出现崩解及死亡, 细胞中CD44蛋白质的表达较对照组有所降低, Lgr5蛋白质的表达均低于对照组, 单独用药组与对照组比较具有统计学意义(P<0.05); 二者联合应用时, CD44、Lgr5蛋白质的表达均显著降低, 而且与对照组和各单一用药组比较差异具有统计学意义(P<0.05).
结论: (1)姜黄素和氯丙胺呈剂量依赖性地抑制体外培养的人结肠癌肿瘤样干细胞的生长增殖, 且二者具有协同抑制作用; (2)姜黄素和氯丙胺可能是通过下调CD44和Lgr5分子的表达来抑制肿瘤干细胞增殖.
核心提示: 结肠癌是消化系常见的恶性肿瘤之一, 其发病率和死亡率呈不断上升的趋势, 居全球肿瘤发病率的第3位, 直到目前为止其具体发生机制尚不清楚. 本文主要阐述如何识别"肿瘤干细胞", 并对其进行相关肿瘤生物学研究.
引文著录: 谢光洪, 金海, 朱蓉, 赵逵. 姜黄素、氯丙胺对人结肠癌肿瘤样干细胞CD44、Lgr5表达的作用. 世界华人消化杂志 2016; 24(9): 1398-1404
Revised: January 3, 2016
Accepted: January 11, 2016
Published online: March 28, 2016
AIM: To investigate the synergistic effect of curcumin and gastrin receptor antagonist chloropropionic amine on the proliferation of human colon cancer stem-like cells in vitro and the possible mechanisms.
METHODS: Colon cancer SW480 cells in logarithmic growth phase were cultured in complete medium containing 10% serum for 48 h, synchronized by culturing in serum-free medium for 24 h, and then divided into three groups: a curcumin group, a chloropropionic amine group, and a combination group. Each group was further divided into a control group, low-, medium-, and high-concentration groups. After treatment, cells were cultured for another 48 h, and FITC labeled mouse anti-human CD44 monoclonal antibody was added, while the isotype control antibody IgG2b was used in the control group. After incubation at 4 ℃ for 30 min, CD44 expression was detected by flow cytometry. Western blot was used to detect the expression of Lgr5.
RESULTS: Curcumin and chloropropionic amine, alone or in combination, could inhibit SW480 cell growth and proliferation time- and dose-dependently, and they had a synergistic effect. Curcumin and chloropropionic amine alone significantly decreased CD44 and Lgr5 protein expression compared with the normal control group (P < 0.05). Chloropropionic amine combined with curcumin also significantly CD44 and Lgr5 protein expression compared with the normal control group, and the decrease was more significant in the combination group compared with either of them alone (P < 0.05).
CONCLUSION: Both curcumin and chloropropionic amine inhibit the growth and proliferation of SW480 cells time- and dose-dependently. Curcumin and chloropropionic amine may inhibit CD44 and Lgr5 expression to prevent the growth and proliferation of colon cancer stem cells.
- Citation: Xie GH, Jin H, Zhu R, Zhao K. Effect of curcumin and chloropropionic amine on expression of CD44 and Lgr5 in human colon cancer stem-like cells. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1398-1404
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1398.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1398
结肠癌是人类胃肠道常见的恶性肿瘤, 由于生活环境和饮食习惯的改变, 结肠癌发病率不断增高, 每年有数百万的人患上结肠癌[1]. 目前, 结肠癌的治疗主要以手术治疗为主, 并辅以化疗和放疗. 但是手术治疗往往由于切除不彻底, 药物和放射治疗由于特异性及敏感性差而不良反应多等缺点导致治疗效果不甚理想[2], 远没有达到人们的期望. 因此, 研究者们开始探索如何才能够尽早发现结肠肿瘤并对其进行早期有效的治疗, 甚至对其进行预防性治疗. 随着研究的深入, 20世纪末 "肿瘤干细胞"这一概念被提出. 该理论认为肿瘤可能是因为肿瘤干细胞的存在导致肿瘤治疗后很容易复发[3]. 本实验选用CD44和Lgr5作为结肠癌干细胞观察的一个窗口, 以此来探讨结肠癌的发生、发展以及药物对他的作用及作用机制, 为结肠癌肿瘤干细胞的分选和结肠癌的治疗提供一种可能的途径和依据.
人结肠癌细胞株SW480来自重庆医科大学细胞实验室(细胞编号: KCB200848YJ), 航空运输, 干冰保存, 姜黄素、氯丙胺(Sigma公司). Lgr5(Abcam公司), CD44(BD公司), CD44引物、Lgr5引物(上海生物工程服务有限公司). 人结肠癌细胞株SW480. 培养条件: 37 ℃ 50 mL/L CO2培养箱. 营养供给: 含10%胎牛血清的完全培养基和无血清培养基. 实验的细胞要求: 处于对数生长期的细胞.
取对数生长期的结肠癌SW480细胞, 用0.25%胰酶和0.02% EDTA液消化后制成单细胞悬液, 将浓度调整至2×107个/mL, 后用10%的完全培养基继续培养48 h后转移至75 cm2的培养瓶中换用无血清培养基进行同步化培养24 h, 然后进行分组: 姜黄素组、氯丙胺组、联合用药组, 每一种药物组又分为对照组、低浓度组、中浓度组、高浓度组, 姜黄素组低浓度为40 μmol/L, 中浓度为45 μmol/L, 高浓度为49 μmol/L, 氯丙胺组的低浓度为4 mmol/L, 中浓度为8 mmol/L, 高浓度为16 mmol/L, 联合用药组的浓度梯度依次为两药浓度的对应叠加, 继续培养48 h, 后用0.25%胰酶和0.02%EDTA液消化后制成单细胞悬液, 将浓度调整至2×107个/mL, 用PBS洗涤细胞2次, 向BD管中每管加入100 μL细胞悬液, 使浓度变为2×106个/mL, 加入FITC标记的小鼠抗人CD44单克隆抗体20 μL, 同时在对照组细胞中加入同型对照抗体IgG2b, 4 ℃避光放置30 min, 然后用PBS洗2遍, 洗去尚未结合的一抗, 1000 r/min离心5 min, 吸掉上清液, 各管加入200 μL PBS重悬, 然后使用目筛网滤过, 上流式细胞仪进行检测CD的表达变化. 与对照组比较, 姜黄素、氯丙胺在中浓度、高浓度作用下, CD44表达的阳性率逐渐降低, 与对照组比较有差异性, 单一用药处于低浓度时效果不明显, 联合用药作用时效果明显, 与各单一用药组相比有差异性, 差异有统计学意义(P<0.05).
统计学处理 实验数据按随机对照原则进行收集整理, 所有数据以mean±SD表示, 并采用SPSS14.0进行处理, P<0.05为差异有统计学意义.
姜黄素和氯丙胺均呈时间和剂量依赖性抑制SW480细胞的生长增殖, 且二者具有协同抑制作用; 单独应用姜黄素和氯丙胺干预时, SW480细胞增殖逐渐减慢, 数量减少, 细胞逐渐变形, 并出现崩解及死亡(图1-3).
结肠癌是消化系常见的恶性肿瘤之一, 其发病率和死亡率呈不断上升的趋势, 居全球肿瘤发病率的第3位[4], 直到目前为止其具体发生机制尚不清楚. 现在一种比较新的学说即"肿瘤干细胞"学说, 该学说认为在肿瘤细胞中存在含量极少的肿瘤干细胞, 当"某种条件"改变时他们能够分化成肿瘤细胞. 而如何识别这些"肿瘤干细胞"并对其进行相关肿瘤生物学研究即是本实验的重点.
最近研究[5]发现CD44分子是一个糖基化的细胞表面黏附分子, 在淋巴细胞, 成纤维细胞表面均能检测到他的表达, 主要参与细胞-细胞, 细胞-基质之间的特异性黏连过程. CD44+的细胞能够刺激肿瘤新生血管的生成, 促进肿瘤细胞的生长和侵袭转移, 大量的研究[6,7]发现CD44在多种肿瘤细胞中均有高表达, 其表达水平是结肠癌细胞转移潜能和预后的标志. 在SW480细胞株中CD44分子大部分存在于细胞表面, 肿瘤干细胞的百分比为10%左右. CD44+分子在肿瘤干细胞中的阳性率约为0.22%[8]. 因此本实验采用CD44抗体来分选结肠癌肿瘤样干细胞. 先用不同浓度药物作用于细胞株后, 加入FITC标记的小鼠抗人CD44单克隆抗体于分离管中, 同时在对照组细胞中加入同型对照抗体IgG2b, 通过流式细胞仪作用分选后得出CD44的变化. Lgr5是结肠癌发生密切相关的Wnt通路的靶基因[9-11]. 在关于结肠癌的研究中发现Lgr5是许多自我更新组织包括肠道和毛囊等的干细胞标志物, 许多研究[12,13]认为Lgr5可以作为结肠癌干细胞最为理想的标志物之一. Lgr5一部分存在于细胞质中, 一部分存在于细胞表面, 通过Western blot技术能够检测到所有Lgr5蛋白质的变化.
姜黄素是一种植物多酚, 从姜科植物中提取而得. 姜黄素作为食物色素和香料广泛用于食品加工业, 最新研究[14,15]发现姜黄素具有抗肿瘤、抗炎症、抗诱变等多个方面的药理作用. 由于姜黄素不良反应低, 能够明显抑制肿瘤细胞生长, 因此成为近年国际上天然药物研究的一个重要对象, 被认为是一种具有良好应用前景的抗癌化合物[16]. 本实验前期研究发现姜黄素能够抑制结肠癌细胞的生长. 氯丙胺是谷胺酸的衍生物, 是胃泌素受体的不全阻断剂, 研究证实胃泌素受体阻断剂能够阻断Wnt/β-catenin通路和COX-2/PGE2通路产生生长素样的作用促进肿瘤的生长. 该药有一很大特点是几乎无不良反应. 大量实验证实氯丙胺对结肠癌组织及细胞株均有抑制作用; 对人类结肠癌患者可延长生存期并抑制肝转移.
本实验采用体外培养的人结肠癌细胞株SW480, 首先进行细胞培养, 待其处于对数生长期后对细胞进行标记, 分别及联合应用姜黄素和氯丙胺, 采取低浓度, 中浓度, 高浓度进行干预后, 通过流式细胞仪检测SW480细胞中CD44表达增殖情况. 结果显示, 姜黄素和氯丙胺均呈剂量依赖性的抑制SW480细胞的生长增殖; 联合用药对SW480细胞的生长增殖具有协同抑制作用. 结果显示, 单一用药组Lgr5蛋白质的表达均低于阴性对照组; 姜黄素组、氯丙胺组与正常对照组之间, 联合用药组与单一用药组之间, 差异均具有统计学意义(P<0.05). 本实验证明了姜黄素和氯丙胺具有协同抑制体外培养的人结肠癌细胞株SW480生长增殖的作用, 且呈剂量依赖性; 该作用可能是通过协同抑制CD44、Lgr5的表达而实现. 随着人们对结肠癌肿瘤样干细胞研究的逐步深入, 对姜黄素生物学特性及药理作用、GAS受体拮抗剂性质的不断更新, 相信在不远的未来, 人类一定能够找到一种特异性的肿瘤干细胞标志物, 和一些不良反应很小但是可以作用于肿瘤干细胞的特效药, 那么人类攻克恶性肿瘤将会不再是一个医学界的难题.
结肠癌是人类胃肠道常见的恶性肿瘤, 目前治疗主要以手术治疗为主, 并辅以化疗和放疗. 但是手术治疗往往由于切除不彻底, 药物和放射治疗由于特异性及敏感性差而不良反应多等缺点导致治疗效果不甚理想. 随着研究的深入, 20世纪末"肿瘤干细胞"这一概念被提出, 该理论认为肿瘤可能是因为肿瘤干细胞的存在导致肿瘤治疗后很容易复发.
丁永斌, 主任医师, 南京医科大学第一附属医院普外科
最近研究发现CD44分子是一个糖基化的细胞表面黏附分子, 主要参与细胞-细胞, 细胞-基质之间的特异性黏连过程. CD44+的细胞能够刺激肿瘤新生血管的生成, 促进肿瘤细胞的生长和侵袭转移.
本文从细胞及蛋白水平探讨了姜黄素及氯丙胺在体外对结肠癌肿瘤细胞生长的影响, 结果表明姜黄素及氯丙胺对结肠癌肿瘤细胞有抑制作用, 研究有一定的临床意义.
编辑: 于明茜 电编:都珍珍
| 1. | Tenesa A, Dunlop MG. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet. 2009;10:353-358. [PubMed] [DOI] |
| 3. | Navarro-Alvarez N, Kondo E, Kawamoto H, Hassan W, Yuasa T, Kubota Y, Seita M, Nakahara H, Hayashi T, Nishikawa Y. Isolation and propagation of a human CD133(-) colon tumor-derived cell line with tumorigenic and angiogenic properties. Cell Transplant. 2010;19:865-877. [PubMed] [DOI] |
| 4. | Grizzi F, Celesti G, Basso G, Laghi L. Tumor budding as a potential histopathological biomarker in colorectal cancer: hype or hope? World J Gastroenterol. 2012;18:6532-6536. [PubMed] [DOI] |
| 5. | O'Brien CA, Pollett A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106-110. [PubMed] [DOI] |
| 6. | Bendardaf R, Algars A, Elzagheid A, Korkeila E, Ristamäki R, Lamlum H, Collan Y, Syrjänen K, Pyrhönen S. Comparison of CD44 expression in primary tumours and metastases of colorectal cancer. Oncol Rep. 2006;16:741-746. [PubMed] [DOI] |
| 7. | Bendardaf R, Elzagheid A, Lamlum H, Ristamäki R, Collan Y, Pyrhönen S. E-cadherin, CD44s and CD44v6 correlate with tumour differentiation in colorectal cancer. Oncol Rep. 2005;13:831-835. [PubMed] |
| 9. | Barker N, Huch M, Kujala P, van de Wetering M, Snippert HJ, van Es JH, Sato T, Stange DE, Begthel H, van den Born M. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 2010;6:25-36. [PubMed] [DOI] |
| 10. | Ruffner H, Sprunger J, Charlat O, Leighton-Davies J, Grosshans B, Salathe A, Zietzling S, Beck V, Therier M, Isken A. R-Spondin potentiates Wnt/β-catenin signaling through orphan receptors LGR4 and LGR5. PLoS One. 2012;7:e40976. [PubMed] [DOI] |
| 11. | Barker N, Ridgway RA, van Es JH, van de Wetering M, Begthel H, van den Born M, Danenberg E, Clarke AR, Sansom OJ, Clevers H. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 2009;457:608-611. [PubMed] [DOI] |
| 12. | Kleist B, Xu L, Li G, Kersten C. Expression of the adult intestinal stem cell marker Lgr5 in the metastatic cascade of colorectal cancer. Int J Clin Exp Pathol. 2011;4:327-335. [PubMed] |
| 13. | Takahashi H, Ishii H, Nishida N, Takemasa I, Mizushima T, Ikeda M, Yokobori T, Mimori K, Yamamoto H, Sekimoto M. Significance of Lgr5(+ve) cancer stem cells in the colon and rectum. Ann Surg Oncol. 2011;18:1166-1174. [PubMed] [DOI] |
| 16. | Kelloff GJ, Boone CW, Crowell JA, Steele VE, Lubet RA, Doody LA, Malone WF, Hawk ET, Sigman CC. New agents for cancer chemoprevention. J Cell Biochem Suppl. 1996;26:1-28. [PubMed] [DOI] |