修回日期: 2016-01-14
接受日期: 2016-01-19
在线出版日期: 2016-03-28
目的: 探讨Notch信号节点分子Hes-1以及神经元素3(neurogenin 3, Ngn3)在人脐带间充质干细胞(human umbilicalcord mesenchyreal stem cells, hUMSCs)向胰岛前体细胞分化过程中的表达变化.
方法: (1)分离培养并鉴定hUMSCs; (2)采用联合分阶段诱导法, 取P5代hUMSCs向胰岛前体细胞分化, 倒置相差显微镜观察诱导前后细胞形态变化, 免疫组织化学技术检测诱导后Insulin、Ngn3、胰高血糖素的表达; (3) 诱导后7、14、21 d分别取细胞进行免疫组织化学法、Western blot检测Hes1以及Ngn3的表达变化.
结果: hUMSCs经诱导后, 细胞胞体呈现宽大形态, 并出现胰岛前体细胞的集落, 免疫组织化学技术检测诱导后细胞Ngn3、Insulin、胰高血糖素呈阳性表达; Western blot检测Ngn3在诱导过程中逐渐升高, 诱导14 d(E2组)达到峰值, 21 d(E3组)下降; Hes1的表达7-14 d与空白对照组(CG组)无明显差异, 与21 d(E3组)下降.
结论: 在hUMSCs向胰岛前体细胞诱导过程中Notch信号通路节点分子Hes1表达改变可能参与诱导后细胞进一步分化的调节过程.
核心提示: 糖尿病的生物治疗是近年来糖尿病治疗的热点, 脐带间充质干细胞是其重要的细胞来源. 人脐带间充质干细胞(human umbilicalcord mesenchyreal stem cells, hUMSCs)可分化为具有胰岛细胞分泌功能的胰岛前体细胞, 可作为治疗糖尿病的种子选手. 在hUMSCs向胰岛前体细胞分化过程中, Notch信号通路节点分子Hes1起着至关重要的作用, 其作用机制的明确, 可为干预Notch信号通路来影响干细胞定向分化提供一定的实验资料.
引文著录: 檀梦天, 洪艳, 韩晶, 蒋鑫. Hes1在hUMSCs向胰岛前体细胞诱导过程中的表达改变. 世界华人消化杂志 2016; 24(9): 1357-1365
Revised: January 14, 2016
Accepted: January 19, 2016
Published online: March 28, 2016
AIM: To detect the expression of Hes1 during the transdifferentiation of human umbilical cord mesenchyreal stem cells (hUMSCs) into islet progenitor cells.
METHODS: After hUMSCs were isolated, cultivated and identified, hUMSCs at passage 5 were subjected staged induction to differentiate into islet precursor cells. Cell morphology was observed using an inverted phase contrast microscope. The expressions of insulin, neurogenin 3 (Ngn3) and glucagon after induction were detected by immunocytochemistry. The expression of Hes1 and Ngn3 was evaluated by immunocytochemistry and Western blot on 7 d, 14 d, and 21 d after induction.
RESULTS: After induction, HUMSCs became larger and colony-like, which is the characteristic of pancreatic progenitor cells. The expression of Ngn3, insulin and glucagon was positive. The level of Ngn3 increased gradually in the process of induction, peaked on 14 d (E2) and fell down on 21 d (E3). However, Hes1 remained unchanged from 7 d to 14 d, but was reduced on 21 d (E3).
CONCLUSION: The Notch signaling pathways' node molecule Hes1 may play an important role in the transdifferentiation of hUMSCs into islet progenitor cells.
- Citation: Tan MT, Hong Y, Han J, Jiang X. Expression of Hes1 during transdifferentiation of hUMSCs into islet progenitor cells. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1357-1365
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1357.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1357
糖尿病是以高血糖为特征的代谢性疾病, 高血糖则是由于胰岛素分泌缺陷或其生物作用受损, 或两者兼有引起. 目前的治疗手段多依赖于胰岛素治疗, 但长期使用胰岛素给患者带来较重的经济负担. 胰岛移植作为生物治疗的新型手段之一, 又存在着供体有限, 且移植后存活率低的风险[1-3]. 人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUMSCs)具有来源广泛、易于分离培养、免疫原性低且不涉及法律伦理学的优势, 使其在组织工程和细胞治疗领域具有广阔的应用前景. 如何更有效地将hUMSCs诱导为具有分泌胰岛素功能的胰岛前体细胞, 并且在糖尿病的治疗中能保持其功能的持续性, 是目前干细胞治疗面临的一个挑战[4,5]. Notch信号通路是普遍存在哺乳动物体内的经典信号通路, 活化后影响多种细胞命运的走向, Hes1是Notch信号通路下游重要的节点分子, 是目前公认的隶属碱式螺旋-回折-螺旋转录因子, 在Notch信号通路中发挥重要作用. 其在hUMSCs向胰岛前体细胞诱导的过程中作用如何, 以及是否影响胰岛前体细胞标志分子神经元素3(neurogenin 3, Ngn3)的表达是本课题的研究重点. 阐明Notch信号通路在hUMSCs向胰岛前体细胞诱导中的作用, 丰富Notch信号在细胞诱导分化中的作用, 同时也为通过干预Notch信号来影响干细胞定向诱导分化提供一定的实验资料[6-8]. 本文旨在探讨Notch信号通路节点分子Hes1在hUMSCs分化为胰岛前体细胞过程中的表达变化情况.
人脐带来源足月健康的剖宫产产儿, 由贵州医科大学附属医院产科提供, 家属同意知情. 产妇经检查无艾滋病、乙型肝炎病毒、梅毒、螺旋体、支原体等传染病原体感染情况, 血糖血压均在正常范围内. 激活素A(PEPROTECH)、内皮生长因子(epidermal growth factor, EGF)(PEPROTECH)、尼克酰胺(SIGMA)、倒置相差显微镜(C-SHG, Kikon, Japan).
1.2.1 hUMSCs分离、培养与鉴定: 取健康足月剖宫产产儿脐带, 长度约为5-10 cm, 直径约为1-2 cm, 高压灭菌的PBS溶液内放置, 4 ℃保存, 4 h内使用. 用PBS清洗干净后在超净工作台中剪成1-2 cm段状, 剥离脐动脉和分离脐静脉内皮. 将分离出的组织剪碎至1 mm3大小, 加入含有20%FBS(美国GIBCO)的DMEM/F12培养基, 浸泡1-2 min, 使用眼科镊将其转移到T25培养瓶中成阵列分布, 各组织块间间隔在5-6 mm之间, 倒置放入37 ℃、50 mL/L CO2培养箱内2 h后, 取出加入1 mL含有20%FBS的DMEM/F12培养基, 继续培养, 此后每隔1 d加入1 mL20%FBS的DMEM/F12培养基加至5 mL时停止, 隔日观察至有长梭型细胞迁移出组织块时换液. 当原代细胞铺满瓶底80%时消化传代. 传至第3-5代可进行诱导培养. 采用分阶段联合诱导法诱导, 诱导前10 d采用含10%FBS、20 ng/mL EGF的低葡萄糖培养基培养, 每隔2 d换液, 诱导后11 d采用含10%FBS、10 mmol/L尼克酰胺、10 ng/mL激活素A的高葡萄糖培养基培养, 每隔2 d换液, 共诱导21 d.
1.2.2 实验分组: 以正常传代培养的hUMSCs为空白对照组(CG); 加入诱导因子诱导第7天的为7 d实验组(E1), 14 d为14 d实验组(E2), 21 d为21 d实验组(E3).
1.2.3 免疫组织化学技术鉴定hUMSCs诱导后的胰岛前体细胞: 兔抗人Ngn3、兔抗人Inslin以及CG、E1、E2、E3各组兔抗人Hes1(CST)和鼠抗人Ngn3(ABCAM)表达, 具体操作步骤如下: 将诱导后细胞以1×104密度接种在细胞爬片上, 第2天观察细胞贴壁且细胞形态好, PBS洗后4%多聚甲醛固定细胞30 min后, 使用0.5%TritonX-100进行细胞膜表面打孔, 3%的H2O2室温作用20 min灭活细胞内源性酶, 山羊血清(1:100)封闭20 min后加入一抗, 4 ℃湿盒孵育过夜; 次日取出室温复温后加入二步法免疫组织化学检测试剂(PV-6001/PV-6002)置于37 ℃烤箱20 min, 加入1‰稀释的DAB显色5-10 min, 蒸馏水终止显色, 倒置相差显微镜下观察采集图像.
1.2.4 Western blot检测各组Hes1以及Ngn3表达情况: 具体操作如下: RIPA裂解液裂解六孔板内的细胞收集离心, 上清为总蛋白; 采用BCA法在核酸蛋白定量分析仪上测定出上清样品OD值, 根据蛋白计算公式计算出蛋白浓度; 根据浓度制备20 μL样品体系; SDS-PAGE凝胶电泳; 转膜; 封闭2-4 h后用TBS-T洗涤加入一抗Ngn3、Hes1后4 ℃过夜; 次日取出TBS-T洗涤后加入辣根过氧化物酶标记IgA(北京鼎国)室温孵育后加入化学发光底物, 使用凝胶成像仪曝光系统, 检测蛋白表达.
统计学处理 运用SPSS20.0建立数据库并进行统计分析, 数据符合参数检验条件, 用mean±SD进行统计描述, 多组均数间的比较用方差分析, 两两比较用LSD法; 数据不符合参数检验的条件, 且经变量变换, 仍不符合, 采用秩和检验; 检验水准α = 0.05, P<0.05为差异有统计学意义.
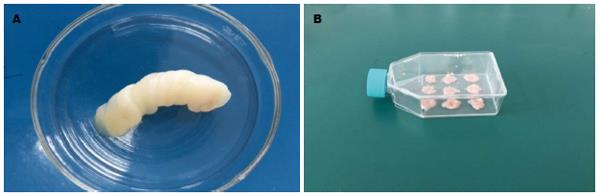
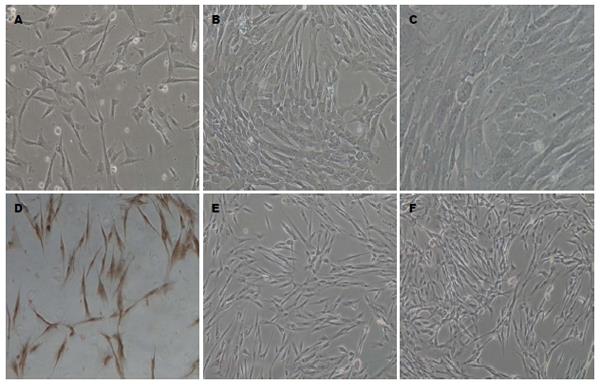
取足月产儿脐带(图1A), 剪碎植入T25培养瓶中(图1B)培养. 续培养1 d后观察, 有脐带间充质干细胞从组织块中迁移出来(图2A), 消化传代至第5代后观察细胞成鱼群状生长, 胞体呈长梭型(图2B, C).
免疫组织化学法显示诱导21 d后hUMSCs内Ngn3(图3A), Inslin(图3B), 胰高血糖素(图3C), 空白对照组(图3D)表达情况如下: 诱导后21 d, hUMSCs分化为胰岛前体细胞, 细胞贴壁生长, 胞体由长梭型逐渐变得宽大, 核圆染色明显, 经免疫组织化学术鉴定Ngn3阳性(图3A), 胞质与胞核均有棕黄染色, 同时胰岛素(图3B)和胰高血糖素(图3C)均有阳性表达, 胞质棕黄色, 空白对照组未着色(图3D).
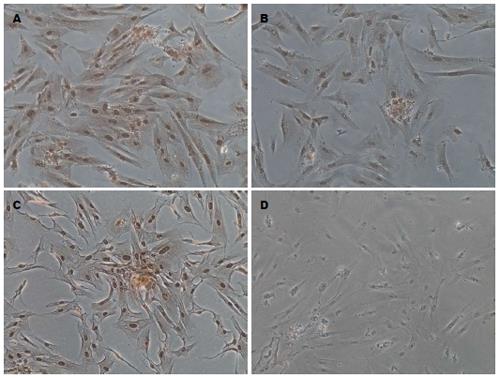
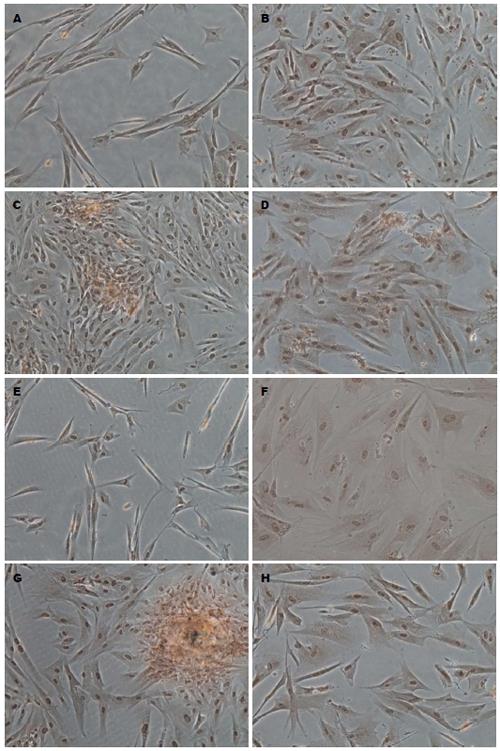
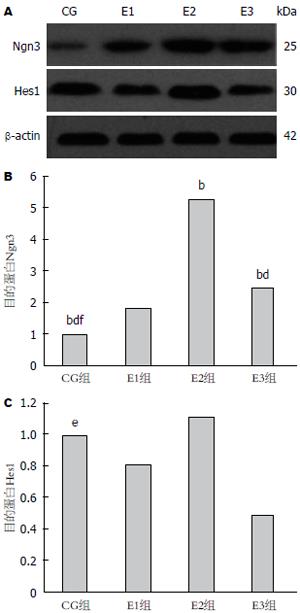
细胞贴壁生长后可见胞体逐渐变得宽大, 呈多边形, 核大, 卵圆形, 核仁明显; CG组Ngn3染色较浅(图4A), E1组逐渐加深(图4B)E2组染色最深(图4C), E3(图4D)略浅. Hes1的CG组(图4E)表达如图显示胞质呈黄色, E2(图4G)组达到峰值, E3组(图4H)降低明显, 染色浅淡.
Ngn3的蛋白表达量随诱导时间延长, 表达量逐渐增高, 于14 d(E2)时数量达到最多, 21 d减少; Hes1的蛋白表达量在CG组较高, E3组表达量下降(表1, 图5).
| 分组 | 目的蛋白Ngn3 | 目的蛋白Hes1 | ||
| Mean | SD | Mean | SD | |
| CG | 1.000 | 0.419 | 1.000 | 0.348 |
| E1 | 1.832 | 0.364 | 0.814 | 0.581 |
| E2 | 5.269 | 0.795 | 1.118 | 0.298 |
| E3 | 2.462 | 0.317 | 0.489 | 0.356 |
本实验采用组织块分离培养方法[9], 分离培养出脐带间充质干细胞, 经免疫组织化学术鉴定, 膜表面分子CD105呈阳性表达, 膜表面分子CD45与CD34呈阴性表达. 通过采取联合分阶段诱导, 成功将hUMSCs分化为胰岛前体细胞, 细胞由干细胞的长梭型形态变为胞体宽大的胰岛前体细胞, 免疫组织化学术鉴定有胰岛素以及胰高血糖素表达, 而胰高血糖素的表达在前期学者研究中鲜有报道, 诱导分化后的胰岛前体细胞存在胰高血糖素的表达, 为进一步体内细胞移植后维持自身血糖稳定提供理论支持.
Ngn3及其转录调控网络调控着胰腺内分泌的发育, 对胰岛形成、成熟胰岛细胞命运的维持起着重要调控作用. 胰腺内分泌的发育, 依赖一系列的转录因子所形成的调控网络作用[9]. 在胰腺内分泌发育过程中, Pdx-1蛋白通过特异性结合Ngn3基因上游启动子调控Ngn3阳性细胞中Ngn3基因的表达, Ngn3基因编码的Ngn3蛋白能调控一系列转录因子基因, 如NuroD1、INSM1、Islet-1和INSM2等的表达, 这些转录因子及其蛋白通过复杂的网络调控胰腺内分泌发育和胰岛的形成[10]. Ngn3被认为是胰腺祖细胞的标志蛋白, 常被作为干细胞向胰岛前体细胞分化的标志分子[11-13]. 本实验中Ngn3的蛋白表达量随诱导时间延长Ngn3表达量逐渐增高, 推测在诱导微环境作用下体外培养的hUMSCs分化形成胰岛前体细胞数量逐渐增多, 于14 d(E2)时数量达到最多, 21 d减少, 同时免疫组织化学术检测也证实诱导21 d细胞胞质中均存在胰岛素和胰高血糖素阳性表达, 故推测胰岛前体细胞数量减少的可能原因是胰岛前体细胞进一步分化成为成熟的且具有分泌功能胰岛A细胞或B细胞.
干细胞在诱导分化中受多种信号的影响, 如Notch、WNT、MAPK、raf等, 特别是Notch信号. Notch信号通路是一条经典的信号途径, 在干细胞向胰岛前体细胞诱导过程中有重要作用[14-17]. 在诸多组织的前体细胞(神经组织、肌肉组织、表皮组织)中, Notch信号具有调节细胞更新和分化的作用[18,19]. Notch信号通路也参与脐带间充质干细胞的诱导分化, 但hUMSCs在向胰岛前体细胞诱导分化过程中Notch信号通路的作用机制尚未阐明[18]. Hes1属于bHLH基因家族, 是Notch通路激活后的靶基因, 有抑制下游Mash1、Ngn2等促神经元分化基因的表达作用, 同时有促进神经前体细胞向星型胶质细胞方向的分化的作用[16-18]. 另有研究[10,19,20]表明, 胰腺祖细胞中Notch信号通路会受到抑制基因Hes1表达降低的同时, Ngn3表达增高. Notch信号依赖的分子网络在平衡胰腺祖细胞向内分泌细胞和导管上皮细胞的分化过程中起重要作用. 其一直被认为在胰腺发育过程中能抑制胰腺祖细胞的分化进程[21,22].
本实验选取Notch信号通路下游经典节点分子Hes1与胰岛前体细胞标志分子Ngn3为研究目标, 分别从形态学、蛋白水平来分析探讨他们的变化以及对hUMSCs向胰岛前体细胞分化的影响. 实验结果显示, Hes1的蛋白表达量在CG组较高, 证明了Notch信号在干细胞的表达是普遍存在的, E3组表达量下降, 与各组比较有显著差异性, 同时免疫组织化学可见其形态学变化与蛋白表达一致; Ngn3与Hes1的表达变化是存在内在联系的, 用基因敲除技术敲除Notch信号通路中部分组成成分的DNA序列发现, Notch信号通路受阻显著增加了未成年小鼠骨小梁的骨量, 而在含有高骨量的小鼠骨髓中检测不到间充质祖细胞, 随着年龄增加, 他们可患上严重的骨质疏松. 这可能是由Notch信号通过下游靶基因产生的Hes等蛋白来抑制间充质祖细胞分化[10,23]. 另有学者报道[24,25], 对Notch信号通路进行阻断后, Ngn3表达量明显提高, 这与本实验对诱导后细胞检测Ngn3以及Hes1表达变化的结果基本一致, 由此推测Hes1表达对胰岛前体细胞形成的标志分子Ngn3的表达可能有抑制作用. hUMSCs向胰岛前体细胞诱导过程中, Notch信号通路的调节机制十分复杂, 除Notch信号通路自身活化调节细胞增殖、分化、凋亡外还受到其他信号通路协同调节作用(如Wnt、BMP、FGF等信号通路)[24-27]. Notch信号通路可以被γ-分泌酶抑制剂DAPT阻断, 实验[9,10,28-30]证明, 鼠多能干细胞在添加阻断剂后Notch1表达量下降. 因此, 为优化hUMSCs诱导条件以及更好的培养出具有胰岛素分泌功能的胰岛前体细胞, 本课题组将在后期对hUMSCs向胰岛前体细胞分化过程中加入Notch信号通路抑制剂DAPT, 对Notch信号通路与Ngn3的变化关系做进一步研究.
Notch信号通路是普遍存在哺乳动物体内的经典信号通路, 活化后影响多种细胞命运的走向. 在诸多组织的前体细胞(神经组织、肌肉组织、表皮组织)中, Notch信号具有调节细胞更新和分化的作用. 胰腺祖细胞中Notch信号通路会受到抑制基因Hes1表达降低的同时, 神经元素3(neurogenin 3, Ngn3)表达增高. Notch信号依赖的分子网络在平衡胰腺祖细胞向内分泌细胞和导管上皮细胞的分化过程中起重要作用. 其一直被认为在胰腺发育过程中能抑制胰腺祖细胞的分化进程.
徐庆, 教授, 桂林医学院药理教研室
相关文献涉及脐带间充质干细胞向胰岛前体细胞诱导的分子机制报道较少. 本文着重介绍了Notch信号通路节点分子Hes1与胰岛前体细胞标志分子Ngn3的关系, 并讨论其在人脐带间充质干细胞(human umbilicalcord mesenchyreal stem cells, hUMSCs)向胰岛前体细胞的分化中的相关问题. Hes1的表达对Ngn3的表达可能存在的抑制作用对日后获得更多具有Ngn3阳性的胰岛前体细胞有着重要意义. 阻断Notch信号通路后Hes1与Ngn3的表达成为下一步亟待研究的问题.
有研究报道在胰腺中Notch信号转录可增加效应蛋白Hes1表达和/或抑制表达bHLH蛋白的转录. Ngn3基因具有多个Hes1结合的靶位点并且可以被Hes1抑制, 这表明他可能是一个Notch的靶基因.
本文采用免疫组织化学和蛋白印迹法分阶段观察hUMSCs向胰岛前体细胞的分化中形态学和分子水平Hes1与Ngn3的分阶段表达情况, 证明二者存在相互影响. 同时通过免疫组织化学证明胰岛前体细胞有胰岛素分泌的同时还要胰高血糖素的分泌.
本文证明了胰岛前体细胞具有分泌胰岛素功能的同时还要胰高血糖素的分泌为胰岛前体细胞进一步分化为成熟的胰岛A或B细胞提供理论支持. Hes1与Ngn3的分阶段表达情况可作为将来阻断Notch信号通路的重要依据.
间充质干细胞: 是一种具有自我复制能力和多向分化潜能的成体干细胞, 这种干细胞能够发育成硬骨、软骨、脂肪和其他类型的细胞. hUMSCs则是来源于人脐带组织具有自我复制和多向分化能力的干细胞; γ-分泌酶抑制剂: γ-分泌酶是Notch信号通路受体裂解产生胞内段NICD的关键酶, γ-分泌酶抑制剂可以有效阻断Notch信号通路中DICD的产生, 从而阻断Notch信号通路.
本文采用人脐带组织培养方法获得hUMSCs, 研究了Hes1在hUMSCs向胰岛前体细胞诱导过程中的表达改变. 说明在人脐带间充质干细胞向胰岛前体细胞诱导过程中Notch信号通路节点分子Hes1表达改变可能参与诱导后细胞进一步分化的调节过程. 总体评价为实验设计合理, 方法可靠, 结论可信, 对糖尿病的细胞治疗有一定的意义.
编辑: 于明茜 电编:都珍珍
| 1. | Liu S, Yuan M, Hou K, Zhang L, Zheng X, Zhao B, Sui X, Xu W, Lu S, Guo Q. Immune characterization of mesenchymal stem cells in human umbilical cord Wharton's jelly and derived cartilage cells. Cell Immunol. 2012;278:35-44. [PubMed] [DOI] |
| 2. | Li DR, Cai JH. Methods of isolation, expansion, differentiating induction and preservation of human umbilical cord mesenchymal stem cells. Chin Med J (Engl). 2012;125:4504-4510. [PubMed] |
| 3. | Bongso A, Fong CY. The therapeutic potential, challenges and future clinical directions of stem cells from the Wharton's jelly of the human umbilical cord. Stem Cell Rev. 2013;9:226-240. [PubMed] [DOI] |
| 4. | Manochantr S, U-pratya Y, Kheolamai P, Rojphisan S, Chayosumrit M, Tantrawatpan C, Supokawej A, Issaragrisil S. Immunosuppressive properties of mesenchymal stromal cells derived from amnion, placenta, Wharton's jelly and umbilical cord. Intern Med J. 2013;43:430-439. [PubMed] [DOI] |
| 5. | Anzalone R, Lo Iacono M, Loria T, Di Stefano A, Giannuzzi P, Farina F, La Rocca G. Wharton's jelly mesenchymal stem cells as candidates for beta cells regeneration: extending the differentiative and immunomodulatory benefits of adult mesenchymal stem cells for the treatment of type 1 diabetes. Stem Cell Rev. 2011;7:342-363. [PubMed] [DOI] |
| 6. | Perdigoto CN, Bardin AJ. Sending the right signal: Notch and stem cells. Biochim Biophys Acta. 2013;1830:2307-2322. [PubMed] [DOI] |
| 7. | Mohr OL. Character changes caused by mutation of an entire region of a chromosome in drosophila. Genetics. 1919;4:275-282. [PubMed] |
| 8. | Maillard I, Koch U, Dumortier A, Shestova O, Xu L, Sai H, Pross SE, Aster JC, Bhandoola A, Radtke F. Canonical notch signaling is dispensable for the maintenance of adult hematopoietic stem cells. Cell Stem Cell. 2008;2:356-366. [PubMed] [DOI] |
| 10. | Mendelson A, Frenette PS. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nat Med. 2014;20:833-846. [PubMed] [DOI] |
| 11. | Li HJ, Kapoor A, Giel-Moloney M, Rindi G, Leiter AB. Notch signaling differentially regulates the cell fate of early endocrine precursor cells and their maturing descendants in the mouse pancreas and intestine. Dev Biol. 2012;371:156-169. [PubMed] [DOI] |
| 12. | Gradwohl G, Dierich A, LeMeur M, Guillemot F. neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proc Natl Acad Sci U S A. 2000;97:1607-1611. [PubMed] [DOI] |
| 13. | Greenwood AL, Li S, Jones K, Melton DA. Notch signaling reveals developmental plasticity of Pax4(+) pancreatic endocrine progenitors and shunts them to a duct fate. Mech Dev. 2007;124:97-107. [PubMed] [DOI] |
| 14. | Kawai T, Takagi N, Nakahara M, Takeo S. Changes in the expression of Hes5 and Mash1 mRNA in the adult rat dentate gyrus after transient forebrain ischemia. Neurosci Lett. 2005;380:17-20. [PubMed] [DOI] |
| 15. | Hald J, Hjorth JP, German MS, Madsen OD, Serup P, Jensen J. Activated Notch1 prevents differentiation of pancreatic acinar cells and attenuate endocrine development. Dev Biol. 2003;260:426-437. [PubMed] [DOI] |
| 16. | Kopinke D, Brailsford M, Pan FC, Magnuson MA, Wright CV, Murtaugh LC. Ongoing Notch signaling maintains phenotypic fidelity in the adult exocrine pancreas. Dev Biol. 2012;362:57-64. [PubMed] [DOI] |
| 17. | Kopinke D, Brailsford M, Shea JE, Leavitt R, Scaife CL, Murtaugh LC. Lineage tracing reveals the dynamic contribution of Hes1+ cells to the developing and adult pancreas. Development. 2011;138:431-441. [PubMed] [DOI] |
| 18. | Androutsellis-Theotokis A, Leker RR, Soldner F, Hoeppner DJ, Ravin R, Poser SW, Rueger MA, Bae SK, Kittappa R, McKay RD. Notch signalling regulates stem cell numbers in vitro and in vivo. Nature. 2006;442:823-826. [PubMed] [DOI] |
| 19. | Bjerknes M, Cheng H. Neurogenin 3 and the enteroendocrine cell lineage in the adult mouse small intestinal epithelium. Dev Biol. 2006;300:722-735. [PubMed] [DOI] |
| 20. | Cras-Méneur C, Li L, Kopan R, Permutt MA. Presenilins, Notch dose control the fate of pancreatic endocrine progenitors during a narrow developmental window. Genes Dev. 2009;23:2088-2101. [PubMed] [DOI] |
| 21. | Jin K, Minami M, Lan JQ, Mao XO, Batteur S, Simon RP, Greenberg DA. Neurogenesis in dentate subgranular zone and rostral subventricular zone after focal cerebral ischemia in the rat. Proc Natl Acad Sci U S A. 2001;98:4710-4715. [PubMed] |
| 22. | Oropeza D, Horb M. Transient expression of Ngn3 in Xenopus endoderm promotes early and ectopic development of pancreatic beta and delta cells. Genesis. 2012;50:271-285. [PubMed] [DOI] |
| 23. | Edri R, Yaffe Y, Ziller MJ, Mutukula N, Volkman R, David E, Jacob-Hirsch J, Malcov H, Levy C, Rechavi G. Analysing human neural stem cell ontogeny by consecutive isolation of Notch active neural progenitors. Nat Commun. 2015;6:6500. [PubMed] [DOI] |
| 24. | Rodriguez M, Choi J, Park S, Sockanathan S. Gde2 regulates cortical neuronal identity by controlling the timing of cortical progenitor differentiation. Development. 2012;139:3870-3879. [PubMed] |
| 25. | Zamurovic N, Cappellen D, Rohner D, Susa M. Coordinated activation of notch, Wnt, and transforming growth factor-beta signaling pathways in bone morphogenic protein 2-induced osteogenesis. Notch target gene Hey1 inhibits mineralization and Runx2 transcriptional activity. J Biol Chem. 2004;279:37704-37715. [PubMed] [DOI] |
| 26. | Crawford TQ, Roelink H. The notch response inhibitor DAPT enhances neuronal differentiation in embryonic stem cell-derived embryoid bodies independently of sonic hedgehog signaling. Dev Dyn. 2007;236:886-892. [PubMed] |
| 27. | Liu Y, Li P, Liu K, He Q, Han S, Sun X, Li T, Shen L. Timely inhibition of Notch signaling by DAPT promotes cardiac differentiation of murine pluripotent stem cells. PLoS One. 2014;9:e109588. [PubMed] [DOI] |
| 28. | Duncan AW, Rattis FM, DiMascio LN, Congdon KL, Pazianos G, Zhao C, Yoon K, Cook JM, Willert K, Gaiano N. Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance. Nat Immunol. 2005;6:314-322. [PubMed] |
| 29. | Anderson AC, Robey EA, Huang YH. Notch signaling in lymphocyte development. Curr Opin Genet Dev. 2001;11:554-560. [PubMed] |