修回日期: 2016-02-22
接受日期: 2016-02-29
在线出版日期: 2016-03-28
目的: 观察蓝莓对免疫性肝纤维化大鼠肝组织微管相关蛋白轻链3(microtubule-associated protein 1 light chain 3, LC3)及Beclin1表达的影响.
方法: 60只健康♂SD大鼠随机分为正常对照组、模型组、蓝莓原浆高剂量组、蓝莓原浆中剂量组、蓝莓原浆低剂量组及复方鳖甲软肝片组. 除正常对照组外, 其余各组均采用腹腔注射无菌猪血清复制大鼠肝纤维化模型. 造模同时各蓝莓组给予不同浓度蓝莓原浆(0.25 mL/100 g、0.5 mL/100 g、1.0 mL/100 g)灌胃, 复方鳖甲软肝片组用复方鳖甲软肝片灌胃(0.054 g/100 g), 1次/d. 12 wk处死大鼠, 测定血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)含量, 行肝组织病理学检查; Western blot检测LC3-Ⅱ、Beclin1、Ⅰ型胶原(ColⅠ)的蛋白水平; 实时定量PCR(real-time quantitative PCR, qRT-PCR)检测LC3-Ⅱ、Beclin1的mRNA水平.
结果: 各组大鼠血清ALT、AST水平差异无统计学意义(均P>0.05). 与正常对照组比较, 模型组肝纤维化程度明显(P<0.05), LC3-Ⅱ、Beclin1的mRNA及蛋白表达、ColⅠ的蛋白表达明显增高(均P<0.01). 与模型组比较, 蓝莓原浆高、中剂量组肝纤维化程度明显减轻(P<0.05), 胶原表达减少; LC3-Ⅱ、Beclin1的mRNA、蛋白表达及ColⅠ的蛋白表达明显降低(均P<0.01).
结论: 猪血清所致的大鼠免疫性肝纤维化中自噬相关蛋白LC3-Ⅱ、Beclin1升高, 蓝莓对大鼠免疫性肝纤维化的干预作用可能与下调LC3和Beclin1的基因及蛋白表达, 进而抑制自噬有关.
核心提示: 最新研究表明自噬为肝星状细胞的活化提供能量从而促进肝纤维化的发生, 本研究发现蓝莓通过抑制自噬相关标志性蛋白的表达来发挥对肝纤维化的干预作用.
引文著录: 丁艳菊, 陆爽, 吴君, 程明亮. 蓝莓对肝纤维化大鼠肝组织自噬相关蛋白LC3和Beclin1表达的影响. 世界华人消化杂志 2016; 24(9): 1321-1330
Revised: February 22, 2016
Accepted: February 29, 2016
Published online: March 28, 2016
AIM: To investigate the effect of blueberry on microtubule-associated protein 1 light chain 3 (LC3) protein and Beclin1 expression in liver tissue of rats with hepatic fibrosis.
METHODS: Sixty male SD rats were randomly divided into a normal control group, a hepatic fibrosis model group, high-, medium-, and low-dose blueberry treatment groups, and a Fufang Biejia Ruangan tablet treatment group. Except the normal control group, hepatic fibrosis was induced in other groups by intraperitoneal injection of porcine serum. Simultaneously, rats in blueberry treatment groups and Fufang Biejia Ruangan tablet treatment group were, respectively, given oral blueberry juice at a dose of 0.25 mL/100 g, 0.5 mL/100 g, and 1.0 mL/100 g, and Fufang Biejia Ruangan tablet (0.054 g/100 g) daily. All rats were killed at the end of the 12th week. Serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were measured. Pathological changes in the hepatic tissue were evaluated by hematoxylin-eosin (HE) and Masson staining. The expression of LC3-Ⅱ and Beclin1 was examined by Western blot and qRT-PCR. The expression of collagen Ⅰ (Col Ⅰ) were examined by Western blot.
RESULTS: Serum levels of ALT and AST had no significant differences in all the groups (P > 0.05). Compared with the normal control group, the expression of LC3-Ⅱ, Beclin1 and Col Ⅰ were significantly higher (P < 0.01) in the hepatic fibrosis model group, and the pathological stages of hepatic fibrosis were significantly aggravated. Compared with the hepatic fibrosis model group, the expressions of LC3-Ⅱ, Beclin1 and Col Ⅰ were significantly lower (P < 0.01), and the pathological stages of hepatic fibrosis were significantly reduced in the high- and medium-dose blueberry treatment groups (P < 0.05).
CONCLUSION: The expression of LC3-Ⅱ and Beclin1 increases in rats with hepatic fibrosis. The inhibitory effects of blueberry on hepatic fibrosis may be achieved by lowering the expression of LC3-Ⅱ and Beclin1 and then inhibiting autophagy.
- Citation: Ding YJ, Lu S, Wu J, Cheng ML. Effect of blueberry on microtubule-associated protein 1 light chain 3 protein and Beclin1 expression in liver tissue of rats with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1321-1330
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1321.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1321
肝纤维化是细胞外基质(extracellular matrix, ECM)合成与降解失衡的动态过程, 其中心环节是肝星状细胞(hepatic stellate cells, HSC)的活化[1]. 氧化应激参与了肝纤维化过程中ECM的沉积、HSC的活化等多个重要过程[2]. 且氧化应激可以激活自噬[3]. 最新的研究[4,5]表明自噬对肝纤维化的作用是双重的: 可通过调节脂滴代谢为HSC的活化提供能量, 另一方面可通过抑制肝脏的炎症来减轻肝纤维化, 但从目前实验研究[6]来看, 对肝纤维化的促进作用可能起主导地位. 因此自噬作为一种新的信号通路, 可能会成为治疗肝纤维化新的靶点. 蓝莓属杜鹃花科越桔属, 小浆果类蓝色水果, 富含花青素、酚酸类和类黄酮类等生物活性物质, 具有强抗氧化性, 可以防止脑神经老化、保护肝脏、抗炎、提高免疫力[7]. 本课题组前期研究[8-12]证明蓝莓可以提高机体抗氧化应激能力, 通过抑制HSC的活化、增殖等多途径对大鼠肝纤维化有一定的干预作用, 但具体机制不明, 为此我们设想蓝莓可能通过其抗氧化作用调节自噬从而发挥其抗肝纤维化作用. 因此本研究建立了免疫性肝纤维化大鼠模型, 探讨自噬在免疫性肝纤维化中所起的作用及蓝莓对其影响, 进一步探讨蓝莓对大鼠免疫性肝纤维化干预作用的机制.
蓝莓: 兔眼品种, 由贵州省麻江县蓝莓生产基地提供, -20 ℃储存, 使用时鲜榨汁. 复方鳖甲软肝片(批号: 20150122)由内蒙古福瑞中蒙药科技股份有限公司生产. 无菌猪血清购自北京燕生政博生物科技有限公司(批号: 141105). 实验动物: 健康♂SD大鼠60只, 体质量180 g±20 g, 购自贵州医科大学动物实验中心[动物批号: SYXK(黔)2015-0001], 室温下普通饲料喂养, 自然采光, 自由饮水, 实验前适应性喂养1 wk. 主要试剂: Maxima SYBR Green/ROX qPCR、RevertAidTirst Strand cDNA Synthesis Kit均购自ThermoScientic公司; LC3-Ⅱ、Beclin1、β-actin引物购自上海生工生物工程有限公司; 引物序列: β-actin, 上游引物: 5'-CTGAACCCTAAGGCCAACCG-3', 下游引物: 5'-GACCAGAGGCATACAGGGACAA-3'; LC3-Ⅱ, 上游引物: 5'-CGGGTTGAGGAGACACACAA-3'; 下游引物: 5'-ATGAGCCGGACATCTTCCAC-3'; Beclin1, 上游引物: 5'-GAATGGAGGGGTCTAAGGCG-3', 下游引物: 5'-TCTTCCTCCTGGCTCTCTCC-3'; LC3-Ⅱ抗体(Cell signaling公司); Beclin1抗体(Santa Cruz公司); ColⅠ抗体(武汉博士德); β-actin抗体、羊抗兔二抗(Abmart公司); BCA蛋白定量试剂盒(碧云天生物公司); ECL化学发光试剂(百乐公司). 主要仪器: 核酸定量仪(Amersham GeneQant™280); 实时定量PCR(real-time quantitative PCR, qRT-PCR)检测仪(Applied Biosystems); 高速低温离心机(sigma3K15); MSS全波长酶标仪(BioTek, ELX808); 电泳仪(Bio-rad).
1.2.1 动物分组及处理: 60只♂SD大鼠适应性喂养1 wk后, 随机分为正常对照组(A组)、模型组(B组)、蓝莓原浆高剂量组(C组)、蓝莓原浆中剂量组(D组)、蓝莓原浆低剂量组(E组)及复方鳖甲软肝片组(F组), 除A组外, 其余各组每周二、五腹腔注射无菌猪血清, 0.5 mL/只, 正常组腹腔注射等量生理盐水, 造模同时C、D、E组分别每天给予蓝莓原浆0.25 mL/100 g、0.5 mL/100 g、1.0 mL/100 g灌胃, F组每天给予复方鳖甲软肝片(0.054 g/100 g)灌胃, A组和B组给予等量生理盐水灌胃, 共12 wk[11]. 12 wk末股动脉放血处死大鼠, 常规留取血清, 取相同部位肝组织用40 g/L中性甲醛固定, 石蜡包埋, 行HE和Masson染色, 并参照文献[13]进行分期. 剩余肝组织-80 ℃保存. 用生化分析仪按试剂盒要求检测血清丙氨酸转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST).
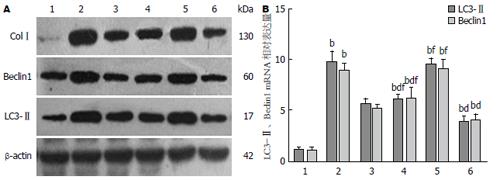
1.2.2 Western blot检测各组大鼠肝组织ColⅠ、LC3-Ⅱ和Beclin1的表达: 按照试剂盒说明书提取蛋白并定量. 取蛋白质样品40 μg, 12%SDS-PAGE电泳, 转膜, 5%脱脂奶粉封闭, 一抗LC3-Ⅱ(1:2000)、Beclin1(1:1000)、ColⅠ(1:500) 4 ℃孵育过夜, 二抗(1:15000)室温摇床孵育2 h, ECL曝光显影, Gel Doc EQ凝胶成像仪扫描, Quantity One软件分析结果. 以β-actin作为内参照, 目标蛋白表达量用其蛋白灰度值与内参蛋白灰度值的比值表示.
1.2.3 qRT-PCR检测大鼠肝组织LC3-Ⅱ和Beclin1的mRNA水平: 采用TRIzol试剂盒提取肝组织总RNA, 测定RNA浓度及纯度. 分别取2000 ng总RNA逆转录成cDNA后加入引物进行PCR扩增, 以β-actin看家基因作为内参照. 每组样本相同条件下重复3孔, 得到每个PCR反应的循环域(Ct)值, 用2-△△Ct值计算各组大鼠LC3-Ⅱ和Beclin1的相对表达量.
统计学处理 采用SPSS19.0统计软件进行数据分析, 计量资料用mean±SD表示; 多组间比较采用单因素方差分析, 分析前先检查方差齐性, 方差齐时采用LSD法, 不齐时采用Tamhane's法; 等级资料采用秩和检验, P<0.05为差异有统计学意义.
与A组对比, B、C、D、E、F组血清ALT、AST水平升高, 差异无统计学意义; 与B组比较, C、D、E、F组血清ALT、AST水平均降低, 差异无统计学意义; 其他各组间差异均无统计学意义(表1).
| 分组 | ALT(U/L) | AST(U/L) | 肝纤维化分期(S) | 平均秩次 | ||||||
| 0 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | ||||
| A组 | 57.44±12.06 | 143.50±20.22 | 9 | 1 | 0 | 0 | 0 | 0 | 0 | 5.70 |
| B组 | 66.48±7.65 | 160.66±23.69 | 0 | 0 | 0 | 0 | 2 | 4 | 4 | 50.20a |
| C组 | 61.59±7.99 | 145.35±28.64 | 0 | 0 | 3 | 4 | 2 | 1 | 0 | 29.80ace |
| D组 | 61.77±13.37 | 156.35±28.66 | 0 | 0 | 3 | 3 | 3 | 1 | 0 | 30.85ace |
| E组 | 66.29±8.62 | 159.90±28.32 | 0 | 0 | 0 | 0 | 3 | 3 | 4 | 47.40ae |
| F组 | 60.91±15.99 | 143.62±23.64 | 0 | 4 | 3 | 3 | 0 | 0 | 0 | 19.05ac |
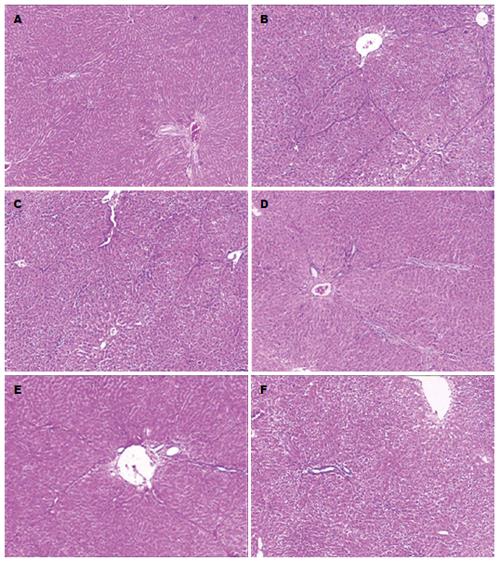
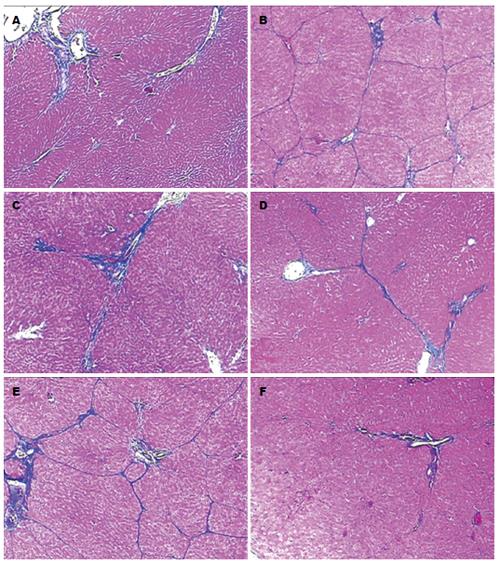
HE染色结果显示: A组大鼠肝脏组织结构正常, 肝小叶结构清楚, 肝细胞以中央静脉为中心呈放射状分布, 汇管区及肝组织内无胶原纤维增生; B组大鼠肝实质广泛被破坏, 肝小叶结构破坏消失, 汇管区纤维组织增生, 胶原纤维形成纤维条索向肝实质延伸形成纤维间隔, 分割并破坏肝小叶, 部分甚至有假小叶形成; E组与B组几乎无差异; C组、D组及F组肝纤维化程度明显减轻, 且F组较C、D组肝纤维化程度轻. Masson染色见A组大鼠肝组织汇管区有少量蓝色胶原纤维; B组大鼠肝组织胶原纤维明显增生、宽大, 延伸分布于肝小叶内, 肝小叶结构破坏, 甚者有假小叶形成; E与B组胶原纤维表达无明显差异; C、D、F组大鼠增生的胶原纤维明显减少、变细, 部分向肝小叶延伸; 且F组较C、D、E组胶原纤维减少(表1, 图1, 2).
与A组比较, B组肝组织LC3-Ⅱ、Beclin1的mRNA及蛋白表达明显增高(P<0.01); 与B组比较, C组、D组和F组LC3-Ⅱ、Beclin1的mRNA及蛋白表达均明显降低(P<0.01); B与E组间无统计学差异; F组与C、D、E组间均有统计学差异(P<0.01)(表2, 图3).
自噬是一种维持细胞内稳态的代谢过程, 通过与溶酶体结合将细胞内受损的或多余的细胞器降解成氨基酸、游离脂肪酸及其他小分子, 用于物质和能量循环[14]. 在营养不足、缺氧、缺血/再灌注损伤和某些细胞应激反应等情况下, 氧化应激和活性氧的积累可以激活自噬的发生[15]. 自噬有两种特异性标记蛋白: LC3和Beclin1. LC3有Ⅰ型、Ⅱ型之分, 自噬发生时, LC3-Ⅰ转变为LC3-Ⅱ, 其数量多少与自噬泡的数量成正比[16]. Beclin1是酵母Atg6的同系物, 也是哺乳动物参与自噬的特异性基因, 检测这两种蛋白可以反映自噬水平[17].
近年来的研究表明自噬在肝纤维化的发生过程中起着双重作用, 一方面他能通过抑制炎症反应和维持细胞内稳态减轻肝纤维化[14], 例如自噬调节能够帮助清除肝细胞中的酒精小体、促进脂滴的分解代谢及细胞内受损的线粒体等细胞器的降解, 对脂肪肝、酒精性肝病及肝毒性药物诱导的肝细胞损伤均具有明显的保护作用[18-20]. 另一方面也有一些研究[3,21-26]发现自噬参与的脂滴丢失为HSC活化提供能量, 且能诱导ColⅠ合成, 从而促进肝纤维化的发生; 同时抑制自噬可以减轻肝纤维化的发生. 虽然自噬对肝纤维化被认为是一把双刃剑, 但从目前实验研究来看, 自噬对肝纤维化的促进作用可能起主导地位.
本课题组前期在蓝莓对CCl4来和猪血清所致大鼠肝纤维化干预作用的研究中发现蓝莓可以增强机体抗氧化能力, 通过减轻肝组织超微结构损伤, 降低大鼠血清ALT、透明质酸水平及肝组织匀浆丙二醛含量, 升高肝组织匀浆超氧化物歧化酶活性及谷胱甘肽水平, 抑制转化生长因子、下调Smad4、TLR4、TLR9及上调Smad7的表达、促进金属硫蛋白酶的表达、增强过氧化物酶体增殖物激活受体γ的活性, 抑制血小板源性生长因子-β从而对大鼠肝纤维化起一定的干预作用. 同时在蓝莓对体外HSC的研究[27-31]中, 我们发现蓝莓可通过抑制大鼠HSC的增殖、活化及诱导HSC的凋亡从而减轻肝纤维化的发生.
鉴于氧化应激可以激活自噬, 近年来的部分研究表明自噬与肝纤维化密切相关, 而蓝莓具有很强的抗氧化活性, 为此我们采用猪血清诱导的免疫性肝纤维化大鼠模型并用蓝莓进行干预, 通过检测各组大鼠肝组织中自噬标志性蛋白LC3-Ⅱ和Beclin1的表达初步探讨自噬在免疫性肝纤维化大鼠肝组织的作用及蓝莓对LC3-Ⅱ和Beclin1表达的影响, 进一步探讨蓝莓对大鼠免疫性肝纤维化干预作用的机制.
本次研究结果显示: 模型组大鼠HE和Masson染色显示肝组织出现不同程度的纤维化, ColⅠ含量较正常组显著增加(P<0.01), 提示模型复制成功. 模型组大鼠肝组织LC3-Ⅱ、Beclin1的表达较正常组显著上调(P<0.01), 表明在猪血清所致的大鼠免疫性肝纤维化肝组织中自噬相关蛋白LC3-Ⅱ、Beclin1水平上调, 提示自噬可促进肝纤维化的发生, 该结果和已有的报道[21-26]一致. 蓝莓原浆高、中剂量组肝纤维化程度较模型组明显减轻, LC3-Ⅱ、Beclin1及ColⅠ含量较模型组明显下调(P<0.01), 提示蓝莓对猪血清诱导的大鼠免疫性肝纤维化有一定的干预作用, 结合我们既往的研究结果, 我们推测其机制可能是通过抑制氧化应激, 下调自噬相关蛋白LC3-Ⅱ、Beclin1的表达, 进而抑制自噬, 减少HSC的活化有关. 进一步我们将对自噬及相关蛋白在肝纤维化形成过程中的变化进行动态观察并在体外实验中进行验证.
肝纤维化是细胞外基质合成与降解失衡的动态过程, 其中心环节是肝星状细胞(hepatic stellate cells, HSC)的活化, 关于肝纤维化机制的研究和防治一直是肝病领域的热点.
蒋炜, 副教授, 复旦大学附属中山医院消化科; 张秋瓒, 主任医师, 天津市第四中心医院消化科; 辛永宁, 副教授, 青岛市市立医院肝病科
Hernández-Gea等通过使用自噬抑制剂和敲除小鼠自噬相关基因后, 发现HSC中脂滴大量积累, 且肝纤维化程度明显减轻, 因此自噬可能成为治疗肝纤维化的新靶点.
大量体内外实验研究发现, 自噬促进肝纤维化的发生, 且抑制自噬可以减轻肝纤维化.
前期研究发现, 蓝莓对肝纤维化大鼠有一定的干预作用, 本研究进一步证实该观点并探究相关机制.
肝纤维化与自噬密切相关, 自噬作为一种信号通路可能成为防治肝纤维化的潜在靶点, 研究发现蓝莓能抑制自噬从而发挥对肝纤维化的干预作用, 为蓝莓的临床研究和药用价值提供依据.
自噬: 是一种维持细胞内稳态的代谢过程, 通过与溶酶体结合将细胞内受损的或多余的细胞器降解成氨基酸、游离脂肪酸及其他小分子, 用于物质和能量循环.
本文设计新颖, 结论可靠, 有临床研究价值, 值得进一步研究.
编辑: 于明茜 电编:都珍珍
| 1. | Song Y, Zhao Y, Wang F, Tao L, Xiao J, Yang C. Autophagy in hepatic fibrosis. Biomed Res Int. 2014;2014:436242. [PubMed] [DOI] |
| 2. | Chen RJ, Wu HH, Wang YJ. Strategies to prevent and reverse liver fibrosis in humans and laboratory animals. Arch Toxicol. 2015;89:1727-1750. [PubMed] [DOI] |
| 3. | Lee J, Giordano S, Zhang J. Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling. Biochem J. 2012;441:523-540. [PubMed] [DOI] |
| 4. | Hernández-Gea V, Ghiassi-Nejad Z, Rozenfeld R, Gordon R, Fiel MI, Yue Z, Czaja MJ, Friedman SL. Autophagy releases lipid that promotes fibrogenesis by activated hepatic stellate cells in mice and in human tissues. Gastroenterology. 2012;142:938-946. [PubMed] [DOI] |
| 5. | Thoen LF, Guimarães EL, Dollé L, Mannaerts I, Najimi M, Sokal E, van Grunsven LA. A role for autophagy during hepatic stellate cell activation. J Hepatol. 2011;55:1353-1360. [PubMed] [DOI] |
| 6. | Hung TM, Yuan RH, Huang WP, Chen YH, Lin YC, Lin CW, Lai HS, Lee PH. Increased autophagy markers are associated with ductular reaction during the development of cirrhosis. Am J Pathol. 2015;185:2454-2467. [PubMed] [DOI] |
| 13. | Ishak K, Baptista A, Bianchi L, Callea F, De Groote J, Gudat F, Denk H, Desmet V, Korb G, MacSween RN. Histological grading and staging of chronic hepatitis. J Hepatol. 1995;22:696-699. [PubMed] [DOI] |
| 14. | Mao YQ, Fan XM. Autophagy: A new therapeutic target for liver fibrosis. World J Hepatol. 2015;7:1982-1986. [PubMed] [DOI] |
| 15. | Lin WJ, Kuang HY. Oxidative stress induces autophagy in response to multiple noxious stimuli in retinal ganglion cells. Autophagy. 2014;10:1692-1701. [PubMed] [DOI] |
| 16. | Klionsky DJ, Abdalla FC, Abeliovich H, Abraham RT, Acevedo-Arozena A, Adeli K, Agholme L, Agnello M, Agostinis P, Aguirre-Ghiso JA. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 2012;8:445-544. [PubMed] [DOI] |
| 17. | Friedman LS, Ostermeyer EA, Lynch ED, Szabo CI, Anderson LA, Dowd P, Lee MK, Rowell SE, Boyd J, King MC. The search for BRCA1. Cancer Res. 1994;54:6374-6382. [PubMed] |
| 18. | Shpilka T, Weidberg H, Pietrokovski S, Elazar Z. Atg8: an autophagy-related ubiquitin-like protein family. Genome Biol. 2011;12:226. [PubMed] [DOI] |
| 19. | Bechmann LP, Hannivoort RA, Gerken G, Hotamisligil GS, Trauner M, Canbay A. The interaction of hepatic lipid and glucose metabolism in liver diseases. J Hepatol. 2012;56:952-964. [PubMed] [DOI] |
| 20. | Ding WX, Manley S, Ni HM. The emerging role of autophagy in alcoholic liver disease. Exp Biol Med (Maywood). 2011;236:546-556. [PubMed] [DOI] |
| 21. | Ni HM, Bockus A, Boggess N, Jaeschke H, Ding WX. Activation of autophagy protects against acetaminophen-induced hepatotoxicity. Hepatology. 2012;55:222-232. [PubMed] [DOI] |
| 22. | Chen Y, Azad MB, Gibson SB. Methods for detecting autophagy and determining autophagy-induced cell death. Can J Physiol Pharmacol. 2010;88:285-295. [PubMed] [DOI] |
| 23. | He W, Wang B, Yang J, Zhuang Y, Wang L, Huang X, Chen J. Chloroquine improved carbon tetrachloride-induced liver fibrosis through its inhibition of the activation of hepatic stellate cells: role of autophagy. Biol Pharm Bull. 2014;37:1505-1509. [PubMed] [DOI] |
| 24. | Shen M, Chen K, Lu J, Cheng P, Xu L, Dai W, Wang F, He L, Zhang Y, Chengfen W. Protective effect of astaxanthin on liver fibrosis through modulation of TGF-β1 expression and autophagy. Mediators Inflamm. 2014;2014:954502. [PubMed] [DOI] |
| 25. | Mao Y, Zhang S, Yu F, Li H, Guo C, Fan X. Ghrelin Attenuates Liver Fibrosis through Regulation of TGF-β1 Expression and Autophagy. Int J Mol Sci. 2015;16:21911-21930. [PubMed] [DOI] |
| 26. | Lodder J, Denaës T, Chobert MN, Wan J, El-Benna J, Pawlotsky JM, Lotersztajn S, Teixeira-Clerc F. Macrophage autophagy protects against liver fibrosis in mice. Autophagy. 2015;11:1280-1292. [PubMed] [DOI] |
| 27. | He Y, Zhu J, Huang Y, Gao H, Zhao Y. Advanced glycation end product (AGE)-induced hepatic stellate cell activation via autophagy contributes to hepatitis C-related fibrosis. Acta Diabetol. 2015;52:959-969. [PubMed] [DOI] |