修回日期: 2016-01-28
接受日期: 2016-01-31
在线出版日期: 2016-03-18
目的: 探讨胰腺实性-假乳头状肿瘤(solid-pseudopapillary-tumor pancreas, SPTP)超声声像图特征及与胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor, PNET)、胰腺癌(pancreatic cancer, PC)的鉴别诊断.
方法: 选取2007-06/2015-12四川大学华西医院经手术切除和病理确诊的52例SPTP为病例组, 随机选择同期经病理证实的63例PNET及68例PC作为对照组, 回顾性分析所有病例的临床资料、常规超声声像图特征及SPTP组6例、PNET组10例、PC组21例超声造影(contrast enhanced-ultrasonography, CEUS)病灶增强特征.
结果: SPTP组与PNET组在发病年龄、性别、出现黄疸、肿块大小、形态、钙化、液化、内部分隔、血流信号、动脉期与实质期增强方式及病灶不增强区方面, 差异有统计学意义(P<0.05), 在出现腹痛、CA-199升高、肿块数目、位置、主胰管扩张、复发或转移方面, 差异无统计学意义(P>0.05); SPTP组与PC组在发病年龄、性别、出现腹痛、黄疸、CA-199升高、肿块大小、位置、形态、钙化、液化、主胰管扩张、复发或转移、动脉期增强方式及病灶内不增强区方面, 差异有统计学意义(P<0.05), 在肿块数目、内部分隔、血流信号及实质期增强方式方面, 差异无统计学意义(P>0.05).
结论: 青年女性胰腺内发现实性或囊实性肿块, 无黄疸、CA-199升高及主胰管扩张, CEUS示肿块动脉期呈环状高增强, 实质期呈低增强, 部分内见不增强区应考虑SPTP可能. 诊断时需注意与PNET及PC鉴别.
核心提示: 胰腺实性-假乳头状肿瘤(solid-pseudopapillary-tumor pancreas, SPTP) 是胰腺实性肿瘤的一种, 与胰腺其他常见实性肿瘤如胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor)、胰腺癌(pancreatic cancer)在临床特点、常规超声及超声造影(contrast enhanced-ultrasonography)表现方面存在一定的鉴别要点, 这些鉴别要点为超声诊断SPTP提供重要线索, 对提高超声对该病的诊断水平有一定帮助.
引文著录: 祁晓英, 马琳, 卢强, 杨蕗璐, 李加伍, 凌文武, 罗燕. 胰腺实性假乳头状瘤的超声特征及鉴别诊断. 世界华人消化杂志 2016; 24(8): 1269-1276
Revised: January 28, 2016
Accepted: January 31, 2016
Published online: March 18, 2016
AIM: To explore the ultrasonographic features of solid pseudopapillary tumors of the pancreas (SPTP) and their differential diagnosis from pancreatic neuroendocrine tumors (PNET) and pancreatic cancer (PC).
METHODS: Clinical data including conventional ultrasonographic characteristics for 52 patients with pathologically confirmed SPTP, 63 patients with PNET, and 68 patients with PC and the patterns of contrast enhanced ultrasonography (CEUS) in 6 cases of SPTP, 10 cases of PNET and 21 cases of PC were retrospectively analyzed.
RESULTS: There were significant differences between the SPTP group and the PNET group in age, sex, jaundice, tumor size, shape, calcification, liquefaction, separation, blood flow, arterial phase and late phase enhancement mode and non-enhancement area in the lesions (P < 0.05), while presence of abdominal pain, elevated CA-199, number of tumors, location, expansion of the main pancreatic duct and recurrence or metastasis had no statistical significance (P > 0.05). There were significant differences between the SPTP group and the PC group in age, sex, abdominal pain, jaundice, elevated CA-199, tumor size, location, shape, calcification, liquefaction, expansion of the main pancreatic duct, recurrence or metastasis, arterial phase enhancement mode and non-enhancement area in the lesions (P < 0.05), while number of tumors, separation, blood flow and late phase enhancement mode had no statistical significance (P > 0.05).
CONCLUSION: A solid or cystic-solid pancreatic tumor which shows peripheral ring enhancement in the arterial phase, hypo-enhancement in the late phase and central non-enhancement area could be considered as an SPTP in young female patients without jaundice, elevated CA-199 or main pancreatic duct dilation. It should be differentiated from PNET and PC.
- Citation: Qi XY, Ma L, Lu Q, Yang LL, Li JW, Ling WW, Luo Y. Ultrasonographic features and differential diagnosis of solid pseudopapillary tumors of the pancreas. Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1269-1276
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1269.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1269
胰腺实性假乳头状瘤(solid-pseudopapillarry-tumor pancreas, SPTP)是一种具有低度恶性潜能及独特病理学特点的胰腺肿瘤, 临床上较少见, 约占胰腺所有肿瘤的1%-2%[1]. SPTP不引起胰腺内分泌功能障碍, 也无特殊的肿瘤标志物, 临床表现缺乏特异性, 术前定性诊断困难, 易误诊为胰腺其他实性肿瘤, 如胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor, PNET)、胰腺癌(pancreatic cancer, PC)等. 多数肿瘤生长缓慢, 部分呈侵袭性生长, 若未及时治疗, 可发展为明显恶性, 向周围浸润性生长并转移, 因此及时做出正确诊断对患者临床治疗及预后非常重要. 关于SPTP的超声表现已有较多报道, 但在超声鉴别诊断方面的报道较少[2-5]. 本研究通过对SPTP与PNET及PC的超声声像图特征的对比分析, 旨在探讨SPTP超声声像图特征及与PNET、PC的鉴别诊断.
回顾性分析2007-06/2015-12四川大学华西医院经手术切除和病理确诊52例SPTP作为病例组, 随机选择同期经病理证实的63例PNET及68例PC作为对照组. 采用Philips iU22、HD 11 XE型彩色超声诊断仪, 探头频率1.0-5.0 MHz.
回顾性分析胰腺肿块大小、位置、数目、形态、有无液化、钙化、分隔、内部或周边血流信号、主胰管扩张、肝脏及其他脏器有无转移灶.
CEUS组病例应用Philips iU22型彩色超声诊断仪超声造影模式, 造影剂采用意大利Bracco公司生产的SonoVue, 生理盐水稀释至5.0 mL, 充分震荡后经肘静脉团注法快速推注2.4 mL, 再用5.0 mL生理盐水冲注. 注射造影剂的同时开启计时器, 监测病灶及周围正常胰腺组织的动态灌注过程2 min, 注入造影剂后1-30 s为动脉期, 31-120 s为实质期; 通过病灶与周围胰腺实质回声高低比较来判断造影后增强水平, 分为高增强、等增强、低增强和无增强4个级别, 高于周围胰腺组织回声者为高增强, 与周围胰腺组织回声一致者为等增强, 低于周围胰腺组织者为低增强, 病灶无造影剂充填为无增强.
统计学处理 采用SPSS17.0统计软件进行分析, 计量资料比较采用t检验, 计数资料比较采用χ2检验, 有单元数据<5时采用Fisher精确概率法. 当P<0.05为差异具有统计学意义.
SPTP组女44例, 男8例, 平均年龄31.73岁±10.9岁; 18例因腹部胀痛不适就诊, 26例因体检时偶然发现或扪及腹部包块就诊; 1例CA-199升高; 1例术后复发出现黄疸. SPTP组与PNET组在发病年龄、性别、出现黄疸方面, 差异有统计学意义(P<0.05); 在出现腹痛及CA-199升高方面, 差异无统计学意义(P>0.05). SPTP组与PC组在发病年龄、性别、出现腹痛、黄疸、CA-199升高方面, 差异有统计学意义(P<0.05)(表1).
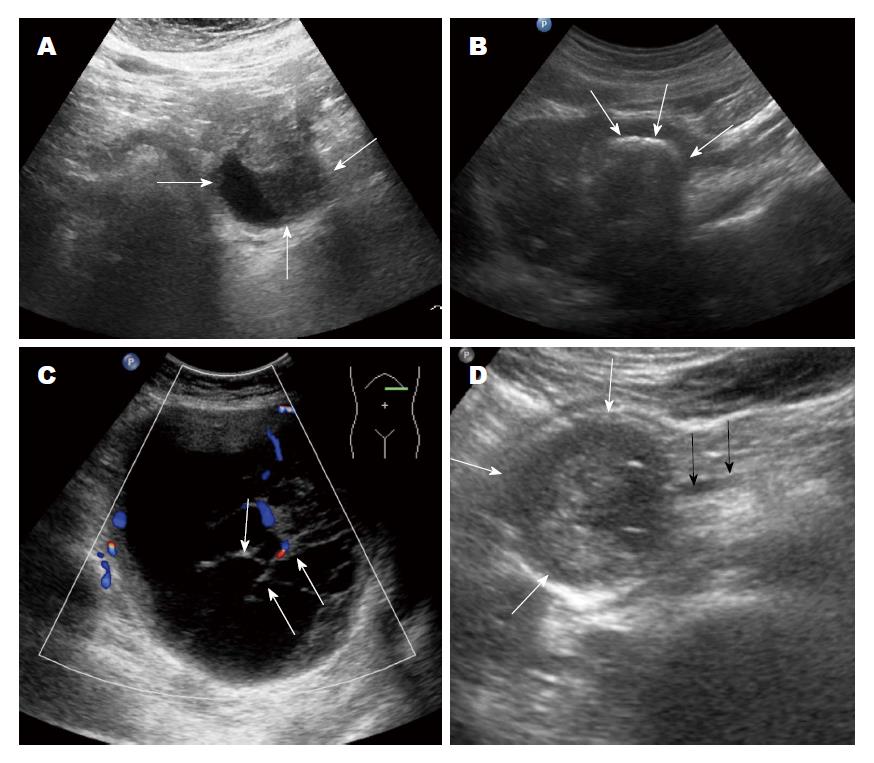
2.2.1 常规超声: SPTP组肿块平均大小5.53 cm±3.53 cm, 96.2%为单发病灶, 3.8%为多发病灶; 40.4%的病灶位于胰头, 59.6%的病灶位于胰体尾; 86.5%的病灶形态规则; 57.7%的病灶内部发生液化; 19.2%的病灶伴有钙化; 11.5%的病灶囊性成分内可见分隔; 30.8%肿块实性成分内可见点线状血流信号; 11.5%的病灶伴有主胰管扩张(图1).
SPTP组与PNET组在肿块大小(2.93 cm±2.04 cm)、形态、钙化、液化、内部分隔、血流信号方面, 差异有统计学意义(P<0.05), 在肿块数目、位置、主胰管扩张、复发或转移方面, 差异无统计学意义(P>0.05); SPTP组与PC组在肿块大小(3.51 cm±0.93 cm)、位置、形态、钙化、液化、主胰管扩张、复发或转移方面, 差异有统计学意义(P<0.05), 在肿块数目、内部分隔、血流信号方面, 差异无统计学意义(P>0.05)(表2).
| 超声特征 | SPTP组 | PNET组 | PC组 |
| 数目 | |||
| 单发 | 50(96.2) | 56(88.9) | 67(98.5) |
| 多发 | 2(3.8) | 7(11.1) | 1(1.5) |
| 位置 | |||
| 胰头 | 21(40.4)c | 29(46.0) | 40(58.8) |
| 胰体尾 | 31(59.6)c | 34(66.0) | 28(41.2) |
| 形态 | |||
| 规则 | 45(86.5)ac | 42(66.7) | 22(32.4) |
| 不规则 | 7(13.5)ac | 21(33.3) | 46(67.6) |
| 钙化 | 10(19.2)ac | 0(0.0) | 2(3.3) |
| 液化 | 30(57.7)ac | 5(7.9) | 4(5.9) |
| 分隔 | 6(11.5)a | 1(1.6) | 2(2.9) |
| 内部/周边有血流信号 | 16(30.8)a | 32(50.8) | 13(19.1) |
| 主胰管扩张 | 6(11.5)c | 11(17.5) | 45(66.2) |
| 复发/转移 | 4(7.7)c | 12(19.0) | 18(26.5) |
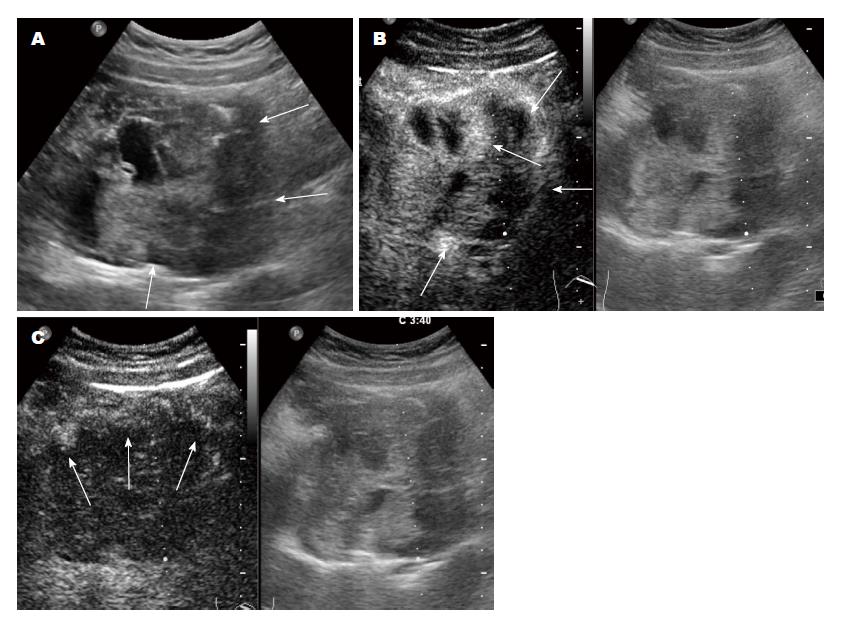
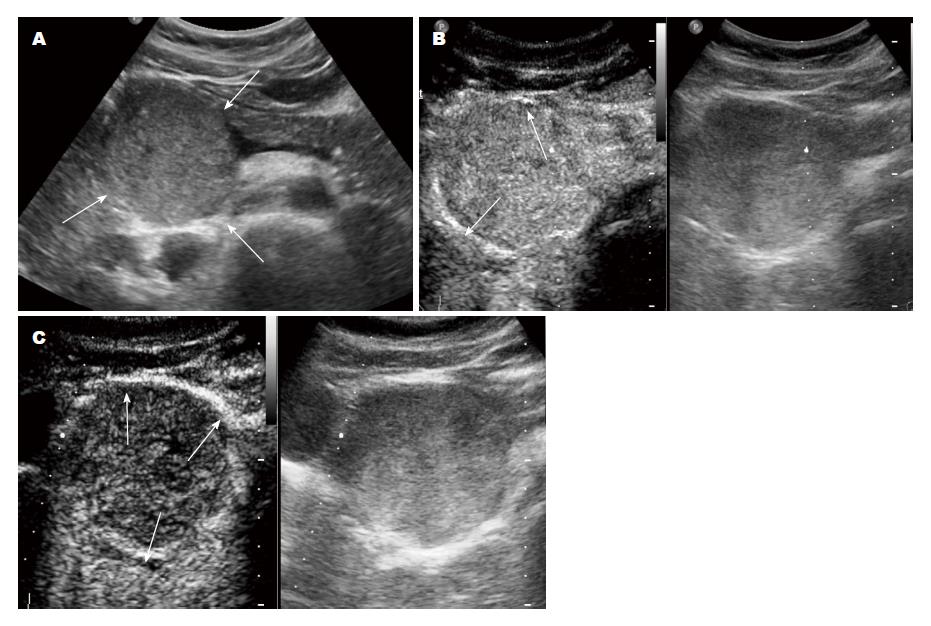
2.2.2 超声造影: SPTP组6例中, 5例动脉期周边呈环状高增强, 内部实性成分呈稍高增强, 4例内部可见片状不增强区; 1例动脉期呈整体轻度高增强. 实质期6例内部及周边增强成分均逐步廓清, 呈低增强(图2, 3).
PNET组10例中, 8例动脉期呈高增强(1例内部出现小片状无增强区), 7例实质期呈稍高增强, 1例实质期呈低增强; 2例动脉期及实质期均呈低增强.
PC组21例中, 16例动脉期呈低增强(1例出现片状无增强区), 3例动脉期呈等增强(2例出现片状无增强区), 2例周边呈等增强; 21例实质期均呈低增强.
SPTP组与PNET组在动脉期与实质期增强方式及病灶内不增强区方面, 差异有统计学意义(P<0.05); SPTP组与PC组在动脉期增强方式及病灶内不增强区方面, 差异有统计学意义(P<0.05), 在实质期增强方式方面, 差异无统计学意义(P>0.05)(表3).
世界上第1例SPTP由Franz[6]于1959年报道, 其发病具有性别及年龄优势, 好发于30岁左右的年轻女性, 因此也被称为daughter lesion[7], 本研究中SPTP组平均年龄为31.73岁±10.09岁, 男:女约为1:5.5, 与上述文献报道相符. SPTP不引起胰腺内分泌功能障碍, 大部分患者无症状, 少数可因肿块较大压迫胃肠道或破裂引起症状, 实验室检查如血常规、肝肾功、空腹血糖、血淀粉酶及肿瘤标志物CA-199大多在正常范围内.
PNET好发于30岁以上成年人, 男性略多于女性. 根据肿瘤细胞的分化程度可分为神经内分泌瘤、神经内分泌癌和混合性腺神经内分泌癌, 根据是否有临床症状分为功能性与无功能性PNET[8]. PC则好发于老年男性, 首发症状以黄疸、腹痛多见, CA-199诊断PC敏感度及特异度较高[9]. 本研究结果显示, 发病年龄、性别、黄疸对SPTP与PNET、SPTP与PC均有鉴别诊断意义, 出现腹痛及CA-199升高对SPTP与PC有鉴别诊断意义.
SPTP常规超声及超声造影特征: SPTP因肿瘤间质含有大量壁薄、脆弱血管而易出血[10], 常见肉眼表现为出血囊性变. 超声图像则表现为胰腺内弱回声或囊实混合回声肿块, 亦可表现为无回声或者等回声肿块. 肿块多单发, 多发少见, 仅有少量研究报道[11,12]. 本组SPTP中, 单发病灶占95.2%(40/42), 多发病灶占4.8%(2/42), 与文献报道相符. SPTP也可出现钙化, 多位于肿瘤周边, 可呈斑点状、细条状、斑块状及蛋壳样[13-15]. 肿块大部分向胰腺外腹腔及腹膜后空虚处生长, 可对邻近胰腺实质挤压形成包膜, 但很少压迫胰管和胆管开口引起其扩张[2]. 本组病例中3例可见主胰管扩张, 其中2例肿块位于胰头(最大径均>4 cm), 1例位于胰尾(最大径约3 cm). 但有学者[3,16]认为, 主胰管与胆管扩张与肿瘤位置及大小均无关, 可能与肿瘤生长方式及出血坏死有关. SPTP为乏血供肿瘤, 但肿瘤周边包膜血供较丰富[17,18]. 本研究6例CEUS病例, 5例动脉期周边可见环状高增强, 内部实性成分及分隔呈稍高增强, 实质期内部增强成分先廓清呈低增强, 周边包膜廓清较晚, 与既往研究相似[4,5]. 不论肿瘤大小, 多数肿瘤内部会发生出血、坏死或囊性变[19], CEUS能很好显示组织微血管灌注, 因此能更清楚的显示肿块内坏死液化情况. 周边环状增强及内部不增强区可看做SPTP特征性增强模式.
SPTP与PNET声像图特征比较: PNET表现为胰腺内低回声肿块, 多为单发, 可发生于胰头及胰体尾部; 功能性PNET就诊时肿瘤多小于3 cm[20], 非功能性PNET因早期无特异症状, 发现时肿瘤多较大, 内部常发生坏死及囊性变; CDFI显示肿块血供丰富. CEUS通常表现为快速均匀高增强, 实质晚期可廓清; 肿瘤级别越高, 强化越不明显[21-24]. 本组多数病例呈高增强, 仅有2例动脉期及实质期均呈低增强, 术后病理证实为高级别PNET. 本研究显示, 肿块大小、形态、钙化、液化、内部分隔、血流信号、动脉期与实质期增强方式及病灶内不增强区, 对SPTP与PNET有鉴别诊断意义, 肿块数目、位置、主胰管扩张、复发或转移在两组间不具有鉴别诊断意义.
SPTP与PC声像图特征比较: PC好发于胰头, 常表现为胰腺内低回声或囊实混合回声肿块, 肿瘤呈侵袭性生长, 形态多不规则, 常伴主胰管及肝内外胆管扩张. 由于PC为乏血供肿瘤, 加之恶性肿瘤内血管紊乱, 易形成动静脉短路[25,26], CEUS多表现为低增强, 即使强化, 也快速廓清. 少数可表现为等增强, 可能与肿瘤分化程度、血管密度、纤维组织含量有关[27,28]. 本研究显示, 肿块大小、位置、形态、钙化、液化、主胰管扩张、复发或转移、动脉期增强方式及病灶内不增强区, 对SPTP与PC有鉴别诊断意义, 肿块数目、内部分隔、血流信号及实质期增强方式, 在两组间不具有鉴别诊断意义.
总之, 青年女性胰腺内发现实性或囊实性肿块, 无黄疸、CA-199升高及主胰管扩张, CEUS显示肿块动脉期周边环状高增强, 实质期呈低增强, 部分内见不增强区, 应考虑SPTP可能. 相比PNET, 青年女性、肿块较大、形态规则、液化、钙化及分隔在SPTP常见, 青中年男性、出现黄疸、CEUS呈高增强在PNET多见; 相比PC, 肿块出现液化及钙化在SPTP多见, PC则好发于中老年男性且多有腹痛、黄疸及CA-199升高, 肿块较小多位于胰头、形态不规则, 主胰管扩张、复发或转移多见, CEUS呈低增强.
胰腺实性-假乳头状肿瘤(solid-pseudopapillary-tumor pancreas, SPTP)是一种少见的胰腺肿瘤, 临床表现缺乏特异性, 术前定性诊断困难, 易误诊为胰腺其他实性肿瘤, 如胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor, PNET)、胰腺癌(pancreatic cancer, PC)等.
杨薇, 副教授, 副主任医师, 北京大学肿瘤医院超声科
探讨SPTP超声及超声造影(contrast enhanced-ultrasonography, CEUS)表现的多样性, 提高超声医师对SPTP诊断及鉴别诊断的水平是临床亟待解决的问题.
Choi等对SPTP典型及不典型的影像学表现进行归纳, 其中一些不典型表现与胰腺其他肿瘤类似, 为提高SPTP影像表现多样性的认识有一定意义.
本文收集了较大样本量的SPTP病例, 以鉴别诊断为目的, 统计和分析了SPTP与PNET、PC在临床特点、超声及CEUS表现方面的不同, 进行比较并总结, 对提高该病定性诊断及鉴别诊断有一定的帮助.
本文提出SPTP与PNET、PC在临床特点、超声及CEUS表现方面的鉴别要点, 对SPTP的超声诊断及鉴别诊断具有重要参考价值.
关于SPTP超声表现研究报道较多, 但是没有专门以鉴别诊断为目的提出并总结, 该文章对SPTP和PNET及PC在超声及CEUS表现方面的不同进行了比较系统全面的统计及分析, 具有一定的临床价值.
编辑: 郭鹏 电编: 闫晋利
| 1. | Martin RC, Klimstra DS, Brennan MF, Conlon KC. Solid-pseudopapillary tumor of the pancreas: a surgical enigma? Ann Surg Oncol. 2002;9:35-40. [PubMed] [DOI] |
| 4. | 蔡 迪明, 李 永忠, 马 步云, 凌 文武, 姜 勇, 张 凌燕, 钟 晓绯, 张 静漪, 宋 彬. 超声检查对于胰腺实性假乳头状瘤诊断的价值. 世界华人消化杂志. 2013;21:1803-1810. [DOI] |
| 5. | Jiang L, Cui L, Wang J, Chen W, Miao L, Jia J. Solid pseudopapillary tumors of the pancreas: Findings from routine screening sonographic examination and the value of contrast-enhanced ultrasound. J Clin Ultrasound. 2015;43:277-282. [PubMed] [DOI] |
| 6. | Frantz VE. Anonymous atlas of tumor pathology: tumors of the pancreas. Washington DC: Armed Forces Institute of Pathology 1959; 32-33. |
| 7. | Dewhurst CE, Mortele KJ. Cystic tumors of the pancreas: imaging and management. Radiol Clin North Am. 2012;50:467-486. [PubMed] [DOI] |
| 8. | Bosman FT, Carneiro F, Hruban RH, Theise ND, World Health Organization Classification of Tumours. Pathology and genetics of tumors of the degestive system. Lyon: IARC Press 2010; 13-14. |
| 11. | Orlando CA, Bowman RL, Loose JH. Multicentric papillary-cystic neoplasm of the pancreas. Arch Pathol Lab Med. 1991;115:958-960. [PubMed] |
| 12. | Kobayashi T, Kimura T, Takabayashi N, Sugimura H. Two synchronous solid and cystic tumors of the pancreas. J Gastroenterol. 1998;33:439-442. [PubMed] [DOI] |
| 14. | Buetow PC, Buck JL, Pantongrag-Brown L, Beck KG, Ros PR, Adair CF. Solid and papillary epithelial neoplasm of the pancreas: imaging-pathologic correlation on 56 cases. Radiology. 1996;199:707-711. [PubMed] [DOI] |
| 15. | Choi JY, Kim MJ, Kim JH, Kim SH, Lim JS, Oh YT, Chung JJ, Yoo HS, Lee JT, Kim KW. Solid pseudopapillary tumor of the pancreas: typical and atypical manifestations. AJR Am J Roentgenol. 2006;187:W178-W186. [PubMed] [DOI] |
| 19. | Coleman KM, Doherty MC, Bigler SA. Solid-pseudopapillary tumor of the pancreas. Radiographics. 2003;23:1644-1648. [PubMed] [DOI] |
| 20. | Buetow PC, Parrino TV, Buck JL, Pantongrag-Brown L, Ros PR, Dachman AH, Cruess DF. Islet cell tumors of the pancreas: pathologic-imaging correlation among size, necrosis and cysts, calcification, malignant behavior, and functional status. AJR Am J Roentgenol. 1995;165:1175-1179. [PubMed] [DOI] |
| 21. | Milan SA, Yeo CJ. Neuroendocrine tumors of the pancreas. Curr Opin Oncol. 2012;24:46-55. [PubMed] [DOI] |
| 22. | Wang SE, Su CH, Kuo YJ, Shyr YM, Li AF, Chen TH, Wu CW, Lee CH. Comparison of functional and nonfunctional neuroendocrine tumors in the pancreas and peripancreatic region. Pancreas. 2011;40:253-259. [PubMed] [DOI] |
| 23. | D'Onofrio M, Mansueto G, Falconi M, Procacci C. Neuroendocrine pancreatic tumor: value of contrast enhanced ultrasonography. Abdom Imaging. 2004;29:246-258. [PubMed] [DOI] |
| 26. | Numata K, Ozawa Y, Kobayashi N, Kubota T, Shimada H, Nozawa A, Nakatani Y, Sugimori K, Matsuo K, Imada T. Contrast-enhanced sonography of pancreatic carcinoma: correlations with pathological findings. J Gastroenterol. 2005;40:631-640. [PubMed] [DOI] |
| 27. | Sofuni A, Iijima H, Moriyasu F, Nakayama D, Shimizu M, Nakamura K, Itokawa F, Itoi T. Differential diagnosis of pancreatic tumors using ultrasound contrast imaging. J Gastroenterol. 2005;40:518-525. [PubMed] [DOI] |
| 28. | Faccioli N, Crippa S, Bassi C, D'Onofrio M. Contrast-enhanced ultrasonography of the pancreas. Pancreatology. 2009;9:560-566. [PubMed] [DOI] |