修回日期: 2016-01-30
接受日期: 2016-02-18
在线出版日期: 2016-03-18
哺乳动物基因组DNA上5-甲基胞嘧(5-methylcytosine, 5-mc)中是一种常见的表观遗传修饰. 随后的研究发现10-11易位蛋白(Ten-Eleven-Translocation protein, TET蛋白)家族可将5-mc氧化成5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5-hmc), 即基因组的第六碱基. 最近研究发现在消化系肿瘤中可发现5-hmc水平的降低, 提示5-hmc可能是一个早期检测消化系肿瘤的表观遗传标志物. 为了更好地了解5-hmc和TET的作用, 本文对TET蛋白的功能和5-hmc与消化系肿瘤的关系进行了如下阐述.
核心提示: 检测5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5-hmc)可了解致癌基因组去甲基化模式, 这可能有助于结直肠癌的早期诊断和预后判断. 因而5-hmc有望成为结直肠癌诊断和预后的重要标志物. 但结直肠癌组织中有无特异的低甲基化位点、去甲基化与转录表达的确切机制及对判断预后的机制还不清楚, 需要进一步的研究和探讨.
引文著录: 张荣, 林辉. 5-羟甲基胞嘧啶: 早期检测消化系肿瘤的新标志物? 世界华人消化杂志 2016; 24(8): 1213-1219
Revised: January 30, 2016
Accepted: February 18, 2016
Published online: March 18, 2016
5-methylcytosine (5-mc) has been recognized as an important epigenetic modification in mammalian genomic DNA. Studies have revealed that TET (ten-eleven translocation) protein family could catalyze the conversion of 5-mc into 5-hydroxyme-thylcytosine (5-hmc), which is now widely recognized as the sixth base in the genome. Recent reports showed that the level of 5-hmc was decreased in digestive system tumors, indicating that 5-hmc may be a useful epigenetic biomarker for the early diagnosis of gastrointestinal tumors. To better understand the roles of TET and 5-hmc, this article will elucidate the function of TET protein and the connections between 5-hmc and digestive system tumors.
- Citation: Zhang R, Lin H. 5-hydroxymethylcytosine: A new marker for early detection of digestive system tumors? Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1213-1219
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1213.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1213
近些年来, 癌症成为威胁人类健康的重要危险因素. 世界卫生组织(World Health Organization, WHO)发布的《全球癌症报告2014》[1]显示, 中国癌症的新增病例和死亡人数的绝对值依然位居世界首位. 其中以胃癌、大肠癌为代表的消化系肿瘤威胁最为显著, 因此早期高效地检测消化系肿瘤对患者的治疗和预后有至关重要的作用. 近年来有许多研究[2-4]表明, 5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5-hmc)可能是早期检测消化系肿瘤的重要表观遗传标志物.
5-甲基胞嘧(5-methylcytosine, 5-mc)由DNA甲基转移酶(DNA methytransferase, DNMT)催化, 在基因组DNA序列CpG二核苷酸(CpG dinucleotides)的胞嘧啶5'碳位共价键结合一个甲基基团(methylgroup, -CH3)而形成, 被称为DNA的第5种碱基, 能调节基因活性. 5-甲基胞嘧啶与染色体构象不稳定、基因组印记、转座子激活、原癌基因激活和抑癌基因失活有关[5]. 随后, 研究者又在哺乳动物中发现了被称之为DNA第6种碱基的一种表观遗传学新修饰, 即5-hmc. 5-hmc是5-mc的羟基化形式, 于1952年在噬菌体DNA中被发现[6]. 同位素标记结果表明体内5-hmc的稳定性与细胞的增殖有关[7], 提示其具有潜在的参与基因表达调控的调节功能[8-10]. 同时, 研究[11-13]表明, 5-hmc水平的降低与肿瘤的发生有关, 故其可能成为早期预测肿瘤的重要表观遗传标志物. 近年来对5-hmc的研究逐渐增多, 也使得5-hmc成为表观遗传学领域的研究热点之一[14]. 5-hmc水平与相关基因转录活性及肿瘤发生的相关性还有待于进一步的研究与证实.
TET蛋白最初是由Tahiliani等[15]发现的. TET蛋白具有加氧酶结构域, 包括TET1、TET2和TET3家族成员, 三种蛋白都能催化5-mc羟基成5-hmc, 且TET1和TET2可调节大鼠胚胎干细胞中5-hmc的水平[16]. 近年来, 多项研究表明双加氧酶TET蛋白家族分布有明显的组织特异性: TET1蛋白主要存在于胚胎组织和脑部细胞内; TET2蛋白主要存在于造血干细胞; 而TET3主要分布在肌肉组织里. 目前认为, TET1和TET2对维持干细胞多能性具有重要作用, 而TET3更多与分化过程有关[17]. 有研究[18]发现, TET家族可以促进基因甲基化, 同时也防止基因的过度甲基化, 其功能的表达主要与染色质的环境有关. 许多研究表明[19-21]TET蛋白的去甲基化功能在调控哺乳动物原始生殖细胞的形成、胚胎发育、干细胞多能性及肿瘤的形成和发展过程中发挥了重要作用.
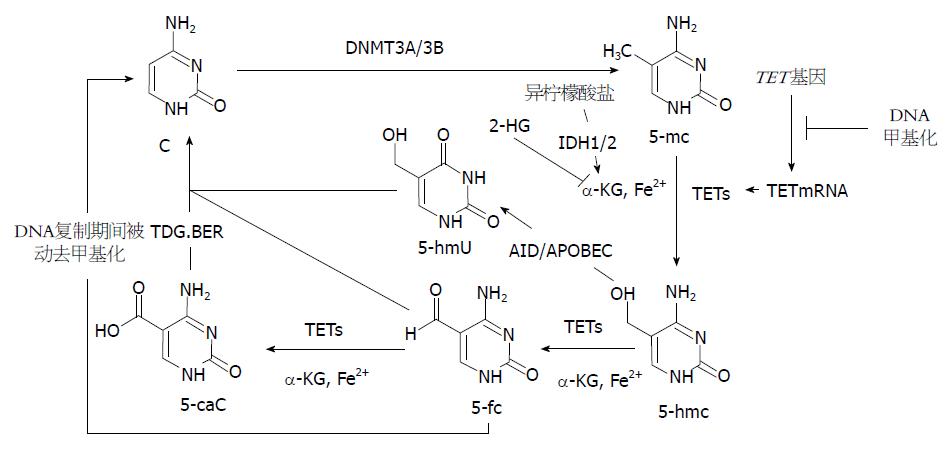
近来Guo等[22]研究发现, 5-hmc在活化诱导脱氨酶(activation-induced deamin-ase, AID)/载脂蛋白基因编辑酶复合物(apolipoprotein B mRNA-editing enzyme complex, APOBEC)作用下脱氨基, 形成5-羟甲基尿嘧啶(5-hydroxymethyluracil, 5-hmU). 而后, 5-hmc脱氨基产物可经碱基切除修复(base-excision repair, BER)途径实现DNA主动去甲基化. He等[23]发现DNA中5-mc和5-hmc都可以被氧化为5-甲酰基胞嘧啶(5-formylcytosine, 5-fC)和5-羧基胞嘧啶(5-carboxylcytosine, 5-caC), 而5-caC又进一步被胸腺嘧啶DNA糖基化酶(thymine-DNA glycosylase, TDG)识别并切除. 切除后的5-caC形成无甲基化修饰的胞嘧啶, 进而通过DNA剪切修复途径替换为没有修饰的胞嘧啶(C), 从而初步阐明了一条DNA主动去甲基化修复途径(5-mc→5-hmc→5-caC→C)(图1).
2009年, Tahiliani等[15]发现TET蛋白酶可以通过α-酮戊二酸(α-ketoglutarate, α-KG)和Fe2+将5-mc催化成为5-hmc. Xu等[24]研究发现2-羟戊二酸(2-hydroxyglutarate, 2-HG)在结构上类似于α-KG, 并能竞争性拮抗α-KG, 抑制多种α-KG依赖性的双加氧酶, 包括组蛋白羟化酶和TET家族DNA羟化酶, 进而降低5-hmc水平. 此外, α-KG也是三羧酸循环(tricarboxylicacidcycle, TCA)中异柠檬酸的代谢物, 异柠檬酸在产生α-KG的过程中需要异柠檬酸脱氢酶1(isocitrate dehydrogenases1, IDH1)及异柠檬酸脱氢酶2(isocitrate dehydrogenases 2, IDH2)的催化. 肿瘤组织中常伴有IDH1/2的突变进一步导致α-KG代谢途径受损, 因而TET酶不能很好地发挥其羟化酶活性, 进而使5-mc向5-hmc的转化受影响[25]. 此外, 细胞的过度增殖也可以引起5-hmc含量的下降, 这是因为5-mc向5-hmc的氧化形成半羟甲基化的CpG岛, 在DNA复制期间, DNMT1不能识别半羟甲基化的CpG岛, 因而在细胞分裂中不能维持DNA的羟甲基化, 随着细胞的分裂, 其中5-hmc的含量逐渐下降[26](图1).
TET1表达的下降可导致实体肿瘤的发生,也可能与混合细胞性白血(mixed lineage leukemia, MLL)有关[27]. TET2在生存率和造血干细胞稳态中有至关重要作用, 且TET2表达的下降导致低水平的5-hmc则与骨髓增殖性肿瘤(myeloproliferative neoplasms, MPNs)、急性髓细胞性白血病(acute myeloid leukemia, AML)及骨髓增生异常综合征(myelodysplastic syndrome, MDS)的发生有关[28,29], 且基因组5-hmc水平的变化与MDS患者预后相关联[30]. 迄今为止, 还没有发现TET3的突变/调节异常与恶性肿瘤有关.
5-hmc不仅是DNA脱甲基化过程中短暂的中间产物, 而且也可能是一个独立的表观遗传学标志物[8,31]. 迄今为止, 几乎所有的肿瘤细胞株中, 都会出现由于5-mc的羟化异常而出现5-hmc含量的降低[32-38], 且许多肿瘤中都伴随着TET表达水平的改变[32-34]. 然而5-hmc水平的变化是肿瘤形成的原因还是结果目前还不清楚, 其可能与肿瘤的类型和分期有关. 5-hmc除了是去甲基化的中间产物, 还具有基因调节作用. 基因调节能灭活或者损害DNA甲基化(如DNMT3A突变)或者DNA去甲基化(如TET2或IDH突变), 进而打破基因组甲基化和去甲基化的平衡, 进而使抑癌基因失活或者激活原癌基因, 最终导致肿瘤的发生[2,39,40]. 此外, 肿瘤细胞中5-hmc水平的降低可能是糖类代谢过程的中心环节, 故5-hmc可通过调节糖类代谢来调控肿瘤的生长[4]. 因此, 5-hmc可能在癌症早期诊断中颇具价值.
近来有研究发现, 在早期消化系肿瘤中也存在5-hmc水平的降低[3,41,42], 同时伴随着TET1 mRNA、TET2 mRNA或者TET3 mRNA水平的下调[19]. 此外, 5-hmc含量的下降也与消化系肿瘤类型和临床病理特征相关[3,42], 例如肿瘤大小、病理分型、肿瘤侵袭程度、TNM分期、淋巴结转移数量等.
Murata等[43]发现在食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)细胞中, 5-hmc水平显著低于周围正常组织, 同时伴有TET水平的降低. 流行病学研究[19,40]发现, 在肝癌患者中, TET1、TET2、TET3基因突变率很少, 但伴有TET1 mRNA、TET2 mRNA、TET3 mRNA、5-hmc水平的降低. 5-hmc的水平不仅与肝癌大小有关[44], 还与患者生存率有关. Chen等[45]对肝癌组织和癌旁组织中的5-mc和5-hmc定量分析, 结果表明肝癌组织中5-hmc含量低于癌旁组织, 且5-hmc的含量与肿瘤分期高度相关. Liu等[46]发现5-hmc和IDH2水平的降低与肝癌的恶性转化、低生存率和高复发率相关. 此外, 5-hmc的水平降低也对预测胃肠道间质瘤的发生有重要作用[47]. 研究还发现, 大约2%的胰腺癌患者伴有IDH1/2的突变[48], 然而并没有研究显示其伴有TET基因的突变. 在胆道肉瘤中也约有10%-20%患者存在IDH1/2的突变[49], 由于IDH1/2的突变可通过调节TET功能来控制5-hmc水平, 因而通过检测5-hmc水平, 可对这些消化系肿瘤进行早期诊断和判断预后.
在胃癌中, TET1基因突变率约4%, TET2基因突变率没有报道, TET3基因突变率则很少, 同时伴随TET1 mRNA和TET1蛋白水平、5-hmc水平的降低, 但未发现他们与患者生存率之间的关系[19,40]. 研究者[50]通过实验推测基因组中Cag毒力岛(cagpathogenecity island, cagPAI)基因编码的CagA蛋白刺激形成的细胞炎症环境下, TET蛋白会受到一些炎性细胞因子的刺激而出现异常表达, 使5-hmc累积水平出现改变, 进而引起细胞内核苷酸甲基化和去甲基化失衡, 激活或抑制了某些信号通道, 从而引起更多的蛋白表达异常, 增加了组织病变甚至癌变的可能性. 同时, DNA去甲基化与甲基化平衡被打破, 使肿瘤细胞逃避了凋亡机制. 以上两种机制共同作用促进了胃癌的发生. 因此, 5-hmc水平的改变可能对早期检测胃癌的发生有一定的指导意义.
结直肠癌是对DNA甲基化调节异常最敏感的肿瘤, 在正常的结肠上皮细胞中存在5-hmc的修饰, 且5-hmc在基因启动子和基因体部的含量和分布与肠道上皮组织功能和分化活性有关.而在结肠癌细胞中, 5-hmc水平也显著降低[32,35,36,51]. 在结直肠癌患者中, TET1基因突变率约为7%, TET2基因突变率约为4%, 而TET3基因突变率约为5%, 同时伴有TET1 mRNA、TET2 mRNA、TET3 mRNA、5-hmc水平的下降, 且TET2 mRNA水平的下降与生存率降低有关[19,40]. Neri等[51]也发现在结直肠肿瘤中, TET1 mRNA(不是TET2/TET3 mRNA)从肿瘤Ⅰ期开始就明显下降. TET1的下调会导致Wnt途径抑制剂基因DKKs和SFRPs表达的下调, 同时, DKKs和SFRPs也可被DNA甲基化灭活, 从而导致肿瘤生长. 此外, TET1可能是通过去甲基化来促进金属蛋白酶组织抑制因子(tissue inhibitors of metalloproteinase, TIMP)家族蛋白TIMP2及TIMP3的表达, 故其抑制肿瘤细胞的侵袭能力降低, 导致癌细胞的侵袭[26]. 黑色素瘤抗原(melanoma antigen, MAGE)基因编码的抗原肽能够被自体细胞毒T淋巴细胞识别并杀灭, 从而达到消除肿瘤细胞的目的. MAGE-1、MAGE-3基因是具有共同特性的肿瘤特异性抗原, 其表达与结直肠癌的发生、转移及恶化相关[52]. 研究[53]发现, 结直肠癌组织中MAGE-1、MAGE-3基因启动子去甲基化可能会激活基因重新表达, 这是结直肠癌发生的一个早期、频发的事件[54]. 由于5-hmc可能是去甲基化过程的中间产物, 故通过检测5-hmc可了解致癌基因组去甲基化模式, 这可能有助于结直肠癌的早期诊断和预后判断. 因而5-hmc有望成为结直肠癌诊断和预后的重要标志物. 但结直肠癌组织中有无特异的低甲基化位点、去甲基化与转录表达的确切机制及对判断预后的机制还不清楚, 需要进一步的研究和探讨.
5-hmc作为一种新的表遗传学修饰, 其水平的降低往往伴随着血液系统肿瘤和实体肿瘤的发生发展. 尽管5-hmc与消化系肿瘤相关性的研究尚处于初步探索阶段, 但他对我们认识表观遗传调控在人体疾病如肿瘤的作用中提供了一个新的思路. 大量的研究已经证实5-hmc 和TET的变化与消化系肿瘤的发生和进展有密切关系, 这种紧密的相关性提示5-hmc可能成为一个有价值的消化系肿瘤早期诊断标志物. 因此, 研究5-hmc及TET蛋白在消化系肿瘤发生中的作用未来会有很重要的意义.
世界卫生组织(World Health Organization, WHO)发布的《全球癌症报告2014》显示, 中国癌症的新增病例和死亡人数的绝对值依然位居世界首位, 其中以胃癌、大肠癌为代表的消化系肿瘤威胁最为显著. 近年来, 许多研究发现5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5-hmc)参与基因表达调控, 对早期预测消化系肿瘤具有重要意义, 因此探讨5-hmc与消化系肿瘤之间的关系显得尤为重要.
聂飚, 副主任医师, 北京清华长庚医院消化科; 董卫国, 教授, 武汉大学人民医院消化内科
近年来, 有许多研究提出了5-hmc与消化系肿瘤的发生有一定相关性, 但其具体机制未明. 因此需要不断地深入探讨5-hmc及其产物、TET蛋白与肿瘤之间的关系. 此外, 由于5-hmc在组织中的含量很低, 需要寻求更高效地检测5-hmc的检测方法.
Vasanthakumar等详述了5-hmc与血液系统和实体肿瘤之间的相关性以及肿瘤的诊断、预后及治疗新靶点.
本文分别从5-hmc的发现、TET蛋白及去甲基化机制、肿瘤组织中5-hmc下降的机制、TET蛋白和5-hmc与肿瘤之间尤其是消化系肿瘤之间的关系等方面进行全面阐述.
阐述5-hmc与消化系肿瘤之间的关系对于消化系肿瘤的早期预测和判断预后具有重要指导作用, 并以此为基础, 寻找肿瘤治疗新靶点.
Wnt途径: Wnt信号通路广泛存在于无脊椎动物和脊椎动物中, 是一类在物种进化过程中高度保守的信号通路. Wnt信号在动物胚胎的早期发育、器官形成、组织再生和其他生理过程中, 具有至关重要的作用. 如果这条信号通路中的关键蛋白发生突变, 导致信号异常活化, 就可能诱导癌症的发生.
本文分别对5-hmc的发现、TET蛋白的功能及其参与5-hmc去甲基化机制, 5-hmc与TET蛋白表达下降在肿瘤发生发展中的关系及其机制, 5-hmc与TET蛋白在消化系肿瘤中的关系进行了综述, 内容及题材较新颖, 收集的文献具有代表性, 逻辑清晰, 具有新颖性和可读性.
编辑: 郭鹏 电编: 闫晋利
| 1. | 世界卫生组织发布《2014年世界癌症报告》. 中国卫生政策研究 2014; 7: 16. . |
| 2. | Kroeze LI, van der Reijden BA, Jansen JH. 5-Hydroxymethylcytosine: An epigenetic mark frequently deregulated in cancer. Biochim Biophys Acta. 2015;1855:144-154. [PubMed] [DOI] |
| 3. | Yang Q, Wu K, Ji M, Jin W, He N, Shi B, Hou P. Decreased 5-hydroxymethylcytosine (5-hmC) is an independent poor prognostic factor in gastric cancer patients. J Biomed Nanotechnol. 2013;9:1607-1616. [PubMed] |
| 4. | Vasanthakumar A, Godley LA. 5-hydroxymethy-lcytosine in cancer: significance in diagnosis and therapy. Cancer Genet. 2015;208:167-177. [PubMed] [DOI] |
| 5. | Luczak MW, Jagodziński PP. The role of DNA methylation in cancer development. Folia Histochem Cytobiol. 2006;44:143-154. [PubMed] |
| 6. | WYATT GR, COHEN SS. A new pyrimidine base from bacteriophage nucleic acids. Nature. 1952;170:1072-1073. [PubMed] |
| 7. | Bachman M, Uribe-Lewis S, Yang X, Williams M, Murrell A, Balasubramanian S. 5-Hydroxymethylcytosine is a predominantly stable DNA modification. Nat Chem. 2014;6:1049-1055. [PubMed] [DOI] |
| 8. | Valinluck V, Tsai HH, Rogstad DK, Burdzy A, Bird A, Sowers LC. Oxidative damage to methyl-CpG sequences inhibits the binding of the methyl-CpG binding domain (MBD) of methyl-CpG binding protein 2 (MeCP2). Nucleic Acids Res. 2004;32:4100-4108. [PubMed] [DOI] |
| 9. | Chapman CG, Mariani CJ, Wu F, Meckel K, Butun F, Chuang A, Madzo J, Bissonette MB, Kwon JH, Godley LA. TET-catalyzed 5-hydroxymeth-ylcytosine regulates gene expression in differentiating colonocytes and colon cancer. Sci Rep. 2015;5:17568. [PubMed] [DOI] |
| 10. | Hahn MA, Szabó PE, Pfeifer GP. 5-Hydroxymeth-ylcytosine: a stable or transient DNA modification? Genomics. 2014;104:314-323. [PubMed] [DOI] |
| 11. | Laird A, Thomson JP, Harrison DJ, Meehan RR. 5-hydroxymethylcytosine profiling as an indicator of cellular state. Epigenomics. 2013;5:655-669. [PubMed] [DOI] |
| 12. | Dong ZR, Zhang C, Cai JB, Zhang PF, Shi GM, Gao DM, Sun HC, Qiu SJ, Zhou J, Ke AW. Role of 5-hydroxymethylcytosine level in diagnosis and prognosis prediction of intrahepatic cholangiocarcinoma. Tumour Biol. 2015;36:2763-2771. [PubMed] [DOI] |
| 13. | Rodger EJ, Chatterjee A, Morison IM. 5-hydroxymethylcytosine: a potential therapeutic target in cancer. Epigenomics. 2014;6:503-514. [PubMed] [DOI] |
| 14. | Matarese F, Carrillo-de Santa Pau E, Stunnenberg HG. 5-Hydroxymethylcytosine: a new kid on the epigenetic block? Mol Syst Biol. 2011;7:562. [PubMed] [DOI] |
| 15. | Tahiliani M, Koh KP, Shen Y, Pastor WA, Bandukwala H, Brudno Y, Agarwal S, Iyer LM, Liu DR, Aravind L. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 2009;324:930-935. [PubMed] [DOI] |
| 16. | Koh KP, Yabuuchi A, Rao S, Huang Y, Cunniff K, Nardone J, Laiho A, Tahiliani M, Sommer CA, Mostoslavsky G. Tet1 and Tet2 regulate 5-hydroxymethylcytosine production and cell lineage specification in mouse embryonic stem cells. Cell Stem Cell. 2011;8:200-213. [PubMed] [DOI] |
| 18. | Putiri EL, Tiedemann RL, Thompson JJ, Liu C, Ho T, Choi JH, Robertson KD. Distinct and overlapping control of 5-methylcytosine and 5-hydroxymethylcytosine by the TET proteins in human cancer cells. Genome Biol. 2014;15:R81. [PubMed] [DOI] |
| 19. | Rawłuszko-Wieczorek AA, Siera A, Jagodziński PP. TET proteins in cancer: Current 'state of the art'. Crit Rev Oncol Hematol. 2015;96:425-436. [PubMed] [DOI] |
| 20. | Huang Y, Rao A. Connections between TET proteins and aberrant DNA modification in cancer. Trends Genet. 2014;30:464-474. [PubMed] [DOI] |
| 21. | Wu YC, Ling ZQ. The role of TET family proteins and 5-hydroxymethylcytosine in human tumors. Histol Histopathol. 2014;29:991-997. [PubMed] |
| 22. | Guo JU, Su Y, Zhong C, Ming GL, Song H. Hydroxylation of 5-methylcytosine by TET1 promotes active DNA demethylation in the adult brain. Cell. 2011;145:423-434. [PubMed] [DOI] |
| 23. | He YF, Li BZ, Li Z, Liu P, Wang Y, Tang Q, Ding J, Jia Y, Chen Z, Li L. Tet-mediated formation of 5-carboxylcytosine and its excision by TDG in mammalian DNA. Science. 2011;333:1303-1307. [PubMed] [DOI] |
| 24. | Xu W, Yang H, Liu Y, Yang Y, Wang P, Kim SH, Ito S, Yang C, Wang P, Xiao MT. Oncometabolite 2-hydroxyglutarate is a competitive inhibitor of α-ketoglutarate-dependent dioxygenases. Cancer Cell. 2011;19:17-30. [PubMed] [DOI] |
| 25. | Figueroa ME, Abdel-Wahab O, Lu C, Ward PS, Patel J, Shih A, Li Y, Bhagwat N, Vasanthakumar A, Fernandez HF. Leukemic IDH1 and IDH2 mutations result in a hypermethylation phenotype, disrupt TET2 function, and impair hematopoietic differentiation. Cancer Cell. 2010;18:553-567. [PubMed] [DOI] |
| 26. | 葛 苗苗, 蔡 春. 表观遗传新标志物5hmC的研究进展. 生物化学与生物物理进展. 2014;41:839-850. |
| 27. | Ficz G, Gribben JG. Loss of 5-hydroxymethylcytosine in cancer: cause or consequence? Genomics. 2014;104:352-357. [PubMed] [DOI] |
| 28. | Ko M, Huang Y, Jankowska AM, Pape UJ, Tahiliani M, Bandukwala HS, An J, Lamperti ED, Koh KP, Ganetzky R. Impaired hydroxylation of 5-methylcytosine in myeloid cancers with mutant TET2. Nature. 2010;468:839-843. [PubMed] [DOI] |
| 29. | Solary E, Bernard OA, Tefferi A, Fuks F, Vainchenker W. The Ten-Eleven Translocation-2 (TET2) gene in hematopoiesis and hematopoietic diseases. Leukemia. 2014;28:485-496. [PubMed] [DOI] |
| 30. | Calvo X, Nomdedeu M, Navarro A, Tejero R, Costa D, Muñoz C, Pereira A, Peña O, Risueño RM, Monzó M. High levels of global DNA methylation are an independent adverse prognostic factor in a series of 90 patients with de novo myelodysplastic syndrome. Leuk Res. 2014;38:874-881. [PubMed] [DOI] |
| 31. | Wang J, Tang J, Lai M, Zhang H. 5-Hydroxyme-thylcytosine and disease. Mutat Res Rev Mutat Res. 2014;762:167-175. [PubMed] [DOI] |
| 32. | Yang H, Liu Y, Bai F, Zhang JY, Ma SH, Liu J, Xu ZD, Zhu HG, Ling ZQ, Ye D. Tumor development is associated with decrease of TET gene expression and 5-methylcytosine hydroxylation. Oncogene. 2013;32:663-669. [PubMed] [DOI] |
| 33. | Liu C, Liu L, Chen X, Shen J, Shan J, Xu Y, Yang Z, Wu L, Xia F, Bie P. Decrease of 5-hydroxymethylcytosine is associated with progression of hepatocellular carcinoma through downregulation of TET1. PLoS One. 2013;8:e62828. [PubMed] [DOI] |
| 34. | Gambichler T, Sand M, Skrygan M. Loss of 5-hydroxymethylcytosine and ten-eleven translocation 2 protein expression in malignant melanoma. Melanoma Res. 2013;23:218-220. [PubMed] [DOI] |
| 35. | Haffner MC, Chaux A, Meeker AK, Esopi DM, Gerber J, Pellakuru LG, Toubaji A, Argani P, Iacobuzio-Donahue C, Nelson WG. Global 5-hydroxymethylcytosine content is significantly reduced in tissue stem/progenitor cell compartments and in human cancers. Oncotarget. 2011;2:627-637. [PubMed] |
| 36. | Uribe-Lewis S, Stark R, Carroll T, Dunning MJ, Bachman M, Ito Y, Stojic L, Halim S, Vowler SL, Lynch AG. 5-hydroxymethylcytosine marks promoters in colon that resist DNA hypermethylation in cancer. Genome Biol. 2015;16:69. [PubMed] [DOI] |
| 37. | Kraus TF, Globisch D, Wagner M, Eigenbrod S, Widmann D, Münzel M, Müller M, Pfaffeneder T, Hackner B, Feiden W. Low values of 5-hydroxymethylcytosine (5hmC), the "sixth base," are associated with anaplasia in human brain tumors. Int J Cancer. 2012;131:1577-1590. [PubMed] [DOI] |
| 38. | Lian CG, Xu Y, Ceol C, Wu F, Larson A, Dresser K, Xu W, Tan L, Hu Y, Zhan Q. Loss of 5-hydroxymethylcytosine is an epigenetic hallmark of melanoma. Cell. 2012;150:1135-1146. [PubMed] [DOI] |
| 40. | Scourzic L, Mouly E, Bernard OA. TET proteins and the control of cytosine demethylation in cancer. Genome Med. 2015;7:9. [PubMed] [DOI] |
| 41. | Zhang LT, Zhang LJ, Zhang JJ, Ye XX, Xie AM, Chen LY, Kang JX, Cai C. Quantification of the sixth DNA base 5-hydroxymethylcytosine in colorectal cancer tissue and C-26 cell line. Bioanalysis. 2013;5:839-845. [PubMed] [DOI] |
| 42. | Frycz BA, Murawa D, Borejsza-Wysocki M, Marciniak R, Murawa P, Drews M, Kołodziejczak A, Tomela K, Jagodziński PP. Decreased expression of ten-eleven translocation 1 protein is associated with some clinicopathological features in gastric cancer. Biomed Pharmacother. 2014;68:209-212. [PubMed] [DOI] |
| 43. | Murata A, Baba Y, Ishimoto T, Miyake K, Kosumi K, Harada K, Kurashige J, Iwagami S, Sakamoto Y, Miyamoto Y. TET family proteins and 5-hydroxymethylcytosine in esophageal squamous cell carcinoma. Oncotarget. 2015;6:23372-23382. [PubMed] |
| 44. | Shen F, Huang W, Qi JH, Yuan BF, Huang JT, Zhou X, Feng YQ, Liu YJ, Liu SM. Association of 5-methylcytosine and 5-hydroxymethylcytosine with mitochondrial DNA content and clinical and biochemical parameters in hepatocellular carcinoma. PLoS One. 2013;8:e76967. [PubMed] [DOI] |
| 45. | Chen ML, Shen F, Huang W, Qi JH, Wang Y, Feng YQ, Liu SM, Yuan BF. Quantification of 5-methylcytosine and 5-hydroxymethylcytosine in genomic DNA from hepatocellular carcinoma tissues by capillary hydrophilic-interaction liquid chromatography/quadrupole TOF mass spectrometry. Clin Chem. 2013;59:824-832. [PubMed] [DOI] |
| 46. | Liu WR, Tian MX, Jin L, Yang LX, Ding ZB, Shen YH, Peng YF, Zhou J, Qiu SJ, Dai Z. High expression of 5-hydroxymethylcytosine and isocitrate dehydrogenase 2 is associated with favorable prognosis after curative resection of hepatocellular carcinoma. J Exp Clin Cancer Res. 2014;33:32. [PubMed] [DOI] |
| 47. | Mason EF, Hornick JL. Succinate dehydrogenase deficiency is associated with decreased 5-hydroxymethylcytosine production in gastrointestinal stromal tumors: implications for mechanisms of tumorigenesis. Mod Pathol. 2013;26:1492-1497. [PubMed] [DOI] |
| 48. | Ghiam AF, Cairns RA, Thoms J, Dal Pra A, Ahmed O, Meng A, Mak TW, Bristow RG. IDH mutation status in prostate cancer. Oncogene. 2012;31:3826. [PubMed] [DOI] |
| 49. | Borger DR, Tanabe KK, Fan KC, Lopez HU, Fantin VR, Straley KS, Schenkein DP, Hezel AF, Ancukiewicz M, Liebman HM. Frequent mutation of isocitrate dehydrogenase (IDH)1 and IDH2 in cholangiocarcinoma identified through broad-based tumor genotyping. Oncologist. 2012;17:72-79. [PubMed] [DOI] |
| 50. | 张 昕. Tet蛋白的表达与CagA诱导胃癌相关性的研究. 上海: 上海交通大学 2013; . |
| 51. | Neri F, Dettori D, Incarnato D, Krepelova A, Rapelli S, Maldotti M, Parlato C, Paliogiannis P, Oliviero S. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway. Oncogene. 2015;34:4168-4176. [PubMed] [DOI] |
| 52. | Li M, Yuan YH, Han Y, Liu YX, Yan L, Wang Y, Gu J. Expression profile of cancer-testis genes in 121 human colorectal cancer tissue and adjacent normal tissue. Clin Cancer Res. 2005;11:1809-1814. [PubMed] [DOI] |
| 53. | Kim R, Kulkarni P, Hannenhalli S. Derepression of Cancer/testis antigens in cancer is associated with distinct patterns of DNA hypomethylation. BMC Cancer. 2013;13:144. [PubMed] [DOI] |