修回日期: 2016-01-23
接受日期: 2016-02-02
在线出版日期: 2016-03-18
目的: 观察大蒜素对肝癌MHCC97H细胞株体外增殖、迁移、侵袭及对MMP-2、MMP-9、CD24 mRNA表达的影响并初步探讨其机制.
方法: 以肝癌MHCC97H细胞株为研究对象, MTT法、Transwell小室实验检测不同浓度大蒜素对肝癌MHCC97H细胞株迁移、侵袭能力的影响. 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)法检测不同浓度大蒜素对MHCC97H细胞株MMP-2、MMP-9、CD24 mRNA表达的影响.
结果: MTT显示大蒜素抑制MHCC97H细胞增殖(P<0.01), 呈现剂量依赖性. Transwell小室实验显示大蒜素抑制MHCC97H细胞的迁移(P<0.01), 一定范围内呈现剂量依赖性, 大蒜素组侵袭细胞较阴性对照组显著减少(P<0.01). qRT-PCR检测发现不同浓度大蒜素可以下调MHCC97H细胞MMP-2、MMP-9、CD24的表达, 且呈现一定程度剂量依赖性(P<0.01)
结论: 大蒜素对肝癌MHCC97H细胞株的增殖、迁移、侵袭有抑制作用, 且在一定范围内呈现出剂量依赖性. 其机制可能与抑制其MMP-2、MMP-9、CD24 mRAN的表达有关.
核心提示: 研究以大蒜素对肝癌细胞迁移和侵袭的抑制作用为主要目的, 初步阐明其机制可能与抑制MMP-2、MMP-9、CD24 mRNA的表达有关, 为大蒜素在肝癌临床治疗中的应用提供理论依据.
引文著录: 王文涛, 原皓, 杨丙信. 大蒜素抑制肝癌MHCC97H细胞的迁移、侵袭. 世界华人消化杂志 2016; 24(8): 1166-1174
Revised: January 23, 2016
Accepted: February 2, 2016
Published online: March 18, 2016
AIM: To observe the effect of allicin on the proliferation, migration and invasion of human hepatocellular carcinoma cell line MHCC97H and to explore the underlying mechanisms.
METHODS: MTT assay and transwell assay were used to assess the proliferation, migration and invasiveness of MHCC97H treated with varying concentrations of allicin for 24 h. Real-time fluorescence quantitative PCR was performed to detect the mRNA expression of MMP-2, MMP-9 and CD24.
RESULTS: MTT assay demonstrated that the proliferation of MHCC97H cell was inhibited by different concentrations of allicin. Transwell assay demonstrated that compared with the negative control group, the number of penetrating cells in the experimental group was decreased significantly (P < 0.01). Real-time fluorescence quantitative PCR showed that allicin could down-regulate the mRNA levels of MMP-2, MMP-9, and CD24 in a dose-dependent manner in MHCC97H cells (P < 0.01).
CONCLUSION: Allicin inhibits the proliferation, migration and invasion of MHCC97H cells via mechanisms possibly related to down-regulation of the mRNA expression of MMP-2, MMP-9, and CD24.
- Citation: Wang WT, Yuan H, Yang BX. Allicin inhibits cell migration and invasion in human hepatocellular carcinoma cell line MHCC97H. Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1166-1174
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1166.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1166
肝细胞癌(hepatocellular carcinoma, HCC)在我国为常见的恶性肿瘤. 浸润性生长和远处转移是其重要的生物学特征和致死的主要原因[1], 因此寻找有效低不良反应的能够抑制肝癌细胞增殖、迁移与侵袭的药物具有重要的临床意义. 大蒜素是百合科葱属植物鳞茎中提取的具有刺激性气味的含硫化合物, 最近研究证明其具有多种生物学功能[2,3], 不仅能杀菌消炎、抗溃疡、提高机体免疫力等药理作用[4-6], 还可以防癌、抗癌[3]. 已有多项研究[3,7-11]证明大蒜素可以抑制动物模型中及体外培养的食管癌、胃癌、结肠癌等多种肿瘤细胞的生长、增殖, 并诱导其凋亡. Chu等[12,13]研究证明大蒜素可以通过调节p53基因, 诱导肝癌细胞凋亡和自体吞噬, 陈传军等[14]研究证明大蒜素对人肝癌HepG-2细胞的增殖有抑制作用, 并能诱导HepG-2细胞凋亡, 其分子机制涉及上调Bax、Caspase3表达. 但大蒜素对体外培养的肝癌细胞迁移与侵袭影响的研究较少, 本研究旨在观察大蒜素对体外培养的人肝癌MHCC97H细胞株的增殖、迁移与侵袭的影响, 并通过检测其对MMP-2、MMP-9、CD24的mRNA表达影响, 分析大蒜素抑制肝癌侵袭和迁移的机制.
MHCC97H细胞株(上海富衡生物科技有限公司), MTT、DMSO、大蒜素(纯度≥98%)(索莱宝公司), 顺铂注射液(江苏豪森药业), DMEM高糖培养基、胎牛血清、0.25%胰蛋白酶-EDTA(biowest), DAPI(Applichem), Transwell小室(Costar公司), Matrigel胶、细胞培养材料(Corning公司), TRIzol试剂(Invitrogen公司), 逆转录试剂盒、实时定量PCR检测(real-time quantitative PCR, qRT-PCR)试剂盒(Takara公司), MMP-2、MMP-9、CD24、GAPDH引物(上海生工).
1.2.1 细胞培养: MHCC97H肝癌细胞株用DMEM培养液(加入10%胎牛血清、100 IU/mL青霉素、和100 IU/mL链霉素), 在37 ℃、50 mL/L CO2培养箱中常规培养, 细胞贴壁生长.
1.2.2 试剂配制: 20 mg大蒜素加入含40 mg吐温80的20 mL生理盐水中制成大蒜素乳剂[15], 4 ℃冰箱保存, 用时用DMEM培养液依次稀释成40、20、10 μg/mL. 30 mg/6 mL顺铂注射液加入54 mL生理盐水中, 制成0.5 g/L的溶液备用, 使用时用DMEM培养液稀释成0.5 μg/mL. DAPI配制: DAPI粉末溶于PBS中, 使其母液浓度为10 μg/mL.
1.2.3 实验分组: 分为DMEM培养液阴性对照组, 40 μg/mL大蒜素组, 20 μg/mL大蒜素组, 10 μg/mL大蒜素组, 5 μg/mL大蒜素组, 5 μg/mL顺铂阳性对照组.
1.2.4 四甲基偶氮唑盐(MTT)法测定大蒜素对细胞增殖活力的影响: 取对数生长期细胞, 调整细胞密度至5×105个/mL, 以100 μL/孔加入96孔板. 细胞贴壁后吸去培养液, 按照实验分组添加相应的培养液. 每组设5个复孔. 继续培养24 h, 每孔加入20 μL MTT继续培养4 h, 弃培养液, 加DMSO 150 μL/孔, 摇床震荡10 min, 自动酶标仪检测490 nm波长处的吸光度(A)值.
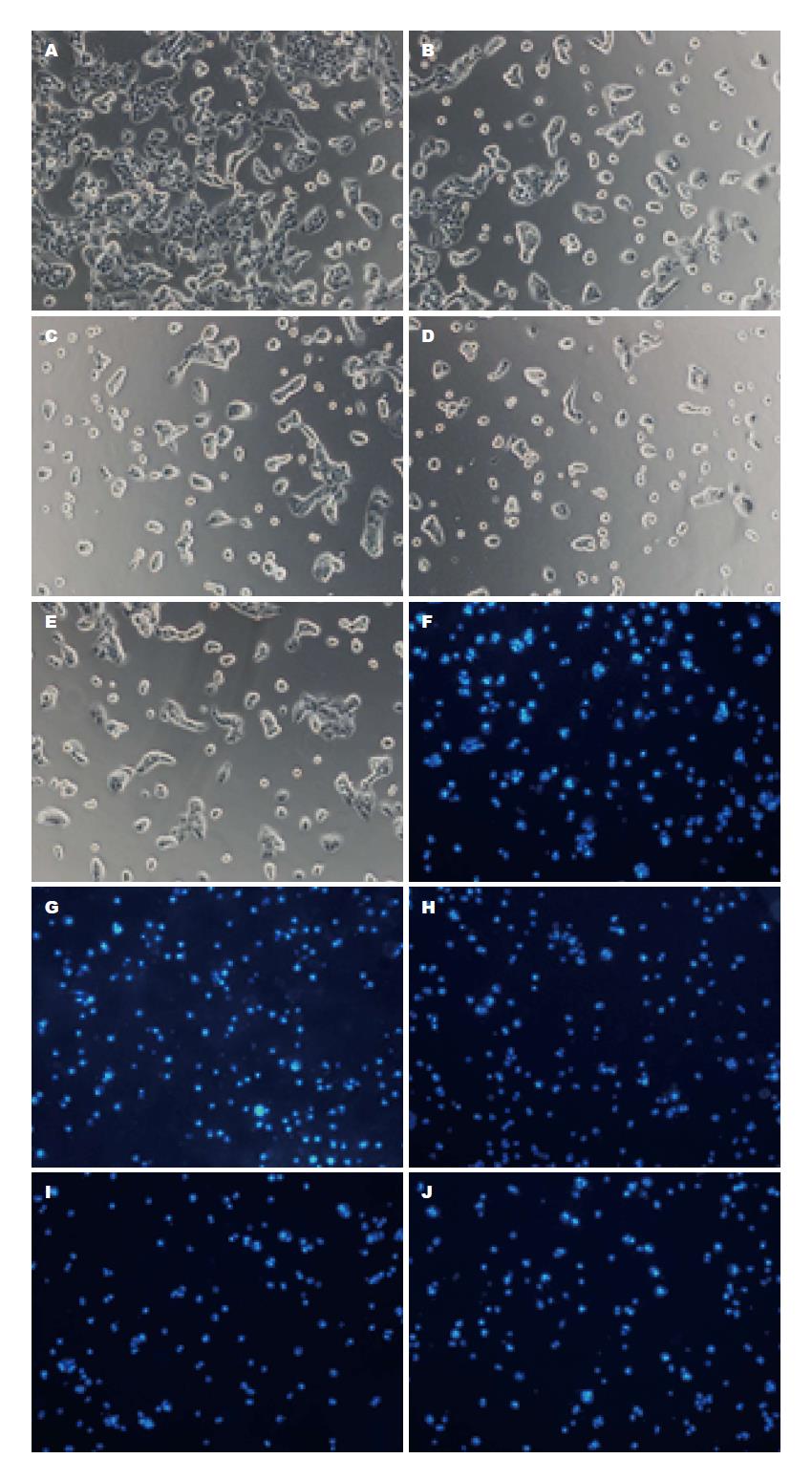
1.2.5 Transwell小室迁移实验: 结合形态学结果及MTT结果去除5 μg/mL大蒜素组, 其余组进一步行迁移实验, 取对数生长期的MHCC97H细胞, 用0.1%胎牛血清的DMEM培养液制成单细胞悬液, 调整细胞悬液浓度至5×105个/mL, 按200 μL/孔分别接种到Transwell上室, 上室5组分别接种0.1%胎牛血清的DMEM培养液制成的单细胞悬液200 μL/孔(5×105个/mL), 下室分别加入含10、20、40 μg/mL大蒜素、5 μg/mL顺铂的10%胎牛血清的DMEM培养液600 μL, 50 mL/L CO2培养箱37 ℃培养24 h后, 去除上室中培养液, 用棉签轻轻擦去上层中的细胞, 4%多聚甲醛中固定20 min, 光镜下观察细胞迁移至小室底部的情况, 随机选取5个视野计数细胞. 每组重复3个复孔.
1.2.6 侵袭实验: Transwell小室铺100 μL Matrigel, 37 ℃凝固. 细胞接种和药物添加同迁移实验, 50 mL/L CO2培养箱37 ℃培养48 h. 弃去上室液体, 4%多聚甲醛固定, 10 ng/mL的DAPI进行染色5 min, 荧光显微镜下观察并拍照. 每组重复3个复孔.
1.2.7 qRT-PCR检测不同浓度大蒜素作用后MHCC97H肝癌细胞MMP-2、MMP-9、CD24的mRNA表达变化: 6 cm培养皿培养细胞, 细胞铺满培养皿后, 培养皿中加入不同浓度大蒜素作用24 h, TRIzol法提取总RNA, 在Nanodrop仪器上检测核酸浓度. 根据试剂盒说明, 每组取1 μg的RNA, 10 μL体系(5×gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, total RNA+H2O 7 μL, 42 ℃ 2 min); 20 μL体系(反应液10 μL, 5×PrimeScript Buffer 24 μL, PrimeScript RT Enzyme MixI 1 μL, RT Primer Mix 1 μL, RNase Free water 4 μL), 37 ℃ 15 min; 85 ℃ 5 s; 所得cDNA加180 μL水稀释, 分别加入: 2×Mix 10 μL, cDNA 5 μL, 50×ROX 0.4 μL, H2O 4.6 μL. 反应程序: 变性阶段: 95 ℃ 30 s, PCR反应阶段40个循环: 95 ℃ 5 s; 60 ℃ 30 s. 解离曲线阶段: 95 ℃ 15 s; 60 ℃ 1 min; 95 ℃ 15 s. 基因引物序列如表1. PCR得到的Ct值结果, 采用2-△△Ct表示mRAN的相对表达量, 对结果进行分析.
| 基因 | 引物序列 |
| h-MMP2 | F: TATGACAGCTGCACCACTGA |
| R: TCATCGTAGTTGGCTGTGGT | |
| h-CD24 | F: GCTCCTACCCACGCAGATTT |
| R: TGAGACCACGAAGAGACTGG | |
| h-MMP9 | F: GGGACGCAGACATCGTCATC |
| R: TCGTCATCGTCGAAATGGGC | |
| h-GAPDH | F: CCATCACCATCTTCCAGG, |
| R: ATGAGTCCTTCCACGATAC |
统计学处理 所得数据应用SPSS20.0进行分析, 实验数据均以mean±SD表示, 首先进行方差齐性检验, 方差齐的两组间比较采用t检验, 多组间比较采用单因素方差分析数据, P<0.05为差异具有统计学意义.
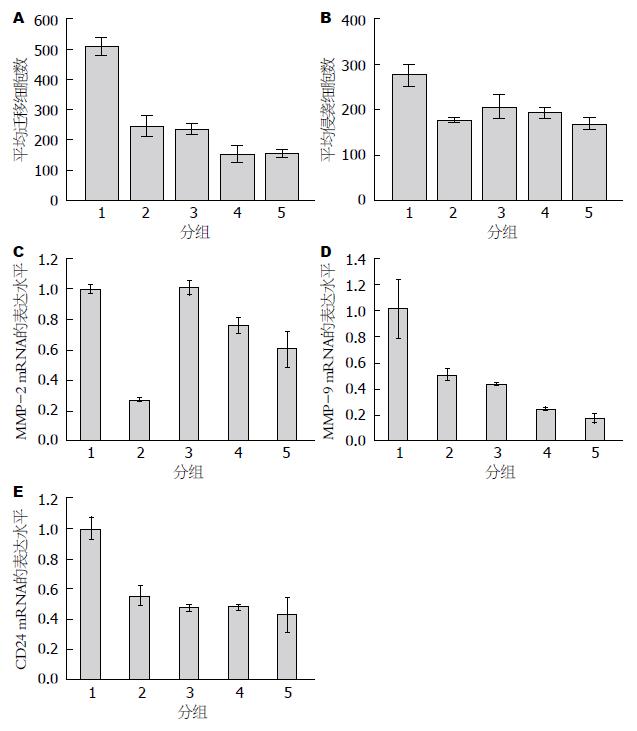
各组A值如表2所示, 6组间A值进行比较差异有统计学意义(P<0.01), 大蒜素各组与阴性对照组相比, 差异有统计学意义(P<0.01), 大蒜素各组与阳性对照组比较, 差异有统计学意义(P<0.01), 大蒜素各组间两两比较, 10、5 μg/mL两组差异无统计学意义, 其余组间比较差异有统计学意义(P<0.01). 说明大蒜素对MHCC97H细胞增殖有抑制作用, 且随剂量增加细胞增殖活性降低, 但大蒜素对MHCC97H的增殖抑制作用较阳性对照组弱.
阴性对照组、10、20、40 μg/mL大蒜素组、阳性对照组的细胞均能穿过滤膜, 100倍显微镜下五组小室底部细胞数分别是: 508.67±28.68、235.67±19.03、152.00±28.16、155.67±13.58、246.67±35.13, 穿过铺Matrigel胶的滤膜的细胞数分别是: 276.00±24.29、206.00±27.06、193.00±12.29、169.00±13.11、177.00±6.00(图1A, B), 5组间比较差异有统计学意义(P<0.01). 大蒜素对MHCC97H细胞的迁移有抑制作用, 一定范围内呈现剂量依赖性, 其中40、20 μg/mL两个浓度的大蒜素对MHCC97H细胞迁移的抑制作用大于阳性对照组(图2A-E). 大蒜素对MHCC97H细胞的侵袭具有抑制作用, 但无明显剂量依赖性. 10 μg/mL以上各浓度梯度对MHCC97H细胞侵袭的抑制作用与阳性对照组无显著差异(图2F-J).
大蒜素作用MHCC97H肝癌细胞24 h后, MMP-2、MMP-9、CD24的mRNA表达水平(图1C-E), 2-△△Ct值(表3): MMP-2、MMP-9、CD24 mRNA表达五组间差异均有统计学意义(P<0.01), MMP-2 mRNA的表达: 40、20 μg/mL大蒜素组显著低于阴性对照组(0.6030±0.1185、0.7590±0.0545 vs 1.0003±0.0276, P<0.01), 40、20 μg/mL大蒜素组显著高于阳性对照组(0.6030±0.1185、0.7590±0.0545 vs 0.2761±0.0136, P<0.01), 提示大蒜素对MHCC97H细胞MMP-2的表达有抑制作用, 其作用较阳性对照组弱; MMP-9 mRNA的表达: 大蒜素各组与阴性对照组两两比较差异均有统计意义(P<0.01), 40、20 μg/mL大蒜素组显著低于阳性对照组(0.1757±0.0380、0.2480±0.0156 vs 0.5109±0.0459, P<0.01), 差异均有统计学意义. 40 μg/mL与20 μg/mL大蒜素组比较, 差异有统计学意义(P<0.05), 说明大蒜素对MHCC97H细胞MMP-9 mRNA表达有抑制作用, 且呈现剂量依赖性.
CD24 mRNA表达: 10、20、40 μg/mL大蒜素组显著低于阴性对照组(0.4726±0.0218、0.4790±0.0189、0.4321±0.1157 vs 1.0018±0.0719), 差异均有统计学意义(P<0.01), 大蒜素各组与阳性对照组(0.5553±0.0645)两两比较, 差异均无统计学意义, 大蒜素各组之间两两比较, 差异均无统计学意义, 提示大蒜素对CD24 mRNA的表达有抑制作用, 无明显剂量依赖性. 扩增和溶解曲线如图3.
肝癌细胞在侵袭、转移的过程中, 细胞外基质的降解和破坏是关键步骤, 在细胞外基质合成与降解的动态平衡中, 基质金属蛋白酶(matrix metalloproteinases, MMPs)发挥了重要调节作用, MMPs是一组含锌离子的依赖性内切酶, MMPs可通过破坏肿瘤细胞周围的物理屏障, 导致肿瘤细胞脱落, 通过破坏基底膜的完整, 从而使肿瘤向周围组织浸润并侵入血管、淋巴管, 研究[16-19]证实, MMPs还可以通过改建细胞外基质, 促进肿瘤血管的生成, 参与肿瘤的免疫过程等机制促进肿瘤细胞发生侵袭和转移. 其中与肝癌侵袭、转移关系最为密切的有MMP-2、MMP-9. Bu等[20]研究表明肝癌组织中MMP-2含量升高与癌栓形成相关, 而癌栓形成是肝癌侵袭转移性最为可靠的指标之一, 因此MMP-2是判断肝癌的侵袭和转移一个重要指标; 此外, Chen等[21]研究证实MMP-9也是用于判断肝癌侵袭、转移和术后复发方面的较好指标. 陈春洲等[22]研究发现MMP-2、MMP-9在肝癌中表达升高, 与有无静脉浸润、有无肝内外转移及有无包膜有关, MMP-2、MMP-9表达明显升高, 与肝癌的生长、侵袭和转移有密切的关系. 本研究证实大蒜素下调MMP-2、MMP-9的mRNA的表达与其抑制肝癌细胞的迁移与侵袭相关, 然而MMPs的表达可在多水平上受到多种方式的调节, 血管内皮生长因子(vascular endothelial growth factor, VEGF)通过转录因子Ets-1调节MMP-9启动子而上调MMP-9 mRNA的表达[23]; 通过转录因子EIAF调节MMP-2启动子[24], 高勇等[25]研究表明大蒜素能下调结肠癌细胞中的VEGF的表达, 因此我们推断大蒜素可能通过抑制VEGF的表达, 进而下调MMP-2、MMP-9的mRNA的表达. 另外肝细胞生长因子、血小板衍生生长因子、表皮生长因子、碱性成纤维细胞因子、核因子-κB等都能不同程度、不同方向的影响MMPs mRNA的表达[26], 但大蒜素对这些因子的影响的报道较少, 因此大蒜素下调肝癌MMP-2、MMP-9 mRNA表达的机制还需更深入的研究.
CD24是一种低分子量高度糖基化的蛋白质黏分子, 由27个氨基酸组成, 通过糖基化磷酯酰肌醇黏附在细胞膜上, 具有多种功能性的糖基化模式, CD24的唯一配体是P-selectin, 其在血小板和活化的内皮细胞中均呈高表达, 所以CD24阳性的肿瘤细胞更容易与血小板及内皮细胞黏附并在循环系统中形成肿瘤栓子[27,28]. CD24的糖基化具有重要作用, 其充当细胞连接位点上分子间相互作用的媒介, 介导细胞间、细胞与基质间的黏附, 这种黏附与淋巴转移和神经网络生成有关[29], 王聪仁等[30]研究发现CD24 mRAN与术前AFP水平、组织学分级、血管浸润正相关, Yang等[31]研究发现CD24的高表达与肝细胞癌的高增殖、侵袭、转移能力相关, 且CD24也可能是一个新的肝癌术后判断预后的指标. 本研究证明大蒜素可以下调CD24 mRNA的表达, 但其作用机制尚无文献报道, 有研究[32]证明NDRG2通过调控CD24进而影响肝癌细胞侵袭能力, 因此大蒜素是否通过上调NDRG2进而影响CD24 mRNA的表达有待进一步研究.
总之, MMP-2、MMP-9及CD24的作用包含导致肝癌细胞脱落、基底膜破坏、血管、淋巴管浸润以及与血小板、内皮细胞结合进而发生远处转移的全过程, 本研究证明大蒜素可以下调MMP-2、MMP-9、CD24的mRNA的表达, 进而抑制肝癌细胞的迁移与侵袭. 另外, 我国大多数的肝癌都发生在病毒性肝炎、肝硬化的基础上, 患者正常肝组织减少, 同时还存在不同程度肝损害, 这不仅使传统化疗药物吸收及代谢出现障碍[33], 而且传统化疗药物的不良反应较多, 肝癌细胞存在原发性耐药, 这些都影响了化疗药物的疗效, 限制了其临床上的应用. 大蒜素相比其他化疗药物, 不良反应较少[34], 近来一些研究[35,36]证实大蒜素还可以提高血管内皮细胞中Ⅱ相解毒酶和谷胱甘肽的表达水平, 其解毒和抗氧化作用, 可以保护肝癌患者的残余肝功能, 因此作为一种潜在的具有保肝作用的抗癌药物, 大蒜素在肝癌中的应用, 尤其是对肝癌远处转移及预后的作用值得进一步研究, 其作用机制也有待更深入的研究.
肝癌起病隐匿, 缺乏特异性症状和体征, 大部分患者发现时多因病灶广泛、或有远处转移等失去手术切除的机会细胞, 且肝癌存在原发性耐药, 绝大多数的肝癌发生在病毒性肝炎、肝硬化的基础上, 正常肝组织减少, 且存在不同程度肝损害, 使传统化疗药物吸收及代谢存在障碍, 很难提高患者生存时间, 改善生存质量. 因此寻找低毒兼具保肝作用的药物很有必要. 大蒜素是百合科葱属植物鳞茎中提取的含硫化合物, 不良反应少, 因此研究大蒜素对肝癌侵袭与迁移的作用有其重要临床意义.
汪余勤, 副主任医师, 上海交通大学医学院附属新华医院内科
大蒜素的防癌、抗癌作用虽已早有报道, 但其对肝癌的作用, 尤其是对肝癌迁移与侵袭的影响及机制的研究较少, 因此本文旨在对这一课题进行初步研究.
大蒜素较之传统化疗药物, 不良反应少, 且兼杀菌消炎、抗溃疡、调血脂、抗高压、提高机体免疫力、保肝等作用, 因此大蒜素是一种潜在的辅助或全身治疗的药物.
自体吞噬: 指细胞将自己细胞质的一部分(如线粒体和内质网)包围起来形成液泡(自体吞噬泡), 再依靠初级溶酶体供应的水解酶将其消化. 自体吞噬可由于饥饿和激素的作用等诱导产生.
本文阐明的大蒜素对肝癌细胞的增殖、迁移和侵袭有抑制作用, 初步阐述的其抑制迁移和侵袭的机制可能与下调MMP-2、MMP-9、CD24 mRNA的表达有关. 而其蛋白表达情况有待进一步阐明, 肝癌的发生、发展和远处转移是多基因改变共同作用的结果, 因此其机制有待进一步研究.
编辑: 于明茜 电编: 闫晋利
| 2. | Borlinghaus J, Albrecht F, Gruhlke MC, Nwachukwu ID, Slusarenko AJ. Allicin: chemistry and biological properties. Molecules. 2014;19:12591-12618. [PubMed] [DOI] |
| 3. | Zhang X, Zhu Y, Duan W, Feng C, He X. Allicin induces apoptosis of the MGC-803 human gastric carcinoma cell line through the p38 mitogen-activated protein kinase/caspase-3 signaling pathway. Mol Med Rep. 2015;11:2755-2760. [PubMed] [DOI] |
| 5. | Lai KC, Hsu SC, Kuo CL, Yang JS, Ma CY, Lu HF, Tang NY, Hsia TC, Ho HC, Chung JG. Diallyl sulfide, diallyl disulfide, and diallyl trisulfide inhibit migration and invasion in human colon cancer colo 205 cells through the inhibition of matrix metalloproteinase-2, -7, and -9 expressions. Environ Toxicol. 2013;28:479-488. [PubMed] [DOI] |
| 6. | Majewski M. Allium sativum: facts and myths regarding human health. Rocz Panstw Zakl Hig. 2014;65:1-8. [PubMed] |
| 7. | Herman-Antosiewicz A, Singh SV. Signal transduction pathways leading to cell cycle arrest and apoptosis induction in cancer cells by Allium vegetable-derived organosulfur compounds: a review. Mutat Res. 2004;555:121-131. [PubMed] [DOI] |
| 8. | Cha JH, Choi YJ, Cha SH, Choi CH, Cho WH. Allicin inhibits cell growth and induces apoptosis in U87MG human glioblastoma cells through an ERK-dependent pathway. Oncol Rep. 2012;28:41-48. [PubMed] [DOI] |
| 9. | Hu Y, Chen L, Yi C, Yang F, Chen J. Experimental study on inhibitory effects of diallyl sulfide on growth and invasion of human osteosarcoma MG-63 cells. J Huazhong Univ Sci Technolog Med Sci. 2012;32:581-585. [PubMed] [DOI] |
| 10. | Xu L, Yu J, Zhai D, Zhang D, Shen W, Bai L, Cai Z, Yu C. Role of JNK Activation and Mitochondrial Bax Translocation in Allicin-Induced Apoptosis in Human Ovarian Cancer SKOV3 Cells. Evid Based Complement Alternat Med. 2014;2014:378684. [PubMed] |
| 11. | Kaschula CH, Hunter R, Stellenboom N, Caira MR, Winks S, Ogunleye T, Richards P, Cotton J, Zilbeyaz K, Wang Y. Structure-activity studies on the anti-proliferation activity of ajoene analogues in WHCO1 oesophageal cancer cells. Eur J Med Chem. 2012;50:236-254. [PubMed] [DOI] |
| 12. | Chu YL, Ho CT, Chung JG, Raghu R, Lo YC, Sheen LY. Allicin induces anti-human liver cancer cells through the p53 gene modulating apoptosis and autophagy. J Agric Food Chem. 2013;61:9839-9848. [PubMed] [DOI] |
| 13. | Chu YL, Ho CT, Chung JG, Rajasekaran R, Sheen LY. Allicin induces p53-mediated autophagy in Hep G2 human liver cancer cells. J Agric Food Chem. 2012;60:8363-8371. [PubMed] [DOI] |
| 15. | 钟 宁, 马 亚兵, 高 海青, 张 志勉, 程 梅, 由 倍安, 伊 永亮, 刘 新春. 大蒜素抑制体外人肝癌细胞的侵袭能力. 世界华人消化杂志. 2005;13:743-747. [DOI] |
| 16. | Li Q, Park PW, Wilson CL, Parks WC. Matrilysin shedding of syndecan-1 regulates chemokine mobilization and transepithelial efflux of neutrophils in acute lung injury. Cell. 2002;111:635-646. [PubMed] [DOI] |
| 17. | McQuibban GA, Gong JH, Tam EM, McCulloch CA, Clark-Lewis I, Overall CM. Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant protein-3. Science. 2000;289:1202-1206. [PubMed] [DOI] |
| 18. | Vandooren J, Van den Steen PE, Opdenakker G. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9): the next decade. Crit Rev Biochem Mol Biol. 2013;48:222-272. [PubMed] |
| 19. | Poyer F, Coquerel B, Pegahi R, Cazin L, Norris V, Vannier JP, Lamacz M. Secretion of MMP-2 and MMP-9 induced by VEGF autocrine loop correlates with clinical features in childhood acute lymphoblastic leukemia. Leuk Res. 2009;33:407-417. [PubMed] [DOI] |
| 20. | Bu W, Huang X, Tang Z. [The role of MMP-2 in the invasion and metastasis of hepatocellular carcinoma (HCC)]. Zhonghua Yixue Zazhi. 1997;77:661-664. [PubMed] |
| 21. | Chen R, Cui J, Xu C, Xue T, Guo K, Gao D, Liu Y, Ye S, Ren Z. The significance of MMP-9 over MMP-2 in HCC invasiveness and recurrence of hepatocellular carcinoma after curative resection. Ann Surg Oncol. 2012;19 Suppl 3:S375-S384. [PubMed] [DOI] |
| 22. | 陈 春洲, 雷 长江, 李 磊, 曾 诚, 黄 剑彬. 肝癌组织中基质金属蛋白酶表达与侵袭转移的关系研究. 中华临床医师杂志(电子版). 2015;9:2504-2507. |
| 23. | Behrens P, Rothe M, Florin A, Wellmann A, Wernert N. Invasive properties of serous human epithelial ovarian tumors are related to Ets-1, MMP-1 and MMP-9 expression. Int J Mol Med. 2001;8:149-154. [PubMed] [DOI] |
| 24. | Nishikawa A, Iwasaki M, Akutagawa N, Manase K, Yamashita S, Endo T, Kudo R. Expression of various matrix proteases and Ets family transcriptional factors in ovarian cancer cell lines: correlation to invasive potential. Gynecol Oncol. 2000;79:256-263. [PubMed] [DOI] |
| 27. | Friederichs J, Zeller Y, Hafezi-Moghadam A, Gröne HJ, Ley K, Altevogt P. The CD24/P-selectin binding pathway initiates lung arrest of human A125 adenocarcinoma cells. Cancer Res. 2000;60:6714-6722. [PubMed] |
| 28. | Kristiansen G, Sammar M, Altevogt P. Tumour biological aspects of CD24, a mucin-like adhesion molecule. J Mol Histol. 2004;35:255-262. [PubMed] |
| 29. | Lee HJ, Choe G, Jheon S, Sung SW, Lee CT, Chung JH. CD24, a novel cancer biomarker, predicting disease-free survival of non-small cell lung carcinomas: a retrospective study of prognostic factor analysis from the viewpoint of forthcoming (seventh) new TNM classification. J Thorac Oncol. 2010;5:649-657. [PubMed] [DOI] |
| 31. | Yang XR, Xu Y, Yu B, Zhou J, Li JC, Qiu SJ, Shi YH, Wang XY, Dai Z, Shi GM. CD24 is a novel predictor for poor prognosis of hepatocellular carcinoma after surgery. Clin Cancer Res. 2009;15:5518-5527. [PubMed] [DOI] |
| 32. | 邱 新毓, 杨 建栋, 张 毅, 李 燕, 李 成花, 张 兰慧, 刘 新平, 郑 瑾. NDRG2通过调控CD24影响肝癌细胞侵袭能力的研究. 现代生物医学进展. 2014;14:1637-1640. |
| 34. | Tao M, Gao L, Pan J, Wang X. Study on the inhibitory effect of allicin on human gastric cancer cell line SGC-7901 and its mechanism. Afr J Tradit Complement Altern Med. 2014;11:176-179. [PubMed] |
| 35. | Izigov N, Farzam N, Savion N. S-allylmercapto-N-acetylcysteine up-regulates cellular glutathione and protects vascular endothelial cells from oxidative stress. Free Radic Biol Med. 2011;50:1131-1139. [PubMed] [DOI] |
| 36. | Horev-Azaria L, Eliav S, Izigov N, Pri-Chen S, Mirelman D, Miron T, Rabinkov A, Wilchek M, Jacob-Hirsch J, Amariglio N. Allicin up-regulates cellular glutathione level in vascular endothelial cells. Eur J Nutr. 2009;48:67-74. [PubMed] [DOI] |