修回日期: 2016-01-06
接受日期: 2016-01-19
在线出版日期: 2016-03-08
巨大肝血管瘤(≥10 cm)常有明显的生长倾向, 危害性也大, 手术切除是其传统治疗手段, 但创伤大、并发症多. 对于这一良性疾病, 临床医生实施手术切除治疗通常承担较大的心理压力, 遂努力尝试着使用微创手段作为替代. 近年来, 射频消融(radiofrequency ablation, RFA)被越来越多地应用于巨大肝血管瘤治疗, 显示了疗效确定、微创、安全等优点以及良好的应用前景. 巨大肝血管瘤的治疗模式正在从传统的手术切除向以RFA为代表的微创治疗方式转变. 本文简述RFA治疗巨大肝血管瘤的现状并展望其前景.
核心提示: 近十多年来, 射频消融(radiofrequency ablation, RFA)越来越多地应用于巨大肝血管瘤(≥10 cm)的治疗, 显示了疗效确定、微创、安全等优点以及良好的应用前景. 巨大肝血管瘤的治疗模式正在从传统的手术切除治疗向以RFA为代表的微创治疗方式转变, RFA有望成为巨大肝血管瘤治疗的首选方式.
引文著录: 高君, 孙文兵. 射频消融距离巨大肝血管瘤首选治疗方案还有多远. 世界华人消化杂志 2016; 24(7): 987-993
Revised: January 6, 2016
Accepted: January 19, 2016
Published online: March 8, 2016
Huge hepatic hemangiomas (≥ 10 cm) are often growthful and harmful. Surgical resection is the traditional treatment for this disease, however, this treatment modality is rather invasive and the operative morbidity and mortality are relatively high. To avoid surgical risk, many minimally invasive procedures have been developed to treat hepatic hemangiomas. In the recent decade, radiofrequency ablation (RFA) has been performed successfully in patients with huge hepatic hemangiomas, showing many advantages over resection, including minimal invasiveness, low complication rate, reduced cost, short hospital stay and increased patient compliance. The treatment strategy for huge hepatic hemangioma is changing from the traditional surgical resection to the minimally invasive treatment with RFA. In the current review, we discuss the present situation and prospect of RFA application in the treatment of huge hepatic hemangiomas.
- Citation: Gao J, Sun WB. Radiofrequency ablation for huge hepatic hemangiomas: How far from being the first-line treatment. Shijie Huaren Xiaohua Zazhi 2016; 24(7): 987-993
- URL: https://www.wjgnet.com/1009-3079/full/v24/i7/987.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i7.987
肝血管瘤是最常见的肝脏良性肿瘤, 占肝良性肿瘤的73%. 文献报道, 普通人群中肝血管瘤发病率为0.4%-20.0%, 尸检发现率为0.4%-7.3%, 是仅次于肝转移癌的肝脏第二常见肿瘤; 中年女性患者多见, 男女比例为1:5-6[1-6]. 在组织学上, 肝血管瘤可分为海绵状血管瘤、硬化性血管瘤、血管内皮细胞瘤和毛细血管瘤, 临床上以海绵状血管瘤多见. 依照瘤体直径大小, 肝血管瘤可分为三级: 小血管瘤(<5 cm)、大血管瘤(5-10 cm)和巨大血管瘤(≥10 cm). 一些国外学者将直径≥4 cm者归为大血管瘤[1-4].
肝血管瘤生长缓慢, 无恶变倾向, 自发破裂者罕见. 如果瘤体较小, 无明显症状, 可临床随访观察; 如血管瘤体积本身较大(≥5 cm), 且生长趋势明显和/或产生明显临床症状(排除胃肠道疾病)时, 则需要积极治疗[5-11]. 巨大肝血管瘤常压迫周围脏器产生临床症状, 更应该积极治疗[8-11].
手术切除是肝血管瘤的传统治疗手段, 但创伤大、并发症多[5-11]. 瘤体越大, 手术风险越高. 虽然手术技巧和围手术期管理水平不断提升, 但手术切除巨大肝血管瘤仍是颇具挑战的外科手术之一[11-16]. 对这一良性疾病, 临床医生实施手术治疗通常承担着较大的心理压力, 转而尝试着使用微创手段治疗肝血管瘤. 放射治疗和肝动脉栓塞术都曾被尝试性应用于肝血管瘤的治疗, 但因疗效不确切、可能发生严重并发症等原因, 未被广泛应用于临床治疗[17-23].
近年来, 射频消融(radiofrequency ablation, RFA)越来越多地应用于肝血管瘤的临床治疗, 显示了疗效确定、微创、安全等优点以及良好的应用前景[24-41]. RFA治疗大肝血管瘤的文献逐年增多, 结论也较一致, 认为RFA可以作为治疗大血管瘤的首选方案之一[24-32]. RFA治疗巨大肝血管瘤的报道较少, 且结论也不尽一致[32-38]. 本文就RFA治疗肝血管瘤的优势、治疗巨大肝血管瘤的研究进展以及前景展望做一论述.
RFA治疗肝血管瘤的原理是通过射频电流产生足够的热量, 毁损其内的血管内皮细胞, 导致广泛的血管损伤和血栓形成等病理改变, 使肝血管瘤组织凝固、碳化, 肿瘤缩小. 显微镜下见消融区红细胞溶解、血管内皮脱落, 血管平滑肌消失、纤维化[28].
RFA治疗肝血管瘤具有多方面的优势: (1)消融目标更为明确, 只需要消融影像可见的瘤体部分, 无需像在RFA治疗肝癌时, 除了主癌灶, 还需要"额外"地消融瘤体周围多量的"正常"肝组织, 产生足够的安全边界; (2)RFA治疗肝血管瘤的目的是阻断供应肝血管瘤的主要血管, 缩小肿瘤体积, 阻止其进一步生长. 而不是像治疗肝癌时, 需要完全清除病灶. 在治疗过程中, 出于安全方面的考虑, 可以毫无遗憾地选择遗留部分肿瘤组织; (3)RFA治疗肝血管瘤的微创性, 必将在很大程度上影响对肝血管瘤治疗时机的选择. 手术切除是肝血管瘤的传统治疗手段, 创伤大, 并发症多. 承担较大的风险治疗良性肿瘤, 医生和患者通常会有很大的心理压力, 倾向于保守地推迟其治疗时机, 很少积极地开展预防性治疗. RFA治疗的微创性和安全性, 为积极地治疗肝血管瘤提供了心理接受方面的可能性和医学伦理方面的合理性. 目前看来, 如果肝血管瘤的直径≥5 cm, 且生长趋势明显时, 及时地应用RFA治疗是合理的; (4)RFA治疗路径上的多样性为拓宽其适应证范围提供了可能[38]. 对于肝实质内血管瘤, 可首选经皮穿刺路径; 而外生性或部分外生性肝血管瘤, 通常与胃、肠、胆囊等空腔脏器的关系较为密切, 更适宜腹腔镜路径. 另外, 多发性肝血管瘤, 特别是分布于左右肝叶者, 更是腹腔镜路径的良好适应证[38-41].
2000年, 马庆久等[24]报道应用RFA治疗大肝血管瘤, 认为RFA可以作为治疗大肝血管瘤的方案之一. 近十多年来, 该领域研究未获得重大突破性进展, 原因主要如下: (1)临床需要治疗的肝血管瘤病例有限, RFA治疗肝血管瘤相关文献均为个案报道和小样本回顾性研究, 文献级别多较低; (2)RFA治疗肝血管瘤尚处于起步阶段, 经验积累不足, 病例选择慎重, 多选择大血管瘤, 罕有治疗巨大血管瘤的报道[24-31]; (3)开展肝肿瘤RFA治疗的医师多为非外科专业, 对肝血管瘤这一传统的外科疾病少有问津.
2011年, Park等[32]报道了采用超声引导下经皮RFA治疗24例(25个)直径≥4 cm肝血管瘤的资料, 包括10个4-5 cm的小血管瘤、10个大血管瘤和5个巨大血管瘤, 结果显示: 完全消融率为92.0%, 其中20个4-10 cm血管瘤的完全消融率为100.0%, 5个巨大血管瘤的完全消融率为60.0%, 2个巨大血管瘤因RFA过程中担心周围脏器热损伤中断治疗, 导致技术失败. 他们认为, RFA适用于治疗大血管瘤, 但巨大血管瘤是其相对禁忌证. 虽然该文章发表在高影响因子杂志上, 但有明显不足: 他们均为影像学医生, 无法开展腹腔镜下RFA治疗, 难以充分发挥RFA治疗的优势. 巨大肝血管瘤因体积较大, 势必会与周围脏器关系密切; 腹腔镜下建立人工气腹可使瘤体与周围脏器充分分离, 从而保证治疗安全的前提下, 最大程度实现完全消融.
2007-2011年我们尝试性地应用RFA治疗了16例17个巨大肝血管瘤, 瘤体最大直径10-16 cm, 平均13.2 cm[34]. 16例均成功接受RFA治疗, 无技术失败; 肿瘤完全消融率高达82.4%(14/17). 但遗憾的是, 消融相关并发症高达100%. 按照Dindo-Clavien分级标准[42], 2例并发症分别为Ⅲ级(低位食管瘘)和Ⅳ级(急性呼吸窘迫综合征); 其他为Ⅰ级, 包括血红蛋白尿16例、发热10例、溶血性黄疸9例、贫血6例、转氨酶升高6例、一过性肾损伤1例和皮肤烧伤2例. 初步研究结果表明, RFA治疗巨大肝血管瘤, 虽然治疗效果满意, 但消融相关并发症发生率过高. 总结消融相关并发症过高的原因如下: (1)由于巨大肝血管瘤自身的特点, 溶血及其相关并发症(包括血红蛋白尿、贫血、黄疸和一过性肾损伤)不可能完全避免; (2)初期经验不足, 过分强调一次性完全消融策略, 而且也未对消融设备进行优化.
2011年后, 我们针对RFA治疗巨大肝血管瘤并发症发生率过高的问题进行了研究, 通过改变治疗理念、完善治疗策略、提升消融设备, 显著降低了消融相关并发症[36]. 2011-2102年, 我们应用RFA治疗了21例患者的21个巨大肝血管瘤, 瘤体最大径10-15 cm, 平均直径12.5 cm. 21例患者均成功接受RFA治疗, 无技术失败; 肿瘤完全消融率高达90.5%(19/21); 消融相关并发症降至47.6%(10/21), 按照Dindo-Clavien分级标准[42], 并发症均为Ⅰ级, 包括血红蛋白尿10例、发热4例、溶血性黄疸3例、贫血1例和转氨酶升高4例. 表明RFA治疗巨大血管瘤同样是微创、安全、有效的. 其他单位的同期资料也得出了同样的结论[43].
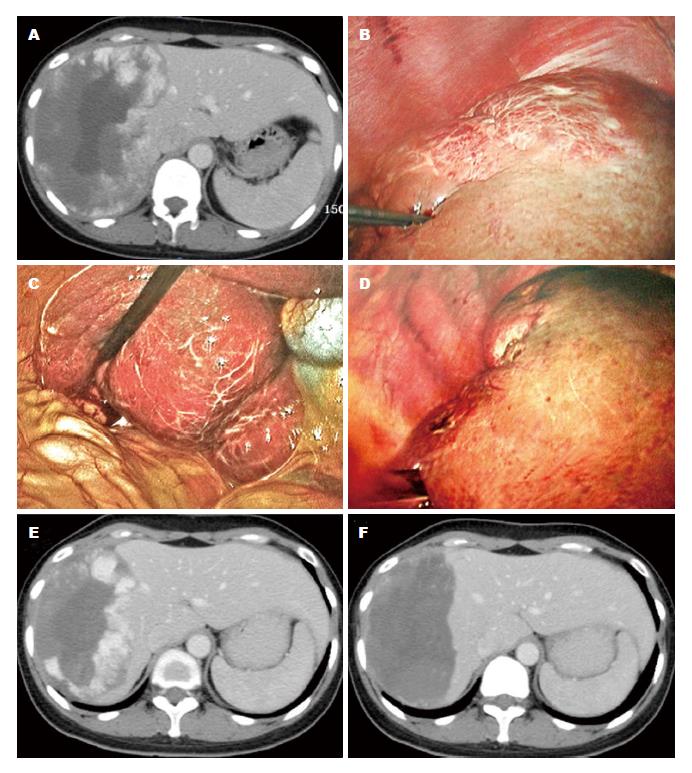
巨大肝血管瘤通常与周围重要脏器毗邻关系密切, 需要消融的时间长, 容易出现肿瘤残留以及穿刺和消融相关并发症. 为进一步提高完全消融率, 降低穿刺和消融相关并发症, 应注意以下几方面: (1)将腹腔镜路径作为首选[37-41](图1). 肝脏毗邻脏器主要有胆囊、胃肠道、肾脏、膈肌、肺脏和心脏等. 巨大肝血管瘤常有部分瘤体突出肝表面, 紧邻周围脏器, 甚至形成黏连. 腹腔镜路径的优势在于可直视肝周的大部分器官, 穿刺和消融过程中可用纱布隔开这些脏器, 减少穿刺伤和热损伤的机会(图1A-C). 消融过程中, 瘤体会逐渐萎缩塌陷, 为后续消融治疗提供更大操作空间(图1D). 腹腔镜路径下, 如有必要, 可采用Pringle法短暂、间断地阻断第一肝门血流, 降低热沉降效应. 此外, 腹腔镜下能够及时发现穿刺点出血和瘤体爆裂出血, 并立即处理, 避免严重后果; (2)巨大肝血管瘤为良性疾病, 不必强求一次性达到完全消融, 必要时可选择重复RFA策略. 具体做法是: 在消融过程中密切监测生命体征和尿液性状, 一旦患者体温超过39 ℃或出现血红蛋白尿, 应终止RFA治疗, 以防发生严重并发症(图1D)[36]. 由于腹腔镜路径下RFA治疗可确保完全消融突出于肝表面的瘤体, 残留瘤体位于肝脏深部(图1E), 重复RFA治疗时, 选择经皮穿刺路径即可实现完全消融(图1F); (3)提升消融效率的系列措施: 包括消融电极经过正常肝组织进入瘤体、适当延长第一个消融点的消融时间、采用"先边缘、后中心"的多点消融策略(图1B)、腹腔镜路径下间断阻断第一肝门血流等. 这些策略可以有效预防穿刺点出血, 提升消融效率; (4)合理选择消融设备. 研究显示, 冷循环、直针设计的消融电极因其功能释放集中、针周组织无焦化等特点, 比较适合肝血管瘤的消融治疗[36]. 另外, 消融电极的直针设计, 更便于术者控制电极的尖端, 最大程度地减少穿刺相关并发症; (5)加强围手术期液体治疗. 肝血管瘤的组织结构特点是充满丰富的血窦. 消融过程中, 瘤体内红细胞不可避免地被破坏, 释放大量血红蛋白进入血循环, 易阻塞肾小管管腔, 影响其滤过功能. 加之消融时患者体温升高, 出汗多, 有效循环血量减少, 易致肾灌注不足, 进一步加重肾功能损伤, 严重者甚至发生急性肾功能衰竭. 因此, 围手术期液体治疗原则是术前要水化, 术中和术后的液体入量要充足, 以保证良好的肾脏灌注; 术中和术后密切观察尿量、尿色, 术中如出现血红蛋白尿, 应终止手术, 给予碱化尿液. 上述措施可最大程度减轻溶血对肾脏的损害, 保护肾功能[44].
RFA治疗巨大肝血管瘤的诸多问题尚待进一步研究, 包括进一步降低消融相关并发症发生率的策略, 肺损伤、肾损伤等严重并发症的发生机制, RFA联合经动脉介入栓塞治疗等微创手段的科学性[45,46], RFA与微波消融[47-50]等手段的应用比较, 巨大肝血管瘤消融过程中生物活性物质的释放及其对靶器官的影响等. 尽管如此, 我们已欣喜地看到, 随着RFA等局部治疗手段在巨大肝血管瘤临床治疗中的广泛开展, 研究资料的循证学证据水平越来越高, 巨大肝血管瘤的治疗模式正在从传统的手术切除治疗向以RFA为代表的局部消融治疗方式转变, RFA可作为巨大肝血管瘤首选治疗方式的那一天已经不远.
手术切除是巨大肝血管瘤的传统治疗手段, 但创伤大、并发症多. 对于这一良性疾病, 临床医生实施手术切除治疗通常承担着较大的心理压力, 转而努力尝试着使用微创手段替代.
郑虹, 主任医师, 天津市第一中心医院外科
近年来, 射频消融(radiofrequency ablation, RFA)越来越多地应用于肝血管瘤的临床治疗, 显示了疗效确定、微创、安全等优点以及良好的应用前景. 目前认为, RFA可以作为治疗大血管瘤的首选方案之一. 但RFA治疗巨大肝血管瘤的安全性和有效性问题尚存在争议.
本文介绍了应用RFA治疗巨大肝血管瘤的最新研究进展以及我们的临床技术和经验, 所引文献新颖、全面, 代表着巨大肝血管瘤非手术治疗的新水平.
准备或近期已启动应用RFA治疗巨大肝血管瘤治疗的同道, 可以通过该文全面了解这一领域的治疗进展, 吸取教训, 借鉴经验.
RFA: 是肝肿瘤常用的微创和局部消融治疗方式. 主要原理是通过射频电流产生足够的热量, 使组织发生凝固性坏死.
本文介绍了巨大肝血管瘤非手术治疗的最新进展及作者单位的有益尝试, 反映巨大肝血管瘤治疗观点的新水平, 对临床相关工作具有重要指导意义. 该文文题确切, 与正文内容相符. 前言开门见山、直接道出本研究的背景与目的. 正文较为恰当, 层次表述清楚, 内容重点突出, 叙述通顺易懂.
编辑: 于明茜 电编: 都珍珍
| 1. | Schnelldorfer T, Ware AL, Smoot R, Schleck CD, Harmsen WS, Nagorney DM. Management of giant hemangioma of the liver: resection versus observation. J Am Coll Surg. 2010;211:724-730. [PubMed] [DOI] |
| 2. | Yedibela S, Alibek S, Müller V, Aydin U, Langheinrich M, Lohmüller C, Hohenberger W, Perrakis A. Management of hemangioma of the liver: surgical therapy or observation? World J Surg. 2013;37:1303-1312. [PubMed] [DOI] |
| 3. | Bajenaru N, Balaban V, Săvulescu F, Campeanu I, Patrascu T. Hepatic hemangioma -review-. J Med Life. 2015;8 Spec Issue:4-11. [PubMed] |
| 4. | Mocchegiani F, Vincenzi P, Coletta M, Agostini A, Marzioni M, Baroni GS, Giovagnoni A, Guerrieri M, Marmorale C, Risaliti A. Prevalence and clinical outcome of hepatic haemangioma with specific reference to the risk of rupture: A large retrospective cross-sectional study. Dig Liver Dis. 2015; Oct 3. [Epub ahead of print]. [PubMed] [DOI] |
| 5. | Toro A, Mahfouz AE, Ardiri A, Malaguarnera M, Malaguarnera G, Loria F, Bertino G, Di Carlo I. What is changing in indications and treatment of hepatic hemangiomas. A review. Ann Hepatol. 2014;13:327-339. [PubMed] |
| 6. | Hasan HY, Hinshaw JL, Borman EJ, Gegios A, Leverson G, Winslow ER. Assessing normal growth of hepatic hemangiomas during long-term follow-up. JAMA Surg. 2014;149:1266-1271. [PubMed] [DOI] |
| 7. | Yoon SS, Charny CK, Fong Y, Jarnagin WR, Schwartz LH, Blumgart LH, DeMatteo RP. Diagnosis, management, and outcomes of 115 patients with hepatic hemangioma. J Am Coll Surg. 2003;197:392-402. [PubMed] [DOI] |
| 8. | Hamaloglu E, Altun H, Ozdemir A, Ozenc A. Giant liver hemangioma: therapy by enucleation or liver resection. World J Surg. 2005;29:890-893. [PubMed] [DOI] |
| 9. | Miura JT, Amini A, Schmocker R, Nichols S, Sukato D, Winslow ER, Spolverato G, Ejaz A, Squires MH, Kooby DA. Surgical management of hepatic hemangiomas: a multi-institutional experience. HPB (Oxford). 2014;16:924-928. [PubMed] [DOI] |
| 10. | Li M, Zhang C, Zhang T, Wang L, Ding Y, Niu Z, He S, Yang Z. Outcome using selective hemihepatic vascular occlusion and Pringle maneuver for hepatic resection of liver cavernous hemangioma. World J Surg Oncol. 2015;13:267. [PubMed] [DOI] |
| 11. | Zhang W, Huang ZY, Ke CS, Wu C, Zhang ZW, Zhang BX, Chen YF, Zhang WG, Zhu P, Chen XP. Surgical Treatment of Giant Liver Hemangioma Larger Than 10 cm: A Single Center's Experience With 86 Patients. Medicine (Baltimore). 2015;94:e1420. [PubMed] [DOI] |
| 12. | Lanthaler M, Freund M, Nehoda H. Laparoscopic resection of a giant liver hemangioma. J Laparoendosc Adv Surg Tech A. 2005;15:624-626. [PubMed] [DOI] |
| 14. | Toro A, Gagner M, Di Carlo I. Has laparoscopy increased surgical indications for benign tumors of the liver? Langenbecks Arch Surg. 2013;398:195-210. [PubMed] [DOI] |
| 15. | Cai X, Li Z, Zhang Y, Yu H, Liang X, Jin R, Luo F. Laparoscopic liver resection and the learning curve: a 14-year, single-center experience. Surg Endosc. 2014;28:1334-1341. [PubMed] [DOI] |
| 16. | Boggi U, Caniglia F, Vistoli F, Costa F, Pieroni E, Perrone VG. Laparoscopic robot-assisted resection of tumors located in posterosuperior liver segments. Updates Surg. 2015;67:177-183. [PubMed] [DOI] |
| 17. | Park WC, Rhillips R. The role of radiation therapy in the management of hemangiomas of the liver. JAMA. 1970;212:1496-1498. [PubMed] [DOI] |
| 18. | McKay MJ, Carr PJ, Langlands AO. Treatment of hepatic cavernous haemangioma with radiation therapy: case report and literature review. Aust N Z J Surg. 1989;59:965-968. [PubMed] [DOI] |
| 19. | Gaspar L, Mascarenhas F, da Costa MS, Dias JS, Afonso JG, Silvestre ME. Radiation therapy in the unresectable cavernous hemangioma of the liver. Radiother Oncol. 1993;29:45-50. [PubMed] [DOI] |
| 20. | Cao X, He N, Sun J, Wang S, Ji X, Wang J, Zhang C, Yang J, Lu T, Li J. Interventional treatment of huge hepatic cavernous hemangioma. Chin Med J (Engl). 2000;113:927-929. [PubMed] |
| 21. | Huang XQ, Huang ZQ, Duan WD, Zhou NX, Feng YQ. Severe biliary complications after hepatic artery embolization. World J Gastroenterol. 2002;8:119-123. [PubMed] [DOI] |
| 22. | Giavroglou C, Economou H, Ioannidis I. Arterial embolization of giant hepatic hemangiomas. Cardiovasc Intervent Radiol. 2003;26:92-96. [PubMed] [DOI] |
| 23. | Sun JH, Nie CH, Zhang YL, Zhou GH, Ai J, Zhou TY, Zhu TY, Zhang AB, Wang WL, Zheng SS. Transcatheter Arterial Embolization Alone for Giant Hepatic Hemangioma. PLoS One. 2015;10:e0135158. [PubMed] [DOI] |
| 25. | Cui Y, Zhou LY, Dong MK, Wang P, Ji M, Li XO, Chen CW, Liu ZP, Xu YJ, Zhang HW. Ultrasonography guided percutaneous radiofrequency ablation for hepatic cavernous hemangioma. World J Gastroenterol. 2003;9:2132-2134. [PubMed] [DOI] |
| 26. | Zagoria RJ, Roth TJ, Levine EA, Kavanagh PV. Radiofrequency ablation of a symptomatic hepatic cavernous hemangioma. AJR Am J Roentgenol. 2004;182:210-212. [PubMed] [DOI] |
| 27. | Fan RF, Chai FL, He GX, Wei LX, Li RZ, Wan WX, Bai MD, Zhu WK, Cao ML, Li HM. Laparoscopic radiofrequency ablation of hepatic cavernous hemangioma. A preliminary experience with 27 patients. Surg Endosc. 2006;20:281-285. [PubMed] [DOI] |
| 28. | Tak WY, Park SY, Jeon SW, Cho CM, Kweon YO, Kim SK, Choi YH, Chung JM. Ultrasonography-guided percutaneous radiofrequency ablation for treatment of a huge symptomatic hepatic cavernous hemangioma. J Clin Gastroenterol. 2006;40:167-170. [PubMed] |
| 29. | Hinshaw JL, Laeseke PJ, Weber SM, Lee FT. Multiple-electrode radiofrequency ablation of symptomatic hepatic cavernous hemangioma. AJR Am J Roentgenol. 2007;189:W146-W149. [PubMed] [DOI] |
| 30. | Sharpe EE, Dodd GD. Percutaneous radiofrequency ablation of symptomatic giant hepatic cavernous hemangiomas: report of two cases and review of literature. J Vasc Interv Radiol. 2012;23:971-975. [PubMed] [DOI] |
| 31. | Zhang X, Yan L, Li B, Wen T, Wang W, Xu M, Wei Y, Yang J. Comparison of laparoscopic radiofrequency ablation versus open resection in the treatment of symptomatic-enlarging hepatic hemangiomas: a prospective study. Surg Endosc. 2015; Jun 27. [Epub ahead of print]. [PubMed] [DOI] |
| 32. | Park SY, Tak WY, Jung MK, Jeon SW, Cho CM, Kweon YO, Kim KC. Symptomatic-enlarging hepatic hemangiomas are effectively treated by percutaneous ultrasonography-guided radiofrequency ablation. J Hepatol. 2011;54:559-565. [PubMed] [DOI] |
| 34. | Gao J, Ke S, Ding XM, Zhou YM, Qian XJ, Sun WB. Radiofrequency ablation for large hepatic hemangiomas: initial experience and lessons. Surgery. 2013;153:78-85. [PubMed] [DOI] |
| 36. | Gao J, Ding X, Ke S, Xin Z, Ning C, Sha Q, Sun W. Radiofrequency ablation in the treatment of large hepatic hemangiomas: a comparison of multitined and internally cooled electrodes. J Clin Gastroenterol. 2014;48:540-547. [PubMed] [DOI] |
| 37. | Gao J, Kong J, Ding XM, Ke S, Niu HG, Xin ZH, Ning CM, Guo SG, Li XL, Zhang L. Laparoscopic vs computerized tomography-guided radiofrequency ablation for large hepatic hemangiomas abutting the diaphragm. World J Gastroenterol. 2015;21:5941-5949. [PubMed] [DOI] |
| 41. | 刘 浩润, 王 观发, 李 为民, 赵 洪强, 郑 方, 杜 继东, 戴 新, 许 长涛. 腹腔镜射频消融治疗肝海绵状血管瘤的体会. 胃肠病学和肝病学杂志. 2013;22:28-30. |
| 42. | Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240:205-213. [PubMed] [DOI] |
| 43. | van Tilborg AA, Nielsen K, Scheffer HJ, van den Tol P, van Waesberghe JH, Sietses C, Meijerink MR. Bipolar radiofrequency ablation for symptomatic giant (& gt; 10 cm) hepatic cavernous haemangiomas: initial clinical experience. Clin Radiol. 2013;68:e9-e14. [PubMed] [DOI] |
| 44. | 孔 健, 高 君, 王 劭宏, 钟 玉萍, 秦 晓新, 丁 雪梅, 柯 山, 孙 文兵. 肝血管瘤射频消融致严重溶血和明显肾功能损害一例. 中华普通外科杂志. 2010;25:691-692. |
| 45. | 何 伏虎. 经导管动脉栓塞联合CT导引经皮经肝肿瘤射频消融术治疗肝血管瘤. 中华普通外科学文献(电子版). 2010;4:560-563. |
| 46. | 高 珲, 何 显力, 鲁 建国, 乔 庆, 吴 涛, 曹 伟, 徐 根强, 包 国强. 射频消融联合动脉栓塞治疗肝脏巨大血管瘤的疗效分析. 现代肿瘤医学. 2011;19:2276-2280. |
| 48. | Ziemlewicz TJ, Wells SA, Lubner MA, Musat AI, Hinshaw JL, Cohn AR, Lee FT. Microwave ablation of giant hepatic cavernous hemangiomas. Cardiovasc Intervent Radiol. 2014;37:1299-1305. [PubMed] [DOI] |
| 49. | Tang XY, Wang Z, Wang T, Cui D, Zhai B. Efficacy, safety and feasibility of ultrasound-guided percutaneous microwave ablation for large hepatic hemangioma. J Dig Dis. 2015;16:525-530. [PubMed] [DOI] |
| 50. | Liu L, Li N. Feasibility and Advantages of Large Liver Hemangioma Treated with Laparoscopic Microwave Ablation. Hepatogastroenterology. 2014;61:1068-1073. [PubMed] |