修回日期: 2016-01-05
接受日期: 2016-01-19
在线出版日期: 2016-02-28
炎症性肠病(inflammatory bowel disease, IBD)是由于自身免疫系统紊乱引起免疫系统过度反应的慢性炎症性疾病, 包括克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(ulcerative colitis, UC). 其病因未完全明确, 且多发的肠外表现加重了IBD治疗的复杂性. 骨关节炎(osteoarthritis, OA)是IBD中最常见的肠外表现, 因其也是一种炎性疾病, 所以我们设想, 在关节炎关节形成过程中的炎症反应是否可引起IBD的发生, 或加剧IBD的进展. 作者在哈佛大学电子数据库中的PubMed使用关键词" Crohn's disease、ulcerative colitis、arthritis、treatment"搜索近5年来此领域的文献, 并筛选出与本篇综述相关的文献进行阅读, 在此对IBD的肠外表现及治疗进行全面综述, 并对骨关节炎与IBD之间的关系进行总结与设想.
核心提示: 炎症性肠病(inflammatory bowel disease, IBD)是消化系统疾病中临床表现多样的一类慢性复发性疾病, 包括克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(ulcerative colitis, UC), 发病率呈逐年上升趋势. 其复杂的肠外表现给患者带来更多的身心痛苦, 也使得临床治疗变得更为复杂. 本文综述了CD和UC的肠外表现及主要肠外表现的治疗, 以供临床参考.
引文著录: 张夏璐, 李冶夫, 周平. 炎症性肠病肠外临床表现及对应治疗策略的研究进展. 世界华人消化杂志 2016; 24(6): 894-901
Revised: January 5, 2016
Accepted: January 19, 2016
Published online: February 28, 2016
Inflammatory bowel disease (IBD) is characterized by severe inflammation and the mucosal damage in the intestines, including Crohn's disease (CD) and ulcerative colitis (UC). The etiology of IBD is currently unknown. Patients with IBD exhibit clinical symptoms in digestive systems and extra-intestinal manifestations (EIMs). The EIMs make the treatment of IBD becomes more complicated. Numerous studies report that osteoarthritis (OA) is the most EIM in patients with IBD. The clinical consequence of IBD is due to the overreaction of the immune system. Data from recent investigations suggest that inflammation is, at least in part, involved in the development of OA. Based on inflammation implicated in both IBD and OA, a question remains whether inflammation in OA can initiate IBD or exacerbate the condition of IBD. To address this question, the authors search articles on Pubmed in the last five years from Harvard University Database by use of the key words "Cronh's disease", "ulcerative colitis", "treatment" and "arthritis". The authors review all of these articles to describe OA in IBD and discuss the possible relationship between IBD and OA.
- Citation: Zhang XL, Li YF, Zhou P. Extraintestinal manifestations of inflammatory bowel disease and their treatment strategies. Shijie Huaren Xiaohua Zazhi 2016; 24(6): 894-901
- URL: https://www.wjgnet.com/1009-3079/full/v24/i6/894.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i6.894
炎症性肠病(inflammatory bowel disease, IBD)是一种以肠道严重的炎症及黏膜破坏为特征的慢性疾病, 包括克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(ulcerative colitis, UC). CD可发生在任何年龄, 以青少年时期最常见[1]. 可影响从口腔到肛门的任何胃肠道的部分, 呈节段式或跳跃式分布. 其中以末端回肠、结肠、同时累及小肠和结肠这三种最常见, 发生率分别为30%、20%、45%[2]. UC也可发生在任何年龄, 以15-30岁及50-70岁这两个年龄段最为多发, 主要侵犯直肠和乙状结肠, 呈弥漫性分布. IBD有多种临床表现, 包括消化系症状、全身症状及肠外表现. 肠外表现在IBD中有很高的发病率, 同一种肠外表现的复发很常见, 且患一种肠外表现后出现其他种类肠外表现的风险也明显增高[3]. 这一特点又加重了IBD 治疗的复杂性. 在IBD患者的肠外表现中, 最多发且严重影响患者生活质量的疾病为骨关节炎. 他是一种滑膜关节的进行性疾病, 表现为滑膜关节组织异常使得重力导致的关节损害不能正常修复. 因IBD与骨关节炎均为炎性疾病, 但现阶段尚无骨关节炎是否对IBD的发生、发展起到一定作用的研究. 所以我们对IBD的肠外表现及治疗作详细综述, 并在此基础上对骨关节炎与IBD的关系进行总结与设想.
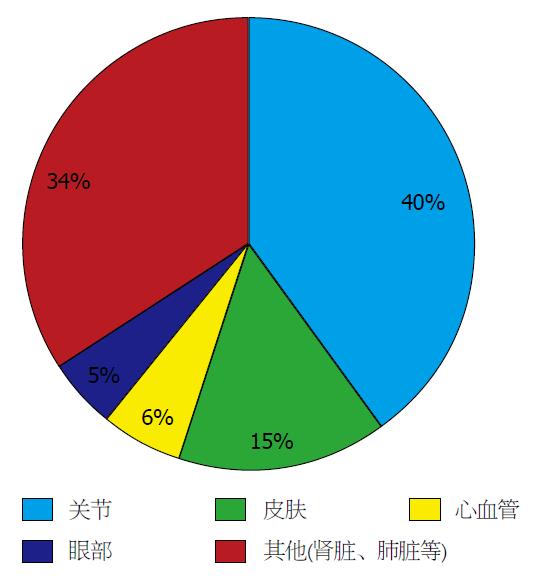
肠外表现在IBD患者中发病率较高, 已报道的发病率范围为6%-47%[4]. 可于消化系症状之前或之后出现, Vavricka等[5]在今年发表的文章中对肠外表现与IBD诊断时间的关系进行了总结. 他们指出, 有1/4的IBD患者在诊断之前就出现了肠外表现, 3/4的患者在诊断之后出现, 且在诊断IBD以后的30年中, 有1/2的患者出现至少一种肠外表现. 肠外表现的发病机制尚不完全清楚, 但可以肯定的是细菌通过胃肠道黏膜可以引发肠道外部位的免疫反应[6,7]. 肠外表现可发生在任何器官及组织, 对患者的身体状态和生活质量有很大的影响. 有研究[8,9]指出, 在某些器官引发自身免疫反应与遗传因素有关: 70%的父母与子女、84%的兄弟姐妹之间会出现同一器官的肠外表现. 此外, 更有文章[10]报道CD患者的肠外表现更常出现于有HLA-A2、HLA-DR1和HLA-DQw5这些组织相容性复合体基因位点的患者中; UC患者则为HLA-DR103. 根据2015年最新发表的关于IBD肠外表现的文章[4,11], 肠外表现最常侵犯关节、皮肤、心血管系统及眼部; 其次为肾脏、肺脏等, 其发病率如图1.
关节病变包括外周大关节、小关节以及脊柱关节. 骨关节炎是关节炎最常见的类型[12], 被定义为滑膜关节的进行性疾病, 表现为滑膜关节组织异常使得重力导致的关节损害不能正常修复. 软骨和骨骼的破坏最终导致疼痛、僵硬和功能丧失等临床表现[13]. 尽管骨关节炎的病因尚不十分明确, 但普遍认为骨关节炎是一种多因子疾病, 包括基因和环境因素[12]. 遗传因素是指基因突变导致关节软骨基质和软骨细胞代谢的缺陷. 环境因素包括肥胖、关节承受载荷加大, 半月板和韧带的反复损伤、肌肉强度的减少和关节错位. 这些因素使异常的机械应力作用于正常关节, 最终导致骨关节炎. 此外, 越来越多的证据证明炎症, 如滑膜、软骨细胞和其他组织释放细胞因子, 在关节软骨的破坏中发挥作用[14,15]. 显然, 骨关节炎是由于关节组织及一种或多种的基因、环境因素共同作用下产生的. 相对于复杂的病因, 在骨关节炎的发展中, 关节软骨破坏的根本原因是由于一定的病理学模式[16-19]. 对骨关节炎动物模型及人类骨关节炎组织的研究表明, 在关节软骨退化的过程中, 最早出现的现象为软骨细胞聚集以及软骨细胞合成活性的上调[20]. 在人类骨关节炎病例中, 于关节软骨退化的早期阶段从关节中获得关节软骨是非常困难的. 然而, 软骨细胞聚集和细胞周基质膨胀在骨关节炎晚期剩余的关节软骨中被发现[17]. 观察软骨细胞合成活动的上调时发现, 软骨细胞合成和释放细胞外基质降解酶. 随后出现关节软骨表面蛋白多糖的逐渐丢失, 与Ⅱ型胶原降解同时发生. 关节表面出现裂纹, 产生的组织学图像称为纤维化. 在退化过程的末期, 纤维软骨和骨赘形成. 关节软骨退化相似的病理进展表明, 可能存在多种起始途径朝向共同的靶点作用于关节软骨退化, 这些最终导致骨关节炎的发生.
骨关节炎在IBD患者中的发病率为40%. Dorofeyev等[21]在2009年发表了一篇针对319例UC患者的关节病变研究的文章, 其中表明95例(29.8%)的UC患者患有关节病变, 且多见于左侧及全结肠炎. 此外, 在一项关于小儿科IBD患者关节病的研究中显示, 儿童IBD患者关节病的发病率为25%[22].
1.1.1 外周关节炎及关节痛: 外周关节炎及关节痛属于血清反应阴性关节炎及关节痛[23], 较少甚至不引起关节破坏. 其被分为少关节型关节炎及关节痛和多关节型关节炎及关节痛(表1): 少关节炎型关节炎及关节痛累及少于5个大关节, 如踝关节、膝关节、髋关节、腕关节、肩关节等, 多不对称, 与 IBD的活动性相关, 但又具有自限性(10 wk)[24]. 多关节型关节炎及关节痛是一种对称性关节炎, 常发生于5个或5个以上的小关节, 与肠道疾病的活动性无关, 且可能发生于IBD诊断之前. 其无自限性, 常可持续发病多年(平均3年)[24].
| 项目 | 少关节型 | 多关节型 |
| 在UC中发病率 | 35% | 24% |
| 在CD中发病率 | 29% | 20% |
| 累及关节数量 | 少于5个关节 | 5个或更多关节 |
| 累及关节类型 | 主要为大关节 | 主要为小关节 |
| 关节受累几率 | 膝关节>踝关节>腕关节>肘关 节>掌指关节>髋关节>肩关节 | 掌指关节>膝关节>近端指间关节 >腕关节>踝关节>肘关节>肩关节 |
| 对称性与否 | 非对称性 | 对称或不对称性 |
| 与肠道疾病活动的关系 | 与肠道疾病活动相关 | 与肠道疾病活动无关 |
| 病情持续时间 | 自限性, <10 wk | 病情持续数月甚至数年 |
| 相关因子 | 与HLA-B27, B35和DR103相关 | 与HLA-B44相关 |
1.1.2 脊柱关节炎: 脊柱关节炎较周围关节炎及关节痛少见, 在IBD患者中发病率约为3%-5%, 男性较女性多发[4]. 脊柱关节炎包括强直性脊柱炎和骶髂关节炎. 强直性脊柱炎在IBD患者中发病率为5%-10%, 且多伴随HLA-B27阳性[4,8,25]. 强制性脊柱炎患者在年轻时多出现严重的背痛、晨僵及睡眠休息时疼痛加剧. 骶髂关节炎在约25%的患者的X线片中被发现[26], 且患者多为HLA-B27阴性, 不会发展为强直性脊柱炎.
皮肤病变在IBD患者中的发病率为15%, 仅次于关节病变. 根据发病机制, 将皮肤病变分为三类[2]: (1)特异性病变. 即与胃肠道病变有相同的病理组织学发现; (2)反应性病变. 即其炎症过程与胃肠道病理学不同; (3)并发症. 即由HLA相关因子引起或为慢性炎症的后遗症. 临床常见的皮肤病变为结节性红斑(erythema nodosum, EN)、坏疽性脓皮病(pyoderma gangrenosum, PG)、Sweet's综合征及口腔病变等.
EN是间隔性脂膜炎的一种, 无伴随的血管炎. 在CD中患病率为约15%, 在UC中为10%[27], 女性中更常见. EN常表现为凸起的、红色或紫色的炎性皮下结节, 直径为1-5 cm. 特征性地易出现在下肢前伸肌表面, 较少出现于面部和躯干[27]. 当情绪不安、疲劳及关节痛时更易引起EN.
PG是一种更罕见、更危重的皮肤肠外表现, 在IBD患者中的发病率为0.4%-2.0%, 在UC中更常见, 女性比男性多发[4]. 其最常出现于下肢伸肌表面, 也可出现于身体任何部位, 包括生殖器[28]. 有文章报道1例年轻的女性CD患者出现腋窝部位的PG[29]. 早在1983年, Gellert等[30]报道了1例女性CD患者的PG是从EN发展而来. PG首先表现为红斑、脓包、结节, 进而侵犯周围皮肤出现肉芽组织坏死、青紫色, 有脓液流出, 且病变与周围组织分辨不清[31].
Sweet's综合征又名急性发热性嗜中性皮病, 是IBD的一种罕见的皮肤病学方面的肠外表现. 除IBD之外, Sweet's综合征也与恶性肿瘤联系紧密. 其常于手臂、腿部、躯干、手部和面部出现鳞屑性丘疹或结节. 实验室及组织学检查可发现白细胞增多及中性粒细胞浸润. 还可引起其他症状, 如关节炎、发热、视觉病变(结膜炎等)[4]. 其与胃肠道病变的活动性无关, 常可在IBD诊断之前出现[32].
口腔病变在CD患者及儿童中更常见, 牙周炎、口疮性口炎及一些危重病例中出现的增殖性脓性口炎在IBD中的发病率约为10%[4,8]. 口疮可发生在唇黏膜或颊黏膜, 以及舌头和口咽部. 2014年, Salek等[33]报道了1例64岁男性CD患者, 近30年处于缓解期, 口腔黏膜突然出现鹅卵石样溃疡伴疼痛, 但无胃肠道症状. 对其溃疡进行外科活组织检查示无坏死的、慢性肉芽肿性溃疡, 与其30年前诊断CD时的小肠活组织检查结果相似, 在局部激素治疗后好转. 此外, 上颚溃疡、嘴唇肿胀等也已见报道[34,35].
2010年, 有学者曾报道1例35岁的男性UC患者被诊断心包填塞, 在此之前, 仅有9篇文献报道过类似病例[36]. Kuy等[11]在2015年发表的文章中对过去十年里全国患者样本数据库(Nationwide Inpatient Sample Database)中的46万多例IBD患者进行研究, 血栓栓塞的发生率为6%. 在最近的一份Meta分析中显示: IBD患者患有深静脉血栓及肺栓塞的风险较普通人群比较, 其相对风险为1.96(95%CI: 1.67-2.30)[37]. 活动期的肠道疾病、高同型半胱氨酸血症、脱水、长期卧床、留置导管、吸烟、应用口服避孕药等都为深静脉血栓的风险因素. 也曾有文章报道1例62岁的男性CD患者, 因腹膜后脓肿入院治疗, 在此期间出现外周动脉栓塞并进行紧急的栓塞切除术, 随后运用长期的抗凝剂低分子肝素维持治疗.
除关节、皮肤和心血管系统之外, 眼部是第4个IBD主要的肠外表现好发部位, 约2%-5%的患者出现眼部病变[4,8], CD和UC患者发病率分别为3.5%-6.3%和1.6%-4.6%, 主要包括巩膜炎和葡萄膜炎[2,4,38]、视神经炎等.
巩膜炎病因尚不十分明确, 多见于外源性抗原抗体所致的过敏性反应, 好发于40-50岁的中年人. 以急性充血、眼痛、畏光等为特征, 如不早期诊断及治疗可引起视觉损伤. 周期性的巩膜炎可引起巩膜软化、视网膜脱离或视神经肿胀.
葡萄膜炎较巩膜炎少见, 在IBD患者中的发病率为0.5%-3.0%[39]. 在UC患者中常发病隐匿、病程长、多为双侧发病[39]. 其表现为眼痛、视力模糊、畏光和头痛. 2011年, 有学者在对18例患有眼内疾病的IBD患者进行研究的过程中发现, 严重的葡萄膜炎患者常伴有HLA-B27阳性[40].
有研究报道视神经炎在成人IBD患者中的发病率为4%, 可在IBD被诊断之前出现, 且与IBD活动性无关[41]. 主要表现为视力的突然下降, 眼球后部牵引样疼痛, 眼眶压痛, 瞳孔对光反射迟钝甚至消失. 现只有少量文章报道对其进行报道, 且均为成人IBD患者. 2011年, Barabino等[41]第1次报道了1例11岁儿童CD患者患有视神经炎, 并突然失明的病例.
1.5.1 肾脏: IBD患者最常见的肾脏损害有: 肾结石、肾小管间质肾炎、肾小球肾炎和肾淀粉样变性[42]. 肾脏损害被认为与药物不良反应相关[42,43]. 一般肾脏损害好发于成人, 仅有少量文献报道儿童IBD患者的肾脏病变.
1.5.2 肺脏: 肺脏疾病出现在IBD患者中的报道可追溯到1976年, 此后陆续出现超过400例的病例报道[44]. 肺脏病变在IBD患者中有多种形式, 如气管支气管炎、支气管扩张、朗格汉斯细胞肉芽肿、纤维性肺泡炎和隐源性机化性肺炎等[45].
1.5.3 耳部: 1973年, Levitan等[46]第1次在文章中对5例IBD患者听力损失进行报道, 至今只有极少量的病例和小的流行病学研究对对称的感觉性听力损失及IBD之间的关系进行研究. 2013年, 有文章报道[47]了1例20岁的男性患者, 3 mo前开始出现腹泻、疲劳、体质量减轻及炎性背痛, 随后1 mo突然出现双侧耳聋伴眩晕和呕吐, 入院后经过体格检查、实验室检查、内镜检查及听力图测试, 诊断其为CD伴脊柱关节炎及对称的感觉性听力损失.
1.5.4 精神疾病: 早在1987年就有文章报道了IBD患者较普通人群有更高的风险出现精神疾病[48]. 2013年, Triantafillidis等[49]报道了第1例以精神病为主要临床表现的CD患者, 手术切除肠道病灶后, 其精神症状随之消失.
1.5.5 卵巢: 卵巢病变在IBD患者中十分罕见. 在2015-07最新发表的一篇文章中, 作者对11篇英文文献共15例卵巢肉芽肿的IBD患者进行研究发现, 患者最好发年龄为33.7岁, 且右侧卵巢多发[50]. 此外, 也有文章报道1例26岁的女性UC患者患有免疫性血小板减少性紫癜, 使用抗肿瘤坏死因子成功治愈[51].
IBD肠外表现的治疗应以其临床症状的多样性及与IBD活动的相关性为基础. 主要目的为控制临床症状及保护各受累组织和器官的灵活性或功能性[3].
现阶段对IBD相关性骨关节炎的治疗是以减少炎症和防止残疾及畸形为目的[52]. Ⅰ型外周关节炎与IBD的活动性相关, 使用药物和手术积极治疗原发IBD就可以有效控制关节炎病情. 有研究表明, 在成功治疗IBD之后的8-10 wk, 骨关节炎症状可消失[4], 且无关节损害和畸形[23]. Ⅱ型外周关节炎与IBD的活动性无关, 肠道症状治疗对骨关节炎无效, 所以以物理疗法和止痛治疗为主[4]. IBD相关的强直性脊柱炎治疗完全依据无IBD的单纯强直性脊柱炎治疗方案: 物理治疗被用来保持脊柱灵活性和防止脊柱畸形; 运动方案包括深呼吸、脊柱运动和游泳[53]. 骶髂关节炎通常无症状[54], 无特殊治疗方案, 以物理治疗为主. 除此之外, 非甾体抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)、抗肿瘤坏死因子(anti-TNF)、柳氮磺吡啶、类固醇类等药物广泛应用于IBD相关的骨关节炎治疗中, 但因药物自身的不良反应及病情的复杂性, 使得药物在IBD相关骨关节炎中的应用更为谨慎和多样化[3,4,52,54].
EN的治疗主要基于原发IBD的治疗, 包括全身类固醇的使用, 几天内即可改善症状, 随后剂量可根据临床疗效适当增减. 如患者出现耐药或反复复发的情况, 可单独或联合使用免疫抑制剂和英夫利西单抗[55,56]. 口腔病变, 如口内炎等的治疗, 也与疾病的活动性和原发IBD的治疗紧密相关. PG是IBD患者最严重的皮肤病变, 通常在治疗原发IBD及对症治疗皮肤症状后仍不能缓解. 因此, 积极早期的治疗和局部伤口护理显得尤为重要. 有文章报道, 高剂量的全身类固醇成为一线治疗药物, 与硫唑嘌呤和6-巯基嘌呤被使用于激素依赖型患者中[57]. 静脉环孢霉素和他克莫司单独使用或联合糖皮质激素被用于治疗难治性患者[58]. 此外, 氨苯砜、沙利度胺、氯法齐明、血浆置换及高压氧治疗也被报道用于PG的治疗中[3]. 多数Sweet's综合征患者对局部或系统的激素治疗有效, 且痊愈后没有疤痕.
抗凝药用于治疗急性肾静脉栓塞和肺栓塞. 治疗在遵守国际准则[59]的同时需根据患者的不同病情作出适当调整. 对急性肾静脉栓塞和肺栓塞的患者, 应持续使用抗凝剂: 至少连续3 mo使用低分子或普通肝素, 或将Xa因子抑制剂用于初始治疗, 随后使用维生素K拮抗剂. 长期治疗尤其应应用于静脉栓塞的患者中.
由于眼部病变有潜在的失明的风险, 每一个疑似出现眼部病变的IBD患者均需经过专业的眼科医生评估, 通过裂隙灯等检查确认诊断并指导治疗. 有文章报道, 表层巩膜炎或为自限性, 通常在治疗原发IBD后病情好转, 可同时使用局部类固醇及镇静剂[60]. 葡萄膜炎有时需要紧急的眼科治疗以防出现视力丧失的风险, 治疗包括局部或全身类固醇的使用. 此外, 咪唑硫嘌呤、甲氨蝶呤、英夫利西被报道用于难治性患者[61].
肺脏病变可使用气管支气管镜及胸腔镜检查帮助诊断, 多用皮质类固醇进行治疗. 肾脏病变、卵巢病变及精神病变等, 多见于个案报道中, 尚无清晰明确的治疗方案.
IBD的发病率呈现逐年增长的趋势, 因其发病原因尚不十分明确、病情迁延不愈等特点, 使得IBD成为消化系统疾病中亟待攻克的难题. 众所周知, IBD的临床表现除了消化系及全身症状外, 其多发的肠外表现给患者带来更多身心的痛苦, 也使疾病的治疗等变得更加复杂. IBD的肠外表现可累及多个组织或器官, 除关节、皮肤等病变外, 肾脏、肺脏、肝胆等器官的肠外表现仍只多见于个案报道, 尚需多样本的前瞻性研究, 以更全面地了解IBD的肠外表现特点及探索更优质的治疗方案. 本篇文章在综述IBD肠外表现及其治疗的同时, 也深入了解了肠外表现中发病率最高的骨关节炎. 在20世纪50年代末期, 人们才把出现在IBD患者中的关节炎从风湿性关节炎中区别开来[52]. 1964年, 美国风湿协会将IBD中的关节炎划分为独立的临床形式[62]. IBD是由于自身免疫系统紊乱引起免疫系统过度反应而导致临床症状的出现, 而骨关节炎也是一种炎性疾病, 所以根据现有的知识及研究, 我们设想关节软骨退化过程中的炎症反应是否可引起IBD的发生, 或加剧IBD的进展. 若在关节软骨退化过程中, 小鼠肠道炎性细胞明显增加, 则说明关节炎有引起IBD发生的可能, 并使IBD加重. 这一重要发现将提示临床医师在治疗有关节炎的IBD患者的过程中决不能忽视关节炎的治疗. 若在关节软骨退化的过程中, 小鼠肠道炎性细胞无明显增加, 则说明关节炎的出现对IBD本身无特殊影响, 只给患者带来更多的身体不适及使其生活质量下降. 临床医师可重点治疗IBD, 随着原发疾病的好转, 关节炎症状或可缓解或消失. 关于这一设想, 我们可通过建立骨关节炎小鼠模型进行更深入的研究, 其结果将弥补IBD研究中的一项空白, 并为 IBD的治疗贡献一份力量.
炎症性肠病(inflammatory bowel disease, IBD)是一种以肠道严重的炎症及黏膜破坏为特征的慢性疾病, 包括克罗恩病和溃疡性结肠炎. 其有多种临床表现, 包括消化系症状、全身症状及肠外表现. 肠外表现在IBD中有很高的发病率, 同一种肠外表现的复发很常见, 且患一种肠外表现后出现其他种类肠外表现的风险也明显增高, 使IBD治疗更为复杂多样. 在IBD患者的肠外表现中, 最多发且严重影响患者生活质量的疾病为骨关节炎, 但骨关节炎是否对IBD的发生发展起作用, 尚无研究证实. 现阶段, IBD的肠外表现及治疗已经得到越来越多学者的关注.
冯百岁, 教授, 郑州大学第五附属医院消化内科; 钟英强, 教授, 主任医师, 中山大学孙逸仙纪念医院消化内科
目前国内外对IBD及其肠外表现的治疗尚无明确统一的方案, 各种肠外表现与IBD的关系仍有待进一步深入研究, 且有些肠外表现仅报道于个案报道中. 因此, 大家仍需对IBD患者进行大样本量的前瞻性临床及基础研究, 对其病因及治疗方面提供更可靠的指导信息.
Lakatos等在2012年发表的文章中, 对IBD肠外表现的治疗进行了详细地总结, 对临床有重大的指导意义. Vavricka等在2015年发表了最新的关于IBD肠外表现的文章, 对IBD的肠外表现进行了更为细致地总结与概括.
作者在大量阅读近5年最新文献的基础上, 对IBD的肠外表现及主要肠外表现的治疗进行了全面细致地总结. 同时又对骨关节炎这一最常见的肠外表现进行深入了解, 提出骨关节炎是否对IBD的发生发展起到一定影响的假设.
本文或可对临床医生在治疗IBD合并复杂的肠外表现时起到指导作用, 并使读者更全面地了解IBD的肠外表现.
本文重点是介绍IBD的肠外表现, 对临床有一定的指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Loftus EV. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences. Gastroenterology. 2004;126:1504-1517. [PubMed] |
| 2. | Hagen JW, Swoger JM, Grandinetti LM. Cutaneous manifestations of crohn disease. Dermatol Clin. 2015;33:417-431. [PubMed] [DOI] |
| 3. | Lakatos PL, Lakatos L, Kiss LS, Peyrin-Biroulet L, Schoepfer A, Vavricka S. Treatment of extraintestinal manifestations in inflammatory bowel disease. Digestion. 2012;86 Suppl 1:28-35. [PubMed] [DOI] |
| 4. | Vavricka SR, Schoepfer A, Scharl M, Lakatos PL, Navarini A, Rogler G. Extraintestinal manifestations of inflammatory bowel disease. Inflamm Bowel Dis. 2015;21:1982-1992. [PubMed] [DOI] |
| 5. | Vavricka SR, Rogler G, Gantenbein C, Spoerri M, Prinz Vavricka M, Navarini AA, French LE, Safroneeva E, Fournier N, Straumann A. Chronological order of appearance of extraintestinal manifestations relative to the time of IBD diagnosis in the swiss inflammatory bowel disease cohort. Inflamm Bowel Dis. 2015;21:1794-1800. [PubMed] [DOI] |
| 6. | Biancone L, Mandal A, Yang H, Dasgupta T, Paoluzi AO, Marcheggiano A, Paoluzi P, Pallone F, Das KM. Production of immunoglobulin G and G1 antibodies to cytoskeletal protein by lamina propria cells in ulcerative colitis. Gastroenterology. 1995;109:3-12. [PubMed] |
| 7. | Das KM, Vecchi M, Sakamaki S. A shared and unique epitope(s) on human colon, skin, and biliary epithelium detected by a monoclonal antibody. Gastroenterology. 1990;98:464-469. [PubMed] |
| 8. | Su CG, Judge TA, Lichtenstein GR. Extraintestinal manifestations of inflammatory bowel disease. Gastroenterol Clin North Am. 2002;31:307-327. [PubMed] |
| 9. | Satsangi J, Grootscholten C, Holt H, Jewell DP. Clinical patterns of familial inflammatory bowel disease. Gut. 1996;38:738-741. [PubMed] |
| 10. | Roussomoustakaki M, Satsangi J, Welsh K, Louis E, Fanning G, Targan S, Landers C, Jewell DP. Genetic markers may predict disease behavior in patients with ulcerative colitis. Gastroenterology. 1997;112:1845-1853. [PubMed] |
| 11. | Kuy S, Dua A, Chappidi R, Seabrook G, Brown KR, Lewis B, Rossi PJ, Lee CJ. The increasing incidence of thromboembolic events among hospitalized patients with inflammatory bowel disease. Vascular. 2015;23:260-264. [PubMed] [DOI] |
| 12. | Felson DT, Lawrence RC, Dieppe PA, Hirsch R, Helmick CG, Jordan JM, Kington RS, Lane NE, Nevitt MC, Zhang Y. Osteoarthritis: new insights. Part 1: the disease and its risk factors. Ann Intern Med. 2000;133:635-646. [PubMed] |
| 13. | Lane NE, Brandt K, Hawker G, Peeva E, Schreyer E, Tsuji W, Hochberg MC. OARSI-FDA initiative: defining the disease state of osteoarthritis. Osteoarthritis Cartilage. 2011;19:478-482. [PubMed] [DOI] |
| 14. | Loeser RF. Molecular mechanisms of cartilage destruction: mechanics, inflammatory mediators, and aging collide. Arthritis Rheum. 2006;54:1357-1360. [PubMed] |
| 15. | Scanzello CR, Goldring SR. The role of synovitis in osteoarthritis pathogenesis. Bone. 2012;51:249-257. [PubMed] [DOI] |
| 16. | Hamerman D. The biology of osteoarthritis. N Engl J Med. 1989;320:1322-1330. [PubMed] |
| 17. | Lotz MK, Otsuki S, Grogan SP, Sah R, Terkeltaub R, D'Lima D. Cartilage cell clusters. Arthritis Rheum. 2010;62:2206-2218. [PubMed] [DOI] |
| 18. | Xu L, Flahiff CM, Waldman BA, Wu D, Olsen BR, Setton LA, Li Y. Osteoarthritis-like changes and decreased mechanical function of articular cartilage in the joints of mice with the chondrodysplasia gene (cho). Arthritis Rheum. 2003;48:2509-2518. [PubMed] |
| 19. | Xu L, Polur I, Lim C, Servais JM, Dobeck J, Li Y, Olsen BR. Early-onset osteoarthritis of mouse temporomandibular joint induced by partial discectomy. Osteoarthritis Cartilage. 2009;17:917-922. [PubMed] [DOI] |
| 20. | Xu L, Golshirazian I, Asbury BJ, Li Y. Induction of high temperature requirement A1, a serine protease, by TGF-beta1 in articular chondrocytes of mouse models of OA. Histol Histopathol. 2014;29:609-618. [PubMed] |
| 21. | Dorofeyev AE, Vasilenko IV, Rassokhina OA. Joint extraintestinal manifestations in ulcerative colitis. Dig Dis. 2009;27:502-510. [PubMed] [DOI] |
| 22. | Cardile S, Romano C. Current issues in pediatric inflammatory bowel disease-associated arthropathies. World J Gastroenterol. 2014;20:45-52. [PubMed] [DOI] |
| 23. | Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestations and complications in inflammatory bowel diseases. World J Gastroenterol. 2006;12:4819-4831. [PubMed] |
| 24. | Orchard TR, Wordsworth BP, Jewell DP. Peripheral arthropathies in inflammatory bowel disease: their articular distribution and natural history. Gut. 1998;42:387-391. [PubMed] |
| 25. | Brewerton DA, James DC. The histocompatibility antigen (HL-A 27) and disease. Semin Arthritis Rheum. 1975;4:191-207. [PubMed] |
| 26. | Bernstein CN, Blanchard JF, Rawsthorne P, Yu N. The prevalence of extraintestinal diseases in inflammatory bowel disease: a population-based study. Am J Gastroenterol. 2001;96:1116-1122. [PubMed] |
| 27. | Greenstein AJ, Janowitz HD, Sachar DB. The extra-intestinal complications of Crohn's disease and ulcerative colitis: a study of 700 patients. Medicine (Baltimore). 1976;55:401-412. [PubMed] |
| 28. | Orchard T. Extraintestinal complications of inflammatory bowel disease. Curr Gastroenterol Rep. 2003;5:512-517. [PubMed] |
| 29. | Shahid S, Myszor M, De Silva A. Pyoderma gangrenosum as a first presentation of inflammatory bowel disease. BMJ Case Rep. 2014;2014:pii bcr2014204853. [PubMed] [DOI] |
| 30. | Gellert A, Green ES, Beck ER, Ridley CM. Erythema nodosum progressing to pyoderma gangrenosum as a complication of Crohn's disease. Postgrad Med J. 1983;59:791-793. [PubMed] |
| 31. | Lebwohl M, Lebwohl O. Cutaneous manifestations of inflammatory bowel disease. Inflamm Bowel Dis. 1998;4:142-148. [PubMed] |
| 32. | Banet DE, McClave SA, Callen JP. Oral metronidazole, an effective treatment for Sweet's syndrome in a patient with associated inflammatory bowel disease. J Rheumatol. 1994;21:1766-1768. [PubMed] |
| 33. | Salek H, Balouch A, Sedghizadeh PP. Oral manifestation of Crohn's disease without concomitant gastrointestinal involvement. Odontology. 2014;102:336-338. [PubMed] [DOI] |
| 34. | Bruscino N, Arunachalam M, Galeone M, Scarfì F, Maio V, Difonzo EM. Lip swelling as initial manifestation of Crohn's disease. Arch Dis Child. 2012;97:647. [PubMed] [DOI] |
| 35. | Nishikawa J, Hosokawa A, Sugiyama T. Palatal ulcer as an initial manifestation of Crohn's disease. Clin Gastroenterol Hepatol. 2014;12:e115-e116. [PubMed] [DOI] |
| 36. | Rezaie A, Wong K, Gyenes G. Pericardial tamponade in a patient with inactive ulcerative colitis. Case Rep Med. 2010;2010:352417. [PubMed] [DOI] |
| 37. | Papa A, Papa V, Marzo M, Scaldaferri F, Sofo L, Rapaccini GL, Danese S, Gasbarrini A. Prevention and treatment of venous thromboembolism in patients with IBD: a trail still climbing. Inflamm Bowel Dis. 2015;21:1204-1213. [PubMed] [DOI] |
| 38. | Vavricka SR, Brun L, Ballabeni P, Pittet V, Prinz Vavricka BM, Zeitz J, Rogler G, Schoepfer AM. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol. 2011;106:110-119. [PubMed] [DOI] |
| 39. | Orchard TR, Chua CN, Ahmad T, Cheng H, Welsh KI, Jewell DP. Uveitis and erythema nodosum in inflammatory bowel disease: clinical features and the role of HLA genes. Gastroenterology. 2002;123:714-718. [PubMed] |
| 40. | Brichová M, Heissigerová J, Svozílková P, Dvorák J, Jenícková D, Ríhová E. [Eye and inflammatory bowel diseases]. Cesk Slov Oftalmol. 2011;67:92-96. [PubMed] |
| 41. | Barabino AV, Gandullia P, Calvi A, Vignola S, Arrigo S, Marco RD. Sudden blindness in a child with Crohn's disease. World J Gastroenterol. 2011;17:4344-4346. [PubMed] [DOI] |
| 42. | Corica D, Romano C. Renal Involvement in Inflammatory Bowel Diseases. J Crohns Colitis. 2015; Jul 29. [Epub ahead of print]. [PubMed] |
| 43. | Schreiber S, Hämling J, Zehnter E, Howaldt S, Daerr W, Raedler A, Kruis W. Renal tubular dysfunction in patients with inflammatory bowel disease treated with aminosalicylate. Gut. 1997;40:761-766. [PubMed] |
| 44. | Storch I, Sachar D, Katz S. Pulmonary manifestations of inflammatory bowel disease. Inflamm Bowel Dis. 2003;9:104-115. [PubMed] |
| 45. | Basseri B, Enayati P, Marchevsky A, Papadakis KA. Pulmonary manifestations of inflammatory bowel disease: case presentations and review. J Crohns Colitis. 2010;4:390-397. [PubMed] [DOI] |
| 46. | Levitan HL. The etiologic significance of deafness in ulcerative colitis. Int J Psychiatry Med. 1973;4:379-387. [PubMed] |
| 47. | Jachiet M, Lependu C, Fragny D, Mariette X, Lepajolec C, Seror R. Severe deafness associated with Crohn's disease and spondylarthropathy: successful treatment with anti-TNF. Rheumatology (Oxford). 2013;52:1145-1147. [PubMed] [DOI] |
| 48. | Tarter RE, Switala J, Carra J, Edwards KL, Van Thiel DH. Inflammatory bowel disease: psychiatric status of patients before and after disease onset. Int J Psychiatry Med. 1987;17:173-181. [PubMed] |
| 49. | Triantafillidis JK, Vagianos K, Rontos I. Psychotic reaction as a cardinal first clinical manifestation in a patient with Crohn's disease. J Crohns Colitis. 2013;7:e76-e77. [PubMed] [DOI] |
| 50. | Rindos N, Ecker A, Carter G, Mansuria S. Crohn's disease with ovarian granuloma: A case report and review of the literature. J Minim Invasive Gynecol. 2015;22:914-916. [PubMed] [DOI] |
| 51. | Chandra S, Finn S, Obah E. Immune thrombocytopenic purpura in ulcerative colitis: a case report and systematic review. J Community Hosp Intern Med Perspect. 2014;4:23386. [PubMed] [DOI] |
| 52. | Peluso R, Manguso F, Vitiello M, Iervolino S, Di Minno MN. Management of arthropathy in inflammatory bowel diseases. Ther Adv Chronic Dis. 2015;6:65-77. [PubMed] [DOI] |
| 53. | Williams H, Walker D, Orchard TR. Extraintestinal manifestations of inflammatory bowel disease. Curr Gastroenterol Rep. 2008;10:597-605. [PubMed] |
| 54. | Trikudanathan G, Venkatesh PG, Navaneethan U. Diagnosis and therapeutic management of extra-intestinal manifestations of inflammatory bowel disease. Drugs. 2012;72:2333-2349. [PubMed] [DOI] |
| 55. | Kaufman I, Caspi D, Yeshurun D, Dotan I, Yaron M, Elkayam O. The effect of infliximab on extraintestinal manifestations of Crohn's disease. Rheumatol Int. 2005;25:406-410. [PubMed] |
| 56. | Clayton TH, Walker BP, Stables GI. Treatment of chronic erythema nodosum with infliximab. Clin Exp Dermatol. 2006;31:823-824. [PubMed] |
| 57. | Bennett ML, Jackson JM, Jorizzo JL, Fleischer AB, White WL, Callen JP. Pyoderma gangrenosum. A comparison of typical and atypical forms with an emphasis on time to remission. Case review of 86 patients from 2 institutions. Medicine (Baltimore). 2000;79:37-46. [PubMed] |
| 58. | Juillerat P, Mottet C, Pittet V, Froehlich F, Felley C, Gonvers JJ, Vader JP, Michetti P. Extraintestinal manifestations of Crohn's disease. Digestion. 2007;76:141-148. [PubMed] [DOI] |
| 59. | Qaseem A, Chou R, Humphrey LL, Starkey M, Shekelle P. Venous thromboembolism prophylaxis in hospitalized patients: a clinical practice guideline from the American College of Physicians. Ann Intern Med. 2011;155:625-632. [PubMed] [DOI] |
| 60. | Mintz R, Feller ER, Bahr RL, Shah SA. Ocular manifestations of inflammatory bowel disease. Inflamm Bowel Dis. 2004;10:135-139. [PubMed] |
| 61. | Fries W, Giofré MR, Catanoso M, Lo Gullo R. Treatment of acute uveitis associated with Crohn's disease and sacroileitis with infliximab. Am J Gastroenterol. 2002;97:499-500. [PubMed] |
| 62. | Blumberg BS, Bunim JJ, Calkins E, Pirani CL, Zvaifler NJ. Ara nomenclature and classification of arthritis and rheumatism (tentative). Arthritis Rheum. 1964;7:93-97. [PubMed] |