修回日期: 2016-01-11
接受日期: 2016-01-19
在线出版日期: 2016-02-28
目的: 研究蓝莓对非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)大鼠的保护作用及相关机制.
方法: 40只健康大鼠随机分为4组: 正常组、蓝莓组、姜黄素组、模型组. 正常组饲喂正常饲料, 其余各组饲喂高脂饲料. 蓝莓组每日灌胃蓝莓原浆[15 mL/(kg•d)]; 姜黄素组每日灌胃姜黄素溶液[200 mg/(kg•d)]; 其余组大鼠灌胃等体积生理盐水, 12 wk后处死. HE染色、油红O染色观察各组肝细胞损伤及脂肪沉积情况; 全自动生化分析仪检测血清谷丙转氨酶(alanine transaminase, ALT), 谷草转氨酶(aspartate transaminase, AST), 甘油三脂(triglyeride, TG), 胆固醇(total cholesterol, TC)含量; 酶联免疫吸附法检测肝组织中超氧化物歧化酶(superoxide dismutase, SOD)活性及谷胱甘肽(glutathione, GSH)、丙二醛(malondialdehyde, MDA)、甘油三酯(triglyeride, TG)含量; 免疫组织化学、Western blot和逆转录-聚合酶链反应检测大鼠肝组织中B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)、Bcl-2相关x蛋白(bcl-associated x protein, Bax)的表达.
结果: 与模型组大鼠相比, 蓝莓组、姜黄素组HE染色、油红O染色肝组织中脂肪沉积明显减少, 血清AST、ALT、TG、TC含量升高幅度较小(P<0.01), 肝组织中TG、MDA含量升高幅度也较小(P<0.01), 而SOD活性、GSH含量明显增高(P<0.01). 与模型组大鼠相比, 蓝莓组、姜黄素组Bcl-2 mRNA和蛋白质的表达明显增加(P<0.01), Bax mRNA和蛋白质的表达明显降低(P<0.01), Bcl-2/Bax比值明显增加(P<0.01).
结论: 蓝莓对NAFLD有较好的预防作用, 其机制可能是上调肝脏Bcl-2表达, 下调Bax表达, 纠正两者平衡失调, 提高机体抗氧化能力从而抑制肝细胞凋亡有关.
核心提示: 本研究通过观察蓝莓对非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)大鼠干预后的肝组织表现、血清肝功能生化指标、超氧化物歧化酶活性、谷胱甘肽、丙二醛、甘油三酯含量及B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)、Bcl-2相关x蛋白(bcl-associated x protein, Bax)的变化, 证明蓝莓通过Bcl-2/Bax凋亡途径来抑制NAFLD的进展.
引文著录: 禹萍, 任婷婷, 程明亮, 赵旦博. 蓝莓对非酒精性脂肪性肝病大鼠Bcl-2、Bax表达的影响. 世界华人消化杂志 2016; 24(6): 842-850
Revised: January 11, 2016
Accepted: January 19, 2016
Published online: February 28, 2016
AIM: To investigate the effect of blueberry on non-alcoholic fatty liver disease in mice and the underlying mechanism.
METHODS: Forty healthy SD mice were randomly divided into a normal control group, a blueberry group, a curcumin group and a model group. The normal control group was given a normal diet, and the other groups were all given a high fat diet. The blueberry group was intragastrically given blueberry juice [15 mL/(kg•d)], the curcumin group was given curcumin solution [200 mg/(kg•d)], and the other groups were given physiological saline daily. At the end of 12 wk, all mice were sacrificed. Liver cell injury and fat deposition were assessed by HE staining and oil red O staining, respectively. The levels of alanine transaminase (ALT), aspartate transaminase (AST), triglyeride (TG) and total cholesterol (TC) in serum were detected with an automatic biochemical analyzer. Hepatic TG, TC, malondialdehyde (MDA), glutathione (GSH) and superoxide dismutase (SOD) were quantified by ELISA. The expression of Bcl-2 and Bax in liver tissue was detected by immunohistochemistry, Western blot and RT-PCR.
RESULTS: Compared to the model group, the blueberry and curcumin groups showed significantly decreased lipid accumulation, serum levels of ALT, AST, TG and TC (P < 0.01), and hepatic levels of TG and MDA (P < 0.01), and increased GSH contents and SOD activity (P < 0.01). Compared to the model group, the blueberry and curcumin groups also showed significantly increased Bcl-2 mRNA and protein expression (P < 0.01), significantly decreased Bax mRNA and protein expression (P < 0.01), and significantly increased Bcl-2/Bax ratio (P < 0.01).
CONCLUSION: Blueberry has a protective effect on non-alcoholic fatty liver disease in mice, and the mechanism may be associated with up-regulating the Bcl-2 expression, down-regulating Bax expression, correcting balance disorders, and enhancing the body's antioxidant ability to inhibit liver cell apoptosis.
- Citation: Yu P, Ren TT, Cheng ML, Zhao DB. Effect of blueberry on expression of Bcl-2 and Bax in non-alcoholic fatty liver disease in mice. Shijie Huaren Xiaohua Zazhi 2016; 24(6): 842-850
- URL: https://www.wjgnet.com/1009-3079/full/v24/i6/842.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i6.842
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是与遗传-环境-饮食密切相关的代谢应激性肝损伤, 已经成为21世纪重要的公共健康问题[1,2]. 细胞凋亡是细胞死亡的形式之一, 近期研究[3]表明, 肝细胞凋亡在NAFLD向肝纤维化乃至肝硬化、肝细胞癌进展中扮演着至关重要的角色. 正常情况下, 肝细胞增殖再生与细胞凋亡处于平衡状态, NAFLD时由于持续的氧化应激反应造成细胞过度凋亡, 产生大量凋亡小体, 引起炎症细胞聚集, 导致炎症和坏死, 进而发展为非酒精性脂肪性肝炎等终末期肝病[4,5]. 多数研究[6]显示, 抑制细胞凋亡可达到保护肝细胞损伤的目的. 抗氧化应激作用能抑制细胞凋亡[7]. 蓝莓是杜鹃花科越桔属(Vaccinium spp), 是花青素含量最丰富的水果, 被称为果蔬中"第一号抗氧化剂"[8,9]. B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)是抗凋亡基因, 可阻止许多因素所诱导的细胞凋亡, 而Bcl-2相关x蛋白(bcl-2-assaciated x protein, Bax)是促凋亡基因, 二者的比例是决定细胞是否发生凋亡的重要调控因素[10]. 本课题探讨蓝莓对NAFLD大鼠Bcl-2和Bax表达的影响.
SD大鼠40只, 8周龄, 体质量150 g±20 g; 购自贵阳医学院动物实验中心(动物批号SYXK黔2012-0001, 伦理学文件批号1403070); 纯化型高脂饲料(江苏南通特洛菲饲料科技有限公司, TP26300); 蓝莓[(兔眼品种)购自贵州省麻江蓝莓基地]; 姜黄素溶液(Sigma); 兔抗鼠Bcl-2多克隆抗体(Abcam); 兔抗鼠Bax多克隆抗体(Abcam); 蛋白提取试剂盒(宝生物工程有限公司); GAPDH兔抗鼠一抗(武汉博士德生物技术有限公司); 辣根过氧化物酶标记羊抗兔二抗(上海基因工程部); BCA蛋白定量试剂盒(Biomiga); ECL化学发光试剂(百乐公司); 总RNA提取纯化试剂盒(Biomiga生物有限公司)、SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)、RT reagent Kit with gDNA Eraser(Perfect Real Time)(宝生物工程有限公司); Bcl-2、Bax、GAPDH引物(宝生物工程有限公司), Bcl-2引物: 上游引物: 5'-TTGAGGAAGTGAACATTTCGGTG-3', 下游引物: 5'-AGGTTCTGCGGACTTCGGTC-3'; Bax引物: 上游引物: 5'-CCTTTTGCTTC AGGGTTTCAT-3', 下游引物: 5'-GAGACACTCGCTCAGCTTCTTG-3'; GAPDH引物: 上游引物: 5'-GTTGTCTCCTGCGACTTCA-3', 下游引物: 5'-GTTGTCTCCTGCGACTTCA-3'; 肝组织谷胱甘肽(glutathione, GSH)、丙二醛(malondialdehyde, MDA)、甘油三酯(triglyeride, TG)测定试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)活性蛋白检测试剂盒(上海凯基); 全自动生化分析仪(日本ADVIA2400); 高速低温离心机(Sigma3K15); 电子天平(JA10003B); 分光光度仪(上海奥析科学仪器); MSS全波长酶标仪(BioTec); 1DYCZ-24DN型电泳仪(自北京市六一仪器厂); 图像采集系统(OLYMPUS, BX41); Gel Doc XR凝胶成像系统(BIO-RAD).
1.2.1 实验动物分组及处理: 40只大鼠普通饲料适应性喂养1 wk后, 随机分为正常组(A)、蓝莓组(B)、姜黄素组(C)及模型组(D)4组, 每组10只. 除正常组饲喂正常饲料外, 其余各组均饲喂高脂饲料. 蓝莓组每日固定时间予蓝莓原浆[15 mL/(kg•d)]灌胃, 姜黄素组予姜黄素溶液[200 mg/(kg•d)]灌胃, 其余两组予等容量的生理盐水灌胃, 实验动物均自由饮食、饮水. 饲喂12 wk后, 禁食水12 h, 称体质量, 大鼠麻醉后处死, 留取血液, 常规制备血清于-80 ℃保存; 取相同部位肝组织用40 g/L中性甲醛固定用于HE及油红O染色, 剩余肝脏-80 ℃保存.
1.2.2 病理学检测及指标检测: 取新鲜小鼠肝组织制备病理切片, 行HE、油红O染色. 血清生化指标检测: 全自动生化分析仪测定小鼠血清谷丙转氨酶(alanine transaminase, ALT), 谷草转氨酶(aspartate transaminase, AST), TG, 胆固醇(total cholesterol, TC)含量. 肝组织中GSH、MDA、TG含量及SOD活性检测: 取肝组织50 mg, 严格按照试剂盒说明书进行检测并记录数据.
1.2.3 免疫组织化学检测Bcl-2、Bax表达: 采用EnVision二步法, 光镜下观察Bcl-2、Bax在细胞中的表达位置. 400倍高倍视野下每张盖玻片随机取5个视野, 结果用Image-Pro Plus 6.0系统分析图像, 取平均积分光密度值(AIOD)表示Bcl-2、Bax相对表达量.
1.2.4 Western blot检测Bcl-2、Bax表达: 按试剂盒说明书提取蛋白, 测定蛋白含量. 取蛋白质样品50 μg, 行SDS-PAGE电泳, 转膜, 封闭. 一抗4 ℃孵育过夜, 二抗室温1 h, ECL曝光显影, Gel Doc EQ凝胶成像仪扫描, Quantity One软件分析结果. 以GAPDH表达水平作为内参, 目标蛋白的表达量以目标蛋白与内参照蛋白灰度值的对比值表示.
1.2.5 逆转录-聚合酶链反应检测Bcl-2、Bax mRNA的表达: 实验过程中总RNA提取、cDNA合成及PCR反应体系严格按照试剂盒说明书中的操作步骤进行. 取100 mg肝组织提取RNA并测定浓度. 将提取的RNA逆转录合成cDNA后加入引物行逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)检测, 实验过程中以GAPDH作为内参对照, 进行标准转换得到各组样本的拷贝数(Ct值), 以Ct值均数来得出目的基因的表达量.
统计学处理 应用SPSS17.0统计软件分析, 实验数据均用mean±SD表示, 两组间比较均采用t检验. P<0.05为差异具有统计学意义.
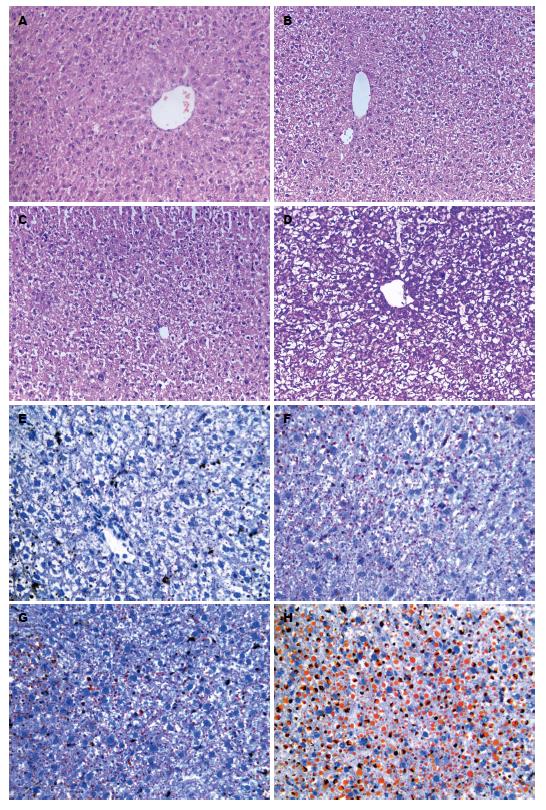
各组HE染色: A组肝细胞以中央静脉为中心呈放射状排列, 肝索排列整齐; D组可见重度脂肪变性, 胞浆中出现大小不等的脂滴, 肝组织出现弥漫性气球样变、肝细胞脂肪变性, 部分区域可见炎性细胞浸润; B、C组肝细胞以中央静脉为中心呈放射状排列, 比较D组来说肝细胞气球样变及脂肪变性明显少见. 各组油红O染色: A组肝组织见极少量红色脂肪滴; D组肝组织见弥漫性细胞水肿及重度脂肪变性, 胞浆中出现大量的红色脂滴; B、C组肝细胞较D组来说, 肝细胞脂质沉积明显较轻(图1).
与A组相比, B组、C组、D组血清ALT、AST、TG、TC含量明显增高(P<0.01); 与D组相比, B组、C组血清ALT、AST、TG、TC含量升高幅度较小(P<0.01). 各组大鼠肝组织中GSH、MDA、TG含量及SOD活性: 与D组相比, A组、B组、C组肝组织中TG、MDA含量明显下降(P<0.01), 而SOD活性、GSH含量明显增高(P<0.01). 与A组相比, B组、C组SOD活性、GSH含量明显增高(P<0.01)(表1).
| 分组 | A组 | B组 | C组 | D组 |
| ALT(U/L) | 63.21±9.6b | 74.49±8.64bd | 75.25±8.40bd | 92.85±11.11 |
| AST(U/L) | 159.25±11.65b | 199.40±14.04bd | 201.95±14.25bd | 367.89±23.94 |
| TG(mmol/L) | 1.24±0.25b | 1.66±0.17bd | 1.72±0.15bd | 2.48±0.14 |
| TC(mmol/L) | 2.45±0.12b | 2.83±0.19bd | 2.74±0.21bd | 3.42±0.18 |
| GSH(nmol/mgprot) | 1.56±0.18b | 1.73±0.09bc | 1.76±0.14bc | 1.09±0.23 |
| MDA(nmol/mgprot) | 0.77±0.14b | 1.14±0.19b | 1.20±0.19b | 1.85±0.17 |
| TG(U/L) | 1.08±0.17b | 1.89±0. 14b | 1.97±0.14b | 3.68±0.16 |
| SOD(U/L) | 32.88±3.08b | 35.54±3.12bc | 36.59±2.95bc | 19.22±2.66 |
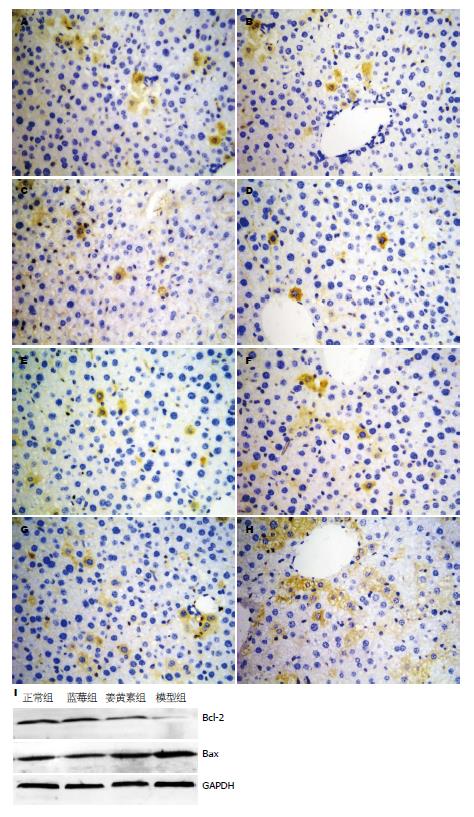
Bcl-2主要在肝细胞胞浆表达, A组、B组、C组、D组肝细胞胞浆见棕黄色颗粒, D组表达低于A组、B组、C组(P<0.01)(表2, 图2A-D); Bax主要在肝细胞胞浆表达, 呈棕黄色颗粒, D组表达最高, A组、B组、C组表达低于D组(P<0.01)(表2, 图2E-H).
| 检测方法 | A组 | B组 | C组 | D组 |
| 免疫组织化学检测 | ||||
| Bcl-2 | 0.88±0.03b | 0.82±0.06b | 0.83±0.07b | 0.40±0.05 |
| Bax | 0.81±0.04b | 0.98±0.18b | 0.90±0.15b | 1.62±0.06 |
| Bcl-2/Bax | 1.09±0.04b | 0.83±0.13b | 0.94±0.17b | 0.25±0.03 |
| Western blot检测 | ||||
| Bcl-2/GAPDH | 0.52±0.02b | 0.51±0.01b | 0.50±0.02b | 0.14±0.01 |
| Bax/GAPDH | 0.51±0.01b | 0.53±0.01b | 0.52±0.02b | 1.13±0.02 |
| Bcl-2/Bax | 1.06±0.05b | 0.97±0.04b | 0.97±0.01b | 0.12±0.01 |
| RT-PCR检测 | ||||
| Bcl-2 | 1.03±0.02b | 0.99±0.04b | 0.97±0.07b | 0.26±0.05 |
| Bax | 1.01±0.03b | 1.04±0.01b | 1.05±0.03b | 2.31±0.07 |
| Bcl-2/Bax | 1.01±0.11b | 0.95±0.04b | 0.92±0.06b | 0.11±0.18 |
D组Bcl-2表达低于A组、B组、C组(P<0.01); Bax表达高于A组、B组、C组(P<0.01); 与A组相比, B组、C组Bcl-2、Bax表达差异无统计学意义(表2, 图2I).
D组Bcl-2表达低于A组、B组、C组(P<0.01); Bax表达高于A组、B组、C组(P<0.01); 与A组相比, B组、C组Bcl-2、Bax表达差异无统计学意义(表2).
目前在NAFLD的发病机制中, "二次打击"学说得到普遍公认. 初次"打击"主要是胰岛素抵抗, 脂质代谢紊乱导致脂肪酸和三酰甘油在肝脏沉积, 引起肝脏的脂肪变性[11-13]. 第二次"打击"是在此基础上引发了氧化应激反应, 活性氧造成肝脏的持续损伤和炎性反应[14-16]. 如果肝脏炎性反应持续存在, 加上细胞因子和其他因素的综合作用, 便会导致肝细胞凋亡和坏死的增加, 使肝脏细胞外基质的合成大于降解, 进一步发展为脂肪性肝纤维化和肝硬化[17-20]. 凋亡的肝细胞可招致炎症细胞聚集, 库普弗细胞吞噬凋亡小体而活化, 释放大量细胞因子, 如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1(interleukin-1, IL-1)和转化生长因子-β(transforming growth factor-β, TGF-β)等, 进一步活化肝星状细胞, 促进肝纤维化的发生[21]. 且不断有证据表明在NAFLD中, 肝细胞凋亡可能是单纯NAFLD发展为非酒精性脂肪性肝炎"二次打击"理论的关键步骤, 也是该过程的重要标志, 与炎症程度和纤维化进展相关[22].
细胞凋亡受多种凋亡基因调控, 其中Bcl-2家族成员在细胞凋亡的基因调控过程中起着至关重要的作用[23], 尤其这一家族的两个代表性成员Bcl-2和Bax, 分别是凋亡抑制和促进因子, 两者的比率Bcl-2/Bax是调控细胞死亡的"可变电阻器"[24]. Bax蛋白不但拮抗Bcl-2的抑制凋亡作用, 而且有直接促进细胞凋亡的功能. 实验[25]表明, Bcl-2家族成员通过调节线粒体外膜的通透性和完整性起重要调控作用. Bcl-2/Bax镶嵌在线粒体膜上, 调控凋亡诱导蛋白的释放和线粒体功能, 两者间的平衡影响凋亡的发生[10].
姜黄素可通过抗氧化作用, 对NAFLD具有保护作用[26], 且有研究[27]发现姜黄素对对乙酰氨基酚所致的肝损伤及其他肝脏疾病可通过上调Bcl-2, 下调Bax, 调节Bcl-2/Bax比值从而抑制细胞凋亡来保护肝脏, 故推测姜黄素可能通过调节Bcl-2、Bax的相对表达来抑制细胞凋亡, 拮抗NAFLD的进展.
蓝莓中的花青素可通过与活性氧等自由基结合, 是一种很好的氧自由基清除剂和脂质过氧化抑制剂. 近年来, Yuji等[28]报道蓝莓的一些活性成份, 能防止大鼠脂肪肝的进展. Çoban等[29]也用蓝莓喂食血清高脂水平的豚鼠, 证实蓝莓可降低氧化应激和减少胆固醇在肝脏的累积. Liu等[30]报道蓝莓多酚类提取物能有效抑制甘油三酯在HepG2细胞中的累积, 从而在早期阶段对NAFLD有潜在的预防作用. 本课题组前期研究[31]也发现, 蓝莓可通过增加sirt1的表达, 进而上调PPAR-α, 下调SREBP-1c水平来提高肝脏的抗氧化能力, 减轻氧化应激, 从而抑制NAFLD. 另还通过上调肝组织中Nrf2蛋白的表达, 从而提高机体抗氧化能力拮抗高脂饮食下NAFLD的发生与发展[32]. 因此本文在前期工作的基础上继续研究蓝莓对Bcl-2及Bax的影响.
本研究发现, 与模型组相比, 蓝莓组、姜黄素组HE染色、油红染色肝组织中脂肪沉积明显减少, 血清AST、ALT、TG、TC含量升高幅度较小(P<0.01), 肝组织中TG、MDA含量升高幅度也较小(P<0.01), 而SOD活性、GSH含量明显增高(P<0.01)提示蓝莓与姜黄素能有效改善NAFLD发病过程中肝细胞的损伤及脂质代谢紊乱, 减少脂肪在肝细胞内的沉积, 且提高机体的抗氧化应激能力. 抗氧化应激增强, 是否进一步抑制细胞凋亡呢. 采用PCR、免疫组织化学、免疫印迹检测Bcl-2、Bax mRNA、蛋白在各组大鼠肝组织的表达, 结果发现: 与正常组比, 模型组Bcl-2 mRNA和蛋白表达下降(P<0.01), Bax mRNA和蛋白表达增多(P<0.01), 且Bcl-2/bax比值较正常组下降(P<0.01), 与赵和平等[21]对NAFLD中Bcl-2及Bax的研究相符合. Li等[27]研究发现, 在对乙酰氨基酚所致的肝损伤中, 上调Bcl-2, 下调Bax的表达能保护肝细胞, 说明Bcl-2表达下调和Bax表达增多, 在NAFLD的发生中可能有一定意义. 经蓝莓与姜黄素干预后, 与模型组相比, 干预组Bcl-2 mRNA和蛋白表达增加(P<0.01), Bax mRNA和蛋白表达降低(P<0.01), 且Bcl-2/Bax比值增加(P<0.01), 提示蓝莓可能通过调节肝组织中Bcl-2、Bax的相对表达来保护肝细胞, 从而减轻肝脏的炎症反应.
总之, 本研究明确了蓝莓的抗氧化活性对NAFLD有较好的预防作用, 可能通过提高机体抗氧化应激能力从而抑制肝细胞凋亡, 其抑制肝细胞凋亡机制之一可能是通过Bcl-2/Bax凋亡途径, 上调肝脏Bcl-2表达, 调节线粒体膜对一些凋亡蛋白前体的通透性, 将凋亡前体Apaf-1等定位至线粒体膜上, 使其不能发挥凋亡作用, 下调Bax表达, 使一些离子和小分子物质(细胞色素C等)不能穿过线粒体膜, 而不能进入细胞质, 从而保护细胞免于凋亡, 此外还通过提高Bcl-2/Bax比值, 纠正两者平衡失调, 可减少肝细胞凋亡, 拮抗由大量凋亡小体引起的炎症细胞聚集而导致的炎症和坏死, 从而拮抗大鼠NAFLD的发生发展. 故蓝莓通过他的抗氧化活性从抗氧化应激方面与抑制细胞凋亡方面来抑制NAFLD的进展.
目前在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的发病机制中, "二次打击"学说得到普遍公认, 然而不断有研究表明肝细胞凋亡在NAFLD向肝纤维化乃至肝硬化、肝细胞癌进展中扮演着至关重要的角色.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科; 卢秉久, 教授, 博士生导师, 辽宁中医药大学附属医院感染科; 张明辉, 教授, 主任医师, 河北省唐山市人民医院感染性疾病科
B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)是抗凋亡基因, Bcl-2相关x蛋白(Bcl-2-assaciated x protein, Bax)是促凋亡基因, 二者的比例是决定细胞是否发生凋亡的重要调控因素, 而蓝莓是否通过Bcl-2/Bax凋亡途径来抑制NAFLD的进展, 未见相关报道.
Li等研究发现, 在对乙酰氨基酚所致的肝损伤中, 上调Bcl-2, 下调Bax的表达能保护肝细胞.
本研究通过免疫组织化学、Western blot、RT-PCR观察蓝莓对NAFLD大鼠肝组织中Bcl-2、Bax的表达, 从细胞凋亡方面阐述了蓝莓对NAFLD大鼠的保护作用, 为预防NAFLD提供了新的切入点.
蓝莓通过Bcl-2/Bax凋亡途径对NAFLD起到了较好的预防作用, 为临床治疗NAFLD提供了新的思路与方法.
本文设计合理, 选用指标较先进, 能够反映脂肪肝的基本病理机制, 具有一定的科学性, 创新性和可读性, 也是近年来实验研究的热点之一.
编辑: 于明茜 电编:闫晋利
| 1. | Arslan N. Obesity, fatty liver disease and intestinal microbiota. World J Gastroenterol. 2014;20:16452-16463. [PubMed] [DOI] |
| 2. | Corey KE, Kaplan LM. Obesity and liver disease: the epidemic of the twenty-first century. Clin Liver Dis. 2014;18:1-18. [PubMed] [DOI] |
| 4. | Zhou Y, Xu JC, Jia YF, Xu CS. Role of death receptors in the regulation of hepatocyte proliferation and apoptosis during rat liver regeneration. Genet Mol Res. 2015;14:14066-14075. [PubMed] [DOI] |
| 5. | Ramadori P, Kroy D, Streetz KL. Immunoregulation by lipids during the development of non-alcoholic steatohepatitis. Hepatobiliary Surg Nutr. 2015;4:11-23. [PubMed] |
| 6. | Ma X, Han S, Zhang W, Fan YJ, Liu MN, Liu AY, Liu BR. Protection of cultured human hepatocytes from hydrogen peroxideinduced apoptosis by relaxin3. Mol Med Rep. 2015;11:1228-1234. [PubMed] [DOI] |
| 7. | Conde de la Rosa L, Vrenken TE, Buist-Homan M, Faber KN, Moshage H. Metformin protects primary rat hepatocytes against oxidative stress-induced apoptosis. Pharmacol Res Perspect. 2015;3:e00125. [PubMed] [DOI] |
| 8. | Wu X, Beecher GR, Holden JM, Haytowitz DB, Gebhardt SE, Prior RL. Lipophilic and hydrophilic antioxidant capacities of common foods in the United States. J Agric Food Chem. 2004;52:4026-4037. [PubMed] [DOI] |
| 9. | Prior RL, Cao G, Prior RL, Cao G. Analysis of botanicals and dietary supplements for antioxidant capacity: a review. J AOAC Int. 2000;83:950-956. [PubMed] |
| 10. | Burguillos MA, Hajji N, Englund E, Persson A, Cenci AM, Machado A, Cano J, Joseph B, Venero JL. Apoptosis-inducing factor mediates dopaminergic cell death in response to LPS-induced inflammatory stimulus: evidence in Parkinson's disease patients. Neurobiol Dis. 2011;41:177-188. [PubMed] [DOI] |
| 11. | Yahagi N, Shimano H, Matsuzaka T, Sekiya M, Najima Y, Okazaki S, Okazaki H, Tamura Y, Iizuka Y, Inoue N. p53 involvement in the pathogenesis of fatty liver disease. J Biol Chem. 2004;279:20571-20575. [PubMed] [DOI] |
| 12. | Sethi JK, Vidal-Puig AJ. Thematic review series: adipocyte biology. Adipose tissue function and plasticity orchestrate nutritional adaptation. J Lipid Res. 2007;48:1253-1262. [PubMed] [DOI] |
| 13. | Zarfeshani A, Ngo S, Sheppard AM. MicroRNA Expression Relating to Dietary-Induced Liver Steatosis and NASH. J Clin Med. 2015;4:1938-1950. [PubMed] [DOI] |
| 14. | Hardwick RN, Fisher CD, Canet MJ, Lake AD, Cherrington NJ. Diversity in antioxidant response enzymes in progressive stages of human nonalcoholic fatty liver disease. Drug Metab Dispos. 2010;38:2293-2301. [PubMed] [DOI] |
| 15. | Henao-Mejia J, Elinav E, Jin C, Hao L, Mehal WZ, Strowig T, Thaiss CA, Kau AL, Eisenbarth SC, Jurczak MJ. Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity. Nature. 2012;482:179-185. [PubMed] [DOI] |
| 16. | Day CP. Non-alcoholic fatty liver disease: current concepts and management strategies. Clin Med (Lond). 2006;6:19-25. [PubMed] [DOI] |
| 17. | Chatterjee N, Das S, Bose D, Banerjee S, Jha T, Saha KD. Leishmanial lipid affords protection against oxidative stress induced hepatic injury by regulating inflammatory mediators and confining apoptosis progress. Toxicol Lett. 2015;232:499-512. [PubMed] [DOI] |
| 18. | Li X, Wang Y, Wang H, Huang C, Huang Y, Li J. Endoplasmic reticulum stress is the crossroads of autophagy, inflammation, and apoptosis signaling pathways and participates in liver fibrosis. Inflamm Res. 2015;64:1-7. [PubMed] [DOI] |
| 19. | Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology. 2010;52:1836-1846. [PubMed] [DOI] |
| 20. | Schuppan D, Kim YO. Evolving therapies for liver fibrosis. J Clin Invest. 2013;123:1887-1901. [PubMed] [DOI] |
| 22. | Wieckowska A, Zein NN, Yerian LM, Lopez AR, McCullough AJ, Feldstein AE. In vivo assessment of liver cell apoptosis as a novel biomarker of disease severity in nonalcoholic fatty liver disease. Hepatology. 2006;44:27-33. [PubMed] |
| 23. | Jiang J, Li L, Xie M, Fuji R, Liu S, Yin X, Li G, Wang Z. SPATA4 Counteracts Etoposide-Induced Apoptosis via Modulating Bcl-2 Family Proteins in HeLa Cells. Biol Pharm Bull. 2015;38:1458-1463. [PubMed] [DOI] |
| 24. | Bi D, Yang M, Zhao X, Huang S. Effect of cnidium lactone on serum mutant P53 and BCL-2/BAX expression in human prostate cancer cells PC-3 tumor-bearing BALB/C nude mouse model. Med Sci Monit. 2015;21:2421-2427. [PubMed] [DOI] |
| 25. | Zhang T, Barclay L, Walensky LD, Saghatelian A. Regulation of mitochondrial ceramide distribution by members of the BCL-2 family. J Lipid Res. 2015;56:1501-1510. [PubMed] [DOI] |
| 26. | Vera-Ramirez L, Pérez-Lopez P, Varela-Lopez A, Ramirez-Tortosa M, Battino M, Quiles JL. Curcumin and liver disease. Biofactors. 2013;39:88-100. [PubMed] [DOI] |
| 27. | Li G, Chen JB, Wang C, Xu Z, Nie H, Qin XY, Chen XM, Gong Q. Curcumin protects against acetaminophen-induced apoptosis in hepatic injury. World J Gastroenterol. 2013;19:7440-7446. [PubMed] [DOI] |
| 28. | Yuji K, Sakaida H, Kai T, Fukuda N, Yukizaki C, Sakai M, Tsubouchi H, Kataoka H. Effect of dietary blueberry (Vaccinium ashei Reade) leaves on serum and hepatic lipid levels in rats. J Oleo Sci. 2013;62:89-96. [PubMed] |
| 29. | Çoban J, Evran B, Özkan F, Çevık A, Doğru-Abbasoğlu S, Uysal M. Effect of blueberry feeding on lipids and oxidative stress in the serum, liver and aorta of guinea pigs fed on a high-cholesterol diet. Biosci Biotechnol Biochem. 2013;77:389-391. [PubMed] |
| 30. | Liu Y, Wang D, Zhang D, Lv Y, Wei Y, Wu W, Zhou F, Tang M, Mao T, Li M. Inhibitory effect of blueberry polyphenolic compounds on oleic acid-induced hepatic steatosis in vitro. J Agric Food Chem. 2011;59:12254-12263. [PubMed] [DOI] |
| 31. | Ren T, Huang C, Cheng M. Dietary blueberry and bifidobacteria attenuate nonalcoholic fatty liver disease in rats by affecting SIRT1-mediated signaling pathway. Oxid Med Cell Longev. 2014;2014:469059. [PubMed] [DOI] |