修回日期: 2015-12-21
接受日期: 2016-01-19
在线出版日期: 2016-02-18
目的: 探讨上皮细胞间质化(epithelial to mesenchymal transition, EMT)与胰腺癌预后的关系.
方法: 采用免疫组织化学的方法检测60例胰腺癌组织中E-cadherin、Vimentin蛋白的表达, 根据E-cadherin和Vimentin的表达将EMT程度分为3级: 1级: E-cadherin(+)和Vimentin(-); 2级: E-cadherin(-)和Vimentin(-); 3级: E-cadherin(-)和Vimentin(+). 通过生存分析研究上皮间质化程度与预后的关系.
结果: 60例胰腺癌患者的1、2、3年累计生存率分别是50%、29%、21%. E-cadherin高表达与胰腺癌较好预后相关(P = 0.006); 而Vimentin的表达与胰腺癌预后呈负相关(P = 0.002). EMT 1级、2级、3级中位生存时间分别为24.07 mo±4.50 mo、11.97 mo±0.92 mo、6.30 mo±0.52 mo, 上皮细胞-间质化程度越高预后越差(P = 0.001). Cox比例风险模型提示EMT程度是影响患者预后的独立因素(P = 0.025), 其HR值为1.779(95%CI: 1.077-2.939).
结论: 上皮细胞-间质化是胰腺癌预后的独立危险因素, 其间质化程度越高, 预后越差.
核心提示: 目前缺乏有效预测胰腺癌预后的方法, 已有的研究表明上皮细胞间质化与肿瘤演进、复发转移密切相关, 因此在胰腺癌中, 上皮细胞间质化程度可能有效地预测胰腺癌预后.
引文著录: 马睿锐, 贡海兵, 龚健, 徐彬. 上皮细胞间质化预测胰腺癌预后的价值. 世界华人消化杂志 2016; 24(5): 686-691
Revised: December 21, 2015
Accepted: January 19, 2016
Published online: February 18, 2016
AIM: To investigate the relationship between epithelial to mesenchymal transition (EMT) and patient's prognosis in pancreatic cancer.
METHODS: E-cadherin and Vimentin protein expression was detected by immunohistochemistry in 60 pancreatic cancer specimens. EMT was divided into three grades according to the expression of E-cadherin and Vimentin: Ⅰ [E-cadherin (+)/ Vimentin (-)], Ⅱ [E-cadherin (-)/Vimentin (-)], and Ⅲ [E-cadherin (-)/Vimentin (+)]. Kaplan-Meier survival analysis was used to evaluate the relationship between EMT and patient's prognosis.
RESULTS: The 1-, 2-, and 3-year overall survival rates in 60 patients with pancreatic cancer were 50%, 29% and 50%, respectively. High expression of E-cadherin was associated with a good prognosis (P = 0.006), while elevated expression of Vimentin related with a poor prognosis (P = 0.002). Median survival of patients with grades Ⅰ, Ⅱ and Ⅲ EMT was 24.07 mo ± 4.50 mo, 11.97 mo ± 0.92 mo and 6.30 mo ± 0.52 mo, respectively. A higher grade of EMT was associated with a worse prognosis (P = 0.001). Cox proportional hazards models suggested that EMT was one of independent risk factors for poor prognosis in pancreatic cancer (P = 0.025), with HR = 1.779 (95%CI: 1.077-2.939).
CONCLUSION: EMT is an independent predicable risk factor for poor prognosis in pancreatic cancer.
- Citation: Ma RR, Gong HB, Gong J, Xu B. Relationship between epithelial to mesenchymal transition and prognosis in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 686-691
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/686.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.686
胰腺癌预后极差[1,2], 与其具有高侵袭和高转移的生物学特性相关, 5年生存率仅3%-7%[3]. 最近的研究[4]表明: 上皮细胞间质化(epithelial to mesenchymal transition, EMT)参与肿瘤的演进[5,6], 并扮演着重要的角色, EMT以上皮细胞极性的丧失和间质特性的获得为主要特征. 在肿瘤演进过程中, 可通过EMT的信号机制[7-9]下调E-cadherin和其他上皮细胞性标志物, 同时上调间质性标志物如波形蛋白(Vimentin)等, 从而促进肿瘤的侵袭和转移[10-13]. 目前仍然缺乏有效的预测胰腺癌预后的方法, 在胰腺癌中, EMT与其预后的相关性仍有待进一步证实.
60例石蜡标本取自2006-01-01/2010-06-01经手术切除病理证实的胰腺导管腺癌患者. 其中男37例, 女23例, 男女比例为1.6:1, 年龄34-87岁, 平均61.7岁±12.4岁, 中位年龄62.0岁. 胰头癌49例, 胰体尾癌9例, 全胰癌2例. 行胰十二指肠切除术(Child术式)46例、胰体尾切除+脾脏切除术8例、胰十二指肠切除(Child术式)+门静脉切除重建术3例、全胰腺切除+门静脉切除重建术2例、保留胰头次全切除术1例. 术后病理示高分化腺癌8例, 中分化腺癌33例, 低分化腺癌19例. 有淋巴结转移26例, 其中3例并发肝转移. 根据UICC第6版TNM分期: ⅠA期1例、ⅠB期10例、ⅡA期23例、ⅡB期20例、Ⅲ期3例、Ⅳ期3例. 鼠抗人E-cadherin单克隆抗体: DAKO公司, 鼠抗人Vimentin单克隆抗体: DAKO公司, DAB显色试剂盒: 北京中山公司.
1.2.1 免疫组织化学染色: 取60例患者的蜡块制作成4微米厚的组织芯片, 芯片由上海芯超生物科技有限公司构建. 免疫组织化学染色方法简述如下: 常规二甲苯脱蜡, PBS液洗3次×3 min; H2O2抑制内源性过氧化物酶, 室温下30 min; PBS液洗3次×3 min; 抗原修复: 微波炉加热柠檬酸缓冲液至沸腾, 组织芯片放入10 min; 滴加抗-Vimentin、抗-E-cadherin抗体(均1:100), 4 ℃过夜; PBS液洗3次×3 min; EnVision™孵育37 ℃ 30 min; PBS液洗3次×3 min; DAB+H2O2显色10 min; 苏木精复染2 min; 蒸馏水漂洗, 晾干后封片.
1.2.2 免疫组织化学结果判定和EMT程度定义: E-cadherin定位于细胞膜, 结果判断参照Lepage等[3], 稍作修改: 以≥70%癌细胞着色, 且着色位于细胞膜视为E-cadherin保留(+), <70%癌细胞着色或着色不位于细胞膜均视为E-cadherin降低(-). Vimentin定位于细胞浆, 胞浆内出现黄色或棕黄色颗粒视为阳性. 阳性癌细胞≥20%视为Vimentin上调(+), 阳性癌细胞<20%视为阴性(-). 根据E-cadherin和Vimentin的表达将上皮间质化程度分为3级: 1级[E-cadherin(+)和Vimentin(-)]、2级[E-cadherin(-)和Vimentin(-)]和3级[E-cadherin(-)和Vimentin(+)].
统计学处理 采用SPSS for windows 13.0软件包. 生存分析采用寿命表法和Kaplan-Meier法, 组间比较采用Log-rank(Mantel-Cox). 多因素生存分析采用Cox比例风险回归模型. P<0.05为差异有统计学意义.
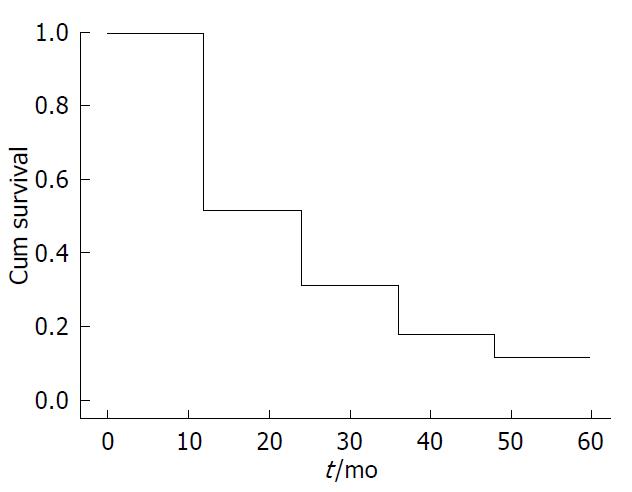
采用电话或者门诊随访等方式获得患者的生存资料, 随访至2014-04-11, 9例失访, 60例胰腺癌患者的1、2、3年累计生存率分别是50%、29%、21%(图1).
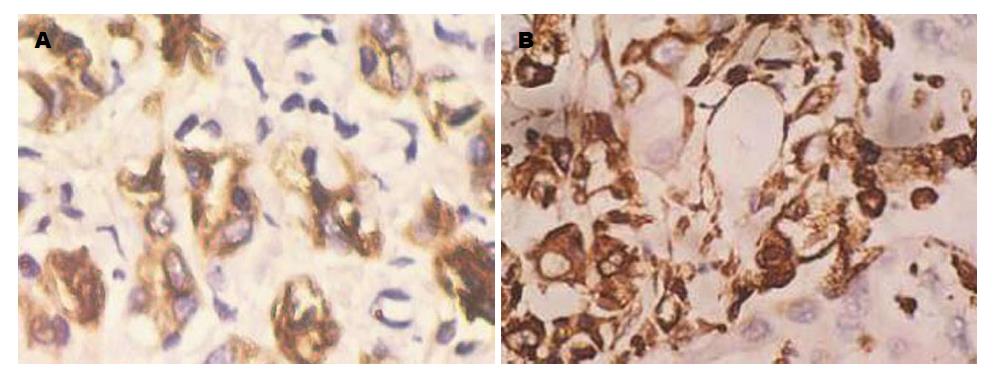
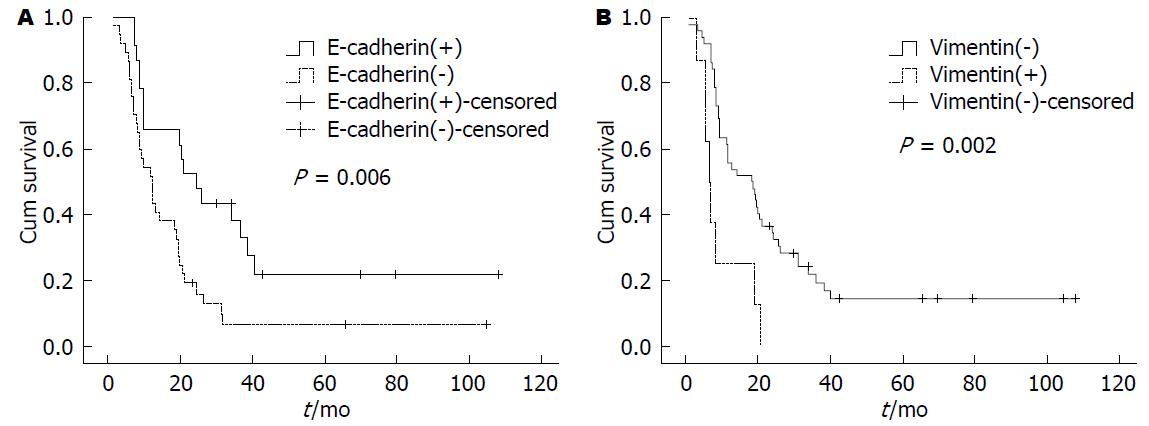
E-cadherin阳性表达主要位于细胞膜. 胰腺正常上皮细胞E-cadherin均为细胞膜强阳性均匀致密着色. 而在胰腺癌细胞中, 表达则有明显异质性(图2A). 依据E-cadherin蛋白表达状况, 将60例患者分为2组: E-cadherin(+)组和E-cadherin(-)组, E-cadherin(+)组的中位生存期为24.07 mo±4.50 mo, 而E-cadherin(-)组为11.93 mo±1.76 mo(P = 0.006)(图3A).
Vimentin阳性表达位于间质细胞浆, 胰腺正常上皮细胞不表达. 60例胰腺癌中, 有8例(12.3%)表达上调(图2B). 8例Vimentin上调者有7例(87.5%)发生区域淋巴节转移, 而52例Vimentin阴性者只有19例(36.5%)发生区域淋巴节转移, 两者间比较有显著差异(P<0.05), Vimentin上调预示着高转移倾向. 进一步分析发现Vimentin(+)组患者的中位生存时间短于Vimentin(-)组, 分别为6.30 mo±0.52 mo和18.10 mo±4.41 mo, 经检验P<0.01(图3B).
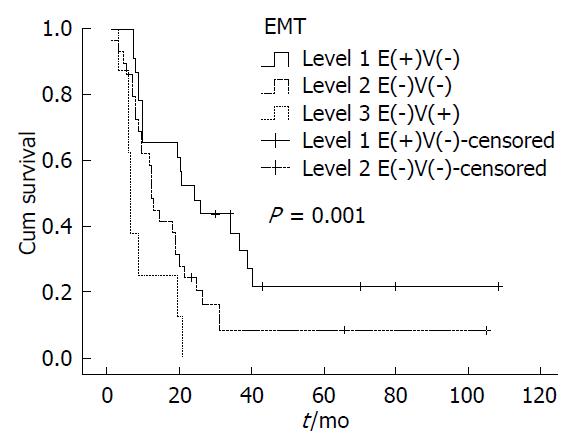
通过生存分析发现: 胰腺癌上皮间质化程度越高, 其预后越差. EMT的程度: 1级<2级<3级, 而术后生存时间: 1级>2级>3级(表1, 图4). 单因素分析提示肿瘤直径、组织学分级、术后化疗及EMT的程度与患者预后有关(P<0.05), Cox比例风险模型进行对上述多因素分析发现EMT程度是影响患者预后的独立因素(P = 0.025), 其HR值为1.779(95%CI: 1.077-2.939).
| EMT程度 | 平均生存时间 | 中位生存时间 | ||||||
| 估计值 | 标准误 | 95%可信区间 | 估计值 | 标准误 | 95%可信区间 | |||
| 上限 | 下限 | 上限 | 下限 | |||||
| 1级 | 39.246 | 8.240 | 23.096 | 55.396 | 24.067 | 4.498 | 15.250 | 32.884 |
| 2级 | 21.315 | 4.999 | 11.518 | 31.113 | 11.967 | 0.919 | 10.165 | 13.769 |
| 3级 | 9.417 | 2.349 | 4.812 | 14.021 | 6.300 | 0.519 | 5.284 | 7.316 |
| 总体 | 26.956 | 4.300 | 18.528 | 35.383 | 12.933 | 3.947 | 5.198 | 20.669 |
EMT是指上皮细胞在特定的生理和病理情况下向间质细胞转分化的现象. 在此过程中, 上皮细胞极性丧失, 迁移能力增强, 同时逐渐获得间质表型[14]. 肿瘤细胞从原发病灶脱落是侵袭转移的起始阶段, EMT可促进肿瘤细胞脱落和转移. 我们的研究表明: 在胰腺癌中, EMT扮演了促癌侵袭和转移的角色, 并能较好的预测胰腺癌的预后.
E-cadherin和Vimentin分别是上皮细胞和间质细胞的主要标志物[15-17]. E-cadherin在正常上皮细胞膜均匀而稳定的表达, 细胞外信号可通过E-cadherin传到细胞骨架, 调节细胞形态. E-cadherin的高表达能降低胰腺癌细胞的侵袭性. Vimenin特异性分布于间质来源的细胞, 因此可作为间质细胞标志物, Vimentin表达上调可增加肿瘤细胞的迁移能力[18]. 此外, E-cadherin和Vimentin均与肿瘤预后相关[19-21]. 我们的研究[22,23]也证实了E-cadherin表达与胰腺癌较好预后相关, 而Vimentin蛋白上调预示着高转移倾向和较差预后. E-cadherin表达下降、Vimentin表达升高被认为是EMT程序启动的主要分子标识[24], 通过观察E-cadherin和Vimentin在肿瘤细胞中的表达状况, 可定性的反映肿瘤细胞间质化的程度. 因此, 本研究采用免疫组织化学的方法检测了60例患者的E-cadherin和Vimentin蛋白的表达, 并依据两者的表达情况将胰腺癌细胞的上皮间质化程度定性分为3级: 1级E-cadherin蛋白(+)和Vimentin蛋白(-)、2级E-cadherin蛋白(-)和Vimentin蛋白(-)和3级E-cadherin蛋白(-)和Vimentin蛋白(+), 其EMT的程度: 1级<2级<3级. 胰腺癌细胞发生EMT, 其侵袭转移的能力会明显的增强[25-27]. 本研究结果显示, EMT 3级的患者术后生存时间明显短于EMT 1级或者2级的患者, 同时Cox比例风险模型分析也证实EMT程度是影响患者预后的独立因素. 这说明了胰腺癌中EMT的程度是可以预测胰腺癌患者的预后, 因为EMT程度越严重, 上皮来源的肿瘤细胞结构发生间质化会越明显, 与周围细胞和基质的接触减少也越明显, 从而显著地增强了其迁移和运动能力. 在EMT 3级中, E-cadherin表达下调, 间质标志物Vimentin表达上调最明显, 这种表型的转换可以使胰腺癌细胞摆脱细胞与细胞之间的连接, 从而侵袭和转移能力明显增强, 这与其最差预后密切相关.
近期, 学者们进一步探究EMT促进胰腺癌侵袭与转移的机制. Liu等[28]发现miR-208可促进胰腺癌EMT, 从而导致胰腺癌细胞的侵袭及转移. 同样, Bo等[29]提出上调Wnt5a的表达可促进胰腺癌上皮细胞的间质化及转移能力. 而Xu等[30]研究发现可以逆转胰腺癌上皮细胞的间质化, 从而改善胰腺癌患者的预后. 本研究明确了EMT是胰腺癌预后的独立危险因素, 为临床应用奠定了基础, 而其进一步的机制研究将对临床应用提供依据.
胰腺癌预后极差, 5年生存率极低, 而目前临床缺乏有效的预测胰腺癌预后的方法, 大量研究表明上皮细胞间质化(epithelial to mesenchymal transition, EMT)参与肿瘤的侵袭与转移. 本文的研究拟表明EMT与胰腺癌预后的关系, 为临床应用开拓新思路.
华海清, 教授, 主任医师, 解放军第八一医院全军肿瘤中心肿瘤内三科; 梁国刚, 教授, 大连医科大学附属第一医院
大量研究EMT参与肿瘤的演进, 本研究采用免疫组织化学的方法检测上皮细胞性标志物(E-cadherin蛋白)和间质性标志物(Vimentin蛋白)在胰腺癌细胞中的表达情况, 并依据两者的表达情况将胰腺癌细胞的上皮间质化程度定性, 从而证实EMT是胰腺癌预后的独立危险因素.
Yamada等研究证实EMT的程度与胰腺癌的预后密切相关.
本研究采用组织芯片技术检测EMT标志物的表达情况, 研究结果表明EMT是胰腺癌预后的独立危险因素, 为胰腺癌预后的预测提供一种新思路.
EMT在胰腺癌中扮演了促癌侵袭和转移的角色, 可成为临床预测胰腺癌预后的一种新方法.
本文阐明了EMT与胰腺癌预后的关系, 选题科学, 内容详实, 写作流畅, 研究结论对临床有一定的指导价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Xu B, Zheng WY, Jin DY, Wang DS, Liu XY, Qin XY. Treatment of pancreatic cancer using an oncolytic virus harboring the lipocalin-2 gene. Cancer. 2012;118:5217-5226. [PubMed] [DOI] |
| 2. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65:5-29. [PubMed] [DOI] |
| 3. | Lepage C, Capocaccia R, Hackl M, Lemmens V, Molina E, Pierannunzio D, Sant M, Trama A, Faivre J, EUROCARE-5 Working Grouph. Survival in patients with primary liver cancer, gallbladder and extrahepatic biliary tract cancer and pancreatic cancer in Europe 1999-2007: Results of EUROCARE-5. Eur J Cancer. 2015; Sep 5. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Pasquier J, Abu-Kaoud N, Al Thani H, Rafii A. Epithelial to Mesenchymal Transition in a Clinical Perspective. J Oncol. 2015;2015:792182. [PubMed] [DOI] |
| 5. | Brivio S, Cadamuro M, Fabris L, Strazzabosco M. Epithelial-to-Mesenchymal Transition and Cancer Invasiveness: What Can We Learn from Cholangiocarcinoma? J Clin Med. 2015;4:2028-2041. [PubMed] [DOI] |
| 7. | 高 振芹, 胡 永斌, 周 建华. MAPK信号通路与上皮间质转型. 国际病理科学与临床杂志. 2009;29:303-306. |
| 8. | 孙 建平, 李 锋, 万 国兴, 李 文琴, 曹 玉文. Notch信号通路及上皮间质转化与乳腺癌相关性研究进展. 中华实用诊断与治疗杂志. 2013;27:625-626. |
| 10. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420-1428. [PubMed] [DOI] |
| 11. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 12. | Wan L, Pantel K, Kang Y. Tumor metastasis: moving new biological insights into the clinic. Nat Med. 2013;19:1450-1464. [PubMed] [DOI] |
| 13. | Polyak K, Weinberg RA. Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits. Nat Rev Cancer. 2009;9:265-273. [PubMed] [DOI] |
| 15. | Fei F, Zhang D, Yang Z, Wang S, Wang X, Wu Z, Wu Q, Zhang S. The number of polyploid giant cancer cells and epithelial-mesenchymal transition-related proteins are associated with invasion and metastasis in human breast cancer. J Exp Clin Cancer Res. 2015;34:158. [PubMed] [DOI] |
| 16. | Qin Y, Tang B, Hu CJ, Xiao YF, Xie R, Yong X, Wu YY, Dong H, Yang SM. An hTERT/ZEB1 complex directly regulates E-cadherin to promote epithelial-to-mesenchymal transition (EMT) in colorectal cancer. Oncotarget. 2015; Oct 20. [Epub ahead of print]. [PubMed] [DOI] |
| 17. | Zhao J, Dong D, Sun L, Zhang G, Sun L. Prognostic significance of the epithelial-to-mesenchymal transition markers e-cadherin, vimentin and twist in bladder cancer. Int Braz J Urol. 2014;40:179-189. [PubMed] [DOI] |
| 19. | Zhao C, Li X, Su C, Li J, Cheng N, Ren S, Chen X, Zhou C. High expression of E-cadherin in pleural effusion cells predicts better prognosis in lung adenocarcinoma patients. Int J Clin Exp Pathol. 2015;8:3104-3109. [PubMed] |
| 20. | Toiyama Y, Yasuda H, Saigusa S, Tanaka K, Inoue Y, Goel A, Kusunoki M. Increased expression of Slug and Vimentin as novel predictive biomarkers for lymph node metastasis and poor prognosis in colorectal cancer. Carcinogenesis. 2013;34:2548-2557. [PubMed] [DOI] |
| 21. | Zhai X, Zhu H, Wang W, Zhang S, Zhang Y, Mao G. Abnormal expression of EMT-related proteins, S100A4, vimentin and E-cadherin, is correlated with clinicopathological features and prognosis in HCC. Med Oncol. 2014;31:970. [PubMed] [DOI] |
| 22. | Mallini P, Lennard T, Kirby J, Meeson A. Epithelial-to-mesenchymal transition: what is the impact on breast cancer stem cells and drug resistance. Cancer Treat Rev. 2014;40:341-348. [PubMed] [DOI] |
| 24. | 申 震, 周 颖, 赵 卫东, 程 勇, 徐 汉杰, 杨 春梅. Vimentin及E-Cadherin在子宫颈癌中的表达及其与上皮细胞间质化的相关性. 安徽医科大学学报. 2013;48:505-508. |
| 25. | 刘 庆, 陈 芳芳, 段 唐海, 朱 海涛, 谢 小东, 吴 荧荧, 张 志坚, 王 冬青. CCL21通过上皮间质转化促进胰腺癌Panc-1细胞的迁移. 细胞与分子免疫学杂志. 2015;31:6-9. |
| 26. | Beuran M, Negoi I, Paun S, Ion AD, Bleotu C, Negoi RI, Hostiuc S. The epithelial to mesenchymal transition in pancreatic cancer: A systematic review. Pancreatology. 2015;15:217-225. [PubMed] [DOI] |
| 27. | Yamada S, Fuchs BC, Fujii T, Shimoyama Y, Sugimoto H, Nomoto S, Takeda S, Tanabe KK, Kodera Y, Nakao A. Epithelial-to-mesenchymal transition predicts prognosis of pancreatic cancer. Surgery. 2013;154:946-954. [PubMed] [DOI] |
| 28. | Liu A, Shao C, Jin G, Liu R, Hao J, Song B, Ouyang L, Hu X. miR-208-induced epithelial to mesenchymal transition of pancreatic cancer cells promotes cell metastasis and invasion. Cell Biochem Biophys. 2014;69:341-346. [PubMed] [DOI] |
| 29. | Bo H, Zhang S, Gao L, Chen Y, Zhang J, Chang X, Zhu M. Upregulation of Wnt5a promotes epithelial-to-mesenchymal transition and metastasis of pancreatic cancer cells. BMC Cancer. 2013;13:496. [PubMed] [DOI] |
| 30. | Xu B, Jin DY, Lou WH, Wang DS. Lipocalin-2 is associated with a good prognosis and reversing epithelial-to-mesenchymal transition in pancreatic cancer. World J Surg. 2013;37:1892-1900. [PubMed] [DOI] |