修回日期: 2015-12-18
接受日期: 2015-12-29
在线出版日期: 2016-02-08
目的: 探讨miR-135b、LZTS1及β-catenin在胰腺癌中的表达意义及三者之间的相关性.
方法: 分别采用锁定核酸原位杂交技术(LNA-ISH)和免疫组织化学法检测miR-135b、LZTS1和β-catenin蛋白在70例胰腺癌及相应癌旁组织中的表达情况.
结果: miR-135b在胰腺癌中的表达率高于癌旁正常组织(71.4% vs 42.9%, P = 0.001), LZTS1、β-catenin蛋白在胰腺癌中的表达率均低于癌旁正常组织(34.3% vs 68.6%、34.3% vs 74.3%, P<0.05). 在胰腺癌组织中miR-135b与LZTS1的表达水平呈负相关(r = -0.61, P<0.05), 与β-catenin无相关性(r = 0.06, P>0.05); LZTS1与β-catenin呈正相关(r = 0.37, P<0.05), 且miR-135b、LZTS1和β-catenin的阳性表达水平与胰腺癌的临床分期及淋巴结转移密切相关(P<0.05), 与胰腺癌患者年龄、性别、肿瘤部位及组织学分级无关(P>0.05).
结论: miR-135b在胰腺癌中表达升高, LZTS1与β-catenin在胰腺癌中表达减少, 并且表达升高的miR135b可能通过下调LZTS1基因表达而参与了胰腺癌的发生发展.
核心提示: 在胰腺癌组织中miR-135b表达显著上调, LZTS1和β-catenin蛋白表达显著下调, 且miR-135b与LZTS1呈负相关, LZTS1与β-catenin呈正相关, 均与TNM分期有关, 提示在胰腺癌中miR-135b通过下调LZTS1的表达, 导致β-catenin向核内转移, 促发上皮间质转化并激活Wnt/β-catenin信号通路, 对胰腺癌的发生发展有着重要作用.
引文著录: 张炳丽, 王春峰, 周琳, 张连峰. miR-135b、LZTS1、β-catenin在胰腺癌中的表达及临床意义. 世界华人消化杂志 2016; 24(4): 521-527
Revised: December 18, 2015
Accepted: December 29, 2015
Published online: February 8, 2016
AIM: To detect the expression of miR-135b, LZTS1 and β-catenin in pancreatic cancer in an attempt to explore their clinical significance.
METHODS: Locked nucleic acid in situ hybridization (ISH) and immunohisto-chemistry were used to detect the expression of miR-135b, LZTS1 and β-catenin proteins in 70 pancreatic cancer tissues and adjacent normal tissues, respectively.
RESULTS: The positive rate of miR-135b in pancreatic cancer was higher than that in adjacent tissues (71.4% vs 42.9%, P = 0.001). The positive rates of LZTS1 and β-catenin proteins in pancreatic cancer were significantly lower than those in adjacent tissues (34.3% vs 68.6%, 34.3% vs 74.3%, P < 0.05). Expression of miR-135b had a negative correlation with that of LZTS1 in pancreatic cancer (r = -0.61, P < 0.05), but miR-135b expression had no significant correlation with β-catenin (r = 0.06, P > 0.05). LZTS1 expression had a positive correlation with that of β-catenin (r = 0.37, P < 0.05). Expression of miR-135b, LZTS1 and β-catenin was closely related with lymph node metastasis and clinical stage (P < 0.05), but had no correlation with patient age, sex, tumor site or histological grade (P > 0.05).
CONCLUSION: miR-135b is highly expressed in pancreatic cancer, while the expression of LZTS1 and β-catenin is decreased. Up-regulated expression of miR-135b may participate in the development of pancreatic cancer by down-regulating the expression of LZTS1 protein.
- Citation: Zhang BL, Wang CF, Zhou L, Zhang LF. Clinical significance of expression of miR-135b, LZTS1 and β-catenin in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(4): 521-527
- URL: https://www.wjgnet.com/1009-3079/full/v24/i4/521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i4.521
胰腺癌是一种恶性度高、预后差的恶性肿瘤, 5年生存率<5%, 其发生发展受多基因多步骤调控[1]. LZTS1作为一种潜在的抑癌基因, 通过上调β-catenin蛋白的表达间接抑制上皮间质转化(epithelial-mesenchymal transition, EMT), 从而抑制肿瘤侵袭、转移[2]. 但其在许多肿瘤如肺癌[3,4]、胃癌[5]、膀胱癌[6]、乳腺癌[7-9]、结肠癌[10]等中表达减少. miRNAs作为一种可以调控编码基因表达的小RNA分子, 参与一系列如细胞增殖、分化、侵袭、转移及凋亡等生物学过程[11,12]. 近年来许多研究[13-17]发现, miR-135b在多种类型恶性肿瘤中表达上调, 起原癌基因作用, 并且能够通过下调LZTS1蛋白的表达而抑制肿瘤形成[3,18,19]. 同时Munding等[20]、Brand等[21]也检测到miR-135b在胰腺癌中表达上调, 但miR-135b与LZTS1及β-catenin蛋白之间的关系尚不清楚. 本实验旨在研究miR-135b、LZTS1及β-catenin蛋白在胰腺癌中的表达及其与胰腺癌临床病理关系, 初步探讨三者在胰腺癌中的作用及相关性.
选择2011-01/2014-12郑州大学第一附属医院经手术切除的胰腺癌组织标本及对照的癌旁组织标本各70例. 所有标本术前未经放疗、化疗及免疫治疗, 且经2名病理医师证实均为胰腺导管腺癌. 标本均经常规固定后规范取材, 切片厚度为3 μm. 70例胰腺癌病例中, 男性48例, 女性22例, 平均年龄36-81岁(57.4岁±10.3岁). 肿瘤部位: 胰头40例, 胰体尾30例. 病理分级: 高分化10例, 中分化44例, 低分化16例. 临床分期: Ⅰ-Ⅱ期44例, Ⅲ期16例, Ⅳ期10例. 有淋巴结转移38例, 无淋巴结转移32例. miR-135b探针购自丹麦Exiqon公司, 兔抗人LZTS1、β-catenin多克隆抗体分别购自北京博奥森和美国Santa Cruz公司, 抗地高辛抗体、NBT/BCIP等试剂购自武汉博士德公司, SP免疫组织化学试剂盒及DAB显色剂等购自北京中杉金桥生物技术有限公司.
1.2.1 锁定核酸原位杂交染色: 组织切片脱蜡脱水, 于37 ℃蛋白酶K消化15 min, 漂洗后4%多聚甲醛固定15 min, 53 ℃预杂交2 h后, 地高辛标记的miR-135b探针(20 nmol/L)于53 ℃恒温水浴锅中杂交过夜, 严格洗涤, 常温封闭30 min后加抗地高辛抗体(1:800)室温孵育2 h, NBT/BCIP黑暗中显色2-8 h, 核固红复染、脱水、透明及封片. 去除探针作为阴性对照.
结果评分[22]: 以出现蓝色或蓝紫色颗粒为阳性信号, 按阳性细胞数≥10%为1分, <10%为0分, 按着色细胞染色强度分: 无表达或低表达为0分, 中等强度或强表达为1分, 两项积分乘积为0表示阴性(-), 1分为阳性(+).
1.2.2 免疫组织化学SP法染色: 一抗均采用工作液(LZTS1以1:300稀释, β-catenin以1:100稀释), PBS作为阴性对照, 在相同条件下进行SP染色. 按说明书步骤进行操作, 组织切片常规脱蜡脱水, 经SP染色, 然后DAB显色、苏木素复染、脱水、透明、封片. 结果评分[23]: 以出现棕黄色颗粒为阳性信号, 按阳性细胞所占百分比与着色强度进行评分: (1)按染色强度打分: 0分为无色, 1分为淡黄色, 2分为棕黄色, 3分为棕褐色; (2)按阳性细胞所占的百分比打分: 0分为阴性, 1分为阳性细胞≤10%, 2分为11%-50%, 3分为51%-75%, 4分为>75%. 染色强度与阳性细胞百分比的乘积>3分为阳性(+), ≤3分为阴性(-).
统计学处理 应用SPSS17.0软件进行统计分析, 癌组织与癌旁正常组织中miR-135b、LZTS1及β-catenin的表达差异以及三者与患者临床病理特征的关系采用χ2检验, 以及三者之间的相关性采用Spearman相关分析, 检验水准α = 0.05, P<0.05为差异具有统计学意义.
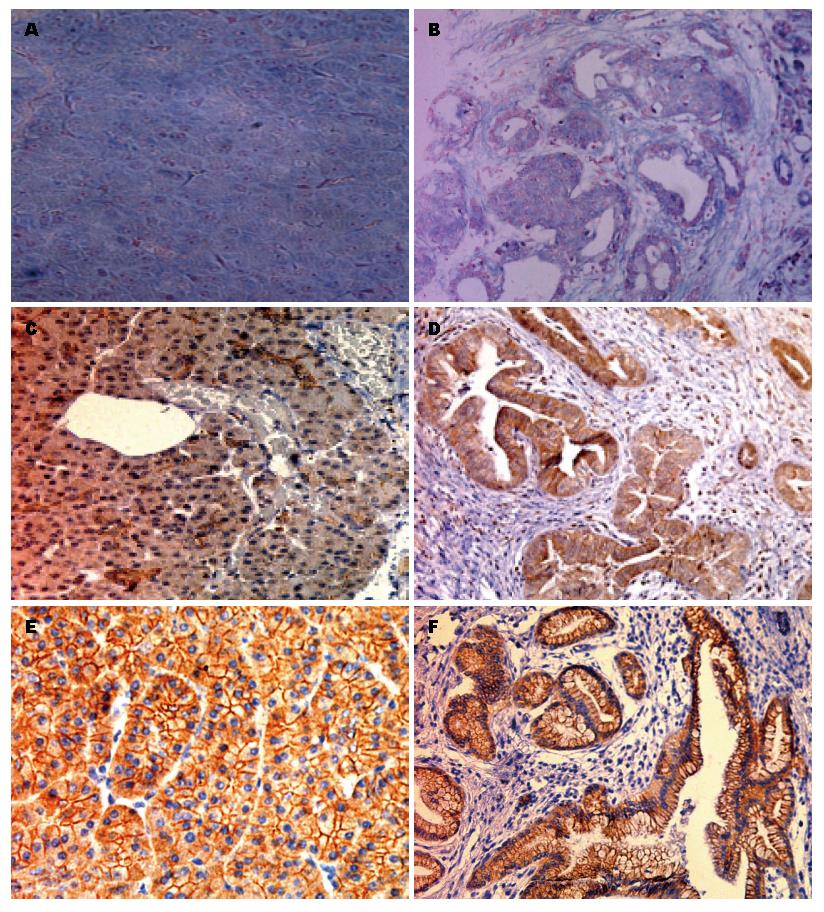
原位杂交结果显示, 蓝色或蓝紫色为阳性信号, 定位于胞浆及部分胞核; 免疫组织化学结果显示, LZTS1和β-catenin阳性显色呈棕黄色或棕褐色, 定位于胞浆和胞膜(图1). 在胰腺癌组织和癌旁正常组织中, miR-135b、LZTS1蛋白、β-catenin蛋白的阳性表达率分别为[71.4%(50/70) vs 42.9%(30/70)]、[34.3%(24/70) vs 68.6%(48/70)]、[34.3%(24/70) vs 74.3%(52/70)], 三者各自在胰腺癌及癌旁组织中的表达水平差异均具有统计学意义(P<0.05)(表1).
| 组织学类型 | miR-135b | LZTS1 | β-catenin | |||||||||
| + | - | χ2值 | P值 | + | - | χ2值 | P值 | + | - | χ2值 | P值 | |
| 胰腺癌组织 | 50 | 20 | 11.67 | 0.001 | 24 | 46 | 16.47 | 0.000 | 24 | 46 | 22.57 | 0.000 |
| 癌旁正常组织 | 30 | 40 | 48 | 22 | 52 | 18 | ||||||
Spearman相关分析显示, miR-15b与LZTS1在胰腺癌组织中的表达水平呈负相关(r = -0.61, P<0.05), LZTS1与β-catenin在胰腺癌中的表达水平呈正相关(r = 0.37, P<0.05), miR-135b与β-catenin在胰腺癌中的表达水平无相关性(r = 0.06, P>0.05)(表2).
| LZTS1 | β-catenin | |||||||
| + | - | P值 | r值 | + | - | P值 | r值 | |
| miR-135b | 0.000 | -0.61 | 0.633 | 0.06 | ||||
| + | 8 | 42 | 18 | 32 | ||||
| - | 16 | 4 | 6 | 14 | ||||
| β-catenin | 0.002 | 0.37 | ||||||
| + | 14 | 10 | ||||||
| - | 10 | 36 | ||||||
miR-135b、LZTS1及β-catenin表达水平与胰腺癌的临床分期、淋巴结转移相关(均P<0.05), 与胰腺癌患者年龄、性别、肿瘤部位及分化程度无关(均P>0.05)(表3).
| 病理参数 | n | miR-135b | LZTS1 | β-catenin | |||||||||
| + | - | χ2值 | P值 | + | - | χ2值 | P值 | + | - | χ2值 | P值 | ||
| 年龄(岁) | 0.09 | 0.76 | 3.57 | 0.06 | 0.21 | 0.88 | |||||||
| <50 | 30 | 22 | 8 | 14 | 16 | 10 | 20 | ||||||
| ≥50 | 40 | 28 | 12 | 10 | 30 | 14 | 26 | ||||||
| 性别 | 0.03 | 0.87 | 0.70 | 0.41 | 0.06 | 0.80 | |||||||
| 男 | 48 | 34 | 14 | 18 | 30 | 16 | 32 | ||||||
| 女 | 22 | 16 | 6 | 6 | 16 | 8 | 14 | ||||||
| 肿瘤部位 | 0.58 | 0.45 | 1.35 | 0.25 | 1.35 | 0.24 | |||||||
| 头 | 40 | 30 | 10 | 16 | 24 | 16 | 24 | ||||||
| 体尾 | 30 | 20 | 10 | 8 | 22 | 8 | 22 | ||||||
| 分化程度 | 2.891 | 0.241 | 0.841 | 0.661 | 3.971 | 0.141 | |||||||
| 高 | 10 | 6 | 4 | 4 | 6 | 6 | 4 | ||||||
| 中 | 44 | 30 | 14 | 16 | 28 | 12 | 32 | ||||||
| 低 | 16 | 14 | 2 | 4 | 12 | 6 | 10 | ||||||
| 临床分期 | 8.841 | 0.001 | 21.581 | 0.001 | 12.981 | 0.001 | |||||||
| Ⅰ-Ⅱ | 44 | 26 | 18 | 24 | 20 | 22 | 22 | ||||||
| Ⅲ-Ⅳ | 26 | 24 | 2 | 0 | 26 | 2 | 24 | ||||||
| 淋巴结转移 | 17.41 | 0.00 | 12.62 | 0.00 | 20.83 | 0.00 | |||||||
| 有 | 38 | 35 | 3 | 6 | 32 | 4 | 34 | ||||||
| 无 | 32 | 15 | 17 | 18 | 14 | 20 | 12 | ||||||
miRNAs是一类长度约21个核苷酸的非编码单链小RNA分子, 能够通过与靶基因mRNA的3'-非翻译区互补配对而降解或抑制靶基因表达, 广泛存在于动植物中. 许多研究显示差异表达的miRNAs在肿瘤中发挥着类似原癌基因或抑癌基因的作用, 并能通过作用于下游靶基因直接或间接影响相关的信号通路, 对肿瘤的发生、发展以及转移产生重要的作用[24]. 目前已有研究表明miR-135b在非小细胞肺癌中高表达, 通过下调下游靶基因LAST2而间接调控Hippo信号, 促进肿瘤侵袭及转移[3]. Aakula等[13]也报道miR-135b通过调控Era、AR和HIF1AN表达, 促进乳腺癌和前列腺癌细胞的生长及侵袭. 因此, miR-135b在多种肿瘤中表达上调, 通过作用于下游靶基因而调控信号的转导, 参与肿瘤的形成与发展.
LZTS1基因是Ishii等[25]于1999年对原发性食管癌进行研究时利用微卫星技术发现一段全长约1.5 Mb, 位于人类染色体8p21.3的D8S261位点附近的一段基因. 许多研究发现, LZTS1基因在人体的正常组织中广泛表达, 但在50%以上的肿瘤细胞中表达下调或缺失, 因此LZTS1在许多肿瘤的发生发展中发挥着重要的作用. Lin等[3]、Olasz等[18]研究表明miR-135b可通过直接下调下游LZTS1靶基因的表达, 进而促进肿瘤的侵袭及转移, 研究[25-27]发现, LZTS1-/-的癌细胞系转染LZTS1后, 细胞周期阻滞于S-G2/M期, 推测LZTS1可能通过与Cdk1的相互作用而控制cyclineB1/Cdk1复合物在S-G2/M期的稳定性, 从而抑制细胞生长及肿瘤形成. Wang等[2]研究表明了LZTS1通过上调EMT相关分子: E-adherin、β-catenin在胞膜中的表达, 从而抑制细胞转移. β-catenin作为连环蛋白家族成员之一, 主要定位于细胞膜, 与细胞膜上的E-adherin形成复合物, 维持细胞间的黏附及细胞骨架的稳定性, 并减弱上皮细胞的迁移能力. EMT发生可促进β-catenin在胞浆内异常蓄积, 进而激活Wnt/β-catenin信号通路, 促进肿瘤的发生、发展[28].
为初步探讨miR-135b、LZTS1和β-catenin在胰腺癌中的表达情况及与胰腺癌临床病理特征的关系, 本研究结果显示, miR-135b在胰腺癌组织中的表达明显高于癌旁正常组织, LZTS1和β-catenin蛋白在胰腺癌组织中的表达明显下降. Cao等[29]、Ji等[30]研究表明β-catenin在胰腺癌中的表达低于对照的正常细胞, 在胰腺癌的发展中参与了重要的作用. 同时miR-135b、LZTS1和β-catenin的阳性表达水平均与胰腺癌的临床分期及淋巴结转移密切相关, TNM分期越高、有淋巴结转移时, miR-135b阳性表达率越高, 相反, LZTS1和β-catenin的表达水平降低. 此外, 相比于中高分化胰腺癌, 低分化胰腺癌中miR-135b水平升高, 而LZTS1水平呈降低趋势, 提示高表达的miR-135b作为癌基因及低表达的LZTS1作为抑癌基因, 可能协同参与了胰腺癌的侵袭及转移过程. 本研究还发现, miR-135b的表达水平与LZTS1的表达水平呈负相关关系, 与Lin等[3]的研究结果一致, 而LZTS1与β-catenin的表达水平呈正相关关系, 因此我们推测在胰腺癌中过表达的miR-135b可能通过直接负性调控抑癌基因LZTS1的表达, 导致EMT相关分子: E-adherin、β-catenin在胞膜中表达下降, β-catenin在胞浆中异常聚集, 促进EMT的发生并激活Wnt/β-catenin信号通路, 促进胰腺癌的发生发展, 但其具体的作用机制有待于进一步的研究与验证, 从而为胰腺癌疾病的诊断及临床治疗开辟新的思路.
胰腺癌是一种恶性度较高, 预后较差的消化系肿瘤, 其发生发展受多基因多步骤调控. miRNAs作为一种调控分子, 在多种肿瘤的发生发展中起着重要作用. miR-135b通过调控下游靶基因LZTS1的表达, 影响多种恶性肿瘤的生物学行为, 但其在胰腺癌中的研究鲜见报道.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
大量的研究显示miR-135b与多种恶性肿瘤的发展密切相关, 但其对胰腺癌发生发展有何作用及具体机制如何鲜见报道. 在胰腺癌中LZTS1与miR-135b是否为直接调控关系, 以及通过调控LZTS1的表达怎样影响信号通路的转导, 有待学者们更深入的研究与解决, 为以后胰腺癌的治疗提供新的治疗靶点及思路.
目前已有研究证实LZTS1在许多恶性肿瘤中表达减少, 即LZTS1作为miR-135b的靶基因对肿瘤的发生发展密切相关, 但对于其在胰腺癌中的表达及作用研究的甚少.
本文通过锁核原位杂交技术和免疫组织化学方法分别检测了miR-135b、LZTS1及β-catenin蛋白在胰腺癌中的表达, 探讨对胰腺癌发生发展的作用机制, 为胰腺癌的诊断及治疗提供新的方向.
本研究发现miR-135b可能通过下调LZTS1的表达, 间接促进上皮间质转化(epithelial-mesenchymal transition, EMT)并激活Wnt/β-catenin信号通路, 这为大家可通过干预某一环节防治胰腺癌提供可能.
上皮间质转化(EMT): 指上皮细胞在形态学上发生向间(充)质细胞表型的转化并获得迁移的能力, 是正常发育、伤口愈合以及恶性上皮肿瘤发生的基础.
本文研究了miR-135b、LZTS1、β-catenin在胰腺癌中的表达, 并初步探讨了上述3个分子间的表达相关性, 具有一定的创新性和临床潜在应用价值.
编辑: 于明茜 电编: 闫晋利
| 1. | Cho IR, Koh SS, Malilas W, Srisuttee R, Moon J, Choi YW, Horio Y, Oh S, Chung YH. SIRT1 inhibits proliferation of pancreatic cancer cells expressing pancreatic adenocarcinoma up-regulated factor (PAUF), a novel oncogene, by suppression of β-catenin. Biochem Biophys Res Commun. 2012;423:270-275. [PubMed] [DOI] |
| 2. | Wang XX, Zhu Z, Su D, Lei T, Wu X, Fan Y, Li X, Zhao J, Fu L, Dong JT. Down-regulation of leucine zipper putative tumor suppressor 1 is associated with poor prognosis, increased cell motility and invasion, and epithelial-to-mesenchymal transition characteristics in human breast carcinoma. Hum Pathol. 2011;42:1410-1419. [PubMed] [DOI] |
| 3. | Lin CW, Chang YL, Chang YC, Lin JC, Chen CC, Pan SH, Wu CT, Chen HY, Yang SC, Hong TM. MicroRNA-135b promotes lung cancer metastasis by regulating multiple targets in the Hippo pathway and LZTS1. Nat Commun. 2013;4:1877. [PubMed] [DOI] |
| 4. | Nonaka D, Fabbri A, Roz L, Mariani L, Vecchione A, Moore GW, Tavecchio L, Croce CM, Sozzi G. Reduced FEZ1/LZTS1 expression and outcome prediction in lung cancer. Cancer Res. 2005;65:1207-1212. [PubMed] |
| 5. | Vecchione A, Ishii H, Shiao YH, Trapasso F, Rugge M, Tamburrino JF, Murakumo Y, Alder H, Croce CM, Baffa R. Fez1/lzts1 alterations in gastric carcinoma. Clin Cancer Res. 2001;7:1546-1552. [PubMed] |
| 6. | Vecchione A, Ishii H, Baldassarre G, Bassi P, Trapasso F, Alder H, Pagano F, Gomella LG, Croce CM, Baffa R. FEZ1/LZTS1 is down-regulated in high-grade bladder cancer, and its restoration suppresses tumorigenicity in transitional cell carcinoma cells. Am J Pathol. 2002;160:1345-1352. [PubMed] [DOI] |
| 7. | Tysnes BB, Satran HA, Mork SJ, Margaryan NV, Eide GE, Petersen K, Strizzi L, Hendrix MJ. Age-Dependent Association between Protein Expression of the Embryonic Stem Cell Marker Cripto-1 and Survival of Glioblastoma Patients. Transl Oncol. 2013;6:732-741. [PubMed] [DOI] |
| 8. | Lovat F, Ishii H, Schiappacassi M, Fassan M, Barbareschi M, Galligioni E, Gasparini P, Baldassarre G, Croce CM, Vecchione A. LZTS1 downregulation confers paclitaxel resistance and is associated with worse prognosis in breast cancer. Oncotarget. 2014;5:970-977. [PubMed] [DOI] |
| 9. | Wang XX, Liu BB, Wu X, Su D, Zhu Z, Fu L. Loss of Leucine Zipper Putative Tumor Suppressor 1 (LZTS1) Expression Contributes to Lymph Node Metastasis of Breast Invasive Micropapillary Carcinoma. Pathol Oncol Res. 2015;21:1021-1026. [PubMed] [DOI] |
| 10. | Zhou W, He MR, Jiao HL, He LQ, Deng DL, Cai JJ, Xiao ZY, Ye YP, Ding YQ, Liao WT. The tumor-suppressor gene LZTS1 suppresses colorectal cancer proliferation through inhibition of the AKT-mTOR signaling pathway. Cancer Lett. 2015;360:68-75. [PubMed] [DOI] |
| 11. | Guo R, Gu J, Zhang Z, Wang Y, Gu C. MicroRNA-410 functions as a tumor suppressor by targeting angiotensin II type 1 receptor in pancreatic cancer. IUBMB Life. 2015;67:42-53. [PubMed] [DOI] |
| 12. | Yu C, Wang M, Li Z, Xiao J, Peng F, Guo X, Deng Y, Jiang J, Sun C. MicroRNA-138-5p regulates pancreatic cancer cell growth through targeting FOXC1. Cell Oncol (Dordr). 2015;38:173-181. [PubMed] [DOI] |
| 13. | Aakula A, Leivonen SK, Hintsanen P, Aittokallio T, Ceder Y, Børresen-Dale AL, Perälä M, Östling P, Kallioniemi O. MicroRNA-135b regulates ERα, AR and HIF1AN and affects breast and prostate cancer cell growth. Mol Oncol. 2015;9:1287-1300. [PubMed] [DOI] |
| 14. | Pei H, Jin Z, Chen S, Sun X, Yu J, Guo W. MiR-135b promotes proliferation and invasion of osteosarcoma cells via targeting FOXO1. Mol Cell Biochem. 2015;400:245-252. [PubMed] [DOI] |
| 15. | Östling P, Leivonen SK, Aakula A, Kohonen P, Mäkelä R, Hagman Z, Edsjö A, Kangaspeska S, Edgren H, Nicorici D. Systematic analysis of microRNAs targeting the androgen receptor in prostate cancer cells. Cancer Res. 2011;71:1956-1967. [PubMed] [DOI] |
| 16. | He YQ, Sheng JQ, Ling XL, Fu L, Jin P, Yen L, Rao J. Estradiol regulates miR-135b and mismatch repair gene expressions via estrogen receptor-β in colorectal cells. Exp Mol Med. 2012;44:723-732. [PubMed] [DOI] |
| 17. | Wu W, Wang Z, Yang P, Yang J, Liang J, Chen Y, Wang H, Wei G, Ye S, Zhou Y. MicroRNA-135b regulates metastasis suppressor 1 expression and promotes migration and invasion in colorectal cancer. Mol Cell Biochem. 2014;388:249-259. [PubMed] [DOI] |
| 18. | Olasz EB, Seline LN, Schock AM, Duncan NE, Lopez A, Lazar J, Flister MJ, Lu Y, Liu P, Sokumbi O. MicroRNA-135b Regulates Leucine Zipper Tumor Suppressor 1 in Cutaneous Squamous Cell Carcinoma. PLoS One. 2015;10:e0125412. [PubMed] [DOI] |
| 19. | Zhang Y, Wang Y, Guo Y, Liao Z, Xu R, Ruan Z. [miR-135b promotes the invasion and metastasis of hepatocellular carcinoma cells]. Xibao Yu Fenzi Mianyixue Zazhi. 2015;31:1316-1321. [PubMed] |
| 20. | Munding JB, Adai AT, Maghnouj A, Urbanik A, Zöllner H, Liffers ST, Chromik AM, Uhl W, Szafranska-Schwarzbach AE, Tannapfel A. Global microRNA expression profiling of microdissected tissues identifies miR-135b as a novel biomarker for pancreatic ductal adenocarcinoma. Int J Cancer. 2012;131:E86-E95. [PubMed] [DOI] |
| 21. | Brand RE, Adai AT, Centeno BA, Lee LS, Rateb G, Vignesh S, Menard C, Wiechowska-Kozłowska A, Bołdys H, Hartleb M. A microRNA-based test improves endoscopic ultrasound-guided cytologic diagnosis of pancreatic cancer. Clin Gastroenterol Hepatol. 2014;12:1717-1723. [PubMed] [DOI] |
| 22. | 范 瑞琦, 王 晟, 揭 克敏, 熊 小亮, 肖 影群, 贺 晓菊, 刘 卓琦, 罗 达亚. 原位杂交检测microRNA205在乳腺癌中的表达. 中国组织化学与细胞化学杂志. 2014;23:16-19. |
| 24. | Zhang L, Huang J, Yang N, Greshock J, Megraw MS, Giannakakis A, Liang S, Naylor TL, Barchetti A, Ward MR. microRNAs exhibit high frequency genomic alterations in human cancer. Proc Natl Acad Sci USA. 2006;103:9136-9141. [PubMed] |
| 25. | Ishii H, Baffa R, Numata SI, Murakumo Y, Rattan S, Inoue H, Mori M, Fidanza V, Alder H, Croce CM. The FEZ1 gene at chromosome 8p22 encodes a leucine-zipper protein, and its expression is altered in multiple human tumors. Proc Natl Acad Sci USA. 1999;96:3928-3933. [PubMed] [DOI] |
| 26. | Vecchione A, Baldassarre G, Ishii H, Nicoloso MS, Belletti B, Petrocca F, Zanesi N, Fong LY, Battista S, Guarnieri D. Fez1/Lzts1 absence impairs Cdk1/Cdc25C interaction during mitosis and predisposes mice to cancer development. Cancer Cell. 2007;11:275-289. [PubMed] |
| 27. | Vecchione A, Croce CM, Baldassarre G. Fez1/Lzts1 a new mitotic regulator implicated in cancer development. Cell Div. 2007;2:24. [PubMed] [DOI] |
| 28. | Guo Q, Qin W. DKK3 blocked translocation of β-catenin/EMT induced by hypoxia and improved gemcitabine therapeutic effect in pancreatic cancer Bxpc-3 cell. J Cell Mol Med. 2015;19:2832-2841. [PubMed] [DOI] |
| 29. | Cao C, Sun L, Mo W, Sun L, Luo J, Yang Z, Ran Y. Quercetin Mediates β-Catenin in Pancreatic Cancer Stem-Like Cells. Pancreas. 2015;44:1334-1339. [PubMed] [DOI] |
| 30. | Ji M, Fan D, Yuan L, Zhang Y, Dong W, Peng X. EBP50 inhibits pancreatic cancer cell growth and invasion by targeting the β-catenin/E-cadherin pathway. Exp Ther Med. 2015;10:1311-1316. [PubMed] |