修回日期: 2015-12-19
接受日期: 2015-12-29
在线出版日期: 2016-02-08
目的: 研究胃癌中鼠双微体2(murine double mimute 2, MDM2)与核糖体蛋白L23(ribosomal protein L23, RPL23)的表达及其临床相关性, 初步探讨他们在胃癌发生发展中的生物学意义.
方法: 采用免疫组织化学染色方法检测90例胃癌组织和30例胃癌旁正常组织中MDM2和RPL23蛋白的表达; 统计学分析他们表达的相关性及其与临床病理因素、患者生存时间的联系.
结果: 胃癌组织中MDM2表达阳性率与癌旁对照组比较显著性增高(62.2% vs 40.0%, P<0.05), 而RPL23蛋白表达显著性降低(30.0% vs 63.3%, P<0.05). MDM2和RPL23在胃癌中的表达呈负相关(r = -0.23, P = 0.029). 多因素分析显示MDM2高表达和RPL23低表达、淋巴结转移、肿瘤入侵深度、肿瘤的大小对胃癌患者生存预后的影响有统计学意义.
结论: MDM2、RPL23的表达与胃癌的发生发展具有一定的相关性, 针对两者的信号通路或许可作为胃癌预后的标志和新型治疗靶标.
核心提示: 本文对胃癌组织中鼠双微体2(murine double mimute 2)蛋白、核糖体蛋白L23(ribosomal protein L23, RPL23)的表达与临床病理因素、生存时间进行了分析, 结果提示胃癌组织中MDM2表达阳性率显著增高, 而RPL23表达显著下降, 两者呈负相关. 同时多因素分析显示MDM2高表达和RPL23低表达、淋巴结转移、肿瘤入侵深度、肿瘤的大小对生存预后有影响.
引文著录: 蒋雨薇, 张志敏, 冯俊明, 张鹏, 杨波, 赵勇, 王伟星, 章必成, 饶智国. 鼠双微体2与核糖体蛋白L23在胃癌组织中的表达及临床意义. 世界华人消化杂志 2016; 24(4): 513-520
Revised: December 19, 2015
Accepted: December 29, 2015
Published online: February 8, 2016
AIM: To detect the expression of murine double minute 2 (MDM2) and ribosomal protein L23 (RPL23) in gastric cancer and explore their biological significance in the development of gastric cancer.
METHODS: The expression of MDM2 and RPL23 was detected by immunohistochemistry in 90 human gastric carcinoma specimens and 30 normal gastric tissue specimens. The correlation of MDM2 and RPL23 expression with the clinicopathologic features of gastric carcinoma was analyzed statistically.
RESULTS: The positive expression rate of MDM2 in gastric cancer tissues was significantly higher than that in the control group (62.2% vs 40%, P < 0.05), while the positive rate of RPL23 expression was significantly lower in gastric cancer tissues (30% vs 63.3%, P < 0.05). The expression of MDM2 and RPL23 in gastric cancer was negatively correlated (r = -0.23, P = 0.029). Multivariate analysis showed that overexpression of MDM2, low expression of RPL23, lymph node metastasis, depth of invasion and tumor size were significant prognostic factors.
CONCLUSION: MDM2 and RPL23 expression may be associated with the development of gastric cancer, and they may be used as prognostic markers and new therapeutic targets in gastric cancer.
- Citation: Jiang YW, Zhang ZM, Feng JM, Zhang P, Yang B, Zhao Y, Wang WX, Zhang BC, Rao ZG. Clinical significance of expression of murine double minute 2 and ribosomal protein L23 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(4): 513-520
- URL: https://www.wjgnet.com/1009-3079/full/v24/i4/513.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i4.513
胃癌是世界上最常见的恶性肿瘤之一, 全球每年新增近100万例胃癌患者, 其中70%以上发生在发展中国家, 而全球一半以上集中在东亚国家, 特别是在中国[1]. 胃癌病死率位居全球肿瘤死亡率的第2位, 在中国则位居消化道恶性肿瘤死亡率的首位[2]. 胃癌治疗临床上多采用联合治疗为主, 但以手术治疗为首选. 虽然Her2染色和分子靶向治疗在胃癌领域已经显示出了明显的生存优势, 但临床结果仍令人沮丧. 因此, 明确胃癌发生过程中相关信号传导通路, 确定早期胃癌筛查分子靶标十分迫切[3].
鼠双微体2(murine double mimute 2, MDM2)蛋白在人类四十多种不同类型、不同组织起源的恶性肿瘤中过度表达, 包括实体瘤、肉瘤和白血病等[4], 被认为是抑制P53反式激活的癌蛋白. MDM2的表达与细胞周期的进展和凋亡相关, 参与了肿瘤的生物学作用[5,6]. 核糖体蛋白L23(ribosomal protein L23, RPL23)是核糖体蛋白60S亚基的组成部分, 也参与了肿瘤的发生发展. 研究表明RPL23与MDM2相互作用可以直接影响P53的表达水平, 从而参与肿瘤进展期调控. 本文旨在研究MDM2、RPL23两者在胃癌组织与癌旁正常组织中表达的差异性及相关性, 分析MDM2、RPL23与胃癌患者临床病理特征、生存时间的关系. 并讨论90例胃癌患者的临床病理特征对胃癌预后的影响.
收集2010-01/2013-12于广州军区武汉总医院行胃癌根治性手术切除并存档的胃癌石蜡组织切块90例, 临床资料完整, 所有病例均未行术前放化疗, 术后均经病理证实. 90例胃癌患者中年龄27-85岁, 其中年龄≥60岁42例, <60岁48例. 患者男性57例, 女性33例. 按2002年美国联合癌症分类委员会(American Joint Committeeon Cancer, AJCC)和国际抗癌联盟(Union for International Cancer Control, UICC)制定的标准进行TNM分期. 另外, 癌旁正常组织标本30例取自胃癌手术切除标本距肿瘤边缘5 cm以上的切缘. 所有患者均签署知情同意书, 且本研究经过伦理委员会同意.
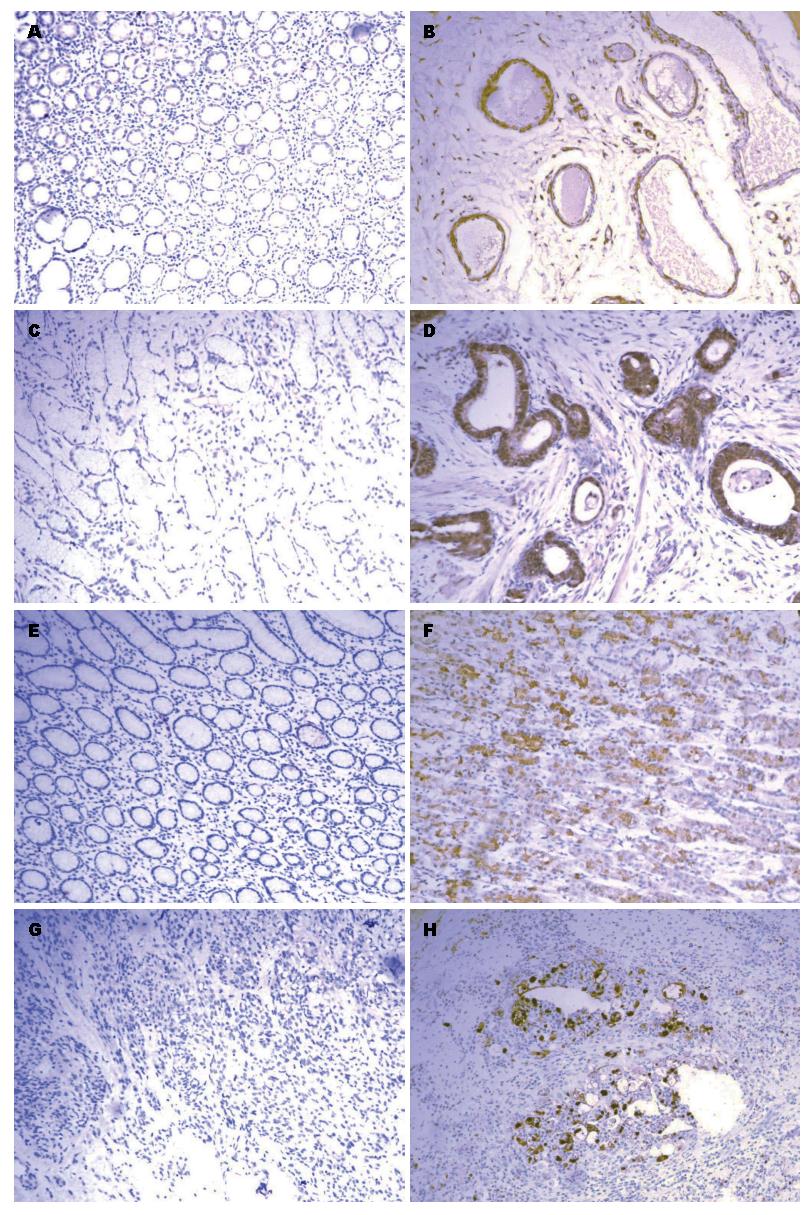
1.2.1 免疫组织化学过程: 根据患者病理号找出存档胃癌组织石蜡切块, 制备3 µm厚片连续切片. 鼠抗人MDM2单克隆抗体购自北京中杉金桥生物技术有限公司; 羊抗人RPL23单克隆抗体购自Santa公司; 免疫组织化学试剂盒购自福建迈新试剂有限公司. 采用免疫组织化学染色化学链霉素抗生物素-过氧化物酶(streptavidin-perosidase)连结法染色: 石蜡组织切片后脱蜡、水化, 用蒸馏水冲洗5次. 每张切片上加50 µL 3%H2O2, 室温下孵育10 min, 以阻断内源性过氧化物酶. 蒸馏水冲洗5次. 用EDTA进行抗原修复20 min, 冷却至室温, 用蒸馏水冲洗甩干. 滴加第一抗体, 4 ℃过夜. PBS缓冲液冲洗5次, 滴加生物素标记的二抗, 室温孵育25 min, PBS冲洗5次, 经DAB显色5-10 min, 在显微镜下掌握染色程度. 苏木紫复染, 盐酸酒精分化, 自来水冲洗后, 用中性树胶封片, 镜检.
1.2.2 结果判定: 结果由2位高年资病理医师在不知任何临床资料的情况下对染色结果进行评估. MDM2与RPL23主要定位于细胞质和细胞核, 以细胞质或细胞核出现棕黄色颗粒为阳性反应, 经苏木素复染显色后, 阴性细胞与阳性细胞进行对比显示可发现, 阴性细胞呈蓝紫色. 每张切片在显微镜下, 随机取5个视野, 根据每个视野中阳性细胞数百分数比和染色强弱进行评分. 阳性细胞数: 阳性细胞数: <5%, 记0分; 5%-25%, 记1分; 介于26%与50%之间, 记2分; 介于51%与75%之间, 记3分; >75%, 记4分. 染色深浅分为: 无染色记为0分; 弱, 1分; 中等, 2分; 强, 3分. 细胞数与染色程度得分相乘为总分, ≥2分记为阳性. 取5次的平均值为最终判定结果[7,8].
1.2.3 随访: 采用门诊随访和电话随访. 随访截止日期为2015-08-31. 总生存期(overall survival, OS)定义为从胃癌术后开始到死亡的时间. 以月(mo)为单位.
统计学处理 本实验数据采用SPSS19.0软件包进行统计学分析. MDM2与RPL23的表达和各临床因素之间的关系采用χ2检验及Fisher精确检验分析. Spearman等级相关分析MDM2和RPL23间的相关性. OS使用Kaplan-Meier法进行生存分析的. 差异生存曲线之间由Log-rank检验进行检验. Cox比例风险回归模型来确定临床病理因素对生存期的作用. 以P<0.05差异具有统计学意义.
MDM2在胃癌组织中阳性率为62.2%(56/90), 癌旁对照组阳性率为40%(12/30); RPL23在胃癌细胞中阳性率为30%(27/90), 癌旁对照组检出率为63.3%(19/30)(表1, 图1). 胃癌组织中MDM2明显高于癌旁正常组织(χ2 = 4.525, P = 0.033), RPL23表达显著低于对照组(χ2 = 10.576, P = 0.001). MDM2及RPL23的表达与年龄(χ2 = 0.143, P = 0.706; χ2 = 2.457, P = 0.117)、性别(χ2 = 0.157, P = 0.692; χ2 = 0.823, P = 0.364)、肿瘤的大小(χ2 = 0.08, P = 0.777; χ2 = 0.035, P = 0.852)、肿瘤发生的部位(χ2 = 0.195, P = 0.907; χ2 = 1.772, P = 0.412)、肿瘤浸润深度(χ2 = 0.074, P = 0.786; χ2 = 1.534, P = 0.215)无关. MDM2及RPL23的染色与淋巴结的转移(χ2 = 6.173, P = 0.013; χ2 = 4.589, P = 0.032)及生存时间(χ2 = 5.424, P = 0.02; χ2 = 4.508, P = 0.034)具有显著的相关性(表2).
| 临床病理因素 | n | MDM2 | RPL23 | ||||
| 阳性 | 阴性 | P值 | 阳性 | 阴性 | P值 | ||
| 年龄(岁) | 0.706 | 0.117 | |||||
| ≥60 | 42 | 27(64.3) | 15(35.7) | 16(38.1) | 26(61.9) | ||
| <60 | 48 | 29(60.4) | 19(39.6) | 11(22.9) | 37(77.1) | ||
| 性别 | 0.692 | 0.364 | |||||
| 男 | 57 | 35(61.4) | 22(38.6) | 19(33.3) | 38(66.7) | ||
| 女 | 33 | 21(63.6) | 12(36.4) | 8(24.2) | 25(75.8) | ||
| 肿瘤大小(cm) | 0.777 | 0.852 | |||||
| ≥5 | 52 | 33(63.5) | 19(36.5) | 16(30.8) | 36(69.2) | ||
| <5 | 38 | 23(60.5) | 15(39.5) | 11(28.9) | 27(71.1) | ||
| 肿瘤位置 | 0.907 | 0.412 | |||||
| 贲门 | 6 | 4(66.7) | 2(33.3) | 3(50) | 3(50) | ||
| 胃体 | 52 | 33(63.5) | 19(36.5) | 15(28.8) | 37(71.2) | ||
| 胃窦 | 32 | 19(59.4) | 13(40.6) | 9(28.1) | 23(71.9) | ||
| 肿瘤浸润深度 | 0.786 | 0.215 | |||||
| T1+T2 | 28 | 18(64.3) | 10(35.7) | 6(21.4) | 22(78.6) | ||
| T3+T4 | 62 | 38(61.3) | 24(38.7) | 21(33.9) | 41(66.1) | ||
| 淋巴结转移 | 0.013 | 0.032 | |||||
| 有 | 52 | 38(73.1) | 14(26.9) | 11(21.2) | 41(78.8) | ||
| 无 | 38 | 18(47.4) | 20(52.6) | 16(42.1) | 22(57.9) | ||
| 5年生存期 | 0.020 | 0.034 | |||||
| 存活 | 55 | 29(52.7) | 26(47.2) | 21(38.2) | 34(61.8) | ||
| 死亡 | 35 | 27(77.1) | 8(22.9) | 6(17.1) | 29(82.9) | ||
MDM2与RPL23的表达结果显示两者共同阳性有15例(16.7%), 共同阴性有22例(24.4%), 两者呈相反表达有53例(58.9%). Spearman等级相关分析表明MDM2和RPL23在胃癌中的表达呈负相关(r = -0.23, P = 0.029)(表3).
| MDM2 | RPL23 | 合计 | r值 | P值 | |
| 阳性 | 阴性 | ||||
| 阳性 | 15 | 41 | 56 | -0.23 | 0.029 |
| 阴性 | 12 | 22 | 34 | ||
| 总数 | 27 | 63 | |||
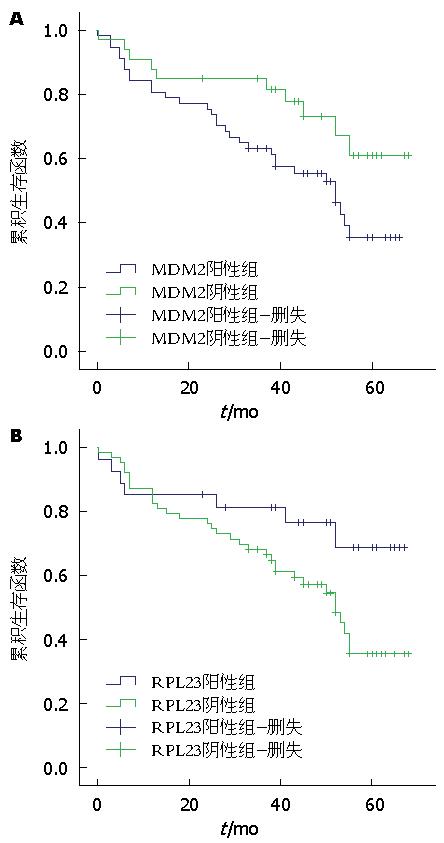
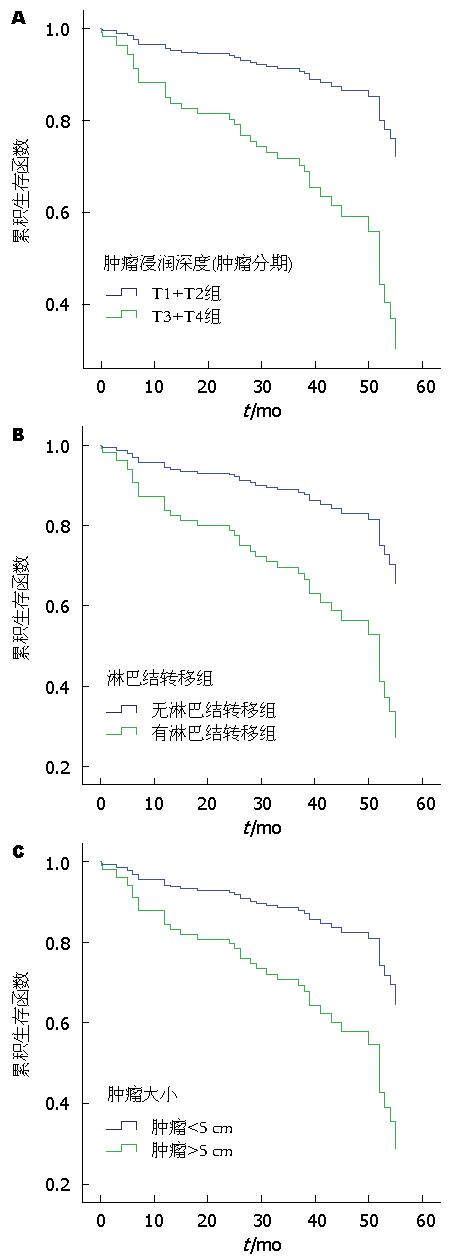
采用Kaplan-Meier分析表明, MDM2和RPL23的表达与胃癌患者总生存期相关(图2). MDM2阳性表达、RPL23阴性表达的胃癌患者总生存期较短. Cox比例风险回归分析结果表明淋巴结的转移(P = 0.005)、肿瘤浸润深度(P = 0.017)、肿瘤大小(P = 0.006)对胃癌预后不良(表4, 图3). 上述数据分析显示MDM2高表达和RPL23低表达、淋巴结转移、肿瘤入侵深度、肿瘤的大小对生存预后的影响有统计学意义.
| 项目 | Wald | P值 |
| 年龄 | 1.429 | 0.232 |
| 性别 | 0.095 | 0.758 |
| 肿瘤的部位 | 1.216 | 0.544 |
| 肿瘤的大小 | 7.638 | 0.006 |
| 肿瘤浸润深度 | 5.696 | 0.017 |
| 淋巴结转移 | 7.840 | 0.005 |
1987年Cahilly-Snyder等[9]首次克隆出MDM2基因, 其是从一个含有双微体的自发转化的BALB/3T3DM细胞中克隆出来的一个高度扩增的基因. 他可普遍表达细胞中, 但在不同功能和条件中表达强度不同[10]. MDM2是维持细胞基本功能的必需物质, 有研究证明MDM2基因敲除的小鼠在胚胎期间或者出生不久即死亡[11]. 但小鼠同时缺失MDM2和P53, 这就表明MDM2具有调节P53水平和功能的作用. 大约50%的癌症患者野生型p53基因是失活的, 而余下的50%患者p53基因发生突变[12]. MDM2或MDMX(MDM2同源性)过表达可诱发p53基因异常通路, 直接导致肿瘤的发生发展[13]. MDM2是第一个确定降解P53的RING结构域的E3连接酶[14]. 如MDM2、Pirh2(RING-H2域中P53诱导蛋白)、COP1(组成型光形态建成蛋白1)、E6AP(E6相关蛋白), 均可通过E3泛素链接酶间接影响P53的活性[15,16]. 其中, MDM2对P53的泛素化和稳定性起着最显著的作用[13]. 他通过蛋白酶介导的通路调自身和P53在细胞中的水平[17]. MDM2编码的蛋白是P53通路的关键调节因子, 可以与抑癌基因蛋白P53结合并抑制P53的功能. MDM2基因中包含P53的结合位点, 两者N端结合, MDM2一方面阻止P53调控靶基因, 直接在转录激活域阻止其转录增殖, 另一方面, 启动P53泛素化促进P53的降解; 同时, P53又可激活MDM2, 两者形成自动调节反馈回路[18]. MDM2与P53之间的相互关系早已在MDM2和/或p53基因敲除的试验中得到证实[19]. Rayburn等[4]总结了MDM2在不同类型肿瘤中过度表达的阳性率, 总体表现为约7%的基因扩增. 可能是由于基因扩增、转录增加或是转换增强. 目前已发现MDM2参与了细胞的生长、存活、入侵等多个过程[20]. Fakharzadeh等[21]分析致瘤性小鼠细胞系中DNA扩增序列, 结果显示MDM2放大了50倍. 该数据支持了MDM2的致瘤性和在控制细胞生长中的作用. 且目前多种证据支持MDM2参与了多条P53通路的活动, 并将MDM2作为肿瘤预后的标志和一种新型的药物靶标[20].
核糖体蛋白(ribosomal protein)是一种常见的RNA结合蛋白, 在核糖体功能表达中起着多种辅助作用, 目前发现其参与了肿瘤的发生发展[22]. RPL23是核糖体蛋白60S亚基的组成部分, 可与MDM2相互作用. RPL23与MDM2结合, 可抑制后者E3连接酶的功能, 抑制MDM2介导的P53泛素化, 从而稳定和激活P53的表达水平, 这就揭示了RPL23与MDM2的相互作用与细胞协调的生长和增殖有一定的联系[23]. Dai等[24]用免疫学方法纯化MDM2, 通过质谱分析发现RPL23是MDM2的一个新的调节器, 两者相互作用形成复杂独立的多聚核糖体, 结果导致P53的活化. 异位表达的RPL23已被证明能够与MDM2在细胞质和细胞核中相互作用, 这就表明RPL23可以通过多种通路间接抑制MDM2-p53结合[23]. 有体外试验发现腺病毒介导的RPL23基因可以稳定野生型p53的降解, 引起G1-S细胞周期停滞, 并抑制携带野生型p53基因的人胃癌MKN45和AGS细胞的细胞凋亡, 同时也抑制MKN45小鼠模型皮下肿瘤的增长[25]. Zhang等[26]比较同时表达RPL23和p53基因双载体与P53单基因载体对人胃癌细胞的抑制作用, 前者表现出更强的抗肿瘤作用, 且在胃癌小鼠模型中前者治疗后的生存获益更大; 同时体内外试验发现RPL23通过对P53-MDM2反馈环的影响可抑制胃癌在体内外的增殖. 通过影响MDM2与RPL23两者的作用关系可以抑制肿瘤的生长.
本研究检测到MDM2在胃癌组织中的表达水平明显高于癌旁正常组织, 而RPL23在胃癌组织中的表达水平明显低于癌旁正常组织, 两者与肿瘤有无淋巴结转移和总生存期密切相关, 与年龄、性别、肿瘤的大小、肿瘤发生的部位无关. 表明MDM2在肿瘤中高表达, RPL23的表达是下调的. 两者在肿瘤的转移、预后中均起重要作用, 结果与文献报道的相关研究结论是一致的. 如在多种肿瘤中已发现MDM2的突变和扩增, 促进肿瘤的发生[27]. Oliner等[28]报道了MDM2基因在骨和软组织肉瘤中呈扩增表达, 扩增的MDM2与P53结合影响P53的功能. Horie等[29]研究发现MDM2的过表达与肝内胆管细胞癌的转移和肿瘤分期相关(P<0.05), 或许通过抑制p53基因的功能导致肿瘤的入侵. 另外, 有报道[30]提示MDM2在50%以上的乳腺癌患者中过表达, 并且阳性患者生存期较短. RPL23通过结合MDM2降低后者的表达, 故推测RPL23的低表达会导致MDM2的高表达, 两者有着负相关的关系. 在肿瘤细胞中表现应更为明显. 我们的研究显示RPL23与MDM2的表达呈负相关, 说明在胃癌组织中两者的表达与推测是一致的. 结果显示r = -0.23弱相关, 提示两者间可能还存在其他因素的参与. 另外, 我们通过Kaplan-Meier分析了MDM2与RPL23在胃癌中的表达, 结果提示MDM2阳性与胃癌恶性程度紧密相关, 而RPL23阳性对胃癌总生存期是有益的. 此外, Cox比例风险回归分析显示淋巴结转移、肿瘤浸润深度、肿瘤大小对胃癌总生存期预后不良.
总之, MDM2、RPL23与胃癌的发生、发展密切相关, 两者均显示出了与生存期的关联性. MDM2是影响胃癌患者术后生存期的不良因素, 而RPL23的高表达对患者生存有益. 两者联合应用可作为胃癌早期诊断、治疗及预后的参考新靶点.
p53基因是一种抑癌基因, 在人类50%以上的肿瘤组织中均发现了p53基因的突变或失活. 鼠双微体2(murine double mimute 2, MDM2)影响P53泛素化, 其过表达可诱发P53通路的功能异常, 直接导致肿瘤的发生发展. 两者形成自动反馈回路. 核糖体蛋白L23(ribosomal protein L23, RPL23)也参与了肿瘤的发生发展, 可与MDM2结合. RPL23、MDM2两者相互作用及关系逐步受到临床的重视.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
MDM2与P53两者形成自动反馈回路的关系已经证实, 然而MDM2与RPL23两者在胃癌组织中表达是否具有相关性尚未明确. 如何预警胃癌早期筛查是待解决的问题.
Oliner等报道了MDM2基因在骨和软组织肉瘤中呈扩增表达, 扩增的MDM2与P53结合影响P53的功能. Zhang等比较同时表达RPL23和p53基因双载体与p53单基因载体对人胃癌细胞的抑制作用, 前者表现出更强的抗肿瘤作用, 且在胃癌小鼠模型中前者治疗后的生存获益更大.
本文通过免疫组织化学检测了胃癌组织及癌旁组织中MDM2和RPL23蛋白的表达, 从染色程度及细胞数评估两者阳性率, 并分析两者的表达与临床病理因素、患者生存时间的联系.
本研究提示MDM2、RPL23两者的表达、淋巴结转移、肿瘤入侵深度、肿瘤的大小与患者生存预后相关, 可指导临床对胃癌患者生存预后评价.
泛素连接酶E3: 泛素蛋白酶体途径是蛋白质降解的重要途径. 泛素连接酶E3通过调节蛋白的泛素化参与细胞的生理活动. RING结构域家族属于泛素连接酶E3的范畴.
本文对胃癌中MDM2与RPL23蛋白的表达与其临床病理因素、患者生存时间的联系进行了探讨, 提示MDM2、RPL23的表达与胃癌的发生发展可能具有一定的相关性, 或许可作为胃癌预后的标志和新型治疗靶标. 内容客观, 实验方法成熟, 观点新颖, 具有一定的科学意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 3. | Lv H, Liu R, Fu J, Yang Q, Shi J, Chen P, Ji M, Shi B, Hou P. Epithelial cell-derived periostin functions as a tumor suppressor in gastric cancer through stabilizing p53 and E-cadherin proteins via the Rb/E2F1/p14ARF/Mdm2 signaling pathway. Cell Cycle. 2014;13:2962-2974. [PubMed] [DOI] |
| 4. | Rayburn E, Zhang R, He J, Wang H. MDM2 and human malignancies: expression, clinical pathology, prognostic markers, and implications for chemotherapy. Curr Cancer Drug Targets. 2005;5:27-41. [PubMed] [DOI] |
| 5. | Momand J, Zambetti GP, Olson DC, George D, Levine AJ. The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation. Cell. 1992;69:1237-1245. [PubMed] [DOI] |
| 6. | Kubbutat MH, Jones SN, Vousden KH. Regulation of p53 stability by Mdm2. Nature. 1997;387:299-303. [PubMed] [DOI] |
| 7. | 张 亚飞, 张 安然, 章 必成, 吴 婷婷, 时 永全, 赵 勇, 刘 健, 杨 波, 饶 智国, 高 建飞. p53和MDM2在胃腺癌组织中的表达及意义. 医学研究杂志. 2013;42:23-25. |
| 8. | Gustafsson B, Stål O, Gustafsson B. Overexpression of MDM2 in acute childhood lymphoblastic leukemia. Pediatr Hematol Oncol. 1998;15:519-526. [PubMed] [DOI] |
| 9. | Cahilly-Snyder L, Yang-Feng T, Francke U, George DL. Molecular analysis and chromosomal mapping of amplified genes isolated from a transformed mouse 3T3 cell line. Somat Cell Mol Genet. 1987;13:235-244. [PubMed] [DOI] |
| 10. | de Oca Luna RM, Tabor AD, Eberspaecher H, Hulboy DL, Worth LL, Colman MS, Finlay CA, Lozano G. The organization and expression of the mdm2 gene. Genomics. 1996;33:352-357. [PubMed] [DOI] |
| 11. | Léveillard T, Gorry P, Niederreither K, Wasylyk B. MDM2 expression during mouse embryogenesis and the requirement of p53. Mech Dev. 1998;74:189-193. [PubMed] [DOI] |
| 12. | Wade M, Wang YV, Wahl GM. The p53 orchestra: Mdm2 and Mdmx set the tone. Trends Cell Biol. 2010;20:299-309. [PubMed] [DOI] |
| 13. | Wei J, Yang Y, Lu M, Xu L, Liu F, Yuan Z, Bao Q, Jiang Z, Xu X, Guo X. Escape, or Vanish: Control the Fate of p53 through MDM2-Mediated Ubiquitination. Anticancer Agents Med Chem. 2015;16:174-189. [PubMed] [DOI] |
| 14. | Coutts AS, Adams CJ, La Thangue NB. p53 ubiquitination by Mdm2: a never ending tail? DNA Repair (Amst). 2009;8:483-490. [PubMed] [DOI] |
| 16. | Love IM, Grossman SR. It Takes 15 to Tango: Making Sense of the Many Ubiquitin Ligases of p53. Genes Cancer. 2012;3:249-263. [PubMed] [DOI] |
| 17. | Fang S, Jensen JP, Ludwig RL, Vousden KH, Weissman AM. Mdm2 is a RING finger-dependent ubiquitin protein ligase for itself and p53. J Biol Chem. 2000;275:8945-8951. [PubMed] [DOI] |
| 18. | Haupt Y, Maya R, Kazaz A, Oren M. Mdm2 promotes the rapid degradation of p53. Nature. 1997;387:296-299. [PubMed] [DOI] |
| 19. | Montes de Oca Luna R, Wagner DS, Lozano G. Rescue of early embryonic lethality in mdm2-deficient mice by deletion of p53. Nature. 1995;378:203-206. [PubMed] [DOI] |
| 20. | Zhang H. MDM2 oncogene as a novel target for human cancer therapy. Curr Pharm Des. 2000;6:393-416. [PubMed] [DOI] |
| 21. | Fakharzadeh SS, Trusko SP, George DL. Tumorigenic potential associated with enhanced expression of a gene that is amplified in a mouse tumor cell line. EMBO J. 1991;10:1565-1569. [PubMed] |
| 22. | Warner JR, McIntosh KB. How common are extraribosomal functions of ribosomal proteins? Mol Cell. 2009;34:3-11. [PubMed] [DOI] |
| 23. | Jin A, Itahana K, O'Keefe K, Zhang Y. Inhibition of HDM2 and activation of p53 by ribosomal protein L23. Mol Cell Biol. 2004;24:7669-7680. [PubMed] [DOI] |
| 24. | Dai MS, Zeng SX, Jin Y, Sun XX, David L, Lu H. Ribosomal protein L23 activates p53 by inhibiting MDM2 function in response to ribosomal perturbation but not to translation inhibition. Mol Cell Biol. 2004;24:7654-7668. [PubMed] |
| 25. | Zhang Y, Shi Y, Li X, Du W, Luo G, Gou Y, Wang X, Guo X, Liu J, Ding J. Inhibition of the p53-MDM2 interaction by adenovirus delivery of ribosomal protein L23 stabilizes p53 and induces cell cycle arrest and apoptosis in gastric cancer. J Gene Med. 2010;12:147-156. [PubMed] [DOI] |
| 26. | Zhang YF, Zhang BC, Zhang AR, Wu TT, Liu J, Yu LF, Wang WX, Gao JF, Fang DC, Rao ZG. Co-transduction of ribosomal protein L23 enhances the therapeutic efficacy of adenoviral-mediated p53 gene transfer in human gastric cancer. Oncol Rep. 2013;30:1989-1995. [PubMed] [DOI] |
| 27. | Bond GL, Hu W, Levine AJ. MDM2 is a central node in the p53 pathway: 12 years and counting. Curr Cancer Drug Targets. 2005;5:3-8. [PubMed] [DOI] |
| 28. | Oliner JD, Kinzler KW, Meltzer PS, George DL, Vogelstein B. Amplification of a gene encoding a p53-associated protein in human sarcomas. Nature. 1992;358:80-83. [PubMed] |
| 29. | Horie S, Endo K, Kawasaki H, Terada T. Overexpression of MDM2 protein in intrahepatic cholangiocarcinoma: relationship with p53 overexpression, Ki-67 labeling, and clinicopathological features. Virchows Arch. 2000;437:25-30. [PubMed] [DOI] |