修回日期: 2015-12-18
接受日期: 2015-12-29
在线出版日期: 2016-02-08
KLFs家族是一类具有锌指结构的转录因子, 参与多个生理活动的调控, 在细胞增殖、凋亡、分化以及胚胎发育等过程中扮演了关键的角色, 与真核基因转录调控密切相关. Kruppel样因子4(Kruppel like factor 4, KLF4)作为KLFs家族中重要的一员, KLF4在原发性肝癌组织中呈现高表达, 但是KLF4在原发性肝细胞癌的作用机制仍需要进一步的探讨, 本文就KLF4在原发性肝细胞癌中的生物学功能进行综述.
核心提示: Kruppel样因子4(Kruppel like factor 4, KLF4)参与了多种机制的调控, 根据靶基因的不同可以激活靶基因的表达或者抑制靶基因的表达. KLF4与原发性肝细胞癌的关系研究可能为原发性肝细胞癌的靶向治疗带来新的思路.
引文著录: 冯潜, 邬林泉. KLF4与原发性肝细胞癌关系的研究进展. 世界华人消化杂志 2016; 24(4): 497-504
Revised: December 18, 2015
Accepted: December 29, 2015
Published online: February 8, 2016
Kruppel-like factors (KLFs) are a family of transcription factors with zinc finger structure, which play a key role in cell proliferation, apoptosis, differentiation and embryonic development. KLF4 is an important member of the KLF family, and it is highly expressed in primary hepatocellular carcinoma tissues. However, the mechanism of KLF4 in primary hepatocellular carcinoma remains to be explored. This paper reviews the biological function of KLF4 in primary hepatocellular carcinoma.
- Citation: Feng Q, Wu LQ. Relationship between KLF4 and primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(4): 497-504
- URL: https://www.wjgnet.com/1009-3079/full/v24/i4/497.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i4.497
原发性肝细胞肝癌(primary hepatocellular carcinoma, PHC)严重影响了到人类生命安全, 癌症死亡率排名第3, 每年新发病例约有100万[1], 预后效果差, 生存率低, 死亡率高. 随着对肝癌认识的不断深化, 早期诊断方法和治疗方法的完善, 在一定程度延长患者生存时间, 但总体效果仍然是很有限的. 目前对于原发性肝癌的治疗仍然是手术切除为首要手段, 但是预后不好. 因此, 进一步研究原发性肝细胞癌的分子学机制十分重要. 研究[2]发现, KLFs家族在肿瘤的发生发展过程中起着重要的作用, 是一种普遍参与多个生理活动的调控的锌指蛋白, 可以通过调控细胞增殖基因的表达来抑制细胞周期进程. Kruppel样因子4(Kruppel like factor 4, KLF4)是KLFs家族中重要的一员, KLF4在多种肿瘤中呈低表达, 低表达KLF4的肿瘤患者的5年生存率较低, 增加KLF4的表达可以抑制肿瘤细胞增殖和肿瘤细胞的侵袭转移能力, 但其在肿瘤细胞生物学中的具体调控机制仍不明确. 本文就KLF4的结构、对肿瘤细胞的生物学功能, 及其对原发性肝细胞癌的发生发展过程的影响进行综述.
KLFs的典型结构特点是在羟基端具有3个串联的Cys2His2锌指结构, 与Sp1样蛋白相似, 第一个、第二个锌指结构包含25个氨基酸, 第三个包含23个氨基酸[3]. 因此, Sp1与KLFs这两类转录因子被统称为Sp/Kruppel样转录因子家族. Sp1主要通过三个C2H2型锌指与DNA序列中富含GC的区域结合. 因此大部分的KLFs同样能通过三个C2H2型锌指结合CACCC盒和GC盒等DNA序列, 而锌指中的三个关键残基则决定了DNA结合的特异性. Sp/KLF转录因子根据序列和结构相似性可分为3个亚家族, 亚家族Ⅰ包括与Sp1最相似的9个成员分别被命名为Sp1-Sp9. 亚家族Ⅱ包括KLF1-KLF8和KLF12, 亚家族Ⅲ包括KLF9-KLF11、KLF13、KLF15和KLF16[4].
KLFs功能各异, 参与了多种机制的调控, 根据靶基因的不同可以激活靶基因的表达或者抑制靶基因的表达. 结合的启动子或与之相互作用的辅助调节因子不同也可导致同一个KLF转录因子发生不同的调控作用. 根据KLF蛋白的功能特性, 可以分为3个不同的组, 第1组包括KLF3、KLF8和KLF12, 作为转录抑制因子与C-末端结合蛋白(C-terminal binding protein 1, CTBP)相互作用; 第2组包括KLF1、KLF2、KLF4、KLF5、KLF6和KLF7, 功能主要是作为转录激活因子; 第3组包括KLF9、KLF10、KLF11、KLF13、KLF14和KLF16, 主要通过与转录抑制因子Sin3A相互作用抑制活性. 在人体中, KLFs与人体多种系统有关, 包括呼吸、消化、血液、免疫、心血管等系统. KLFs也参与肿瘤的生物活动, 在重编程体细胞诱导多能干细胞细胞, 并保持多能胚胎干细胞的状态[5-8].
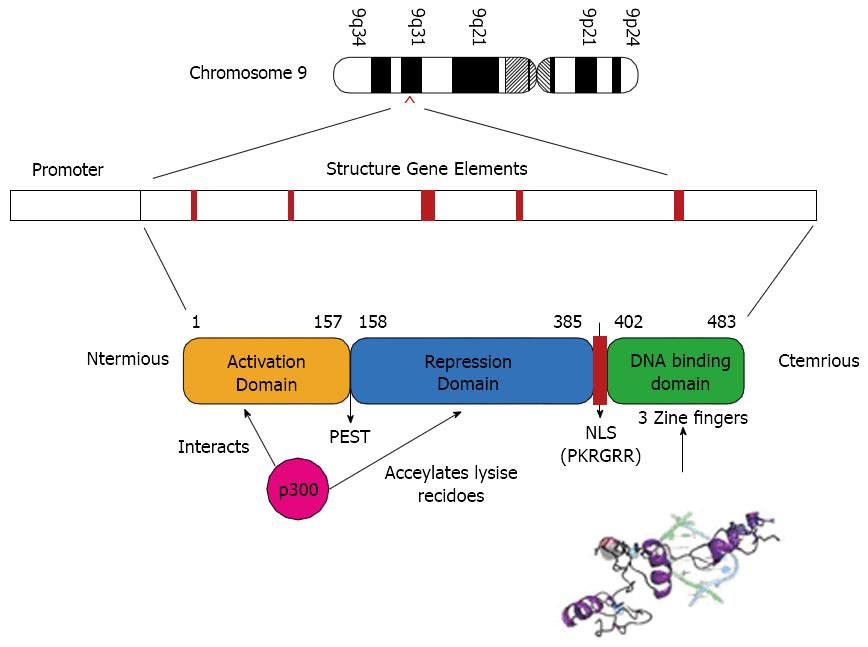
1996年, KLF4被Shields等[9]发现是一种含有锌指结构的转录因子, 以前被称为GKLF. 1998, Yet等[10]首次克隆出人的KLF4基因, 人类KLF4基因位于染色体9q31, 位于负链单拷贝基因, 包括6.3 kb的区域, 有5个外显子, 其编码蛋白分子量约为55 kDa, 含有470个氨基酸的蛋白质. 多个功能域在KLF4蛋白上定位包括: (1)DNA结合结构域, 由81个保守氨基酸形成的3个C2H2锌指结构组成; (2)N末端临近的3个锌指结构核定位序列; (3)位于氨基端并且包含转录活化和转录抑制的转录调节结构域(图1). 抑制域和及活化域同时存在导致了KLF4可根据条件的不同发挥不同的作用[11].
KLF4是人工诱导多能干细胞生成的一个核心转录因子, 可以维持胚胎干细胞端粒酶活性, 激活人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)和人端粒酶催化亚基的表达[12]. 研究[13]发现, 仅Oct4和KLF4就可以将皮肤真皮乳头层细胞诱导成iPSC, 证实了KLF4在维持干细胞全能性中起到一个重要因子的作用. KLF4作为KLFs家族的一员, 同样具有调控细胞增殖、凋亡、分化以及胚胎发育等重要生命过程, 并与代谢性疾病、心血管疾病、癌症等疾病的发生有关. 主要表达在消化道上皮细胞, 在食管上皮、血管内皮、口腔、皮肤、胸腺上皮细胞等方面也有广泛的表达. 研究报道, KLF4作为抑癌基因的候选基因之一, 在食管鳞癌[14]、胃癌[15]、结肠腺瘤和结直肠癌[16]等肿瘤中呈现低表达. 最近我们研究发现KLF4在原发性肝癌中呈现低表达, 增加KLF4的表达可以抑制肿瘤细胞的生物学功能, 但其在肿瘤细胞生物学中的具体调控机制仍不明确.
研究[9]报道KLF4可以通过调控肿瘤细胞增殖基因的表达来抑制肿瘤细胞周期进程. 在NIH3T3细胞中KLF4表达增加可以导致G1和G2/M期细胞周期阻滞, 进而抑制细胞增殖. Zhao等[17]研究发现KLF4可抑制肿瘤细胞周期G1期到S期的过渡, 从而抑制其增殖, 其机制认为是KLF4可直接与p21Waf1/CIP1基因的启动子结合, 与P53协同激活细胞周期蛋白依赖激酶抑制剂p21CIP1/Waf1蛋白, 上调p21Waf1/CIP1蛋白的表达, 使细胞周期进程受到阻止, 进而抑制细胞的增殖[18]. 另外, 也有研究[19]报道, KLF4还可抑制肿瘤细胞周期蛋白(cyclin D1, CCND1)和细胞周期蛋白B1(cyclin B1, CCNB1)的表达, 通过抑制CCND1和CCNB1的表达, 抑制细胞增殖并促进细胞凋亡. 目前有研究[20]报道, 在原发性肝癌细胞中, KLF4可以影响肿瘤细胞增殖. 干扰KLF4的表达可以促进肿瘤细胞的增殖. 然而, 有研究[21]报道, 在人原发性肝癌组织的微血管内皮细胞中获得肿瘤干细胞T3A-A3细胞, 干扰KLF4的表达后T3A-A3细胞的形成能力和裸鼠皮下移植瘤生长速度较对照组明显降低, 并且KLF4干扰组T3A-A3细胞裸鼠成瘤时间明显延长. 但是, 干扰KLF4的表达又可以抑制肿瘤干细胞T3A-A3的自我更新及其在体内外的增殖潜能, 但是其作用机制仍不清楚.
KLFs在发展和维护组织的平衡起着关键性的分化作用, 其调控了一系列的与分化相关的上皮细胞特异性角蛋白基因的表达. 在肠上皮细胞, KLF4表达于终末分化的上皮细胞, 在那里他促进分化[22]. KLF4转录目标包括了Lama1, 他编码的基底膜成分层黏连蛋白-1的编码基因, 和肠细胞的分化标记肠碱性磷酸酶[23,24]. KLF4与皮肤鳞状上皮细胞的分化及屏障功能的建立密切相关, KLF4表达缺失会破坏上皮屏障功能, 导致其不完整. KLF4为杯状细胞分化的具体作用表现在小鼠KLF4-/-的研究. 在这些KLF4表达缺失的小鼠中, 结肠杯状细胞的数目被显著减少和杯状细胞具有异常的形态, 与细胞特异性标记MUC2水平低, 表明胃上皮中的祖细胞分化为成熟的细胞系过程出现紊乱[25]. 低分化PHC中KLF4的表达低于高分化PHC, 预后KLF4表达的降低会导致患者复发率增高及生存时间减少, 但是其具体的作用机制仍不清楚. 因此, 进一步研究KLF4在原发性肝癌中的增殖及分化机制显得十分重要.
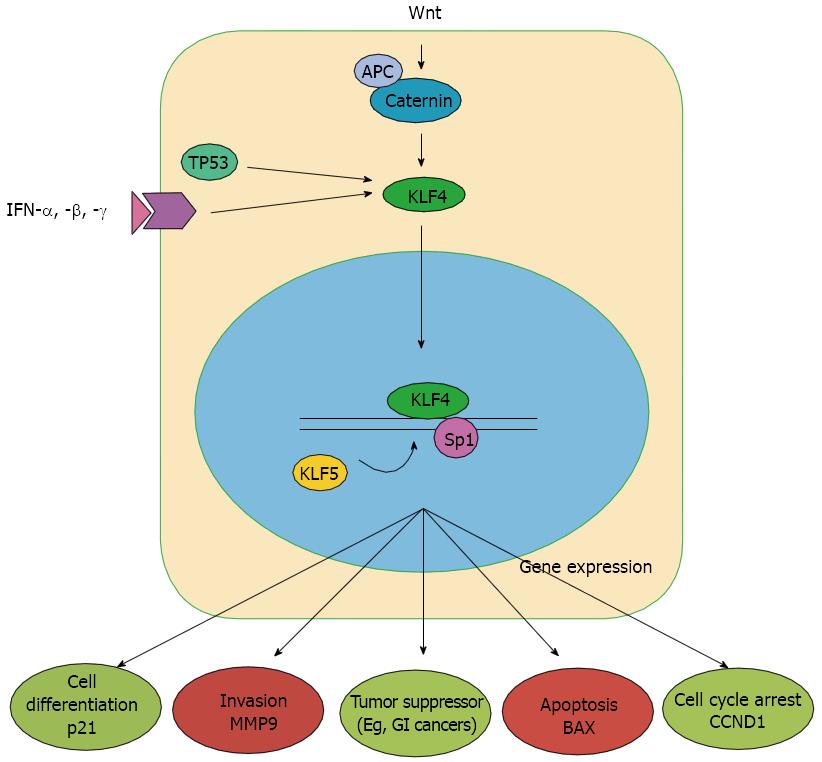
在RKO人肿瘤细胞系中, 发现诱导KLF4表达后, 减少了细胞集落形成, 细胞迁移, 侵袭和体内致瘤性[26]. 在腺瘤性结肠息肉病(adenomatous polyposis coli, APC)中, KLF4是结肠癌组织中最频繁突变的肿瘤抑制基因, APC可诱导KLF4的表达, 依赖于有功能的基因系尾型同源盒基因(caudal homeobox gene, CDX2)对KLF4启动子激活的能力[27]. APC是Wnt信号通路负责通过调节细胞水平和β-连环蛋白的定位维持肠上皮内稳态的一部分[28-30]. 任何一个的Wnt配体或APC的突变失活会导致β-连环蛋白的核易位; 形成核β-连环素/T细胞因子4(T cell factor 4, TCF4)转录复合物增加细胞增殖[31,32]. KLF4可以通过下调β-连环蛋白和mRNA水平抑制Wnt信号[33], 与β-连环蛋白的相互作用抑制β-连环蛋白/TCF4的转录活性, 抑制其介导的相关转录过程, 抑制细胞的癌变或者恶性转化[34]. 在原发性肝细胞癌中, Lin等[35]研究发现KLF4在原发性肝细胞癌中呈现低表达, 是起到抑癌基因的作用, 对肝癌的侵袭转移起到抑制的作用, 低表达KLF4的肝癌患者中, 肝内转移和肝外转移明显高于KLF4高表达的患者, 但其作用机制不清楚. 有意思的是, 我们最近研究[36]发现, 在肝癌细胞HepG2中过表达KLF4后MMP9 mRNA和蛋白表达均明显降低, 表明KLF4可特异性调控MMP9的表达. 同时我们还发现在肝癌细胞HepG2中过表达KLF4后, 肝癌细胞的侵袭及迁移能力明显减弱, 表明KLF4通过调控MMP9的表达可以影响肝癌细胞的迁移和侵袭.
许多研究探讨KLFs在细胞凋亡中的作用与癌症的关系. 在原发性肝细胞癌中, Sirach等[37]研究发现, 使用RNA干扰, 在体外抑制KLFs表达严重受损的细胞增殖诱导G1期阻滞, 抑制细胞周期蛋白依赖性激酶4和细胞周期蛋白D1的表达, 以及随后的成视网膜细胞瘤磷酸化. 沉默KLFs后, 可以导致p53上调和抑制Bcl-xL的表达, 通过凋亡诱导细胞死亡. 表明KLFs在原发性肝癌细胞的凋亡中起着重要的作用. KLF4基因能够使细胞周期停滞, 被普遍认为是一种肿瘤抑制基因. 但是, 当KLF4的诱导生长停滞的能力失活, 他就有助于肿瘤进展, 因为他也可以抑制细胞凋亡[38]. 在γ照射的RKO结肠癌细胞中, 通过对p53基因的抑制, 激活促凋亡基因Bax表达. 最后发现KLF4异位表达显著降低了细胞凋亡率[39]. 在另一项乳腺癌细胞MDA-MB-134研究[40]中, KLF4通过直接结合到p53基因的启动子和抑制其转录调控细胞凋亡. 在抑制细胞生长的剂量的阿霉素中, KLF4起到诱发和促进细胞周期阻滞的作用. 然而, 当细胞暴露于高浓度的阿霉素, KLF4表达则会被抑制. KLF4的异位表达阻止细胞死亡以应对高层次的阿霉素. KLF4是细胞周期停滞或死亡诱导p53的一个重要决定因素. 但是, 研究报道KLF4可以促进原发性肝癌细胞的凋亡, 然而, 其机制不清楚, 仍需进一步研究.
研究报道[41-51], KLF4在多种肿瘤细胞和组织中呈现低表达, 被认为是一个重要的临床预后指标. 对于胃癌组织样本的分析发现, 胃癌进展的早期, KLF4表达缺失, 随着肿瘤分期升高其表达量相对的降低. 与一般的胃癌组织相比, 伴有淋巴结转移的胃癌组织KLF4的蛋白和mRNA表达都显著降低甚至丢失, 且与预后相关, 可以作为一个独立的预后指标. 在结肠癌中, KLF4的表达水平越低, 则肿瘤的体积就越大, 术后的生存率也越低, 存活时间越短[52]. 在乳腺浸润性导管癌的早期, KLF4的表达升高, 与疾病的预后相关, KLF4的核内定位预示着患者预后较差, 可作为一个恶性表型的预后指标[53]. 最近Wei等[54]研究发现, 在人胰腺癌细胞中KLF4可以分为4种亚型, 即KLF4α、KLF4β、KLF4γ和KLF4δ. 其中在人胰腺癌组织和具有转移潜能的胰腺癌细胞系中, KLF4α的蛋白和mRNA的表达都增加, 与胰腺导管腺癌患者的生存时间呈负相关. 在前列腺癌中也发现了KLF4α亚型的存在[55]. 在原发性肝细胞癌中, Sun等[56]研究发现, 肝癌组织中KLF4和HNF-6的表达水平有直接的关系, 过表达KLF4可导致HNF-6表达降低, 恢复HNF-6的表达可抑制肝癌细胞的迁移和侵袭, 而干扰HNF-6的表达却相反, 患者预后KLF4表达的降低会导致生存和复发时间缩短, 可以作为肝癌患者行肝移植等综合治疗后的肝癌复发检测指标. 在原发性肝细胞癌中, KLF4的表达可以作为一个肝癌患者预后生存时间及复发的一个重要的指标.
KLF4作为KLFs家族中重要的一名成员, 在调控细胞增殖、凋亡、分化以及胚胎发育等重要生命过程起着重要的作用, 并与多种肿瘤疾病的发生有关. KLF4基因抑制肿瘤的发生、发展机制尚不十分明确. KLF4基因可影响细胞周期, KLF4可以通过调控促进细胞增殖基因的表达来抑制细胞周期进程, KLF4可以激活几个重要靶基因(P21、P27、cyclinD1), 这些靶基因与细胞周期相关. KLF4基因也可以通过诱导细胞凋亡来调节肿瘤细胞的增殖; 同时KLF4表达的增加还可以降低肿瘤细胞的迁移和侵袭能力. 原发性肝细胞癌的侵袭转移仍然是限制预后生存时间的关键因素(图2), 我们前期研究KLF4调控MMP9对原发性肝癌的侵袭迁移能力的影响发现KLF4原发性肝癌中的作用, 但是对于具体的调控机制我们还未探索. 近年来, KLF4在原发性肝细胞癌中的研究越来越多. 目前大量研究聚焦于KLF4对原发性肝癌细胞的生物学功能, 但是其机制仍不清楚, 有待进一步研究. 因此, 进一步探讨KLF4在原发性肝细胞癌中的具体作用机制显得十分重要, 这可能为原发性肝细胞癌的基因靶向治疗及预后监测复发提供一条新思路.
虽然随着对肝癌认识的不断深化, 早期诊断方法和治疗方法的完善, 在一定程度延长患者生存时间, 但有效的预防和治愈方法仍然处在探索阶段. 目前对进一步研究原发性肝细胞癌的分子学机制十分重要, 这可能为原发性肝细胞癌的基因靶向治疗及预后监测复发提供一条新思路.
王凯峰, 副主任医师, 浙江大学医学院附属邵逸夫医院
本文系统阐述了KLF4在原发性肝细胞癌中的发生发展、靶向调控、增殖凋亡等作用机制的研究进展, KLF4在原发性肝细胞癌中的研究可能对原发性肝细胞癌的靶向治疗及预后提供很好的应用前景.
本文可以反映研究工作的科学问题和特定内容, 具有一定的特色, 基本能够体现本文阐述的研究背景及需要研究的问题, 符合中文综述的要求, 可以修改后发表.
编辑: 于明茜 电编: 闫晋利
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | McConnell BB, Yang VW. Mammalian Krüppel-like factors in health and diseases. Physiol Rev. 2010;90:1337-1381. [PubMed] [DOI] |
| 3. | Brayer KJ, Segal DJ. Keep your fingers off my DNA: protein-protein interactions mediated by C2H2 zinc finger domains. Cell Biochem Biophys. 2008;50:111-131. [PubMed] [DOI] |
| 4. | Kaczynski J, Cook T, Urrutia R. Sp1- and Krüppel-like transcription factors. Genome Biol. 2003;4:206. [PubMed] [DOI] |
| 5. | Jiang J, Chan YS, Loh YH, Cai J, Tong GQ, Lim CA, Robson P, Zhong S, Ng HH. A core Klf circuitry regulates self-renewal of embryonic stem cells. Nat Cell Biol. 2008;10:353-360. [PubMed] [DOI] |
| 6. | Nandan MO, Yang VW. The role of Krüppel-like factors in the reprogramming of somatic cells to induced pluripotent stem cells. Histol Histopathol. 2009;24:1343-1355. [PubMed] |
| 7. | Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007;131:861-872. [PubMed] [DOI] |
| 8. | Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126:663-676. [PubMed] [DOI] |
| 9. | Shields JM, Christy RJ, Yang VW. Identification and characterization of a gene encoding a gut-enriched Krüppel-like factor expressed during growth arrest. J Biol Chem. 1996;271:20009-20017. [PubMed] [DOI] |
| 10. | Yet SF, McA'Nulty MM, Folta SC, Yen HW, Yoshizumi M, Hsieh CM, Layne MD, Chin MT, Wang H, Perrella MA. Human EZF, a Krüppel-like zinc finger protein, is expressed in vascular endothelial cells and contains transcriptional activation and repression domains. J Biol Chem. 1998;273:1026-1031. [PubMed] [DOI] |
| 11. | Chen ZY, Wang X, Zhou Y, Offner G, Tseng CC. Destabilization of Krüppel-like factor 4 protein in response to serum stimulation involves the ubiquitin-proteasome pathway. Cancer Res. 2005;65:10394-10400. [PubMed] [DOI] |
| 12. | Wong CW, Hou PS, Tseng SF, Chien CL, Wu KJ, Chen HF, Ho HN, Kyo S, Teng SC. Krüppel-like transcription factor 4 contributes to maintenance of telomerase activity in stem cells. Stem Cells. 2010;28:1510-1517. [PubMed] [DOI] |
| 13. | Tsai SY, Clavel C, Kim S, Ang YS, Grisanti L, Lee DF, Kelley K, Rendl M. Oct4 and klf4 reprogram dermal papilla cells into induced pluripotent stem cells. Stem Cells. 2010;28:221-228. [PubMed] [DOI] |
| 14. | Wernig M, Meissner A, Foreman R, Brambrink T, Ku M, Hochedlinger K, Bernstein BE, Jaenisch R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 2007;448:318-324. [PubMed] [DOI] |
| 15. | Ma Z, Chen Y, Min L, Li L, Huang H, Li J, Yan Q, Song P, Dai L, Yao X. Augmented miR-10b expression associated with depressed expression of its target gene KLF4 involved in gastric carcinoma. Int J Clin Exp Pathol. 2015;8:5071-5079. [PubMed] |
| 16. | Bianchi F, Hu J, Pelosi G, Cirincione R, Ferguson M, Ratcliffe C, Di Fiore PP, Gatter K, Pezzella F, Pastorino U. Lung cancers detected by screening with spiral computed tomography have a malignant phenotype when analyzed by cDNA microarray. Clin Cancer Res. 2004;10:6023-6028. [PubMed] [DOI] |
| 17. | Zhao W, Hisamuddin IM, Nandan MO, Babbin BA, Lamb NE, Yang VW. Identification of Krüppel-like factor 4 as a potential tumor suppressor gene in colorectal cancer. Oncogene. 2004;23:395-402. [PubMed] [DOI] |
| 18. | Zhang W, Geiman DE, Shields JM, Dang DT, Mahatan CS, Kaestner KH, Biggs JR, Kraft AS, Yang VW. The gut-enriched Kruppel-like factor (Kruppel-like factor 4) mediates the transactivating effect of p53 on the p21WAF1/Cip1 promoter. J Biol Chem. 2000;275:18391-18398. [PubMed] [DOI] |
| 19. | Yoon HS, Yang VW. Requirement of Krüppel-like factor 4 in preventing entry into mitosis following DNA damage. J Biol Chem. 2004;279:5035-5041. [PubMed] [DOI] |
| 20. | Li Q, Gao Y, Jia Z, Mishra L, Guo K, Li Z, Le X, Wei D, Huang S, Xie K. Dysregulated Krüppel-like factor 4 and vitamin D receptor signaling contribute to progression of hepatocellular carcinoma. Gastroenterology. 2012;143:799-810.e1-e2. [PubMed] [DOI] |
| 21. | 贾 勇圣, 张 文健, 刘 虹麟, 彭 亮, 杨 治华, 娄 晋宁. KLF4对肿瘤干细胞自我更新和增殖潜能的影响. 中国肿瘤生物治疗杂志. 2011;18:368-372. |
| 22. | McConnell BB, Ghaleb AM, Nandan MO, Yang VW. The diverse functions of Krüppel-like factors 4 and 5 in epithelial biology and pathobiology. Bioessays. 2007;29:549-557. [PubMed] [DOI] |
| 23. | Hinnebusch BF, Siddique A, Henderson JW, Malo MS, Zhang W, Athaide CP, Abedrapo MA, Chen X, Yang VW, Hodin RA. Enterocyte differentiation marker intestinal alkaline phosphatase is a target gene of the gut-enriched Kruppel-like factor. Am J Physiol Gastrointest Liver Physiol. 2004;286:G23-G30. [PubMed] [DOI] |
| 24. | Piccinni SA, Bolcato-Bellemin AL, Klein A, Yang VW, Kedinger M, Simon-Assmann P, Lefebvre O. Kruppel-like factors regulate the Lama1 gene encoding the laminin alpha1 chain. J Biol Chem. 2004;279:9103-9114. [PubMed] [DOI] |
| 25. | Katz JP, Perreault N, Goldstein BG, Actman L, McNally SR, Silberg DG, Furth EE, Kaestner KH. Loss of Klf4 in mice causes altered proliferation and differentiation and precancerous changes in the adult stomach. Gastroenterology. 2005;128:935-945. [PubMed] [DOI] |
| 26. | Dang DT, Chen X, Feng J, Torbenson M, Dang LH, Yang VW. Overexpression of Krüppel-like factor 4 in the human colon cancer cell line RKO leads to reduced tumorigenecity. Oncogene. 2003;22:3424-3430. [PubMed] [DOI] |
| 27. | Dang DT, Mahatan CS, Dang LH, Agboola IA, Yang VW. Expression of the gut-enriched Krüppel-like factor (Krüppel-like factor 4) gene in the human colon cancer cell line RKO is dependent on CDX2. Oncogene. 2001;20:4884-4890. [PubMed] [DOI] |
| 28. | Chia LA, Kuo CJ. The intestinal stem cell. Prog Mol Biol Transl Sci. 2010;96:157-173. [PubMed] [DOI] |
| 29. | Radtke F, Clevers H. Self-renewal and cancer of the gut: two sides of a coin. Science. 2005;307:1904-1909. [PubMed] [DOI] |
| 30. | Scoville DH, Sato T, He XC, Li L. Current view: intestinal stem cells and signaling. Gastroenterology. 2008;134:849-864. [PubMed] [DOI] |
| 31. | Korinek V, Barker N, Morin PJ, van Wichen D, de Weger R, Kinzler KW, Vogelstein B, Clevers H. Constitutive transcriptional activation by a beta-catenin-Tcf complex in APC-/- colon carcinoma. Science. 1997;275:1784-1787. [PubMed] [DOI] |
| 32. | Morin PJ, Sparks AB, Korinek V, Barker N, Clevers H, Vogelstein B, Kinzler KW. Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC. Science. 1997;275:1787-1790. [PubMed] [DOI] |
| 33. | Stone CD, Chen ZY, Tseng CC. Gut-enriched Krüppel-like factor regulates colonic cell growth through APC/beta-catenin pathway. FEBS Lett. 2002;530:147-152. [PubMed] [DOI] |
| 34. | Zhang W, Chen X, Kato Y, Evans PM, Yuan S, Yang J, Rychahou PG, Yang VW, He X, Evers BM. Novel cross talk of Kruppel-like factor 4 and beta-catenin regulates normal intestinal homeostasis and tumor repression. Mol Cell Biol. 2006;26:2055-2064. [PubMed] [DOI] |
| 35. | Lin ZS, Chu HC, Yen YC, Lewis BC, Chen YW. Krüppel-like factor 4, a tumor suppressor in hepatocellular carcinoma cells reverts epithelial mesenchymal transition by suppressing slug expression. PLoS One. 2012;7:e43593. [PubMed] [DOI] |
| 37. | Sirach E, Bureau C, Péron JM, Pradayrol L, Vinel JP, Buscail L, Cordelier P. KLF6 transcription factor protects hepatocellular carcinoma-derived cells from apoptosis. Cell Death Differ. 2007;14:1202-1210. [PubMed] [DOI] |
| 38. | Rowland BD, Bernards R, Peeper DS. The KLF4 tumour suppressor is a transcriptional repressor of p53 that acts as a context-dependent oncogene. Nat Cell Biol. 2005;7:1074-1082. [PubMed] [DOI] |
| 39. | Ghaleb AM, Katz JP, Kaestner KH, Du JX, Yang VW. Krüppel-like factor 4 exhibits antiapoptotic activity following gamma-radiation-induced DNA damage. Oncogene. 2007;26:2365-2373. [PubMed] [DOI] |
| 40. | Rowland BD, Peeper DS. KLF4, p21 and context-dependent opposing forces in cancer. Nat Rev Cancer. 2006;6:11-23. [PubMed] [DOI] |
| 41. | Wei D, Kanai M, Huang S, Xie K. Emerging role of KLF4 in human gastrointestinal cancer. Carcinogenesis. 2006;27:23-31. [PubMed] [DOI] |
| 42. | Luo A, Kong J, Hu G, Liew CC, Xiong M, Wang X, Ji J, Wang T, Zhi H, Wu M. Discovery of Ca2+-relevant and differentiation-associated genes downregulated in esophageal squamous cell carcinoma using cDNA microarray. Oncogene. 2004;23:1291-1299. [PubMed] [DOI] |
| 43. | Kim B, Bang S, Lee S, Kim S, Jung Y, Lee C, Choi K, Lee SG, Lee K, Lee Y. Expression profiling and subtype-specific expression of stomach cancer. Cancer Res. 2003;63:8248-8255. [PubMed] |
| 44. | Cercek A, Wheler J, Murray PE, Zhou S, Saltz L. Phase 1 study of APTO-253 HCl, an inducer of KLF4, in patients with advanced or metastatic solid tumors. Invest New Drugs. 2015;33:1086-1092. [PubMed] [DOI] |
| 45. | Ohnishi S, Ohnami S, Laub F, Aoki K, Suzuki K, Kanai Y, Haga K, Asaka M, Ramirez F, Yoshida T. Downregulation and growth inhibitory effect of epithelial-type Krüppel-like transcription factor KLF4, but not KLF5, in bladder cancer. Biochem Biophys Res Commun. 2003;308:251-256. [PubMed] [DOI] |
| 46. | Luo J, Dunn T, Ewing C, Sauvageot J, Chen Y, Trent J, Isaacs W. Gene expression signature of benign prostatic hyperplasia revealed by cDNA microarray analysis. Prostate. 2002;51:189-200. [PubMed] [DOI] |
| 47. | Xu J, Lü B, Xu F, Gu H, Fang Y, Huang Q, Lai M. Dynamic down-regulation of Krüppel-like factor 4 in colorectal adenoma-carcinoma sequence. J Cancer Res Clin Oncol. 2008;134:891-898. [PubMed] [DOI] |
| 48. | Wei D, Gong W, Kanai M, Schlunk C, Wang L, Yao JC, Wu TT, Huang S, Xie K. Drastic down-regulation of Krüppel-like factor 4 expression is critical in human gastric cancer development and progression. Cancer Res. 2005;65:2746-2754. [PubMed] [DOI] |
| 49. | Jia Y, Zhang C, Zhou L, Xu H, Shi Y, Tong Z. Micheliolide overcomes KLF4-mediated cisplatin resistance in breast cancer cells by downregulating glutathione. Onco Targets Ther. 2015;8:2319-2327. [PubMed] [DOI] |
| 50. | Fan SH, Wang YY, Wu ZY, Zhang ZF, Lu J, Li MQ, Shan Q, Wu DM, Sun CH, Hu B. AGPAT9 suppresses cell growth, invasion and metastasis by counteracting acidic tumor microenvironment through KLF4/LASS2/V-ATPase signaling pathway in breast cancer. Oncotarget. 2015;6:18406-18417. [PubMed] |
| 51. | Lee HK, Lee DS, Park JC. Nuclear factor I-C regulates E-cadherin via control of KLF4 in breast cancer. BMC Cancer. 2015;15:113. [PubMed] [DOI] |
| 52. | Patel NV, Ghaleb AM, Nandan MO, Yang VW. Expression of the tumor suppressor Krüppel-like factor 4 as a prognostic predictor for colon cancer. Cancer Epidemiol Biomarkers Prev. 2010;19:2631-2638. [PubMed] [DOI] |
| 53. | Pandya AY, Talley LI, Frost AR, Fitzgerald TJ, Trivedi V, Chakravarthy M, Chhieng DC, Grizzle WE, Engler JA, Krontiras H. Nuclear localization of KLF4 is associated with an aggressive phenotype in early-stage breast cancer. Clin Cancer Res. 2004;10:2709-2719. [PubMed] |
| 54. | Wei D, Wang L, Kanai M, Jia Z, Le X, Li Q, Wang H, Xie K. KLF4α up-regulation promotes cell cycle progression and reduces survival time of patients with pancreatic cancer. Gastroenterology. 2010;139:2135-2145. [PubMed] [DOI] |
| 55. | Le Magnen C, Bubendorf L, Ruiz C, Zlobec I, Bachmann A, Heberer M, Spagnoli GC, Wyler S, Mengus C. Klf4 transcription factor is expressed in the cytoplasm of prostate cancer cells. Eur J Cancer. 2013;49:955-963. [PubMed] [DOI] |
| 56. | Sun H, Tang H, Xie D, Jia Z, Ma Z, Wei D, Zheng S, Mishra L, Gao Y, Peng Z. Krüppel-Like Factor 4 Blocks Hepatocellular Carcinoma Dedifferentiation and Progression through Activation of Hepatocyte Nuclear Factor-6. Clin Cancer Res. 2015; Sep 2. [Epub ahead of print]. [PubMed] |