修回日期: 2016-10-05
接受日期: 2016-10-24
在线出版日期: 2016-12-28
收集中英文相关随机对照试验(randomized controlled trial, RCT)的研究结果进行Meta分析, 对特利加压素联合白蛋白对肝肾综合征(hepatorenal syndrome, HRS)的疗效进行评价.
采用Cochrane系统评价方法, 检索PubMed, The Cochrane Library, Web of Science and LILACS, Medline, EMBASE, 中国生物医学文献数据库, 维普中文科技期刊数据库, 中国CNKI学术总库, 万方数据资源系统等数据库, 检索截止2016-07以前的所有公开发表文献.
6篇RCT共542例患者纳入本荟萃分析, 特利加压素联合白蛋白在HRS治疗中较单独应用白蛋白可明显提高HRS缓解率(OR = 5.25, 95%CI: 2.77-6.52); 提高生存率(OR = 2.33, 95%CI: 1.11-4.88); 同时可降低血肌酐水平, 升高平均动脉压, 但对尿量的影响无明显差异. 其不良反应包括由于体循环充血及外周循环收缩导致的症状, 如腹痛、肢体末端紫绀等, 但无致死性不良反应报道.
特利加压素联合白蛋白对改善HRS较单独应用白蛋白有较好的作用, 可提高临床缓解率和生存率, 且无明显严重不良反应, 安全性好.
核心提要: 特利加压素联合白蛋白对改善Ⅰ型肝肾综合征(hepatorenal syndrome, HRS)较单独应用白蛋白有较好的作用, 且无明显严重不良反应, 安全性好, 可以作为治疗Ⅰ型HRS的药物.
引文著录: 李慧, 金哲, 吴利娟, 白艳丽, 顾俊霞, 金建军. 特利加压素联合白蛋白治疗Ⅰ型肝肾综合征疗效的荟萃分析. 世界华人消化杂志 2016; 24(36): 4805-4812
Revised: October 5, 2016
Accepted: October 24, 2016
Published online: December 28, 2016
to assess the efficacy of terlipressin plus albumin in the treatment of hepatorenal syndrome (HRS).
Cochrane strategy was used to identify randomized controlled trials published before July 2016 by searching PubMed, The Cochrane Library, Web of Science and LILACS, Medline, EMBASE, Chinese Biomedical Literature Database, Chongqing VIP Information Co., Ltd, China National Knowledge Internet Database, and Wanfang Data.
Six randomized controlled trials involving 542 cases were selected for this meta-analysis. The HRS remission rate and the survival rate were increased by terlipressin plus albumin, with OR = 5.25 (95%CI: 2.77-6.52) and 2.33 (95%CI: 1.11-4.88) compared with albumin alone, respectively. Blood creatinine was decreased by the combination treatment, and mean arterial pressure was increased significantly, while there was no difference in urine output. Side effects due to systemic circulation congestion and peripheral vasoconstriction were reported, such as stomach ache and extremity cyanosis. No fatal side effect was reported.
compared with albumin alone, terlipressin plus albumin is effective in the treatment of HRS, as demonstrated by increased remission rate and survival rate and no occurrence of fatal side effect.
- Citation: Li H, Jin Z, Wu LJ, Bai YL, Gu JX, Jin JJ. Terlipressin plus albumin for treatment of type 1 hepatorenal syndrome: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2016; 24(36): 4805-4812
- URL: https://www.wjgnet.com/1009-3079/full/v24/i36/4805.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i36.4805
肝肾综合征(hepatorenal syndrome, HRS)是继发于严重肝功能损伤及门静脉高压后的肾功能损伤, 表现为进行性少尿或无尿、血尿素氮及肌酐升高等, 但肾脏病理检查多无明显器质性病变, 临床预后差, 短期死亡率高. 其发病机制与外周血管扩张有重要关系, 肝硬化门脉高压形成, 机体出现代偿性回路, 肝脏的首过消除作用下降, 致使各物质的摄取减少, 尤其是舒血管物质在外周循环累积, 继而介导内脏血管和外周循环血管扩张, 导致机体有效循环不足[1]. 代偿期肾脏可通过自身调节作用维持肾血流量稳定, 维持正常肾小球滤过率. 随着病情进展, 或在感染、上消化道出血等诱因下, 肾脏产生缩血管物质增加, 肾灌注下降, 导致肾功能损伤, 出现HRS.
目前对于HRS最有效的治疗方法是进行肝移植, 但在具体实施中有相当大的困难, 包括肝源缺乏、患者自身条件难以耐受手术等. 传统治疗以白蛋白为主, 以维持有效血容量, 改善肾脏功能[2]. 近年来, 基于HRS外周血管扩张的发病机制, 已有多种血管活性药物应用于治疗HRS, 如奥曲肽、去甲肾上腺素、米多君等. 2012年《美国肝病研究学会成人肝硬化腹水指南》提出对于HRS可考虑用白蛋白联合血管活性药物[3], 但未给出详细推荐. 缩血管药物通过收缩过度扩张的血管, 增加有效循环, 提高平均动脉压, 改善肾脏灌注而达到治疗效果. 其中研究最多的是特利加压素, 一种垂体后叶素受体激动剂, 由于其选择性收缩内脏血管、扩张肾动脉的作用, 在欧洲已得到广泛应用[4]. 然而, 在大型的临床随机对照试验(randomized controlled trial, RCT)中, 特利加压素未达到严格的主要终点治疗效果, 未通过美国食品药品监督局的批准, 因而目前尚未应用于美国的临床治疗[5]. 本研究严格纳入相关临床RCT进行荟萃分析, 系统性评价特利加压素联合白蛋白对HRS的治疗效果, 为临床应用提供循证医学证据.
英文检索关键词包括: Terlipressin, Hepatorenal syndrome, Albumin, Randomized controlled trial, Human, Renal function. 中文检索关键词包括: 肝肾综合征, 特利加压素, 白蛋白. 检索数据库包括: PubMed, The Cochrane Library, Web of Science and LILACS, Medline, EMBASE, 中国生物医学文献数据库, 维普中文科技期刊数据库, 中国CNKI学术总库, 万方数据资源系统. 检索时间为数据库收录时间起至2016-07, 检索所有公开发表的文献.
1.2.1 观察对象纳入标准: 年满18周岁以上, 诊断为Ⅰ型HRS的患者, HRS诊断标准为1996年国际肝硬化腹水俱乐部提出的诊断标准[6], 即: (1)慢性或急性肝病伴进行肝功能衰竭和门静脉高压; (2)血清肌酐>133 mol/L; (3)无休克; (4)现时或近期未应用肾毒性药物; (5)撤回利尿剂扩容后肾功能无明确的改善; (6)尿蛋白<500 mg/dL, 超声检查未提示明显尿路阻塞或肾实质疾病.
1.2.2 研究类型: 前瞻性RCT.
1.2.3 干预措施: 在基础治疗基础上, 干预措施为观察组(治疗组)应用特利加压素联合白蛋白治疗, 对照单独应用白蛋白治疗.
1.2.4 结局指标: (1)缓解率; (2)观察期内生存率; (3)血肌酐水平; (4)平均动脉压; (5)尿量.
1.2.5 纳入试验的筛选: 两位研究者独立阅读所有检索出的文献题目和摘要, 排除明显不符合纳入标准的试验后, 对阅读可能符合纳入标准的文献全文, 以确定是否真正符合纳入标准, 对有分歧而难以确定的试验报道, 通过讨论决定其是否纳入.
1.2.6 质量评价: 根据Cochrane协作网推荐的方法由研究中进行文献质量评价, 评价内容包括(1)随机方法是否正确; (2)是否做到分配隐藏; (3)是否采用盲法; (4)随访有无失访、退出或丢失, 是否进行合理描述.
1.2.7 数据提取: 由于无法获取各研究的原始数据, 提取数据基于已公开发表的统计数据进行分析, 缺乏的关键性资料通过信件与作者联系予以补充. 提取的资料包括: 试验的基本情况、试验设计、干预措施、干预时间、随访时间、结局测量指标.
统计学处理 采用Cochrane协作网提供的RevMan5.3进行荟萃分析. 计数资料应用相对危险度作为疗效分析统计量; 计量资料采用标准化均数差进行分析. 各效应量以95%可信区间表示. 各研究结果间的异质性采用χ2检验. 当各研究间有统计学同质性(P>0.10, I2<50%)时, 应用固定效应模型进行分析; 如各研究间存在统计学异质性(P<0.10, I2>50%), 分析其异质性来源, 若两个研究组之间存在统计学异质性而无临床异质性时, 则采用随机效应模型进行分析.
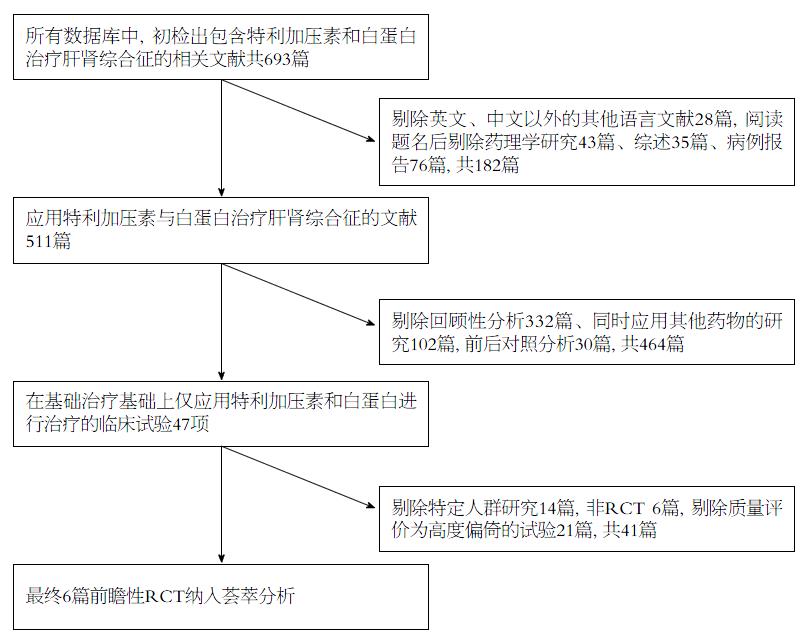
初检出693篇文献, 剔除英、中文以外的其他语言文献28篇, 阅读题名后剔除药理学研究43篇、综述35篇、病例报告76篇, 阅读摘要后剔除回顾性分析332篇、同时应用其他药物的研究102篇, 前后对照分析30篇, 阅读全文后剔除特定人群研究14篇, 非RCT 6篇, 剔除质量评价为高度偏倚的试验21篇, 最终6篇前瞻性RCT纳入荟萃分析(图1).
纳入各研究患者治疗组与对照组基线相似性均较好. 各研究均采取了随机对照方法, 但未明确具体随机方法, 有3篇应用了双盲的方法, 各项研究的基本特征如表1[7-12].
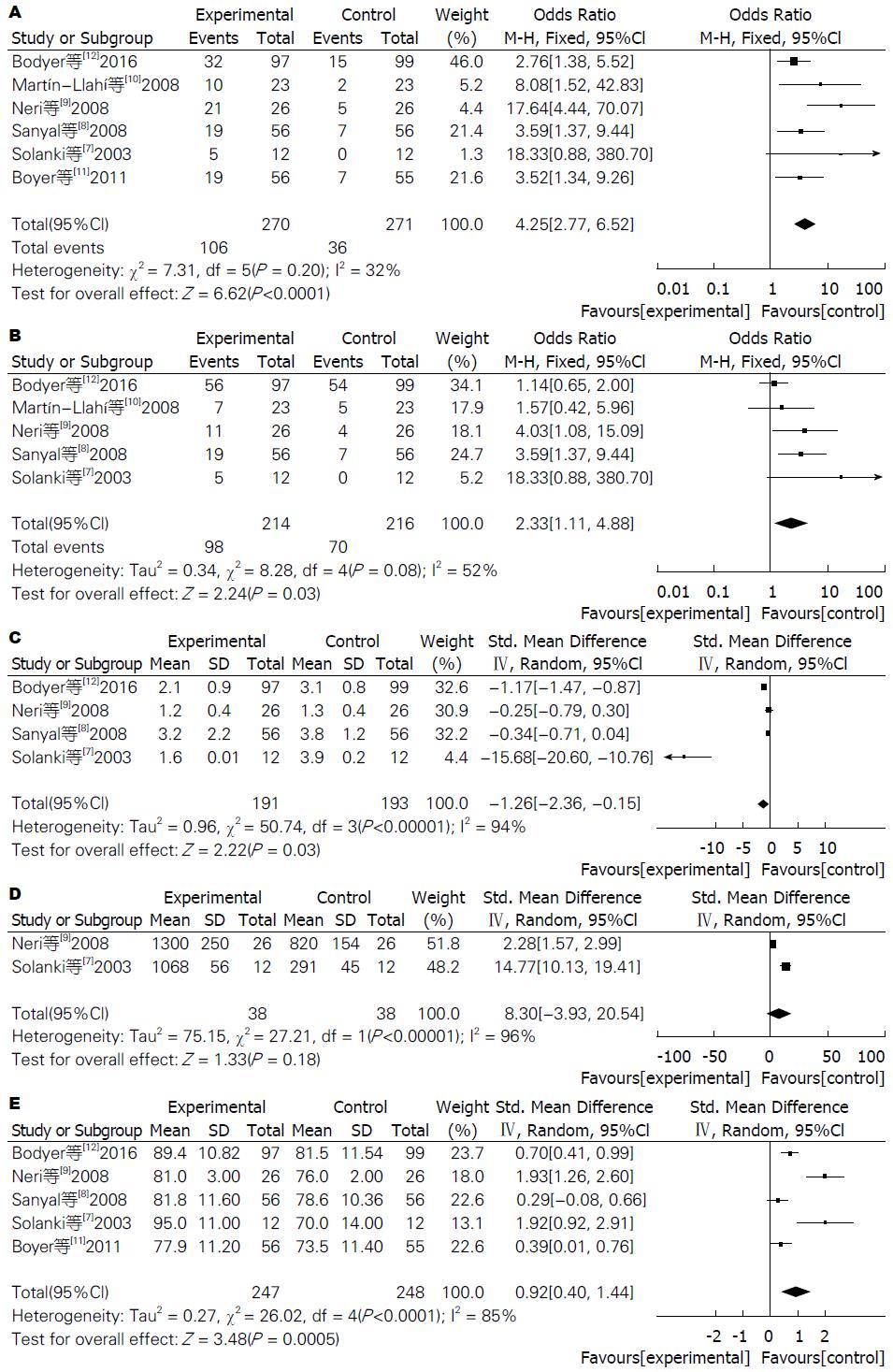
2.3.1 HRS缓解率: 6项研究均比较了白蛋白联合特利加压素联合应用与单独应用白蛋白后的HRS缓解率, 研究之间无显著异质性(P = 0.20), 采用固定效应模型分析, 结果显示, 联合用药组缓解率明显高于单独应用白蛋白组(OR = 5.25, 95%CI: 2.77-6.52, P < 0.00001, 图2A).
2.3.2 随访期内存活率: 5项研究比较了试验中患者随访期内存活率, 由于试验进行年份跨度较大, 几项研究中存在异质性(P = 0.08), 采用随机效应模型分析, 联合用药组观察期内存活率明显高于对照组(OR = 2.33, 95%CI: 1.11-4.88, P = 0.03, 图2B).
2.3.3 血肌酐水平: 纳入研究中有4项研究比较了患者治疗后血肌酐(mg/dL)水平, 异质性检验I2 = 94%, 采用随机效应模型分析, SWD = -1.26, 95%CI: -2.36-(-0.15), 差异有统计学意义(Z = 2.22, P = 0.03), 提示联合用药组较单独应用白蛋白可明显降低HRS患者血肌酐水平(图2C).
纳入研究中仅有2项研究比较了患者治疗后尿量情况, 异质性检验I2 = 96%, 采用随机效应模型分析, SWD = 8.30, 95%CI: -3.93-20.54, 差异无统计学意义(Z =1.33, P = 0.18), 提示两组尿量改善情况无明显差异(图2D).
5项研究比较了试验中495例患者治疗后平均动脉压的变化情况, 异质性检验I2 = 85%, 采用随机效应模型分析, SWD = 0.92, 95%CI: 0.01-0.76, 差异有统计学意义(Z = 3.48, P = 0.0005), 提示联合用药组较单独应用白蛋白可明显提高HRS患者平均动脉压(图2E).
HRS是在严重肝病后期出现、以进行性少尿或无尿、氮质血症等为主要表现, 但肾脏无明显器质性改变的一种功能性肾功能不全. 其发病机制包括循环功能异常、门静脉高压、电解质紊乱及肾脏自身条件系统异常等[11-13], 其中循环功能异常在病变过程中扮演重要角色. 肝硬化患者普遍存在循环阻力下降, 早期的轻度下降可由心输出量和肾脏的自身调节代偿. 随着病情进展, 门静脉压力增加, 循环中血管舒张因子增加, 体循环阻力进一步下降, 大量体液积聚于外周循环, 致使动脉体循环有效循环血量下降, 机体出现交感神经系统活化、肾素-血管紧张素系统活化以维持平均动脉压, 但同时导致使肾血流量减少, 肾球滤过率下降, 诱发肾内缩血管物质增加, 加重肾脏损伤[14].
HRS是重症肝病患者最严重的并发症之一, 也是重症肝病最常见的死亡原因之一[15], 根据肾损伤病变的进展速度, 临床HRS常分为两种类型[16]: 即Ⅰ型和Ⅱ型: Ⅰ型发病急骤, 肾功能在短期内(多<2 wk)迅速恶化, 短期病死率高; Ⅱ型发病相对较缓, 血肌酐水平逐渐升高, 有研究认为Ⅱ型HRS较Ⅰ型患者预后佳[17], 但目前尚无明确定论. 特利加压素是一种较天然的半衰期更长的血管加压素类似物, 研究发现, 联合白蛋白静脉用药可使半数以上的Ⅰ型HRS患者肾功能明显改善[18], 可有效提高3-6 mo存活率[19]但对患者长期生存率无明显改善, 推测与特利加压素不能改善肝脏疾病的预后有关[8], 另外, 联合白蛋白治疗Ⅱ型HRS虽可降低患者血肌酐水平, 但停药后大部分患者复发, 故对Ⅱ型HRS的治疗效果不如Ⅰ型[20]HRS.
本研究纳入了6项前瞻性临床RCT, 比较了联合应用特利加压素和白蛋白与单独应用白蛋白对Ⅰ型HRS患者的缓解率、生存率、血肌酐、尿量及平均动脉压的作用. 结果提示联合应用特利加压素可明显提高Ⅰ型HRS缓解率, 提高生存率, 降低血肌酐水平, 提高平均动脉压, 但对尿量无明显影响. 其不良反应包括: 非致命性心肌梗死、非持续性室上性心动过速、呼吸困难、呼吸性酸中毒、心律失常、房颤、胸痛、腹痛、外周血管痉挛等, 但未报道明显的致死性不良反应. 同时, 在其他的临床研究中[21,22], 也未见有致死性不良反应报道, 表明特利加压素应用于Ⅰ型HRS患者有较好临床疗效且安全.
HRS主要由于严重的血流动力学障碍导致, 尤其是Ⅰ型HRS患者, 应用白蛋白扩容可在一定程度上改善HRS患者的肾灌注[23], 但仅进行常规的扩容无法逆转HRS[24], 扩血管药物对治疗无效. 目前缩血管药物是内科常用的药物, 其中特利加压素和去甲肾上腺素是最常用的药物, 有研究表明二者对HRS患者治疗效果相当[25,26], 但应用去甲肾上腺素需同时进行心脏功能监测, 在一定程度上限制了其应用范围, 近年来的研究更倾向于推荐应用特利加压素[27]. 特利加压素可通过激动V1血管受体, 明显收缩内脏循环系统, 增加有效动脉内血容量, 改善循环功能, 同时可通过V2受体舒张肾脏血管, 减少血浆肾素-血管紧张素Ⅱ的产生, 总效应可增加肾脏血流灌注, 改善肾小球率过滤. Hadengue等[28]首次报道特利加压素安慰剂双盲对照交叉试验, 提示应用特利加压素可明显增加平均动脉压、尿量, 改善血肾素-血管紧张素系统.
本文的荟萃分析表明, 联合应用特利加压素可明显提高HRS缓解率, 提高生存率, 降低血肌酐水平, 提高平均动脉压, 与文献报道基本一致. 但结果显示, 联合用药对HRS患者尿量与单独应用白蛋白无明显影响, 可能与纳入的研究有关. 随着连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)在临床的广泛应用, 近年来的临床研究中均未将尿量作为1项观测指标, 因而缺失了近期的研究结果, 致使结果存在一定偏倚. 另一方面, 特利加压素同其他缩血管药物一样, 可作用于肾小管, 增加其重吸收[29], 导致尿量生成减少, 增加水钠重吸收[30], 一定程度上改善肝硬化患者低钠血症. 另外, 应用高渗钠联合白蛋白可有效提升血容量, 从而缓解HRS的病理改变, 有望提高HRS患者的生存期[31].
本荟萃分析表明特利加压素应用于Ⅰ型HRS患者有较好临床疗效且安全, 但同时存在一定的局限性: (1)纳入的试验时间跨度较大, 患者所应用的基础治疗不尽相同, 随着基础医疗水平的升高, 患者的生存率逐渐升高, 因此, 几项研究对生存率的研究存在明显异质性; (2)尽管纳入的文献质量较高, 但2次分析研究不可避免的受到原始研究偏倚的影响; (3)随着治疗水平的提升, CRRT已广泛应用于临床出现少尿或无尿的患者, CRRT同时可调控患者的液体平衡, 因此, 较新的研究在评估药物对患者尿量、肌酐水平上存在一定限制; (4)所纳入的文献均为国外研究, 可能存在一定的发表偏倚. 国内报道虽多, 但多数为回顾性研究或病例报道, 均未纳入本研究, 未来仍需要有大规模前瞻性临床对照研究, 为治疗提供依据; (5)尽管报道中每次特利加压素的应用剂量均为1 mg, 但每日的用药次数均不相同, 各研究中特利加压素的使用剂量和给药时间的差异, 可能为影响结局的原因之一, 其临床推荐剂量仍有待进一步的临床研究.
总之, 本次荟萃分析表明特利加压素联合白蛋白对改善Ⅰ型HRS较单独应用白蛋白有较好的作用, 且无明显严重不良反应, 安全性好, 可以作为治疗Ⅰ型HRS的药物, 但国内目前缺乏大规模前瞻性临床对照研究, 是否能够成为指南推荐用药, 仍需要进一步的证据支持.
Ⅰ型肝肾综合征(hepatorenal syndrome, HRS)继发于严重肝病, 预后差, 短期死亡率高, 早期治疗对改善其预后意义重大. 目前最有效的方法是肝移植, 但具体实施很困难, 所找到合适的内科治疗方案迫在眉睫.
本文系统评价特利加压素联合白蛋白治疗Ⅰ型HRS的疗效.
Facciorusso等在晚期肝硬化患者合并肝肾综合征, 低钠血症方面疗效的评价.
仅纳入特利加压素联合白蛋白与单独应用白蛋白的研究, 终点指标加入了评价其有效性的尿量、尿素氮、肌酐、平均动脉压、随访期内存活率等连续变量指标, 并对其不良反应作出相应分析.
特利加压素联合白蛋白对改善Ⅰ型HRS较单独应用白蛋白有较好的作用, 不良反应少, 安全性好, 可以作为治疗Ⅰ型HRS的药物, 但国内目前缺乏大规模前瞻性临床对照研究, 是否能够成为指南推荐用药, 仍需要进一步的证据支持.
连续性肾脏替代治疗(CRRT): 是一种新型的血液净化方法, 采用24 h连续性的血液净化替代受损的肾脏发挥代谢功能, 以维持内环境的稳定. 急性肾功能衰竭是其适应证.
兰英华, 副教授, 副主任医师, 哈尔滨医科大学附属第一医院感染科; 涂相林, 主任医师, 南昌市第九医院(南昌大学附属感染病医院)
循证医学证据较高, 有一定的临床实用性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Schrier RW, Arroyo V, Bernardi M, Epstein M, Henriksen JH, Rodés J. Peripheral arterial vasodilation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis. Hepatology. 1988;8:1151-1157. [PubMed] [DOI] |
| 2. | Valerio C, Theocharidou E, Davenport A, Agarwal B. Human albumin solution for patients with cirrhosis and acute on chronic liver failure: Beyond simple volume expansion. World J Hepatol. 2016;8:345-354. [PubMed] [DOI] |
| 3. | Runyon BA. Introduction to the revised American Association for the Study of Liver Diseases Practice Guideline management of adult patients with ascites due to cirrhosis 2012. Hepatology. 2013;57:1651-1653. [PubMed] [DOI] |
| 4. | Velez JC, Nietert PJ. Therapeutic response to vasoconstrictors in hepatorenal syndrome parallels increase in mean arterial pressure: a pooled analysis of clinical trials. Am J Kidney Dis. 2011;58:928-938. [PubMed] [DOI] |
| 5. | Londoño MC, Abraldes JG, Altamirano J, Decaens T, Forns X. Clinical trial watch: reports from the AASLD Liver Meeting®, Boston, November 2014. J Hepatol. 2015;62:1196-1203. [PubMed] [DOI] |
| 6. | Arroyo V, Ginès P, Gerbes AL, Dudley FJ, Gentilini P, Laffi G, Reynolds TB, Ring-Larsen H, Schölmerich J. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club. Hepatology. 1996;23:164-176. [PubMed] [DOI] |
| 7. | Solanki P, Chawla A, Garg R, Gupta R, Jain M, Sarin SK. Beneficial effects of terlipressin in hepatorenal syndrome: a prospective, randomized placebo-controlled clinical trial. J Gastroenterol Hepatol. 2003;18:152-156. [PubMed] [DOI] |
| 8. | Sanyal AJ, Boyer T, Garcia-Tsao G, Regenstein F, Rossaro L, Appenrodt B, Blei A, Gülberg V, Sigal S, Teuber P. A randomized, prospective, double-blind, placebo-controlled trial of terlipressin for type 1 hepatorenal syndrome. Gastroenterology. 2008;134:1360-1368. [PubMed] [DOI] |
| 9. | Neri S, Pulvirenti D, Malaguarnera M, Cosimo BM, Bertino G, Ignaccolo L, Siringo S, Castellino P. Terlipressin and albumin in patients with cirrhosis and type I hepatorenal syndrome. Dig Dis Sci. 2008;53:830-835. [PubMed] [DOI] |
| 10. | Martín-Llahí M, Pépin MN, Guevara M, Díaz F, Torre A, Monescillo A, Soriano G, Terra C, Fábrega E, Arroyo V. Terlipressin and albumin vs albumin in patients with cirrhosis and hepatorenal syndrome: a randomized study. Gastroenterology. 2008;134:1352-1359. [PubMed] [DOI] |
| 11. | Boyer TD, Sanyal AJ, Garcia-Tsao G, Blei A, Carl D, Bexon AS, Teuber P. Predictors of response to terlipressin plus albumin in hepatorenal syndrome (HRS) type 1: relationship of serum creatinine to hemodynamics. J Hepatol. 2011;55:315-321. [PubMed] [DOI] |
| 12. | Boyer TD, Sanyal AJ, Wong F, Frederick RT, Lake JR, O'Leary JG, Ganger D, Jamil K, Pappas SC. Terlipressin Plus Albumin Is More Effective Than Albumin Alone in Improving Renal Function in Patients With Cirrhosis and Hepatorenal Syndrome Type 1. Gastroenterology. 2016;150:1579-1589.e2. [PubMed] [DOI] |
| 13. | Facciorusso A, Amoruso A, Neve V, Antonino M, Prete VD, Barone M. Role of vaptans in the management of hydroelectrolytic imbalance in liver cirrhosis. World J Hepatol. 2014;6:793-799. [PubMed] [DOI] |
| 14. | Barbano B, Sardo L, Gigante A, Gasperini ML, Liberatori M, Giraldi GD, Lacanna A, Amoroso A, Cianci R. Pathophysiology, diagnosis and clinical management of hepatorenal syndrome: from classic to new drugs. Curr Vasc Pharmacol. 2014;12:125-135. [PubMed] [DOI] |
| 17. | Nazal L, Cárdenas A. Prognostic markers in patients with ascites and hepatorenal syndrome. Dis Markers. 2011;31:139-146. [PubMed] [DOI] |
| 19. | Salerno F, Gerbes A, Ginès P, Wong F, Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut. 2007;56:1310-1318. [PubMed] |
| 20. | Alessandria C, Venon WD, Marzano A, Barletti C, Fadda M, Rizzetto M. Renal failure in cirrhotic patients: role of terlipressin in clinical approach to hepatorenal syndrome type 2. Eur J Gastroenterol Hepatol. 2002;14:1363-1368. [PubMed] [DOI] |
| 21. | Srivastava S, Shalimar S, Prakash S, Sharma H, Thakur B, Acharya SK. Randomized Controlled Trial Comparing the Efficacy of Terlipressin and Albumin with a Combination of Concurrent Dopamine, Furosemide, and Albumin in Hepatorenal Syndrome. J Clin Exp Hepatol. 2015;5:276-285. [PubMed] [DOI] |
| 22. | Ortega R, Ginès P, Uriz J, Cárdenas A, Calahorra B, De Las Heras D, Guevara M, Bataller R, Jiménez W, Arroyo V. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study. Hepatology. 2002;36:941-948. [PubMed] [DOI] |
| 23. | Salerno F, Navickis RJ, Wilkes MM. Albumin treatment regimen for type 1 hepatorenal syndrome: a dose-response meta-analysis. BMC Gastroenterol. 2015;15:167. [PubMed] [DOI] |
| 24. | O'Brien A, China L. Is human albumin solution really the best resuscitation fluid for patients with advanced cirrhosis? Gut. 2016;65:1392-1393. [PubMed] [DOI] |
| 25. | Sharma P, Kumar A, Shrama BC, Sarin SK. An open label, pilot, randomized controlled trial of noradrenaline versus terlipressin in the treatment of type 1 hepatorenal syndrome and predictors of response. Am J Gastroenterol. 2008;103:1689-1697. [PubMed] [DOI] |
| 26. | Singh V, Ghosh S, Singh B, Kumar P, Sharma N, Bhalla A, Sharma AK, Choudhary NS, Chawla Y, Nain CK. Noradrenaline vs. terlipressin in the treatment of hepatorenal syndrome: a randomized study. J Hepatol. 2012;56:1293-1298. [PubMed] [DOI] |
| 27. | Pericleous M, Sarnowski A, Moore A, Fijten R, Zaman M. The clinical management of abdominal ascites, spontaneous bacterial peritonitis and hepatorenal syndrome: a review of current guidelines and recommendations. Eur J Gastroenterol Hepatol. 2016;28:e10-e18. [PubMed] [DOI] |
| 28. | Hadengue A, Gadano A, Moreau R, Giostra E, Durand F, Valla D, Erlinger S, Lebrec D. Beneficial effects of the 2-day administration of terlipressin in patients with cirrhosis and hepatorenal syndrome. J Hepatol. 1998;29:565-570. [PubMed] [DOI] |
| 29. | Pesaturo AB, Jennings HR, Voils SA. Terlipressin: vasopressin analog and novel drug for septic shock. Ann Pharmacother. 2006;40:2170-2177. [PubMed] [DOI] |
| 30. | Hesse IF, Johns EJ. The role of alpha-adrenoceptors in the regulation of renal tubular sodium reabsorption and renin secretion in the rabbit. Br J Pharmacol. 1985;84:715-724. [PubMed] [DOI] |