修回日期: 2016-10-28
接受日期: 2016-11-01
在线出版日期: 2016-12-28
研究miR-29在胃癌多药耐药细胞株[SGC7901/长春新碱(vincristine, VCR)及SGC7901/阿霉素(adriamycin, ADR)]及其亲本细胞(SGC7901)中的表达差异, 探讨其在胃癌多药耐药发生中的作用及可能机制.
qRT-PCR检测miR-29在不同胃癌细胞系中的表达差异, 通过细胞转染调控miR-29的表达水平, MTT法检测不同化疗药物对转染后胃癌细胞的IC50值变化; 流式细胞术检测细胞凋亡及周期变化; 并应用Western blot、双荧光素酶报告基因实验等方法探讨其可能机制.
SGC7901/VCR及SGC7901/ADR细胞中miR-29家族(miR-29a/b/c)相对表达量均显著低于其亲本细胞SGC7901(P<0.05); MTT实验表明, 下调miR-29表达后SGC7901细胞对不同化疗药物的IC50值显著增高(P<0.05); 而上调miR-29表达后SGC7901/VCR及SGC7901/ADR细胞对不同化疗药物的IC50值则显著降低(P<0.05); 流式细胞术检测结果显示, miR-29表达变化可显著改变5-氟尿嘧啶诱导胃癌细胞的凋亡水平(P<0.05); Western blot、双荧光素酶报告基因实验等证实髓细胞白血病因子-1(myeloid cell leukemia-1, Mcl-1)是miR-29直接调控靶基因.
miR-29表达下调是人胃癌细胞多药耐药发生的机制之一, 其可能与负性调控抗凋亡蛋白Mcl-1表达有关.
核心提要: miRNA分子广泛参与肿瘤发生发展过程中基因表达的调控. 在本研究中, 我们以胃癌多药耐药细胞株(SGC7901/长春新碱及SGC7901/阿霉素)为细胞模型, 证实miR-29通过调节抗凋亡蛋白髓细胞白血病因子-1表达参与胃癌多药耐药的发生, 进一步显示miR-29在肿瘤发生发展过程中发挥抑癌基因作用.
引文著录: 赵梦雅, 陈虹羽, 刘月, 汪凯, 张晓丹, 张亚飞. miR-29通过调节抗凋亡蛋白Mcl-1表达参与胃癌细胞多药耐药的发生. 世界华人消化杂志 2016; 24(36): 4781-4787
Revised: October 28, 2016
Accepted: November 1, 2016
Published online: December 28, 2016
To investigate the differential expression of miR-29 in SGC7901/vincristine (VCR), SGC7901/adriamycin (ADR) and SGC7901 gastric cancer cell lines, and to explore its role in multidrug resistance of gastric cancer cells and the possible mechanism involved.
qRT-PCR was used to detect the expression of miR-29 in different gastric cancer cell lines. After up- or down-regulation of miR-29 expression, MTT assay was applied to detect the changes in drug sensitivity (IC50) of different gastric cancer cell lines. Apoptosis and cell cycle arrest were analyzed by flow cytometry. Western blot analysis and luciferase assay were performed to investigate the possible mechanism involved.
The expression levels of the miR-29 family members (miR-29a/b/c) in SGC7901/VCR and SGC7901/ADR cell lines were significantly lower than those in parental SGC7901 cells (P < 0.05). MTT assay showed that down-regulation of miR-29 led to a significant increase in the drug sensitivity (IC50) of SGC7901 cells, while up-regulation of miR-29 induced a significant decrease in the drug sensitivity (IC50) of SGC7901/VCR and SGC7901/ADR cells (P < 0.05). Flow cytometry analysis indicated that altered miR-29 expression caused significant changes in 5-fluorouridine induced apoptosis (P < 0.05). Western blot analysis and luciferase assay demonstrated that in gastric cancer cells myeloid cell leukemia-1 (Mcl-1) is the direct functional target of miR-29.
MiR-29 modulates multidrug resistance of gastric cancer cells by directly targeting the expression of anti-apoptotic Mcl-1.
- Citation: Zhao MY, Chen HY, Liu Y, Wang K, Zhang XD, Zhang YF. MiR-29 modulates multidrug resistance of gastric cancer cells by targeting Mcl-1. Shijie Huaren Xiaohua Zazhi 2016; 24(36): 4781-4787
- URL: https://www.wjgnet.com/1009-3079/full/v24/i36/4781.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i36.4781
虽分子靶向药物等在肿瘤治疗中发挥着越来越重要的作用, 化疗仍是目前胃癌主要治疗手段之一[1-3]. 然而, 肿瘤细胞对化疗药物产生的多药耐药现象导致目前多数胃癌患者难以获得满意疗效, 数据表明, 胃癌化疗有效率仅30%-50%, 2年内复发和转移的几率高达50%-70%[1-3].
越来越多的研究显示, miRNA分子广泛参与肿瘤发生发展过程中基因表达的调控[4,5]. miR-29已被证实在多种肿瘤中发挥抑癌基因作用, 其家族成员包括miR-29a、miR-29b及miR-29c[6]. 在胃癌组织中, miR-29表达水平显著低于癌旁正常胃黏膜组织, 且与胃癌的侵袭转移等有关[7-9]. 在本研究中, 我们利用胃癌多药耐药细胞株[SGC7901/长春新碱(vincristine, VCR)及SGC7901/阿霉素(adriamycin, ADR)]探讨了miR-29在人胃癌多药耐药发生中的作用, 并初步探讨其可能作用机制.
1.1.1 细胞培养: 人胃癌VCR耐药细胞株SGC7901/VCR, ADR耐药细胞株SGC7901/ADR及其亲本SGC7901细胞由第四军医大学西京医院消化病研究所惠赠. SGC7901/VCR、SGC7901/ADR及SGC7901细胞均以含10%胎牛血清的RPMI 1640培养液于37 ℃、50 mL/L CO2的培养箱中常规培养, 其中SGC7901/VCR、SGC7901/ADR的细胞培养液中分别含1 μg/mL的VCR及0.6 μg/mL的ADR以维持其耐药性[10].
1.1.2 细胞转染: miR-29(miR-29a/b/c)模拟物、抑制剂及相关阴性对照由Ribobio公司合成. 体外培养的SGC7901/VCR、SGC7901/ADR及SGC7901细胞进入对数生长期后, 接种于6孔细胞培养板中继续培养24 h. 分别利用miR-29模拟物及抑制剂(或相关阴性对照)-Lipofectamine 2000混合液分别转染细胞, 48 h后行相关检测.
1.2.1 MTT体外药敏实验: 取对数生长期经miR-29模拟物(miR-29a、miR-29b及miR-29c模拟物的1:1:1混合物)、抑制剂(miR-29a、miR-29b及miR-29c抑制剂的1:1:1混合物)及相关阴性对照转染后人胃癌细胞[11], 按每孔5×103接种于96孔板, 常规培养24 h后换液, 加入不同浓度梯度的VCR、ADR、顺铂(cis-diaminedichloroplatinum, CDDP)及5-氟尿嘧啶(5-fluorouridine, 5-Fu), 每个药物浓度设4复孔, 继续培养72 h后按常规方法加入MTT及DMSO, 于490 nm处测每孔吸光度(A)值. 细胞存活率 = [实验组(A)值-空白对照组(A)值]/[阴性对照组(A)值-空白对照组(A)值]×100%, 同时计算细胞对各种化疗药物的IC50值.
1.2.2 细胞凋亡检测: miR-29转染人胃癌细胞48 h后更新培养液, 并加入相应量的5-Fu工作液(浓度为10 μg/mL), 继续培养48 h后, 收集细胞, 应用Annexin V-FITC/PI双染法检测细胞凋亡水平的变化.
1.2.3 细胞周期检测: miR-29转染人胃癌细胞48 h后更新培养液, 并加入相应量的5-Fu工作液(浓度为10 μg/mL), 继续培养48 h后, 收集细胞, 应用PI染色法检测细胞周期变化.
1.2.4 Western blot检测: 应用Western blot检测miR-29转染后人胃癌细胞髓细胞白血病因子-1(myeloid cell leukemia-1, Mcl-1)表达水平变化, 以β-actin表达为内参.
1.2.5 双荧光素酶报告基因实验: 根据生物信息学预测结果, 设计引物扩增包含miR-29结合位点的Mcl-1 3'UTR, 构建并制备野生型pMIR-Mcl-1 3'UTR和突变型pMIR-mut-Mcl-1 3'UTR重组质粒. 将对数生长期的SGC7901细胞接种于96孔板中, 将其分为2组: pMIR-Mcl-1 3'UTR组与pMIR-mut-Mcl-1 3'UTR组, 分别与miR-29a、miR-29b、miR-29c模拟物及相关对照miRNA共孵育24 h. 然后根据Promega公司双荧光素酶基因检测试剂盒说明书向各孔内加入萤火虫和海肾荧光素酶试剂, 检测各孔荧光活性.
统计学处理 所有统计均由SPSS19.0软件完成, 实验数据以mean±SD表示, 行student-t检验或ANOVA方差分析, P<0.05为差异具有统计学意义.
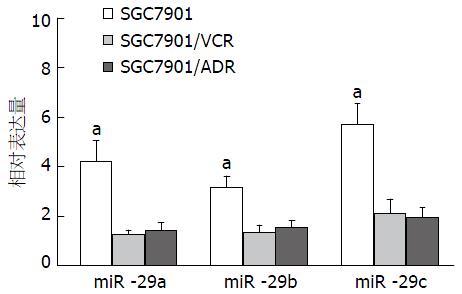
qRT-PCR检测结果显示, 胃癌多药耐药细胞株SGC7901/VCR及SGC7901/ADR中miR-29家族(miR-29a/b/c)的相对表达量均显著低于其亲本细胞SGC7901, 差异具有统计学意义(图1, P<0.05), 提示miR-29家族参与胃癌细胞多药耐药的发生.
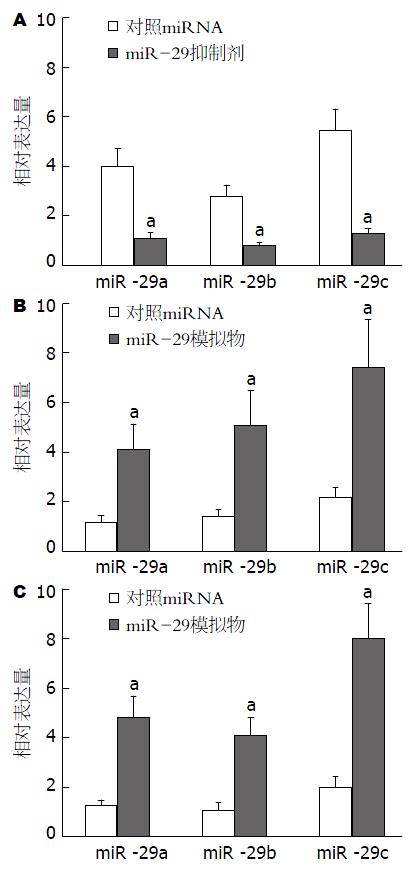
我们首先利用qRT-PCR的方法检测了转染特异性模拟物或抑制剂对细胞miR-29表达水平的调控效果, 结果如图2所示: 与对照相比, 转染特异性抑制剂后SGC7901细胞miR-29(miR-29a/b/c)水平显著降低(P<0.05); 而在SGC7901/VCR及SGC7901/ADR中, 转染特异性模拟物可显著提高细胞miR-29(miR-29a/b/c)的表达水平(P<0.05). 进一步的体外药敏试验结果(表1)显示: 转染miR-29特异性抑制剂(miR-29a、miR-29b及miR-29c抑制剂的1:1:1混合物)后SGC7901细胞对VCR、ADR、CDDP及5-Fu的IC50值显著高于阴性对照组; 而在SGC7901/VCR及SGC7901/ADR耐药细胞株中, 转染miR-29特异性模拟物(miR-29a、miR-29b及miR-29c模拟物的1:1:1混合物)则可显著降低细胞对VCR、ADR、CDDP及5-Fu的IC50值(P<0.05). 上述结果提示: miR-29表达水平下降是导致胃癌细胞多药耐药发生的可能机制之一.
| IC50 | SGC7901 | SGC7901/VCR | SGC7901/ADR | |||
| 对照组 | +抑制剂组 | 对照组 | +模拟物组 | 对照组 | +模拟物组 | |
| VCR | 1.01±0.17 | 2.64±0.58 | 18.21±4.58 | 4.42±1.26 | 6.74±1.89 | 2.13±0.44 |
| ADR | 0.83±0.16 | 1.75±0.40 | 4.36±1.01 | 1.26±0.25 | 16.31±4.85 | 3.65±0.78 |
| CDDP | 2.10±0.53 | 4.83±1.25 | 5.41±1.28 | 2.31±0.41 | 4.28±1.20 | 2.75±0.39 |
| 5-Fu | 1.84±0.46 | 3.16±1.06 | 6.72±1.74 | 2.40±0.56 | 5.55±1.46 | 2.22±0.41 |
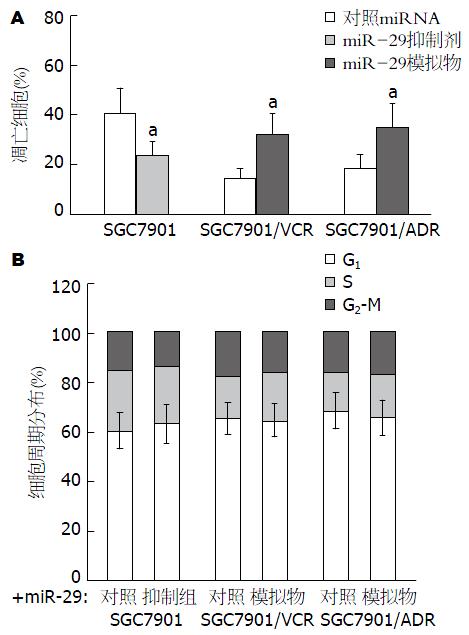
我们进一步探讨了miR-29表达变化对化疗药物(5-Fu)诱导胃癌细胞凋亡及周期阻滞的影响. 结果如图3所示: 与对照组相比, 转染miR-29特异性抑制剂(miR-29a、miR-29b及miR-29c抑制剂的1:1:1混合物)可显著降低SCG7901细胞在5-Fu(10 μg/mL)共孵育48 h后细胞凋亡的比率(40.5±10.52 vs 23.7±5.74, P<0.05), 但对细胞周期的影响并不显著(P>0.05); 而在SGC7901/VCR及SGC7901/ADR多药耐药细胞株中, 转染miR-29特异性模拟物(miR-29a、miR-29b及miR-29c模拟物的1:1:1混合物)则可显著增加其在5-Fu诱导下的细胞凋亡比率(SGC7901/VCR: 14.2±4.36 vs 32.0±8.42; SGC7901/ADR: 18.6±5.21 vs 35.1±9.43, P<0.05), 但其细胞周期变化也不显著(P>0.05). 这一结果提示: miR-29参与胃癌细胞多药耐药发生的机制可能主要与其调控凋亡有关.
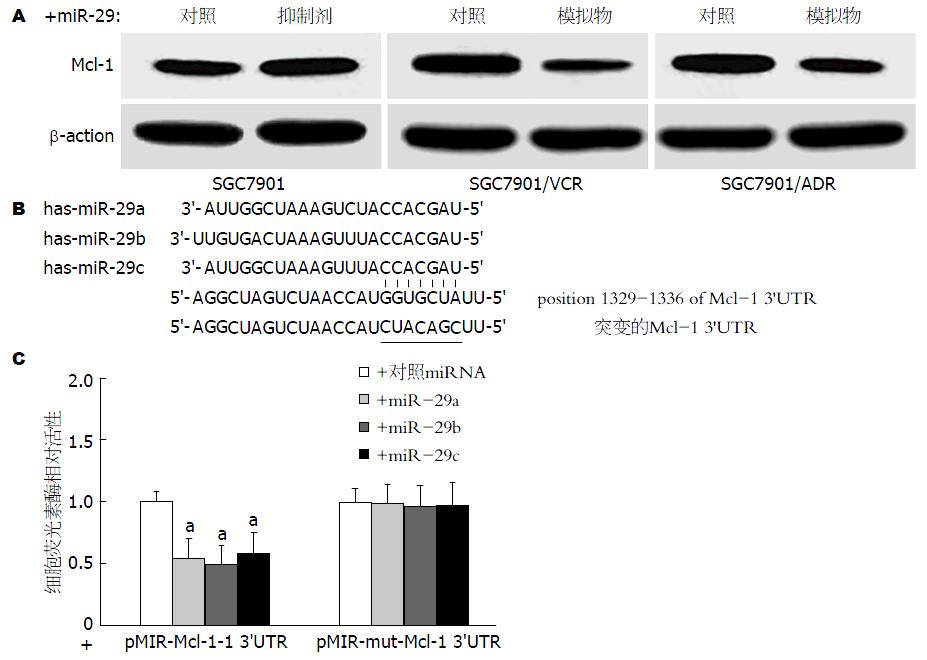
在多个肿瘤细胞系中, Mcl-1已被证实是miR-29的主要功能靶基因之一[6]. 在本研究中, 我们检测了miR-29转染SGC7901、SGC7901/VCR及SGC7901/ADR细胞后Mcl-1蛋白表达水平的变化, 结果如图4A所示: 与对照相比, 下调miR-29表达(转染miR-29a、miR-29b及miR-29c抑制剂的1:1:1混合物)后SGC7901细胞Mcl-1蛋白表达水平显著上调; 而在SGC7901/VCR及SGC7901/ADR细胞中, 上调miR-29表达(转染miR-29a、miR-29b及miR-29c模拟物的1:1:1混合物)则可导致Mcl-1蛋白表达水平显著下调, 提示: 在胃癌细胞中, Mcl-1也是miR-29直接调控的靶基因.
我们构建了含miR-29结合靶位点的Mcl-1 3'UTR片段荧光素酶报告基因载体(pMIR-Mcl-1 3'UTR)及其突变型报告基因载体(pMIR-mut-Mcl-1 3'UTR)(图4B). 双荧光素酶报告基因实验结果(图4C)显示: 与阴性对照相比, 转染miR-29a、miR-29b及miR-29c并共转染pMIR-Mcl-1 3'UTR质粒后, SGC7901细胞荧光素酶活性均显著下降(P<0.05); 而在转染pMIR-mut-Mcl-1 3'UTR质粒的SGC7901细胞中, 共转染miR-29a、miR-29b及miR-29c后, 其细胞荧光素酶活性未见显著变化(P>0.05). 这一结果证实在SGC7901细胞中miR-29a、miR-29b及miR-29c均可通过与Mcl-1 3'UTR靶位点结合对其蛋白表达进行负性调控.
过去10年, 虽胃癌全球的整体发病率在逐渐下降, 但在亚洲特别是中国, 胃癌发病率仍然很高. 据统计, 在我国, 每年有近50万的胃癌新发病例, 占全球的近半数, 且由于社会和经济发展水平等客观因素, 我国早期胃癌的发现比例很低, 多数患者在诊断时已经处于进展期, 其中仅有25%-40%可接受根治性外科手术, 而据既往报道, 接受根治性手术的进展期胃癌患者, 又有高达60%的复发率[12-15]. 虽分子靶向及免疫治疗等近年在部分胃癌患者中已取得令人振奋的结果, 化疗仍是多数进展期胃癌综合治疗的基石. 新辅助化疗、术后辅助化疗、晚期或转移性胃癌化疗等均已被证实能够使部分患者临床症状缓解并获得生存益处. 然而, 在临床实践中, 部分甚至是大部分胃癌患者因肿瘤细胞多药耐药性的产生而导致化疗无效或逐渐转为无效. 此时, 肿瘤细胞不仅对开始诱导的化疗药物产生抗性, 还对其他尚未使用的结构和作用机制均不相同的多种化疗药物产生交叉、广谱耐药性, 影响进一步化疗药物的选择[16-19].
肿瘤细胞多药耐药的发生机制是多方面的, 包括细胞内药物外排及胞内药物重分布、药物靶分子的改变、启动细胞内解毒系统、细胞修复DNA损伤能力增强、细胞凋亡调控、微环境参与影响等[14,15]. miRNA分子已被证实在多种疾病发生发展过程中发挥巨大作用. 在肿瘤中, miRNA分子参与肿瘤发生发展的各个阶段, 并与肿瘤细胞的侵袭转移及多药耐药发生等密切相关. 近年的研究[6]表明, miR-29家族(miR-29a、miR-29b及miR-29c)是一簇重要的具有抑癌功能的miRNA分子, 其高表达于正常组织, 而在多种肿瘤包括神经纤维瘤、乳腺癌、肝癌、结肠癌、前列腺癌等实体瘤中低表达. 在胃癌中, 已有多个研究显示miR-29较癌旁组织明显低表达, 且与预后密切相关. 陈陵等[20]的研究显示miR-29表达与微血管密度水平呈负相关, 微血管密度生成是引起肿瘤侵袭及转移的最重要条件之一, 因而miR-29被推测可通过抑制微血管生成而抑制胃癌的发展. 进一步的研究也显示miR-29可通过抑制VEGF-A、ITCB1等的表达参与胃癌细胞侵袭转移的调控[21,22]. Wang等[23]的研究显示, 在多种胃癌细胞系(MGC803, HGC27, BGC823及MKN45)中, 化疗药物(CDDP及多西他赛等)可诱导miR-29家族上调表达, 且可通过调控Catenin-δ蛋白表达参与胃癌细胞侵袭转移的过程. 在本研究中, 我们发现miR-29在胃癌耐药细胞株SGC7901/VCR及SGC7901/ADR中的表达显著低于其亲本细胞SGC7901, 这一结果提示在耐药细胞株中, miR-29表达受抑, 化疗药物不能诱导miR-29上调表达而发挥其抑癌功能. 通过体外药敏等实验, 我们进一步证实miR-29表达下调可直接诱导胃癌细胞多药耐药发生, 且可能与其凋亡调控功能相关.
Bcl-2蛋白家族在内源性凋亡的调控过程中发挥着关键性的作用. Mcl-1作为Bcl-2家族抗凋亡蛋白成员之一, 在多种肿瘤中高表达[24,25]. 研究已证实, Mcl-1高表达不仅促进肿瘤发生发展, 还参与肿瘤细胞多药耐药的发生. Mcl-1是miR-29最重要的调控靶基因之一[6]. Mott等[26]首先证实在良性的胆管细胞系H69及恶性的胆管癌细胞系KMCH中, miR-29(miR-29b)可直接负性调控Mcl-1蛋白的表达, 并参与细胞凋亡调控. Garzon等[27]及Xu等[28]的研究显示在急性髓性白血病中miR-29(miR-29a/b)与Mcl-1表达水平呈负相关. Xiong等[11]的研究则表明, miR-29表达与肝癌的预后相关, 其低表达不利于预后; 进一步的分子生物学研究显示, 在肝癌细胞中, Mcl-1及Bcl-2是miR-29(miR-29a/b/c)的直接调控靶基因. 甚至有研究显示, miR-29家族可通过对Mcl-1的调控参与成人生殖细胞的凋亡过程及糖尿病的发生等[29,30]. 在本研究中, 我们利用荧光素酶报告基因实验等证实在胃癌SGC7901细胞中, miR-29家族(miR-29a/b/c)均可通过与Mcl-1 3'UTR靶位点的结合对其蛋白表达水平进行负性调控.
总之, 我们的研究初步表明, miR-29表达下调是人胃癌细胞多药耐药发生的机制之一, 其可能与负性调控抗凋亡蛋白Mcl-1表达有关. 本研究结果进一步显示miR-29在肿瘤发生发展中发挥抑癌基因作用, 对未来以miR-29为靶点行肿瘤预防及治疗提供了理论依据.
miR-29家族(miR-29a、miR-29b及miR-29c)是一簇重要的具有抑癌功能的miRNA分子, 其可通过多个信号通路参与肿瘤细胞恶性生物学行为的调控.
多药耐药是目前影响肿瘤化疗疗效最为重要的原因. miRNA分子已被证实广泛参与肿瘤细胞多药耐药的发生.
多个课题组的研究证实, miR-29参与胃癌细胞恶性生物学行为如侵袭转移等的调控.
本研究首次证实miR-29可通过负性调控抗凋亡蛋白髓细胞白血病因子-1表达参与胃癌细胞多药耐药的发生.
本文结果进一步显示miR-29在肿瘤发生发展中发挥抑癌基因作用, 对未来以miR-29为靶点行肿瘤预防及治疗提供了理论依据.
高泽立, 副教授, 周浦医院消化科, 上海交通大学医学院九院周浦分院; 肖恩华, 教授, 中南大学湘雅二医院放射教研室
本文系统研究了miR-29在人胃癌多药耐药发生中的作用, 并初步探讨其可能机制, 实验设计合理, 文章组织严谨, 数据充分, 其结果为以miR-29为靶点抑制胃癌多药耐药发生提供了实验基础.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Tarazona N, Gambardella V, Huerta M, Roselló S, Cervantes A. Personalised Treatment in Gastric Cancer: Myth or Reality? Curr Oncol Rep. 2016;18:41. [PubMed] [DOI] |
| 2. | Coccolini F, Montori G, Ceresoli M, Cima S, Valli MC, Nita GE, Heyer A, Catena F, Ansaloni L. Advanced gastric cancer: What we know and what we still have to learn. World J Gastroenterol. 2016;22:1139-1159. [PubMed] [DOI] |
| 3. | Tomasello G, Ghidini M, Liguigli W, Ratti M, Toppo L, Passalacqua R. Targeted therapies in gastric cancer treatment: where we are and where we are going. Invest New Drugs. 2016;34:378-393. [PubMed] [DOI] |
| 4. | Kong YW, Ferland-McCollough D, Jackson TJ, Bushell M. microRNAs in cancer management. Lancet Oncol. 2012;13:e249-e258. [PubMed] [DOI] |
| 5. | Fernandes JV, Cobucci RN, Jatobá CA, Fernandes TA, de Azevedo JW, de Araújo JM. The role of the mediators of inflammation in cancer development. Pathol Oncol Res. 2015;21:527-534. [PubMed] [DOI] |
| 6. | Ślusarz A, Pulakat L. The two faces of miR-29. J Cardiovasc Med (Hagerstown). 2015;16:480-490. [PubMed] [DOI] |
| 7. | Wang D, Fan Z, Liu F, Zuo J. Hsa-miR-21 and Hsa-miR-29 in Tissue as Potential Diagnostic and Prognostic Biomarkers for Gastric Cancer. Cell Physiol Biochem. 2015;37:1454-1462. [PubMed] [DOI] |
| 8. | Gong J, Li J, Wang Y, Liu C, Jia H, Jiang C, Wang Y, Luo M, Zhao H, Dong L. Characterization of microRNA-29 family expression and investigation of their mechanistic roles in gastric cancer. Carcinogenesis. 2014;35:497-506. [PubMed] [DOI] |
| 10. | 王 思萌, 高 柳村, 帖 君, 卢 瑗瑗, 潘 妍, 雷 少妮, 刘 娜, 吴 开春, 王 新. Cetuximab抑制胃癌SGC7901/ADR细胞的增殖并增加其化疗敏感性. 现代生物医学进展. 2013;13:2253-2257. |
| 11. | Xiong Y, Fang JH, Yun JP, Yang J, Zhang Y, Jia WH, Zhuang SM. Effects of microRNA-29 on apoptosis, tumorigenicity, and prognosis of hepatocellular carcinoma. Hepatology. 2010;51:836-845. [PubMed] [DOI] |
| 14. | Shi WJ, Gao JB. Molecular mechanisms of chemoresistance in gastric cancer. World J Gastrointest Oncol. 2016;8:673-681. [PubMed] [DOI] |
| 16. | Kachalaki S, Ebrahimi M, Mohamed Khosroshahi L, Mohammadinejad S, Baradaran B. Cancer chemoresistance; biochemical and molecular aspects: a brief overview. Eur J Pharm Sci. 2016;89:20-30. [PubMed] [DOI] |
| 18. | Lazăr DC, Tăban S, Cornianu M, Faur A, Goldiş A. New advances in targeted gastric cancer treatment. World J Gastroenterol. 2016;22:6776-6799. [PubMed] [DOI] |
| 19. | Yoo C, Park YS. Companion diagnostics for the targeted therapy of gastric cancer. World J Gastroenterol. 2015;21:10948-10955. [PubMed] [DOI] |
| 23. | Wang Y, Liu C, Luo M, Zhang Z, Gong J, Li J, You L, Dong L, Su R, Lin H. Chemotherapy-Induced miRNA-29c/Catenin-δ Signaling Suppresses Metastasis in Gastric Cancer. Cancer Res. 2015;75:1332-1344. [PubMed] [DOI] |
| 24. | Perciavalle RM, Opferman JT. Delving deeper: MCL-1's contributions to normal and cancer biology. Trends Cell Biol. 2013;23:22-29. [PubMed] [DOI] |
| 25. | Belmar J, Fesik SW. Small molecule Mcl-1 inhibitors for the treatment of cancer. Pharmacol Ther. 2015;145:76-84. [PubMed] [DOI] |
| 26. | Mott JL, Kobayashi S, Bronk SF, Gores GJ. mir-29 regulates Mcl-1 protein expression and apoptosis. Oncogene. 2007;26:6133-6140. [PubMed] [DOI] |
| 27. | Garzon R, Heaphy CE, Havelange V, Fabbri M, Volinia S, Tsao T, Zanesi N, Kornblau SM, Marcucci G, Calin GA. MicroRNA 29b functions in acute myeloid leukemia. Blood. 2009;114:5331-5341. [PubMed] [DOI] |
| 28. | Xu L, Xu Y, Jing Z, Wang X, Zha X, Zeng C, Chen S, Yang L, Luo G, Li B. Altered expression pattern of miR-29a, miR-29b and the target genes in myeloid leukemia. Exp Hematol Oncol. 2014;3:17. [PubMed] [DOI] |
| 29. | Arnold N, Koppula PR, Gul R, Luck C, Pulakat L. Regulation of cardiac expression of the diabetic marker microRNA miR-29. PLoS One. 2014;9:e103284. [PubMed] [DOI] |
| 30. | Meunier L, Siddeek B, Vega A, Lakhdari N, Inoubli L, Bellon RP, Lemaire G, Mauduit C, Benahmed M. Perinatal programming of adult rat germ cell death after exposure to xenoestrogens: role of microRNA miR-29 family in the down-regulation of DNA methyltransferases and Mcl-1. Endocrinology. 2012;153:1936-1947. [PubMed] [DOI] |