修回日期: 2016-10-18
接受日期: 2016-10-24
在线出版日期: 2016-12-18
分析结直肠癌组织中BRG1表达与结直肠癌临床病理特征及预后的关系, 并初步探讨其机制.
应用组织芯片及免疫组织化学方法检测112例结直肠癌组织和71例正常肠黏膜组织中BRG1及基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)蛋白的表达, 统计学分析BRG1表达与临床病理特征及患者预后的关系, 并分析其与MMP-2表达的相关性.
(1)BRG1和MMP-2在结直肠癌组织中的阳性率分别为66.1%和61.2%, 较正常肠黏膜组织35.2%和3.3%明显增高(P<0.01); (2)结直肠癌组织中BRG1高表达与结直肠癌患者临床病理特征包括患者性别、年龄、肿瘤大小、浸润深度、分化程度、淋巴结转移及临床分期之间均没有显著意义, 但与患者5年总体生存率呈明显负相关, BRG1表达越高, 患者预后越差; (3)结直肠癌组织中BRG1的表达与MMP-2呈正相关(r = 0.307, P<0.05).
BRG1在结直肠癌组织中表达增高, 可能成为结直肠癌患者的独立预后因子, 原因可能与促进MMP-2异常表达有关.
核心提要: BRG1在结直肠癌组织中表达增高, 虽与患者临床病理特征无显著关系, 但与患者预后却关系密切, BRG1表达越高, 患者预后越差, 相应基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)表达越高. 因此推论BRG1可能成为结直肠癌患者的独立预后因子, 原因可能与促进MMP-2异常表达有关.
引文著录: 孙晋敏, 郭存存, 王超群, 曹楷, 刘慧, 韩文灿, 郑茂金. BRG1在结直肠癌中的表达与预后和MMP-2的关系. 世界华人消化杂志 2016; 24(35): 4691-4699
Revised: October 18, 2016
Accepted: October 24, 2016
Published online: December 18, 2016
To analyze the relationship of the expression of BRG1 with clinicopathologic characters and prognosis of colorectal cancer.
Tissue microarray and immunohistochemical method were used to detect the expression of BRG1 in 112 cases of colorectal cancer and 71 cases of matched normal intestinal mucosa tissue. The relationship of BRG1 expression with clinicopathologic characters, prognosis, and matrix metalloproteinase-2 (MMP-2) expression was statistically analyzed.
The positive expression rate of BRG1 in colorectal cancer was significantly higher than that in normal intestine mucosa tissue (66.1% vs 35.2%, P < 0.01). The positive expression rate of MMP-2 was also significantly higher in colorectal cancer than in normal intestine mucosa tissue (61.2% vs 3.3%, P < 0.01). The expression of BRG1 showed no significant correlation with clinicopathologic characters including gender, age, tumor size, invasive depth, differentiation degree, lymph node metastasis, and clinical stage, but was significantly correlated with 5-year survival rate of colorectal cancer patients. The prognosis of colorectal cancer patients with high BRG1 expression was much worse than that of patients with low BRG1 expression. There was a positive correlation between BRG1 and MMP-2 expression (r = 0.307, P < 0.05).
BRG1 is highly expressed in colorectal cancer tissue. BRG1 is an independent prognostic factor in colorectal cancer. Increased expression of MMP-2 may be a probable reason of worse prognosis of colorectal cancer.
- Citation: Sun JM, Guo CC, Wang CQ, Cao K, Liu H, Han WC, Zheng MJ. Expression of BRG1 in colorectal cancer: Correlation with prognosis and MMP-2 expression. Shijie Huaren Xiaohua Zazhi 2016; 24(35): 4691-4699
- URL: https://www.wjgnet.com/1009-3079/full/v24/i35/4691.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i35.4691
结直肠癌是消化道的一种常见恶性肿瘤, 统计发现结直肠癌不仅在中老年人中发病率升高, 在青少年中的发病率也在逐渐上升[1]. 结直肠癌的发生、发展是一个长期多因素、多阶段参与的复杂过程, 其病因及发病机制的研究尚未完全明了. 基因的异常表达是细胞恶性转化、侵袭与转移的主要特征. 近年来多种基因及信号通路被证明与结直肠癌的发生发展有关, 比如WNT[2]、转化生长因子-β[3]等. 结直肠癌的发生发展主要涉及两种基因不稳定机制, 即染色体不稳定性和微卫星不稳定现象, 这其中又涉及多种潜在的分子改变[4].
染色体重构活性的平衡对细胞生长过程中对周围环境因子的反应非常重要, 可以防止正常细胞的恶性转化[5]. SWI/SNF染色体重构复合物利用ATP水解能量作用于表观遗传调节, 重构染色体和调节靶基因的转录, 从而控制包括DNA修复等很多细胞过程[6,7]. SWI/SNF染色体重构复合物是一个多亚基复合物, SWI/SNF复合物首先在酵母中发现, 在真核细胞中高度保守, 包含两个相关ATP酶BRG1或BRM其中之一和9-12个相关因子(BAFs)[8]. 尽管这些亚基可以相互转变, 然而BRG1和BRM的功能目前还尚不清楚.
BRG1、BRM和SWI/SNF复合物中的其他组成成分已经证明与肿瘤的发生发展有关[9-11]. BRG1或BRM在众多肿瘤及人类癌细胞系中表达下调, 这些发现表明SWI/SNF 复合物发挥着肿瘤抑制因子的作用[12,13]. 然而BRG1杂合子鼠更容易发生肿瘤, BRG1和BRM表达下调或缺失, 非小细胞肺癌的患者预后更差[14]. 同时发现在胃癌[15]、前列腺癌[16]、黑色素瘤[17]和胶质瘤[18]中BRG1表达增加, 并与肿瘤的侵袭有关. 敲除BRG1可以导致CyclinD1表达下调, 从而抑制肿瘤细胞的增殖能力[18,19]. 然而, BRG1可以与组氨酸乙酰基转移酶结合限制P53活性, 促进癌细胞增殖[20]. 所以在不同组织当中, BRG1的作用可能不尽一致, 同时, BRG1在结直肠癌中的作用目前还不是特别清楚. 因此我们利用临床病理标本探究BRG1在结直肠癌中的作用, 与患者临床病理特征的关系以及与患者预后的关系, 并初步探讨可能的作用机制, 为结直肠癌患者预后评估及临床治疗提供实验依据.
收集徐州医科大学附属医院2008-2011年经手术切除的结直肠癌组织存档蜡112例和相应正常肠黏膜组织(距肿瘤组织5 cm以上)存档蜡块71例, 所有病例的临床和病理资料完整. 其中男62例, 女50例. 年龄22-89岁, 中位年龄50岁. 根据美国肿瘤联合会临床分期: Ⅰ-Ⅱ期59例, Ⅲ-Ⅳ期53例. 所有患者术前均未行放疗、化疗以及其他针对肿瘤的特殊治疗, 术后病理检查均经两位病理医师诊断.
1.2.1 组织芯片的制备: 复查HE染色切片, 对代表性组织位点进行标记, 每个病例的癌组织和相应正常组织各选3个位点, 所使用组织芯片制备仪为Alphelys公司产品MINICORE, 取样针直径1.0 mm, 组织芯间距2.0 mm, 设计10×7点组织列阵, 含70个位点, 共制备组织芯片蜡块7个. 组织阵列块在52 ℃恒温烤箱中加热融合, 4 ℃冰箱存放备用.
1.2.2 免疫组织化学检测: 兔抗人BRG1多克隆抗体、兔抗人基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)多克隆抗体均购自Proteintech公司, DAB显色试剂盒以及其他试剂均购于北京中杉金桥公司. 采用免疫组织化学方法, 每批均设已知阳性切片做阳性对照, PBS代替一抗做阴性对照.
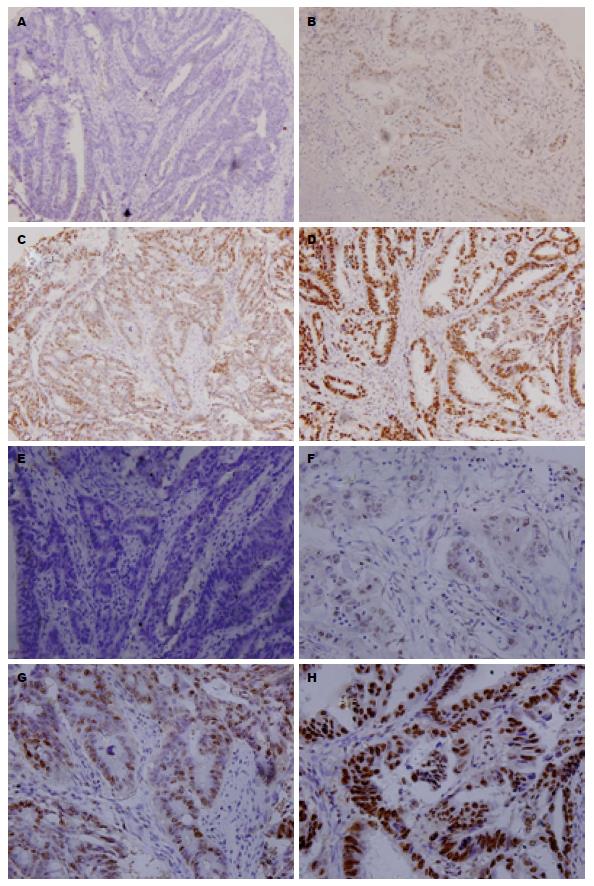
1.2.3 结果判定: 本实验中所有免疫组织化学染色结果均用双盲法阅片, 选取多个视野, 由两位病理医师分别作出判断. BRG1蛋白免疫组织化学以细胞核呈现棕黄色颗粒为阳性, MMP-2以胞浆呈现棕黄色颗粒为阳性. BRG1与MMP-2阳性细胞数百分比分为4个级别, (1)阳性细胞百分比计分: 0%-25%为1分; 26%-50%为2分; 51%-75%计为3分; 76%-100%计为4分; (2)着色强弱也分为4个级别: 无为0分; 弱(淡黄色)为1分; 中(棕黄色)为2分; 强(棕褐色)为3分. 以(1)和(2)的乘积评分, 0分为阴性, 1-4分为弱阳性, 6-8分为中等强度阳性, 9-12分为强阳性. 预后分析中≤4分者为低表达(含阴性和弱阳性), >4分者为高表达(含中等强度阳性及强阳性).
统计学处理 应用SPSS16.0统计软件进行数据分析, 组间比较采用χ2检验. 患者预后分析采用Kaplan-Meier检验. 危险因素分析采用Cox比例风险回归模型及多因素(变量)COX回归模型分析. 相关性分析采用Spearman等级相关性检验.
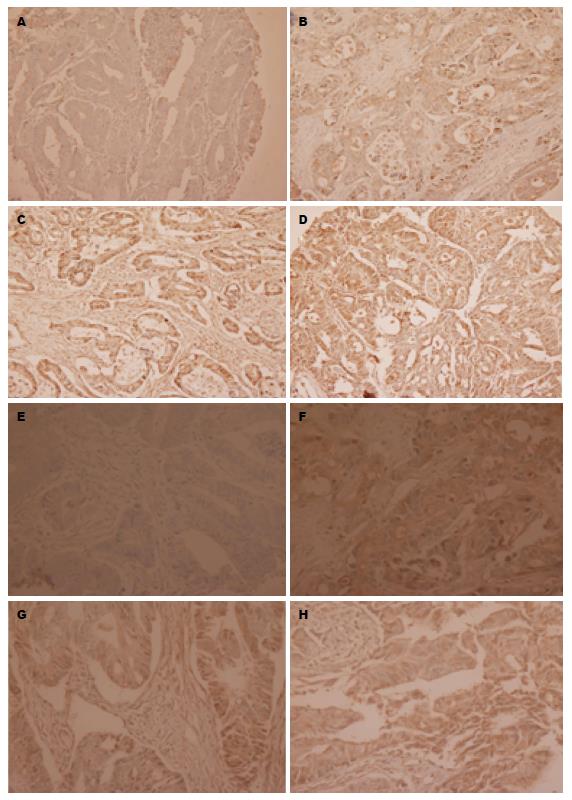
BRG1蛋白阳性产物为棕黄色颗粒, 定位于细胞核(图1), MMP-2定位于细胞浆. BRG1在结直肠癌组织和正常肠黏膜组织中的阳性表达率分别为66.1%和35.2%, MMP-2在结直肠癌组织和正常肠黏膜组织中的阳性表达率分别为61.2%和3.3%(图2). 结直肠癌组BRG1与MMP-2的阳性表达率明显高于正常肠黏膜组(P<0.01, 表1).
| 分组 | n | BRG1 | n | MMP-2 | ||||
| 高表达(%) | χ2 | P值 | 高表达(%) | χ2 | P值 | |||
| 癌组织 | 112 | 74(66.1) | 16.665 | 0.000 | 85 | 52(61.2) | 5.03E1 | 0.000 |
| 正常组织 | 71 | 25(35.2) | 60 | 2(3.3) | ||||
利用112例结直肠癌组织芯片, 免疫组织化学方法检测BRG1在结直肠癌组织中的表达, 分析BRG1表达与患者临床病理特征的关系, 结果发现BRG1与患者的性别、年龄、肿瘤大小、分化程度、浸润深度、临床分期及淋巴结转移均无明显相关性(表2).
| 临床病理特征 | n | BRG1 | ||
| 高表达(%) | P值 | χ2 | ||
| 性别 | 0.678 | 0.173 | ||
| 男 | 62 | 42(67.7) | ||
| 女 | 50 | 32(64.0) | ||
| 年龄 | 0.786 | 0.073 | ||
| <56岁 | 54 | 35(64.8) | ||
| ≥56岁 | 58 | 39(67.2) | ||
| TNM分期 | 0.313 | 1.019 | ||
| Ⅰ-Ⅱ期 | 59 | 37(62.7) | ||
| Ⅲ-Ⅳ期 | 53 | 38(71.7) | ||
| 浸润深度 | 0.830 | 0.046 | ||
| 未浸润浆膜 | 31 | 20(64.5) | ||
| 浸润浆膜 | 81 | 54(66.7) | ||
| 分化程度 | 0.713 | 0.135 | ||
| 高中分化 | 99 | 66(66.7) | ||
| 低分化 | 13 | 8(61.5) | ||
| 肿块大小 | 0.383 | 0.760 | ||
| ≤5 cm | 56 | 36(63.2) | ||
| >5 cm | 56 | 39(70.9) | ||
| 淋巴结转移 | 0.234 | 1.416 | ||
| 有 | 50 | 36(72.0) | ||
| 无 | 62 | 38(61.3) | ||
结直肠癌组织中BRG1与MMP-2蛋白表达均为高表达的有38例, 均为低表达的19例. Spearman等级相关性检验显示结直肠癌组织中BRG1的表达与MMP-2的表达呈正相关(r = 0.307, P<0.05, 表3).
| BRG1 | MMP-2 | r | P值 | |
| 高表达 | 低表达 | |||
| 高表达 | 38 | 14 | 0.307 | 0.004 |
| 低表达 | 14 | 19 | ||
| 合计 | 52 | 33 | ||
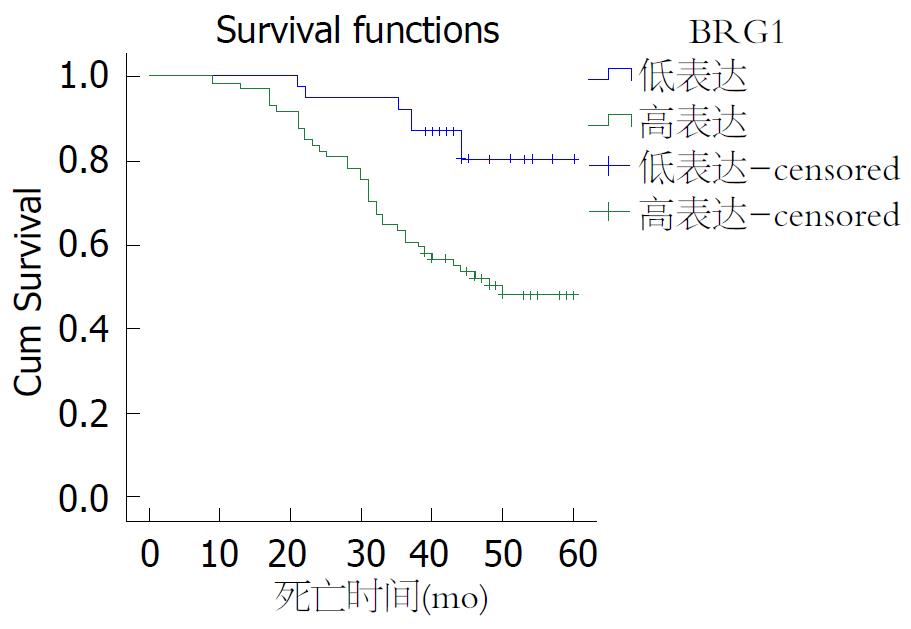
免疫组织化学结果被分成阴性、弱阳性、中等强度阳性及强阳性, BRG1蛋白表达量被划分成低表达(阴性和弱阳性), 所占比例为33.9%, 高表达(中等强度阳性和强阳性), 所占比例为66.1%, Kaplan-Meier检测分析揭示BRG1表达增加, 结直肠癌患者5年总体生存率明显下降(图3). 然而BRG1的表达与临床病理参数包括患者的年龄、性别、肿瘤大小、淋巴结转移、临床分期、组织学级别、组织学类型没有明显的相关性. 利用多变量COX回归模型统计分析找出关键有意义因子, 生存状态变量赋值为: 0 = "删失或生存", 1 = "死亡". Cox比例风险回归模型分析显示, 肿瘤的分期、大小、有无淋巴结转移及BRG1的表达与患者预后相关(P<0.05, 表4). 为进一步评价BRG1的预后价值, 利用Cox多因素分析显示, 肿瘤的分期、大小、有无淋巴结转移和BRG1蛋白的表达与患者预后明显相关(P<0.05, 表5), BRG1对结直肠癌患者5年总体生存率是一个独立的预后因子.
| 变量 | 回归系数b | 标准误Sb | Wald值 | P值 | HR | 95%CI |
| BRG1 | 1.176 | 0.415 | 8.046 | 0.005 | 3.241 | 1.438-7.304 |
| 性别 | -0.063 | 0.320 | 0.038 | 0.873 | 0.939 | 0.502-1.757 |
| 年龄 | 0.568 | 0.317 | 3.216 | 0.073 | 1.764 | 0.949-3.281 |
| TNM分期 | 2.871 | 0.733 | 15.345 | 0.000 | 17.648 | 4.197-74.209 |
| 浸润深度 | -0.197 | 0.523 | 0.143 | 0.706 | 0.821 | 0.295-2.286 |
| 分化 | 0.588 | 0.390 | 2.282 | 0.131 | 1.801 | 0.839-3.864 |
| 大小 | 0.872 | 0.353 | 6.116 | 0.013 | 2.392 | 1.198-4.775 |
| 淋巴结转移 | -1.606 | 0.648 | 6.136 | 0.013 | 0.201 | 0.056-0.715 |
| 变量 | 回归系数b | 标准误Sb | Wald值 | 自由度 | P值 | HR | 95%CI |
| 淋巴结转移 | -1.633 | 0.638 | 6.560 | 1 | 0.010 | 0.195 | 0.056-0.682 |
| TNM分期 | 2.832 | 0.675 | 17.605 | 1 | 0.000 | 16.987 | 4.524-63.788 |
| 大小 | 0.793 | 0.328 | 5.839 | 1 | 0.016 | 2.209 | 1.161-4.201 |
| BRG1 | 1.172 | 0.414 | 8.027 | 1 | 0.005 | 3.230 | 1.435-7.268 |
在真核细胞内, DNA被盘绕压缩成染色体. 染色体重塑复合物使DNA更加容易靠近转录因子, 从而参与基因的表达. SWI/SNF复合物介导了ATP依赖的染色体重塑过程, 对转录调节起到非常重要的作用[6,7]. 越来越多的证据表明在肿瘤的发生发展过程中伴有SWI/SNF复合物成员的失活, 包括BRG1, BRM, SNF5, BAF155和BAF57等, 尤其是BRG1与BRM. 15%-20%的原发性非小细胞肺癌伴有BRG1和BRM的丢失[14]. 在胰腺导管内乳头状黏液性肿瘤BRG1的表达缺失也非常普遍[21]. 而同时研究显示在胃癌[15]、前列腺癌[16]、乳腺癌[22]、黑色素瘤[17]和胶质瘤[18]中表达却增高. 所以, 到目前为止, 很难下结论BRG1是肿瘤抑制因子还是原癌基因.
多项研究证明BRG1是一个肿瘤抑制因子, 在多种肿瘤组织及肿瘤细胞系中表达失活. 他与细胞增殖调节蛋白相互作用抑制细胞增殖, 如RB和他的家族成员LKB1和HIC1, 下调E2F的靶基因如cyclinE和上调cyclin依赖激酶抑制因子如P21, P15和P16[23]. 除此之外, BRG1还可直接与BRCA1肿瘤抑制因子相互作用, 刺激P53蛋白的转录活性[20], 从而抑制肿瘤的生长、增殖.
与上述结论相反, 我们提供了实验证据, BRG1在结直肠癌组织中的表达明显高于正常组织, 与患者的临床病理特征均没有明确关系. 我们的结果与2011年Watanabe等[19]在结直肠癌及2013年Bai等[22]在乳腺癌中的研究是一致的. Shanahan等[23]在结直肠癌细胞系DLD-1中敲除BRG1, 结果发现BRG1通过抑制PTEN的表达从而抑制了PI3K-Akt信号通路, 导致cyclin D1的表达下调. 所以在结直肠癌中BRG1和cyclin D1表达的相关性表明BRG1可能通过激活PI3K-Akt信号通路从而促进了肿瘤的发展. 2010年, Keenen等[24]发现BRG1与一种原癌蛋白小眼畸形转录因子促进黑色素瘤细胞的生长. BRG1与组蛋白乙酰转移酶CREB结合蛋白相互作用从而抑制P53的活性, 促进癌细胞增殖[20]. 以上发现表明BRG1在不同细胞和/或不同组织肿瘤发病机制中具有不同的生物学意义.
我们发现BRG1表达越高, 结直肠癌患者预后越差. 这一结果可能与BRG1促进肿瘤细胞的侵袭、促进淋巴道转移或诱导上皮间质转化有密切关系. 肿瘤细胞的侵袭需要细胞外基质的破坏, 而MMP是一组蛋白水解酶, 在结直肠癌的发生发展中发挥了非常重要的作用[25-27], 尤其是在侵袭和转移过程中. MMP-2的表达与结直肠癌的组织学级别和临床分期明显相关[28]. MMP活性被特异的内源性组织基质金属蛋白酶抑制因子(tissue inhibitors of metalloproteinases, TIMPs)所控制. TIMP-2是MMP-2的一个主要的负性调节因子, 并在很多肿瘤的转移过程中发挥重要作用. 研究[22]显示在BRG1敲除的乳腺癌细胞系中MMP-2的活性明显下降, 相应的TIMP-2的表达上调. MMP2, MMP7和MMP9启动子多态性对肿瘤的发生发展具有非常重要的意义[29]. Saladi等[30]在黑色素瘤中发现, BRG1富集于MMP-2的启动子直接激活该转移相关基因. 因此我们也初步探讨和分析了结直肠癌组织中BRG1与MMP-2的关系, 二者表达呈明显正相关, 在一定程度上说明BRG1调控结直肠癌的侵袭与转移可能与MMP-2有关, 与以往的研究一致.
2016年Zhu等[31]发现BRG1通过STAT/VEGFC信号通路调控结直肠癌中淋巴管的生成促进结直肠癌的转移. 但他们研究结果与在乳腺癌中的研究结果及我们的研究结果是相反的. 他们发现在BRG1低表达的结直肠癌中淋巴管的生成更加丰富. 淋巴管生成越多, 结直肠癌则更容易发生转移, BRG1在结直肠癌中表达越高, 淋巴管的生成越少, BRG1的表达量与淋巴管的生成呈负相关. 2010年Sánchez-Tilló等[32]发现转录因子ZEB1和BRG1相互作用可调节E-cadherin的表达, BRG1结合在E-cadherin的启动子通过ZEB1依赖的一个机制成为E-cadherin表达的一个共抑制因子. 在乳腺癌及结直肠癌等细胞系中阻断ZEB1与BRG1的相互作用, 可诱导E-cadherin的表达量增加, 并下调间质标志物vimentin, 从而抑制肿瘤转移. 在肿瘤侵袭转移的起始阶段, ZEB1/BRG1通过调节E-cadherin表达和上皮间质转化促进了肿瘤的侵袭. BRG1表达增加, E-cadherin表达下降, 促进上皮间质转化, 从而促进肿瘤转移.
总之, 我们的研究进一步明确了BRG1在结直肠癌中的作用及与预后的关系. BRG1在结直肠癌中表达上调, 并与患者的预后明显负相关, 也初步明确其作用机制可能与促进MMP-2表达有关. 随着个体化治疗概念的提出, 分子靶向治疗越来越广泛地应用于临床[33,34], 已使部分结直肠癌患者明显获益. 我们的研究为结直肠癌的预后评估及分子靶向治疗进一步提供了实验依据和理论基础.
BRG1作为染色体重构复合物中的重要组成成分, 对基因表观遗传起到非常重要的调节作用. 结直肠癌的治疗主要以手术为主, 放化疗为辅, 患者的预后虽较前有明显改善, 但仍不是非常理想. 研究筛选有助于分析结直肠癌生物学行为的指标, 有效预测结直肠癌患者的预后, 并制定个体化治疗方案是临床的迫切需要.
目前BRG1在肿瘤发生发展中作用的研究结果不尽一致. 对BRG1是致癌因子还是抑癌因子尚无定论. 在结直肠癌中BRG1促进肿瘤发生发展的机制还不是非常清楚, 已从结直肠癌淋巴血管生成及WNT信号途径等多个方面展开研究, 成为目前结直肠癌的研究热点之一.
BRG1在不同细胞和/或不同组织肿瘤发病机制中具有不同的生物学意义. 在胰腺癌、非小细胞肺癌BRG1的表达缺失非常普遍, 而在胃癌、前列腺癌、乳腺癌、黑色素瘤和胶质瘤中表达增高, 与患者的预后相关性也各不相同. BRG1可能通过激活PI3K-Akt信号通路、抑制P53活性或激活基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)表达等多种方式促进了肿瘤的发展.
BRG1对基因表观遗传起到非常重要的调节作用. BRG1对结直肠癌患者预后的影响尚无人探究. 并初步探讨其可能的作用机制, 为结直肠癌患者预后评估及临床治疗提供实验依据和理论基础.
通过临床病理标本分析BRG1的表达, 并评估其与预后的关系, 可能成为结直肠癌患者的独立预后因子. 有助于筛选分析结直肠癌生物学行为的指标, 并为其提供实验依据和理论基础, 有效预测结直肠癌患者的预后, 并制定个体化治疗方案.
染色质重塑是基因表达的复制和重组等过程中, 染色质的包装状态、核小体中组蛋白以及对应DNA分子会发生改变的过程. 重塑复合物的作用非常重要. SWI/SNF复合物的组成成分BRG1、BRM具有ATP酶活性. 表观遗传是指DNA序列不发生变化, 但基因表达却发生了可遗传的改变. 这种改变是细胞内除了遗传信息以外的其他可遗传物质发生的改变, 且这种改变在发育和细胞增殖过程中能稳定传递.
丁健华, 主任医师, 第二炮兵总医院结直肠肛门外科/全军肛肠专病中心; 孟繁杰, 教授, 主任医师, 上海中医药大学附属第七人民医院普外一科; 许洪卫, 主任医师, 大连大学附属新华医院胃肠微创外科中心, 大连大学消化病研究所
该文探讨了结直肠癌组织中BRG1和MMP-2两指标的表达与其临床病理特征和预后的关系. 设计合理, 文笔流畅, 统计学应用合理, 具有一定的创新性和临床意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Deen KI, Silva H, Deen R, Chandrasinghe PC. Colorectal cancer in the young, many questions, few answers. World J Gastrointest Oncol. 2016;8:481-488. [PubMed] [DOI] |
| 2. | Reed KR, Song F, Young MA, Hassan N, Antoine DJ, Gemici NB, Clarke AR, Jenkins JR. Secreted HMGB1 from Wnt activated intestinal cells is required to maintain a crypt progenitor phenotype. Oncotarget 2016;. 2016; Jun 15. [Epub ahead of print]. [PubMed] [DOI] |
| 3. | Fessler E, Drost J, van Hooff SR, Linnekamp JF, Wang X, Jansen M, De Sousa E Melo F, Prasetyanti PR, IJspeert JE, Franitza M. TGFβ signaling directs serrated adenomas to the mesenchymal colorectal cancer subtype. EMBO Mol Med. 2016;8:745-760. [PubMed] [DOI] |
| 4. | Müller MF, Ibrahim AE, Arends MJ. Molecular pathological classification of colorectal cancer. Virchows Arch. 2016;469:125-134. [PubMed] [DOI] |
| 5. | Ho L, Crabtree GR. Chromatin remodelling during development. Nature. 2010;463:474-484. [PubMed] [DOI] |
| 6. | Wu JI. Diverse functions of ATP-dependent chromatin remodeling complexes in development and cancer. Acta Biochim Biophys Sin (Shanghai). 2012;44:54-69. [PubMed] [DOI] |
| 7. | Dinant C, Houtsmuller AB, Vermeulen W. Chromatin structure and DNA damage repair. Epigenetics Chromatin. 2008;1:9. [PubMed] [DOI] |
| 8. | Wang W, Xue Y, Zhou S, Kuo A, Cairns BR, Crabtree GR. Diversity and specialization of mammalian SWI/SNF complexes. Genes Dev. 1996;10:2117-2130. [PubMed] |
| 9. | Bultman S, Gebuhr T, Yee D, La Mantia C, Nicholson J, Gilliam A, Randazzo F, Metzger D, Chambon P, Crabtree G. A Brg1 null mutation in the mouse reveals functional differences among mammalian SWI/SNF complexes. Mol Cell. 2000;6:1287-1295. [PubMed] |
| 10. | Reisman D, Glaros S, Thompson EA. The SWI/SNF complex and cancer. Oncogene. 2009;28:1653-1668. [PubMed] [DOI] |
| 11. | Wong AK, Shanahan F, Chen Y, Lian L, Ha P, Hendricks K, Ghaffari S, Iliev D, Penn B, Woodland AM. BRG1, a component of the SWI-SNF complex, is mutated in multiple human tumor cell lines. Cancer Res. 2000;60:6171-6177. [PubMed] |
| 12. | Bock VL, Lyons JG, Huang XX, Jones AM, McDonald LA, Scolyer RA, Moloney FJ, Barnetson RS, Halliday GM. BRM and BRG1 subunits of the SWI/SNF chromatin remodelling complex are downregulated upon progression of benign skin lesions into invasive tumours. Br J Dermatol. 2011;164:1221-1227. [PubMed] [DOI] |
| 13. | Serber DW, Rogala A, Makarem M, Rosson GB, Simin K, Godfrey V, Van Dyke T, Eaves CJ, Bultman SJ. The BRG1 chromatin remodeler protects against ovarian cysts, uterine tumors, and mammary tumors in a lineage-specific manner. PLoS One. 2012;7:e31346. [PubMed] [DOI] |
| 14. | Fukuoka J, Fujii T, Shih JH, Dracheva T, Meerzaman D, Player A, Hong K, Settnek S, Gupta A, Buetow K. Chromatin remodeling factors and BRM/BRG1 expression as prognostic indicators in non-small cell lung cancer. Clin Cancer Res. 2004;10:4314-4324. [PubMed] [DOI] |
| 15. | Sentani K, Oue N, Kondo H, Kuraoka K, Motoshita J, Ito R, Yokozaki H, Yasui W. Increased expression but not genetic alteration of BRG1, a component of the SWI/SNF complex, is associated with the advanced stage of human gastric carcinomas. Pathobiology. 2001;69:315-320. [PubMed] [DOI] |
| 16. | Sun A, Tawfik O, Gayed B, Thrasher JB, Hoestje S, Li C, Li B. Aberrant expression of SWI/SNF catalytic subunits BRG1/BRM is associated with tumor development and increased invasiveness in prostate cancers. Prostate. 2007;67:203-213. [PubMed] [DOI] |
| 17. | Lin H, Wong RP, Martinka M, Li G. BRG1 expression is increased in human cutaneous melanoma. Br J Dermatol. 2010;163:502-510. [PubMed] [DOI] |
| 18. | Bai J, Mei PJ, Liu H, Li C, Li W, Wu YP, Yu ZQ, Zheng JN. BRG1 expression is increased in human glioma and controls glioma cell proliferation, migration and invasion in vitro. J Cancer Res Clin Oncol. 2012;138:991-998. [PubMed] [DOI] |
| 19. | Watanabe T, Semba S, Yokozaki H. Regulation of PTEN expression by the SWI/SNF chromatin-remodelling protein BRG1 in human colorectal carcinoma cells. Br J Cancer. 2011;104:146-154. [PubMed] [DOI] |
| 20. | Naidu SR, Love IM, Imbalzano AN, Grossman SR, Androphy EJ. The SWI/SNF chromatin remodeling subunit BRG1 is a critical regulator of p53 necessary for proliferation of malignant cells. Oncogene. 2009;28:2492-2501. [PubMed] [DOI] |
| 21. | Dal Molin M, Hong SM, Hebbar S, Sharma R, Scrimieri F, de Wilde RF, Mayo SC, Goggins M, Wolfgang CL, Schulick RD. Loss of expression of the SWI/SNF chromatin remodeling subunit BRG1/SMARCA4 is frequently observed in intraductal papillary mucinous neoplasms of the pancreas. Hum Pathol. 2012;43:585-591. [PubMed] [DOI] |
| 22. | Bai J, Mei P, Zhang C, Chen F, Li C, Pan Z, Liu H, Zheng J. BRG1 is a prognostic marker and potential therapeutic target in human breast cancer. PLoS One. 2013;8:e59772. [PubMed] [DOI] |
| 23. | Shanahan F, Seghezzi W, Parry D, Mahony D, Lees E. Cyclin E associates with BAF155 and BRG1, components of the mammalian SWI-SNF complex, and alters the ability of BRG1 to induce growth arrest. Mol Cell Biol. 1999;19:1460-1469. [PubMed] |
| 24. | Keenen B, Qi H, Saladi SV, Yeung M, de la Serna IL. Heterogeneous SWI/SNF chromatin remodeling complexes promote expression of microphthalmia-associated transcription factor target genes in melanoma. Oncogene. 2010;29:81-92. [PubMed] [DOI] |
| 25. | Deryugina EI, Quigley JP. Matrix metalloproteinases and tumor metastasis. Cancer Metastasis Rev. 2006;25:9-34. [PubMed] [DOI] |
| 26. | Banday MZ, Sameer AS, Mir AH, Mokhdomi TA, Chowdri NA, Haq E. Matrix metalloproteinase (MMP) -2, -7 and -9 promoter polymorphisms in colorectal cancer in ethnic Kashmiri population- A case-control study and a mini review. Gene. 2016;589:81-89. [PubMed] [DOI] |
| 28. | Wang W, Qi Y, Xu Q, Ren H. [Expression and clinical significance of kisspeptin-1, matrix metalloproteinase-2 and vascular endothelial growth factor in tissue of colon cancer]. Zhonghua Liuxingbingxue Zazhi. 2016;37:415-417. [PubMed] |
| 29. | Zhou Y, Yu C, Miao X, Tan W, Liang G, Xiong P, Sun T, Lin D. Substantial reduction in risk of breast cancer associated with genetic polymorphisms in the promoters of the matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-2 genes. Carcinogenesis. 2004;25:399-404. [PubMed] [DOI] |
| 30. | Saladi SV, Keenen B, Marathe HG, Qi H, Chin KV, de la Serna IL. Modulation of extracellular matrix/adhesion molecule expression by BRG1 is associated with increased melanoma invasiveness. Mol Cancer. 2010;9:280. [PubMed] [DOI] |
| 31. | Zhu X, Sun L, Lan J, Xu L, Zhang M, Luo X, Gong J, Wang G, Yuan X, Hu J. BRG1 targeting STAT3/VEGFC signaling regulates lymphangiogenesis in colorectal cancer. Oncotarget. 2016;7:36501-36509. [PubMed] [DOI] |