修回日期: 2016-10-11
接受日期: 2016-10-20
在线出版日期: 2016-12-18
对羧肽酶A1(carboxypeptidase A1, CPA1)基因进行突变分析, 探讨中国汉族人群慢性胰腺炎(chronic pancreatitis, CP)的分子发病机制.
收集2014-10/2016-04就诊于四川省人民医院和四川省人民医院崇州分院的CP患者146例作为病例组, 另选取200例健康体检者为对照组. 采用PCR扩增及DNA直接测序法对CPA1基因全部外显子进行测序, 并与CPA1基因的正常序列对比分析.
在CPA1基因第3外显子上, 分别检测出1例c.281A>G杂合错义突变和1例c.370A>G杂合错义突变, 另检测到2例第8外显子c.1074C>T杂合同义突变, 在正常对照中均未检测到上述突变. 同时在第3外显子检测到rs1126899单核苷酸多态性位点, 且该位点基因型在病例组和对照组的分布具有统计学差异(P = 0.040), 病例组rs1126899位点G等位基因携带率高于对照组(74.0% vs 63.0%, χ2 = 4.641, P = 0.031), 病例组rs1126899位点G等位基因的频率分布也高于对照组(49.0% vs 39.2%, χ2 = 6.479, P = 0.011), 在不存在酒精因素的病例组与对照组中, CC型携带者与CG+GG型携带者的分布差异具有统计学意义(OR = 1.779, 95%CI: 1.026-3.087, P = 0.039).
CPA1基因c.281A>G、c.370A>G和c.1074C>T突变可能与中国汉族人群CP的发病有关, CPA1基因rs1126899 C/G多态性与中国汉族人群CP的易感性相关.
核心提要: 本文对146例慢性胰腺炎患者和200例健康对照进行研究, 运用直接测序法筛查到CPA1基因的新突变和有意义的单核苷酸多态性位点, 没有发现国外报道的常见突变, 这可能与地域和种族差异有关.
引文著录: 朱雨田, 姚伍秀, 汪洋, 陈俊冀, 严茂林, 陈和平. 中国汉族人群慢性胰腺炎的CPA1基因突变筛查. 世界华人消化杂志 2016; 24(35): 4677-4683
Revised: October 11, 2016
Accepted: October 20, 2016
Published online: December 18, 2016
To screen the mutations in the carboxypeptidase A1 (CPA1) gene in a Han Chinese population and explore the molecular mechanism behind the pathogenesis of chronic pancreatitis (CP).
A total of 146 CP patients treated at Sichuan Provincial People's Hospital and its Chongzhou Branch between October 2014 and April 2016 were included in a case group in this study. Another 200 healthy subjects were selected as a control group. The sequences of the coding region of the CPA1 gene were analyzed using PCR and DNA sequencing and compared with the normal sequence of the CPA1 gene.
In the exon 3 of the CPA1 gene, c.281A>G heterozygous missense mutation and c.370A>G heterozygous missense mutation were detected in one patient each. c.1074C>T heterozygous synonymous mutation in exon 8 was detected in two patients. The c.281A > G, c.370A>G and c.1074C>T mutations were not detected in normal controls. One single nucleotide polymorphism (SNP; rs1126899) was detected in the exon 3 of the CPA1 gene. The distribution of rs1126899 genotype was statistically significant between the CP group and control group. The percentage of CP patients carrying G allele of rs1126899 polymorphism was significantly higher than that of normal controls (74.0% vs 63.0%, χ2 = 4.641, P = 0.031). The frequency of G allele of rs1126899 was higher in CP patients than in normal controls (49.0% vs 39.2%, χ2 = 6.479, P = 0.011). There were statistically significant differences in the distribution of CC genotype and GG + CG genotype between CP patients and normal controls without alcohol consumption (OR = 1.779, 95%CI: 1.026-3.087, P = 0.039).
Novel mutations, c.281A>G, c.370A>G and c.1074C>T of the CPA1 gene, may contribute to the development of CP. The rs1126899 C/G polymorphism of the CPA1 gene is associated with a higher risk for CP in the Chinese Han population.
- Citation: Zhu YT, Yao WX, Wang Y, Chen JJ, Yan ML, Chen HP. Screening of CPA1 gene mutations in a Chinese Han population with chronic pancreatitis. Shijie Huaren Xiaohua Zazhi 2016; 24(35): 4677-4683
- URL: https://www.wjgnet.com/1009-3079/full/v24/i35/4677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i35.4677
慢性胰腺炎(chronic pancreatitis, CP)是一种进展性且不可逆转的胰腺炎症性疾病. 临床可表现为发作性腹痛、腹泻、消瘦、黄疸和糖尿病等, 胰腺在长期慢性炎症的刺激下, 胰腺癌的患病率会增加[1-4]. CP在人群中的年发病率为0.1‰-0.2‰[5-7], 是一种由环境和遗传共同作用的复杂性疾病, 发病存在种族差异, 病因至今尚未明确[8]. 2013年, Witt等[9]通过对944例非酒精性CP患者和3938例对照全外显子测序发现, 在编码羧肽酶A1(carboxypeptidase A1, CPA1)的基因上发现34种突变. 同时功能研究显示, 50%的CPA1基因突变会导致CPA1活性丧失, 从而影响其分泌、水解和催化的能力, 表明CPA1的基因突变可能会增加CP患病风险. 本研究应用Sanger直接测序技术检测中国汉族CP人群的CPA1基因突变情况, 进一步探讨CPA1基因与CP病理机制的关系.
CP患者(病例组)146例, 来源于2014-10/2016-04在四川省人民医院和四川省人民医院崇州分院收治的CP患者, 其诊断标准参照2014年由中华医学会外科学分会胰腺外科学组制定的《慢性胰腺炎诊治指南》[10], 所有患者均排除肿瘤、高血压、糖尿病等代谢性疾病、自身免疫性疾病等基础疾病. 对照组为同期在四川省人民医院和崇州市人民医院健康体检的人群200例, 有胰腺疾病及其他遗传病者不予纳入(表1). 病例组与对照组均来自无亲缘关系的中国四川地区汉族人群. 本研究经四川省人民医院伦理委员会批准, 全部调查和取样均征得受试者同意并签署知情同意书. 基因组DNA小量抽提试剂盒购自上海生工生物工程技术服务有限公司; MyCycler Thermal Cycler扩增仪购自美国Bio-Rad公司; ABI 3130基因分析仪购自美国ABI公司.
| 分组 | 慢性胰腺炎组 | 正常对照组 |
| n | 146 | 200 |
| 年龄(岁) | 64.92±6.23 | 65.72±6.70 |
| 性别(男/女) | 71/75 | 98/102 |
| 饮酒(%) | 24.7 | 18.5 |
| 吸烟(%) | 27.4 | 16.0 |
1.2.1 基因组DNA样品的制备: 抽取全部受试者的外周静脉血(EDTA抗凝)2 mL, 采用基因组DNA小量抽提试剂盒, 提取静脉血白细胞基因组DNA, 并溶解于TE缓冲液中. NanoDrop 2000检测DNA浓度和纯度后, 将DNA工作液校正至50 ng/μL, 于-20 ℃保存备用.
1.2.2 引物及PCR反应: 从UCSC基因组数据库网站(http://genome.ucsc.edu/index.html)检索CPA1基因序列, 引物设计使用Primer 3.0在线软件, 并委托上海生工公司合成(序列如表1). 10个外显子, 用10对引物进行测序, 扩增反应采用MyCycler Thermal Cycler扩增仪. PCR循环条件: 95 ℃预变性5 min, 退火、延伸35个循环后(退火、延伸温度及时间因外显子不同而不同, 如表2), 72 ℃延伸7 min, 4 ℃保温, 1%琼脂糖电泳, 获得清晰、片段大小正确条带后PCR产物用于后续基因测序及基因分型.
| 外显子 | 正向引物序列(5'→3') | 反向引物序列(3'→5') | 退火温度(℃) | 目的片段(bp) |
| 1 | TGGCTTATCTCTCCAGCTGC | GCTGTGTTGCCATGTATCTGT | 65 | 383 |
| 2 | CCTTGGTGCTGTCCCCTG | AGTCGCTTCCTAACAGAGTCA | 58 | 361 |
| 3 | TCTCTGGCCCTATTACCCCT | GCGTTCTACCAGCCATGATG | 63 | 444 |
| 4 | CGCCTGCTCTGTTTCCATG | GGGAGTCCATTTAACAGCGT | 58 | 362 |
| 5 | ACAAGCAGAGCCTCTACCTG | CCTTTCCCCATGTCCTCTGT | 65 | 354 |
| 6 | AGAGGACATGGGGAAAGGTG | TCACCCCAAATGCCAATCAC | 55 | 366 |
| 7 | CTTGTGTTGAGGGCTTCCAC | ATCCCCAAGAGCCCTCAGA | 58 | 375 |
| 8 | AGTGAGCCCTTCCATACCAC | TACTCTGGAGGTGTCTGTGC | 58 | 410 |
| 9 | GAAGGGCCAGAAAACTGTGC | GCCAGCAGTTGACAGATCTG | 55 | 399 |
| 10 | GACTCCACTCAGCATTGCAC | CAGACACTCCACATGCAAGC | 65 | 416 |
1.2.3 荧光标记Sanger直接测序法: PCR产物经纯化后, 直接进行DNA测序, 经ABI 3130基因分析仪毛细管电泳法检测荧光信号, 通过判读不同的荧光检测结果, 确定外显子序列碱基的变化, DNA浓度为50 ng/μL, 测序引物浓度为1 μmol/μL.
1.2.4 突变位点分析: 根据NCBI blast(http://ncbi.nlm.nih.gov/)在线比对, 将测序结果与CPA1基因cDNA全长进行核准, 确定突变位点的可靠性, 并通过SIFT网站(http://sift.jcvi.org)预测突变位点的性质, 以及氨基酸替换是否会影响蛋白质的功能.
统计学处理 运用SPSS17.0软件进行数据分析, 采用χ2检验、t检验, 基因型与CP的相关性采用比数比(odds ratio, OR)及其95%可信区间(confidence intervals, CI)表示, 并行Hardy-Weinberg遗传平衡检验. P<0.05为差异具有统计学意义.
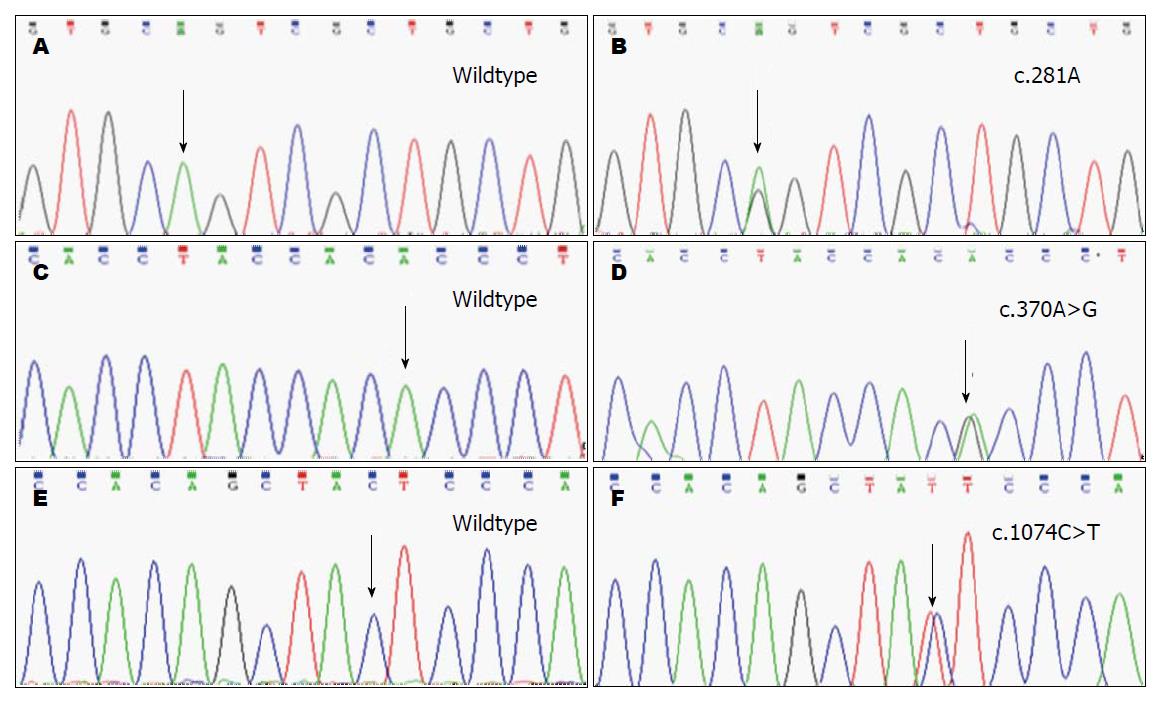
在146例患者中, CPA1基因第3外显子分别检测到1例c.281A>G杂合错义突变(CAG>CGG), 导致的氨基酸改变为第94位精氨酸代替谷氨酰胺(Gln94Arg), 1例c.370A>G杂合错义突变(ACC>GCC), 导致的氨基酸改变为第124位丙氨酸代替苏氨酸(Thr124Ala). 在另2例患者中检测到CPA1基因第8外显子c.1074C>T杂合同义突变(TAC>TAT), 突变前后氨基酸均为酪氨酸(Tyr308Tyr)(图1).
测序分析时检测到病例组与对照组的CPA1基因第3外显子发生了C>G杂合变异, 经SIFT软件分析, 确定其为已知的单核苷酸多态性(single-nucleotide polymorphism, SNP)位点(rs1126899). 统计分析显示rs1126899位点基因型在CP病例组和正常对照组的分布差异有统计学意义(P<0.05), 其中CC基因型在病例与对照组中的频率分别是26.0%和37.0%, CG基因型的频率分别是50.0%和47.5%, GG基因型的频率分别为24.0%和15.5%. 在CP组和正常对照组中, rs1126899位点GG、GC、CC基因型频率(χ2 = 6.424, P = 0.040)和等位基因G、C频率(χ2 = 6.479, P = 0.011)具有显著的统计学差异(表3).
| 基因型/等位基因 | 慢性胰腺炎组 | 对照组 | χ2值 | P值 |
| n | 146 | 200 | ||
| 基因型 | 6.424 | 0.040 | ||
| GG | 35(24.0) | 31(15.5) | ||
| CG | 73(50.0) | 95(47.5) | ||
| CC | 38(26.0) | 74(37.0) | ||
| CG+GG | 108(74.0) | 126(63.0) | 4.641 | 0.031 |
| 等位基因 | 6.479 | 0.011 | ||
| C | 149(51.0) | 243(60.8) | ||
| G | 143(49.0) | 157(39.2) |
在酒精性病例组和对照组中, CC型携带者与CG+GG型携带者的分布差异无统计学意义(P>0.05); 在非酒精性病例组与对照组中, CC型携带者与CG+GG型携带者的分布差异具有统计学意义(OR = 1.779, 95%CI: 1.026-3.087, P = 0.039)(表4).
| 基因型 | 酒精性 | 非酒精性 | ||||
| 病例/对照 | OR值 | P值 | 病例/对照 | OR值 | P值 | |
| CC | 13/18 | 1.0 | 25/56 | 1.0 | ||
| CG+GG | 23/19 | 1.676(0.657-4.278) | 0.279 | 85/107 | 1.779(1.026-3.087) | 0.039 |
CP是一种由遗传和环境因素共同作用所致的复杂性疾病, 发病机制尚不清晰, 且近几年来其发病率呈上升趋势[9,11]. 自1996年Whitcomb等[12]确定第一个CP易感基因PRSS1以来, 已相继发现多个与CP发病相关的易感基因和SNP位点. 诸多遗传学研究[12-20]表明, 胰腺内胰蛋白酶活性的变化在CP发病机制中发挥着重要作用, 阳离子胰蛋白酶(PRSS1)的功能获得性突变、胰腺胰蛋白酶抑制剂(SPINK1)和糜蛋白酶C(CTRC)的功能丧失性突变均会增加CP的患病风险, 阴离子胰蛋白酶(PRSS2)和PRSS1启动子区的突变却可以有效阻止CP的发生. 因此, 明确基因异常与CP发病的关系, 将有助于深化对CP发病机制的认识.
参与编码CPA1的CPA1基因是目前少数明确与CP发病相关的基因之一[21]. CPA1基因位于染色体7q32.2上, 长约8 kb, 包含10个外显子, CPA1基因编码的羧肽酶是锌金属蛋白酶家族中的成员之一, 非激活态原蛋白由419个氨基酸构成, 包括16个氨基酸分泌信号肽和94个胺基酸长肽[9]. 人的胰液中存在3种不同类型的羧肽酶: CPA1、CPA2和CPB1, A型羧肽酶即CPA1和CPA2是一部分哺乳动物组织分泌的肽链端水解酶, 能在被糜蛋白酶和蛋白酶作用后的芳香族和脂肪族氨基酸残基上发挥功能, 其中CPA1是一种被胰蛋白酶激活后由胰腺分泌的无活性酶原[22]. CPA1基因不仅与胰腺的消化功能有关, 还可以参与调控金属羧肽酶相关通路[23], 并且Christianson等[24]发现CPA1基因在大鼠脑、心、胃、肠组织里面均有较低水平的表达. Witt等[9]在患有CP的德国人群、欧洲人群、印度人群和日本人群中均发现, 编码羧肽酶的CPA1基因上存在多种基因突变, 包括31种错义突变, 1种无义突变, 1种移码突变和1种剪切位点突变, CP患者携带最多的是第7外显子c.758C>G突变、第9内含子c.1073-2A>G突变以及第10外显子c.1144C>T突变.
目前, 检测基因突变的方法主要有: 直接测序法、错配的化学切割分析、单链构象多态分析、核糖核酸酶切法、变性梯度凝胶电泳等[25]. 直接测序技术是目前检测基因突变的常用方法, 因该技术检测结果具有客观性和特异性好的优点, 从而使直接测序法成为基因突变检测的金标准[26]. 本研究中通过对病例组和对照组进行Sanger直接测序, 检出了已报道的CPA1基因第3外显子c.281A>G杂合错义突变, 另检测到2个新突变, 第3外显子c.370A>G杂合错义突变和第8外显子c.1074C>T杂合同义突变, 经检索国内外文献, 未见报道. 同时还在患者和正常对照检测到CPA1基因1个SNP位点(rs1126899), 其等位基因频率及基因型分布在两组间的差异具有统计学意义(P<0.05). 由于国外报道CP的病因主要与酗酒等因素相关[27-31], 而国内则以胆源性CP为主[32-34], 所以进一步探讨了rs1126899位点多态性与酒精因素的关系, 在不存在酒精因素的两组中, CC型携带者与CG+GG型携带者的分布差异具有统计学意义(OR = 1.779, 95%CI: 1.026-3.087, P = 0.039).
本研究通过CPA1基因进行突变分析, 探讨中国汉族人群CP的分子发病机制, 研究结果丰富了CP突变数据库, 以后还需进行多中心大样本队列研究, 对检测到的CPA1基因新的突变位点进一步验证, 并进行相应的功能研究, 为有效预防CP的发生提供基因水平的依据.
既往研究表明位于7号染色体长臂7q32.2区间的羧肽酶A1(carboxypeptidase A1, CPA1)的基因是慢性胰腺炎(chronic pancreatitis, CP)的致病基因, 但CPA1基因仍存在着散在的突变位点, 有部分患者未见CPA1基因突变, 提示可能有其他基因参与或还存在其他未知的突变位点.
CP的病因学和发病机制至今尚未清晰, 国外报道多种族人群CP患者均存在CPA1基因突变, 中国西南汉族人群中CP是否存在未被发现的基因异常, 迄今为止未见报道.
Witt等在2013年对多个国家的CP患者进行CPA1基因分析, 发现CPA1基因存在着多个散在的突变位点, 且多数突变位点均会引起功能的改变.
本文通过对中国四川地区CP人群及正常对照人群CPA1基因进行全部外显子直接测序分析, 发现了新的突变位点, 并检测到有意义的单核苷酸多态性位点.
本文可为CP的突变基因库提供实验数据, 国外报道的CPA1基因常见突变可能并非本地区的常见突变位点, 突变位点可能存在其他外显子和/或内含子邻近区域突变.
王刚, 副研究员, 哈尔滨医科大学附属第一医院胰胆外科(普外二科); 张国顺, 主任医师, 华北理工大学附属医院消化内科
本文通过CPA1基因进行突变分析, 探讨中国汉族人群CP的分子发病机制, 选题新颖, 研究结果丰富了我国CP突变数据库, 有一定的价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology. 2013;144:1252-1261. [PubMed] [DOI] |
| 2. | Pinho AV, Chantrill L, Rooman I. Chronic pancreatitis: a path to pancreatic cancer. Cancer Lett. 2014;345:203-209. [PubMed] [DOI] |
| 3. | Cheng H, Luo G, Lu Y, Jin K, Guo M, Xu J, Long J, Liu L, Yu X, Liu C. The combination of systemic inflammation-based marker NLR and circulating regulatory T cells predicts the prognosis of resectable pancreatic cancer patients. Pancreatology. 2016; Sep 16. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Lee JM, Lee HS, Hyun JJ, Choi HS, Kim ES, Keum B, Seo YS, Jeen YT, Chun HJ, Um SH. Prognostic value of inflammation-based markers in patients with pancreatic cancer administered gemcitabine and erlotinib. World J Gastrointest Oncol. 2016;8:555-562. [PubMed] [DOI] |
| 5. | O'Sullivan JN, Nobrega FT, Morlock CG, Brown AL, Bartholomew LG. Acute and chronic pancreatitis in Rochester, Minnesota, 1940 to 1969. Gastroenterology. 1972;62:373-379. [PubMed] |
| 6. | Lankisch PG, Assmus C, Maisonneuve P, Lowenfels AB. Epidemiology of pancreatic diseases in Lüneburg County. A study in a defined german population. Pancreatology. 2002;2:469-477. [PubMed] [DOI] |
| 7. | Bornman PC, Botha JF, Ramos JM, Smith MD, Van der Merwe S, Watermeyer GA, Ziady CC. Guideline for the diagnosis and treatment of chronic pancreatitis. S Afr Med J. 2010;100:845-860. [PubMed] |
| 8. | Tandon RK, Sato N, Garg PK. Chronic pancreatitis: Asia-Pacific consensus report. J Gastroenterol Hepatol. 2002;17:508-518. [PubMed] |
| 9. | Witt H, Beer S, Rosendahl J, Chen JM, Chandak GR, Masamune A, Bence M, Szmola R, Oracz G, Macek M. Variants in CPA1 are strongly associated with early onset chronic pancreatitis. Nat Genet. 2013;45:1216-1220. [PubMed] [DOI] |
| 11. | Braganza JM, Lee SH, McCloy RF, McMahon MJ. Chronic pancreatitis. Lancet. 2011;377:1184-1197. [PubMed] [DOI] |
| 12. | Whitcomb DC, Gorry MC, Preston RA, Furey W, Sossenheimer MJ, Ulrich CD, Martin SP, Gates LK, Amann ST, Toskes PP. Hereditary pancreatitis is caused by a mutation in the cationic trypsinogen gene. Nat Genet. 1996;14:141-145. [PubMed] [DOI] |
| 13. | Whitcomb DC, LaRusch J, Krasinskas AM, Klei L, Smith JP, Brand RE, Neoptolemos JP, Lerch MM, Tector M, Sandhu BS. Common genetic variants in the CLDN2 and PRSS1-PRSS2 loci alter risk for alcohol-related and sporadic pancreatitis. Nat Genet. 2012;44:1349-1354. [PubMed] [DOI] |
| 14. | Witt H, Luck W, Becker M. A signal peptide cleavage site mutation in the cationic trypsinogen gene is strongly associated with chronic pancreatitis. Gastroenterology. 1999;117:7-10. [PubMed] |
| 15. | Le Maréchal C, Masson E, Chen JM, Morel F, Ruszniewski P, Levy P, Férec C. Hereditary pancreatitis caused by triplication of the trypsinogen locus. Nat Genet. 2006;38:1372-1374. [PubMed] [DOI] |
| 16. | Witt H, Luck W, Hennies HC, Classen M, Kage A, Lass U, Landt O, Becker M. Mutations in the gene encoding the serine protease inhibitor, Kazal type 1 are associated with chronic pancreatitis. Nat Genet. 2000;25:213-216. [PubMed] [DOI] |
| 17. | Chandak GR, Idris MM, Reddy DN, Bhaskar S, Sriram PV, Singh L. Mutations in the pancreatic secretory trypsin inhibitor gene (PSTI/SPINK1) rather than the cationic trypsinogen gene (PRSS1) are significantly associated with tropical calcific pancreatitis. J Med Genet. 2002;39:347-351. [PubMed] |
| 18. | Rosendahl J, Witt H, Szmola R, Bhatia E, Ozsvári B, Landt O, Schulz HU, Gress TM, Pfützer R, Löhr M. Chymotrypsin C (CTRC) variants that diminish activity or secretion are associated with chronic pancreatitis. Nat Genet. 2008;40:78-82. [PubMed] [DOI] |
| 19. | Masson E, Chen JM, Scotet V, Le Maréchal C, Férec C. Association of rare chymotrypsinogen C (CTRC) gene variations in patients with idiopathic chronic pancreatitis. Hum Genet. 2008;123:83-91. [PubMed] [DOI] |
| 20. | Witt H, Sahin-Tóth M, Landt O, Chen JM, Kähne T, Drenth JP, Kukor Z, Szepessy E, Halangk W, Dahm S. A degradation-sensitive anionic trypsinogen (PRSS2) variant protects against chronic pancreatitis. Nat Genet. 2006;38:668-673. [PubMed] [DOI] |
| 21. | Ravi Kanth V, Nageshwar Reddy D. Genetics of acute and chronic pancreatitis: An update. World J Gastrointest Pathophysiol. 2014;5:427-437. [PubMed] [DOI] |
| 22. | Joshi L, St Leger RJ. Cloning, expression, and substrate specificity of MeCPA, a zinc carboxypeptidase that is secreted into infected tissues by the fungal entomopathogen Metarhizium anisopliae. J Biol Chem. 1999;274:9803-9811. [PubMed] |
| 23. | Bajzar L, Manuel R, Nesheim ME. Purification and characterization of TAFI, a thrombin-activable fibrinolysis inhibitor. J Biol Chem. 1995;270:14477-14484. [PubMed] |
| 24. | Christianson DW, Mangani S, Shoham G, Lipscomb WN. Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A. J Biol Chem. 1989;264:12849-12853. [PubMed] |
| 25. | Wiley SR, Raman VS. Molecular Methods and Bioinformatic Tools for Adjuvant Characterization by High-Throughput Sequencing. Methods Mol Biol. 2017;1494:353-368. [PubMed] [DOI] |
| 26. | 刘 伟, 王 丽, 余 英豪, 王 旭洲, 武 一曼, 吴 在增, 欧阳 学农, 王 烈. k-ras基因在中国结直肠癌患者中的突变状态. 世界华人消化杂志. 2011;19:1367-1374. [DOI] |
| 28. | Capurso G, Archibugi L, Stigliano S, Delle Fave G. [Epidemiology, clinical features and treatment of chronic pancreatitis: current knowledge and future perspectives]. Recenti Prog Med. 2016;107:328-336. [PubMed] [DOI] |
| 29. | Setiawan VW, Pandol SJ, Porcel J, Wilkens LR, Le Marchand L, Pike MC, Monroe KR. Prospective Study of Alcohol Drinking, Smoking, and Pancreatitis: The Multiethnic Cohort. Pancreas. 2016;45:819-825. [PubMed] [DOI] |
| 30. | Samokhvalov AV, Rehm J, Roerecke M. Alcohol Consumption as a Risk Factor for Acute and Chronic Pancreatitis: A Systematic Review and a Series of Meta-analyses. EBioMedicine. 2015;2:1996-2002. [PubMed] [DOI] |
| 31. | Ahmed Ali U, Issa Y, Hagenaars JC, Bakker OJ, van Goor H, Nieuwenhuijs VB, Bollen TL, van Ramshorst B, Witteman BJ, Brink MA. Risk of Recurrent Pancreatitis and Progression to Chronic Pancreatitis After a First Episode of Acute Pancreatitis. Clin Gastroenterol Hepatol. 2016;14:738-746. [PubMed] [DOI] |
| 33. | Wang Q, Shen M, Leng X, Zeng X, Zhang F, Qian J. Prevalence, severity, and clinical features of acute and chronic pancreatitis in patients with systemic lupus erythematosus. Rheumatol Int. 2016;36:1413-1419. [PubMed] [DOI] |
| 34. | Pan J, Xin L, Wang D, Liao Z, Lin JH, Li BR, Du TT, Ye B, Zou WB, Chen H. Risk Factors for Diabetes Mellitus in Chronic Pancreatitis: A Cohort of 2,011 Patients. Medicine (Baltimore). 2016;95:e3251. [PubMed] [DOI] |