修回日期: 2016-06-04
接受日期: 2016-06-21
在线出版日期: 2016-12-18
淋巴转移是胆囊癌(gallbladder cancer, GBC)最常见的转移方式, 也是GBC预后的重要影响因素之一. 因此明确GBC淋巴引流的途径, 对发生转移的淋巴结进行准确分站, 探讨手术清扫范围, 寻找相应淋巴转移指标显得尤为重要; 同时淋巴示踪剂的使用极大方便了术中淋巴结清扫; 积极探索GBC淋巴转移的分子机制将可能提供新的GBC治疗靶点. 本文就近年来GBC的淋巴转移途径、分站、相应评估指标、示踪剂和淋巴转移的发生机制等方面的进展进行简要总结.
核心提要: 本文叙述了胆囊癌淋巴转移重要的预后意义、转移的途径、淋巴结分组, 清扫范围, 淋巴结转移的评价指标, 淋巴结示踪技术的应用以及转移的机制研究等各个方面的研究现状及存在争议之处, 并对相应的研究结果进行评论.
引文著录: 陈晨, 王林, 丛龙龙, 刘德春, 耿智敏. 胆囊癌淋巴转移的研究现状与展望. 世界华人消化杂志 2016; 24(35): 4634-4643
Revised: June 4, 2016
Accepted: June 21, 2016
Published online: December 18, 2016
Lymphatic metastasis is the most common way of metastasis in gallbladder cancer (GBC), and it is also one of the important factors influencing prognosis. Therefore, it is important to elucidate the lymphatic drainage pathways, group the metastatic lymph nodes, assess the extent of lymphadenectomy, and identify relevant predictors of lymphatic metastasis. The development of lymph node tracer technique has greatly improved the surgical procedure, and exploration of the molecular mechanisms of lymphatic metastases may provide new therapeutic targets. In the current review, we discuss the lymphatic drainage pathways as well as the substation, predictors, tracers and mechanisms of lymphatic metastasis of GBC.
- Citation: Chen C, Wang L, Cong LL, Liu DC, Geng ZM. Lymphatic metastasis of gallbladder cancer: Present and future. Shijie Huaren Xiaohua Zazhi 2016; 24(35): 4634-4643
- URL: https://www.wjgnet.com/1009-3079/full/v24/i35/4634.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i35.4634
胆囊癌(gallbladder cancer, GBC)是胆道系统最常见的恶性肿瘤, 居消化道恶性肿瘤发病第6位[1]. 近年来调查资料显示, 我国部分地区GBC的发病率呈递增趋势, 而国外报道近年发病率无明显变化[2,3]. GBC呈现出恶性程度高、侵袭性强、易于局部浸润和远处转移的特征, 根治性切除仍然是治愈GBC的唯一手段, 然而由于早期诊断困难, 大多数患者就诊时已失去根治性手术机会, 仅约10%-30%的患者有手术切除机会[4], 且缺乏有效的综合性治疗手段, 预后极差, 晚期GBC患者中位生存期约6 mo, 5年生存率不足10%[5].
淋巴转移是GBC最常见的转移方式, 研究[6-10]显示60%-80%的T3-4期患者出现淋巴结转移. GBC手术的预后效果主要与淋巴转移、肿瘤侵及范围、组织学类型等多种因素有关, 其中淋巴转移是影响根治性切除患者预后的最重要的影响因素之一[11-13]. 目前对于GBC淋巴转移的具体分子机制仍不清楚, 主要认为淋巴管生成过程在GBC的增殖、侵袭、转移、复发等方面具有重要作用. 此外, 针对GBC淋巴结转移清扫范围及方式还存在争议, 但行GBC根治性手术包括淋巴清扫能提高患者预后, 控制肿瘤复发, 已达成共识. 本文就GBC淋巴转移的研究现状及进展作一总结.
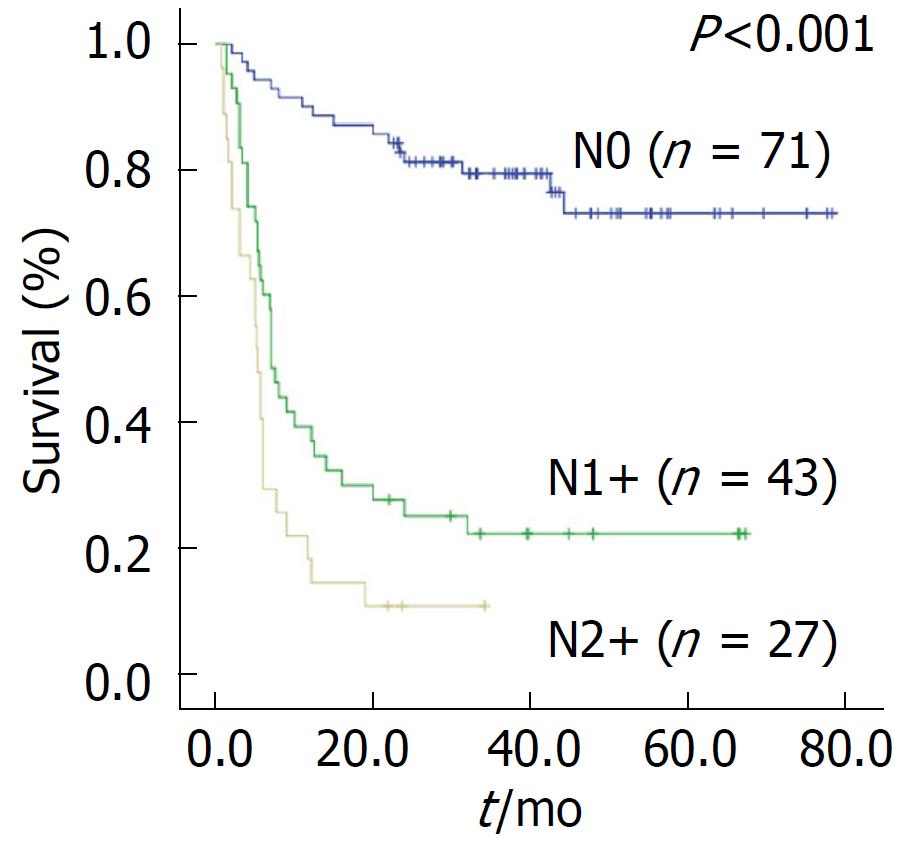
由于胆囊浆膜下层有丰富的淋巴管, 肿瘤一旦突破该层面极易发生淋巴结转移[14], 因此淋巴结转移呈现出随T分期增高而增加的趋势, 在T3-T4期患者中淋巴转移率可高达60%-80%[6-10]. 我们对西北五省17家医院2379例GBC资料分析显示, 淋巴转移占55.9%, 其中N1转移26.6%, N2转移29.3%[2]. 淋巴转移同时也是影响根治性切除患者预后的最重要的影响因素之一[11-13]. 西安交通大学第一附属医院2008-2012年手术治疗的438例GBC患者中, 331例合并淋巴结转移(75.6%), 其中N1转移40.9%, N2转移34.7%, 预后多因素分析结果显示, 手术方式为R1/2切除、有腹腔积液、N1期、N2期及M1期为影响患者预后的独立危险因素, 其中N1及N2淋巴结转移的相对危险度分别为3.801及4.418, 提示淋巴结转移为GBC患者最重要的独立预后影响因素, 而T分期并非为独立影响因素, 可能与T0-2期患者数量较少有关[15]. Birnbaum等[16]同样报道在进展期GBC中, N分期决定患者的预后, 而T分期并非相关影响因素. 在我们根治性手术的162例患者中91例(56.2%)患者呈现出淋巴结转移, 其中仅1例为T1期, 其余患者均为T3-4期. 进一步对该162例GBC根治性手术预后分析显示, 是否出现淋巴转移的患者间预后存在显著性差异, N0患者术后5年生存率为73.4%, N1+患者5年生存率为22.6%, 而N2+患者5年生存率仅为11.1%, 证实淋巴结转移对GBC患者预后至关重要(图1).
淋巴受累情况决定着GBC手术方式及预后, 因此了解GBC的淋巴回流途径十分必要. Ito等[17]提出胆囊的淋巴引流可能有3条途径: (1)胆囊-胰十二指肠后途径: 从肝十二指肠韧带右侧下降至胰腺头后方; (2)胆囊-腹腔动脉途径: 经肝十二指肠韧带走向左侧至肝总动脉周围及腹腔干周围; (3)胆囊-肠系膜上动脉途径: 从肝十二指肠韧带的内在淋巴引流至胰腺后肠系膜上动脉起始部周围淋巴结. 3种途径最后均汇合在靠近左肾静脉处的腹主动脉旁淋巴结. Uesaka等[18]用活体染色法在手术中向GBC及胃癌患者的胆囊颈部注射碳粒子悬液(CH40), 观察淋巴结的染色情况, 将胆囊的淋巴引流分为3个方向, 右侧是沿胆总管旁至胰十二指肠后上方淋巴结或者门静脉后淋巴结而至腹主动脉旁淋巴, 此途径最恒定, 见于95%的患者; 左侧途径见于50%的病例, 是经肝十二指肠韧带左缘至胰头后方的淋巴结, 肝总动脉后淋巴结最常着色, 见于45%的患者; 肝门淋巴结着色者只见于20%的病例. Shimada等[19]研究GBC淋巴结受累情况同样认为右侧淋巴回流途径是GBC经淋巴道扩散的主要途径, 左侧途径是一种补充途径. 两种途径在胰头后方有交叉, 这说明为何胰头周围淋巴结受累是外科治疗进展期GBC预后的重要因素.
按照胆囊的淋巴回流途径, 国际抗癌联盟(Union for International Cancer Control, UICC)将与GBC转移有关的淋巴结分为两站: 胆囊颈淋巴结及胆总管周围淋巴结为第1站(N1), 其余淋巴结为第2站(N2). 但日本胆道外科协会(Japanese Society of Biliary Surgery, JSBS)则将淋巴结分为3站: 胆囊颈淋巴结及胆总管周围淋巴结为第1站(N1); 胰十二指肠上后淋巴结、肝总动脉旁淋巴结、门静脉后淋巴结为第2站(N2); 主动脉旁淋巴结、肠系膜上动脉淋巴结、腹腔动脉淋巴结为第3站(N3)[20]. Chijiiwa等[21]将GBC患者的淋巴结分别按UICC及JSBS标准分类进行对比研究, 发现JSBS标准的N1与UICC标准的N1生存期无显著差异, 而N2淋巴结局限于肝十二指肠韧带内, 患者可获得根治手术的机会, 生存期明显长于UICC分期的N2患者, N3及N4受侵的患者5年生存率极低. Kishi等[20]同样认为JSBS分期可更精确地评估预后. 然而, 虽然JSBS的淋巴结分组更为合理, 对GBC手术方式的选择更有临床意义, 但由于大部分欧美等西方学者的反对, 在日本以外很少应用[22]. 我国对GBC分期使用UICC发布的TNM分期, 同时指南中指出胰头后淋巴结(13a组)淋巴结系GBC淋巴转移第1站淋巴结和第2站淋巴结的分界点, 16组淋巴结是GBC淋巴结远处转移的分界点[23], 术中应注意此2站淋巴结活检结果并进行相应手术.
目前, 针对不同淋巴结转移患者的手术仍存在争议. 首先, 不同淋巴结转移状态下的手术方式尚未达成统一意见. 根据UICC发布的第7版TNM分期系统, 超越N1的淋巴结被归于第2站(N2)[24]. 有学者的研究[25-29]指出根治性切除并不能改善伴有N2淋巴结转移的患者的预后, 因此此类患者应进行针对症状的姑息性手术. 然而, 近年来Nishio等[30]和Regimbeau等[31]的研究表明根治性切除可改善N2转移患者的预后, 日本学者对已转移至腹主动脉旁淋巴结的患者进行了相关研究, 结果表明对此类患者进行根治性切除依然可以延长术后生存时间[30]. 我们对西安交通大学第一附属医院2008-2012年手术治疗的152例N2+ GBC患者进行相应研究, 其中31例达到R0切除, 结果显示R0切除患者1、2、3年生存率(21.7%、13.0%、13.0%)明显高于R1/2切除患者(1.9%、0%、0%)(P = 0.004), 提示N2+并非GBC患者根治性切除的禁忌证.
其次对于N1淋巴结转移患者的淋巴清扫范围, 同样存在争议. 根据Kelly等[32]的报道, 胰头后淋巴结(13a)转移为患者预后的独立危险因素, 同时可作为N2淋巴结转移的前哨淋巴结(sentinel lymph node, SLN). 根据中华医学会外科学分会胆道外科学组于2015年发布的GBC诊断和治疗指南, 对于N1阳性的患者, 术中应常规行13a组淋巴结活组织检查, 13a组淋巴结活组织检查结果为阴性, 行肝十二指肠韧带(12组)和肝动脉(8组)淋巴结清扫; 13a组淋巴结活组织检查结果为阳性, 行扩大淋巴结清扫, 包括肝十二指肠韧带(12组)、肝总动脉(8组)、胰头周围(13组)和腹腔干周围(9组)淋巴结[23]. 然而, 国外的部分医疗中心对仅伴有N1转移或者无淋巴结转移的患者同样行扩大的淋巴结清扫, 这些医疗中心的报道[33]称即使对于N0患者, 扩大淋巴结清扫术亦可改善预后, 因此对所有根治性切除的患者都应行扩大的淋巴结清扫. 我们的资料显示, 在51例行扩大淋巴清扫的患者中, 4例发现跳跃性转移, 因此为了获得更精确的分期以评估预后, 对于所有行根治性切除的患者, 均应行扩大的淋巴结清扫.
对于判定淋巴结转移的相关指标一向存在争议. 在淋巴结状态的三个相关指标, 即阳性淋巴结位置(即淋巴结分站)、阳性淋巴结数(positive lymph nodes count, PLNC)、阳性淋巴结率(lymph nodes ratio, LNR)中, 依据阳性淋巴结解剖学位置对患者进行淋巴结状态的评估为现行较为广泛接受的指标, 然而此系统对于评判淋巴结状态仍具有一定的局限性, 原因在于淋巴结位置的评估依赖于淋巴清扫的范围, 仅考虑了最远转移的淋巴结位置而忽略了转移的淋巴结数量. 同时由于针对部分淋巴结(胰周淋巴结、腹腔干淋巴结)归属、JSBS分期系统与TNM分期系统中针对淋巴结分站划分等的争议[34,35], 此评判系统对于预后的估算价值并未受到所有研究者的认可, 部分研究甚至认为阳性淋巴结位置对于预后并无指导意义[16].
因此, 近年来提出了PLNC、LNR这两项指标用于评判淋巴结状态, 与传统的淋巴结位置相比, 此二者考虑到了转移的淋巴结的数量. Sakata等[36-38]的研究证实PLNC为影响根治性切除患者预后的独立危险因素. 在Shiral等[36]针对135例根治性切除患者的研究中, PLNC的截点与我们的结果相同, 同样为PLNC≥4提示不良预后. 我们对西安交通大学第一附属医院2008-2012年间行根治性切除的162例GBC患者进行相应分析, 结果确认PLNC为患者预后的独立危险因素, RR值为2.81, 提示除阳性淋巴结位置外, PLNC也可作为评判患者淋巴结状态的有效参数.
LNR是近年来广泛用于部分胃肠道肿瘤的预后评估参数[39,40], 为解决淋巴结数量过少引起的对PLNC的错误评估而导致的错误分期, 引入了LNR这一概念, 即PLNC除以清扫所得总淋巴结数. Negi等学者[41]通过对57例GBC患者的研究, 首次在GBC中提出了LNR为预后的独立危险因素. 随后Birnbaum[42]的研究也证实了此观点. 然而, 我们通过对更大数据量的患者(162例)进行研究, 结果证实虽然LNR影响患者预后, 却并不是预后的独立危险因素. LNR取决于PLNC与清扫所获总淋巴结数, 淋巴清扫范围直接影响LNR, 因此对于N1+患者进行D1清扫, 可能获得较高的LNR数值, 而此类患者往往预后较好, 因此限制了LNR在评估预后中的价值, 此类观点同样在Murakami等[43]、Lee等[44]、Sierzega等[45]学者对其他肿瘤的研究中证实, 因此我们认为在PLNC与LNR二者中, PLNC对预后具有更好的指导意义.
GBC外科手术治疗的重点、难点以及争论点均集中于淋巴结清扫, 然而, 由于不同个体淋巴引流途径的不确定性、快速冰冻病理的局限性, 难以在术中获得准确的淋巴结分站、PLNC、LNR等指标, 因此如何在手术中明确肿瘤淋巴结转移途径、范围, 并对转移淋巴结予以清楚显示、对周围组织加以颜色区分、辅助术中淋巴结清扫, 对于肿瘤能否达到R0切除至关重要. 目前淋巴示踪技术在多种肿瘤手术过程中已广泛应用, 通过染色可以实现肿瘤区域引流淋巴结的活体染色, 指导合理的切除和彻底的淋巴结清扫, 同时可减少组织损伤, 缩短手术时间并减少复发概率, 在胰腺癌、乳腺癌、甲状腺癌、胃癌、结直肠癌、GBC等多种肿瘤已得到应用[46]. 目前常用的淋巴示踪剂包括亚甲蓝、纳米活性炭及吲哚菁绿(indocyanine green, ICG).
亚甲蓝注射液为深蓝色的澄明液体, 其相对分子质量较小, 扩散较快, 蓝染效果好. 柯孔亮等[47]研究报道亚甲蓝应用于胃癌术中SLN清扫, SLN检出率可达98%, 检出的SLN平均为4.4枚. Eitan等[48]的研究证实亚甲蓝进行淋巴示踪SLN阳性率明显高于普通蓝色染色剂, 但阳性率容易受到体质量指数及淋巴管和血管的空间侵袭能力影响. 同时Cozzaglio等[49]报道亚甲蓝对于跳跃转移或存在淋巴管堵塞的肿瘤其染色效果欠佳, 敏感性波动较大(61.1%-100.0%), 因此亚甲蓝的临床广泛应用受到限制.
纳米活性炭是将活性炭经过特殊加工, 加悬剂、生理盐水制成平均直径为150 nm的炭团混悬液. 纳米炭淋巴示踪剂具有淋巴组织吸收快、能清楚显示淋巴管和淋巴结、在淋巴结中聚集并停留较长时间、使用简便、价格适中、无不良反应的特点. 通过纳米炭混悬注射液淋巴示踪技术可以清楚显示肿瘤淋巴转移途径, 并及时发现跳跃式转移淋巴结, 可帮助外科医生清扫更多的淋巴结, 对重点部位进行更精细彻底的清扫; 还可以提供术者视觉上的提示, 避免重要血管的损伤[46,50]. Wu等[50]在关于早期乳腺癌淋巴结碳纳米示踪的研究发现碳纳米管淋巴结示踪的敏感性、准确性明显高于亚甲蓝. Li等[51]在碳纳米应用于头颈外科淋巴结示踪的Meta分析中报道, 应用碳纳米进行淋巴结示踪, 患者平均清扫所得淋巴结数增加2.7个, 同时对甲状旁腺的损伤风险降低了23%, 且手术时间明显缩短. 在GBC中, 兰良军等[52]研究报道应用碳纳米在术中对淋巴结示踪显示, 可增强术者对淋巴结的识别, 清扫出更多阳性淋巴结. 但颜博等[53]报道应用纳米碳检测阳性淋巴结受到肿瘤分期、患者年龄、肿瘤位置关系、示踪剂注射位置不同等因素的影响. 同亚甲蓝相比碳纳米淋巴结示踪剂在淋巴清扫中有一定的优势, 但同时仍具有一定的局限性.
ICG静脉注射后和血浆蛋白结合, 随血液循环迅速分布于全身血管内, 高效率、选择性的被肝细胞摄取, 从肝细胞以游离形式排泄到胆汁中, 随粪便排出体外. 当肝脏病变时, 血浆ICG清除率明显降低, 因此目前广泛应用于肝脏功能测定、肝功能储备、血管造影等检查[54]. 目前多项研究发现, ICG应用经近红外激发显示出荧光特性, 因此将其应用于肿瘤示踪、淋巴结显影. How等[55]在子宫内膜癌淋巴结示踪研究中, 应用ICG、亚甲蓝对淋巴结显影, ICG的总体检出率、双边检测率均明显高于亚甲蓝. 另外研究证明ICG显色效果明显好于碳纳米. 在肝脏原发性肿瘤及转移肿瘤中ICG能够良好显示肿瘤轮廓, 且在不同类型的肝转移癌中其肿瘤显示轮廓各异, 在一定程度上能够帮助手术医师准确规划手术范围及切缘[56,57]. 目前ICG在肝胆外科手术中应用仍局限于对于肝脏轮廓的显示, 在GBC淋巴结清扫中的价值尚未见相关报道.
胆道外科医师在关注GBC的淋巴转移时, 不仅应从外科医师的角度出发去改善外科治疗手段, 更应从转化医学的角度去探索新的治疗方式. 转化医学包含从实验室到临床和从临床到实验室两个方面, 二者双向循环方可更大程度地促进疾病的治疗, 如上文所述, 淋巴结示踪剂在GBC中的应用正是转化医学促进胆道外科发展的成功案例, 因此, 胆道外科医师也应了解GBC发生淋巴转移的具体机制, 以探索新的治疗方法. 肿瘤淋巴转移的机制包括两个方面: (1)淋巴管密度增加导致肿瘤细胞有更多的机会侵入淋巴管, 从而促进了肿瘤转移; (2)淋巴内皮细胞分泌趋化因子及类似物, 趋化肿瘤细胞进入淋巴管[58]. 肿瘤淋巴转移过程中, 肿瘤细胞需先侵入淋巴管然后到达引流淋巴结. 以往对肿瘤淋巴管生成的研究主要集中在肿瘤生长部位及其邻近组织, 称作肿瘤淋巴管生成(lymphangiogenesis). 同样在区域淋巴结也能发现淋巴管的生成, 尤其是肿瘤首先转移的淋巴结(即SLN) , 这种现象被称为淋巴结的淋巴管生成. 淋巴结淋巴管生成和淋巴液的增加启动了淋巴转移过程[59].
淋巴管生成过程是一个与血管生成过程类似的、十分复杂的、多功能协调的过程, 包括增殖、萌出及管状结构形成等. 目前认为, GBC的淋巴转移主要通过新的淋巴管的生成以及改造现有的淋巴管来完成. 目前大量研究[58]正在试图找出淋巴转移的具体机制、不同的淋巴管亚型的不同作用, 以便于为早期诊断及治疗肿瘤提供新的机会. 淋巴管生成的过程是在原有淋巴管的基础上生成新的淋巴管, 这一过程在胚胎发育、创伤、修复、各种病理环境(包括肿瘤)等状况下都是存在的, 肿瘤细胞及其微环境产生各种生长因子均在促进初始淋巴管生成新的淋巴管中发挥了作用.
目前多项研究[60]表明血管内皮生长因子(vascular endothelial growth factor, VEGF)-C和VEGF-D可能与淋巴管生成有关, 其酪氨酸激酶受体家族中的特异性受体VEGFR-3表达于淋巴管内皮细胞, 在淋巴管生成中起重要作用, 是目前应用最多的淋巴管内皮细胞标志物之一. VEGF-C/-D、VEGFR-3信号传导通路是调控淋巴管形成的主要途径之一[61], 通过VEGFR-3信号传导以诱导淋巴管形成. 肿瘤细胞分泌的VEGF-C/-D与淋巴管内皮细胞上的受体VEGFR-3结合作用后, 促进淋巴内皮细胞生长、迁移, 促进肿瘤内以及癌周的毛细淋巴管形成, 肿瘤细胞与毛细淋巴管的接触机会增加, 导致肿瘤细胞淋巴转移. 神经菌毛素-2是一种多功能、单链非酪氨酸激酶跨膜糖蛋白, 通过与VEGFR-3形成受体复合物, 共同提高VEGF-C的活性, 参与淋巴管的生成过程[62]. VEGF-D通过影响淋巴管内皮细胞前列腺素代谢途径, 促进肿瘤淋巴管的生成和扩张[63]. 在GBC中, 已有研究[64]证实VEGF-C在GBC的淋巴转移及淋巴管生成中发挥了重要作用, 并能促进肿瘤的淋巴结转移. 在裸鼠皮下及原位种植瘤模型中, 沉默肿瘤细胞的VEGF-D分泌可抑制肿瘤的生长及淋巴管形成[65]. 此外Du等[66]证实了TNF-Ⅱ能够通过NF-κB与VEGF-C启动子的结合上调GBC中VEGF-C表达从而促进GBC淋巴管新生.
淋巴管标志物是淋巴内皮细胞表面用于标记并便于检测的受体或抗体, 对研究肿瘤淋巴转移的具体机制具有重要作用. 目前研究较为广泛的包括VEGFR-3、淋巴管内皮透明质酸受体-1[67]、肾小球足细胞表面蛋白(podoplanin)[68]、Podoplanin相关的同源基因-1[69]及D2-40[70]等. D2-40是一种抗Podoplanin单克隆抗体, 是一种仅在淋巴组织表达而不在血管组织中表达的一种高度选择性淋巴管内皮细胞标志物. 近几年国内外报道表明D2-40可用于宫颈癌[71]、乳腺癌[72]等肿瘤淋巴管形成、浸润和转移及临床病理关系的研究. 张斌斌等[73]以D2-40单克隆抗体应用组织微阵列、免疫组织化学技术检测了GBC、癌旁组织和正常胆囊中微淋巴管密度的表达情况, 发现癌周的微淋巴管密度明显高于癌中心和正常组织, 提示癌周边区淋巴管的新生对GBC淋巴转移可能具有重要作用. 我们通过D2-40标记淋巴管发现, 低分化GBC瘤周的淋巴管密度明显高于高、中分化型GBC, 且瘤周淋巴管密度高的GBC预后更差.
除肿瘤细胞外, 肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs)在淋巴结转移中同样扮演了重要的角色. CAFs是肿瘤间质里最主要的细胞成分, 通过分泌多种细胞因子及生长因子促进肿瘤的侵袭、转移、血管新生、淋巴管新生[74-76]. Garmy-Susini等[77]对结直肠癌淋巴转移研究发现, 转移淋巴结中表达大量活化的肌成纤维细胞, 并且与转移淋巴结大小相关, 表明CAFs的活化与招募参与了肿瘤淋巴转移的形成. 此外, 淋巴管生长需要ECM作用, 活化的CAF可产生多种ECM成分如胶原、层黏连蛋白和纤连蛋白, 可提供结构支撑和调节淋巴管形成信号. GBC亦有明显的间质纤维化反应, 我们已从GBC组织中成功分离出CAF[78], 目前初步研究证实CAF能够促进淋巴内皮细胞的增殖、迁移及小管形成, 进一步的相关机制尚待研究.
此外, 缺氧是肿瘤物理微环境的基本特征之一[79]. 低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是肿瘤细胞对抗缺氧的环境而生成的核转录调控因子蛋白, 在肿瘤的发生、发展、浸润、转移和凋亡等方面起着十分重要的作用[80]. 在GBC中, HIF-1α的表达与VEGF-C的表达、癌组织微淋巴管密度显著相关[81,82], HIF-1α高表达与GBC的侵袭、转移及预后不良等密切相关[83].
近年来关于GBC淋巴转移的途径、手术治疗、淋巴转移相关预测指标、术中淋巴示踪、分子机制等知识不断增加. 深入认识GBC淋巴转移的途径, 进行合理的分站、分期以指导外科治疗, 术中应用示踪剂规划淋巴清扫范围, 同时探索肿瘤细胞、CAFs等与淋巴内皮细胞的相互作用以明确发生淋巴转移的机制可为GBC的治疗提供新的机遇和途径.
胆囊癌(gallbladder cancer, GBC)是胆道系统最常见的恶性肿瘤, 近年来调查资料显示, 我国部分地区GBC的发病率呈递增趋势. GBC呈现出恶性程度高、侵袭性强、易于局部浸润和远处转移、预后极差的特征. 淋巴转移是GBC最常见的转移方式, 也是影响根治性切除患者预后的最重要的影响因素之一. 因此深入了解探索GBC淋巴转移的特征、评价指标、分子机制显得尤为重要.
GBC的淋巴转移是GBC治疗的热点问题, 也是争议所在. 针对GBC淋巴结转移分组、清扫范围、相关预后评判指标尚有诸多争议, 同时对于其具体分子机制仍不清楚.
阳性淋巴结数(positive lymph nodes count, PLNC)与阳性淋巴结率(lymph nodes ratio, LNR)是近年来在评判淋巴结状态中两项新的指标, Shiral等人的研究指出PLNC≥4提示不良预后, 此项结果与作者的数据结果相同; 此外Negi等学者首次在GBC中提出了LNR为预后的独立危险因素, 但作者认为LNR取决于PLNC与清扫所获总淋巴结数, 淋巴清扫范围直接影响LNR, 相较而言二者中PLNC可能具有更好的临床应用价值.
本文首次全面地叙述了PLNC、LNR在GBC预后评判的意义, 同时综合性地介绍了亚甲蓝、纳米碳及吲哚菁绿(indocyanine green, ICG)在术中淋巴示踪中的应用及GBC淋巴结转移机制相关基础研究进展.
本文阐述了GBC淋巴结转移在评判预后的重要意义, 推荐所有根治性切除的GBC患者进行扩大的淋巴结清扫, 同时指出PLNC作为评价淋巴结转移指标的价值, 对比亚甲蓝、纳米碳及ICG在术中淋巴示踪中的优劣, 提出了ICG在淋巴结示踪的应用前景.
前哨淋巴结(sentinel lymph node, SLN): 是指首先收纳某器官、区域组织淋巴液的1个或数个淋巴结或某器官、组织原发肿瘤转移的第1站淋巴结, 其病理学状态可以代表其收纳区域整个淋巴结状态;
阳性淋巴结率(LNR): 即PLNC除以清扫所得总淋巴结数;
跳跃性转移: 指原发肿瘤临近淋巴结无转移而远处淋巴结发生转移.
吴健雄, 教授, 中国医学科学院肿瘤医院腹部外科
本文叙述了GBC淋巴结转移重要的预后意义、转移的途径、淋巴结分组, 清扫范围, 淋巴结转移的评价指标, 淋巴结示踪技术的应用以及转移的机制研究等各个方面的研究现状及存在争议之处, 内容比较充实, 层次分明, 逻辑清晰, 有较好的学术价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:李瑞芳
| 1. | Hundal R, Shaffer EA. Gallbladder cancer: epidemiology and outcome. Clin Epidemiol. 2014;6:99-109. [PubMed] [DOI] |
| 2. | 慎 浩鑫, 宋 虎伟, 王 林, 徐 新建, 焦 作义, 遆 振宇, 李 昭宇, 邓 勇, 陈 晨, 马 丽. 西北五省17家医院2379例胆囊癌临床分析. 中华外科杂志. 2015;53:747-751. |
| 3. | 慎 浩鑫, 宋 虎伟, 陈 晨, 马 丽, 赵 亚玲, 马 建仓, 耿 西林, 张 小弟, 王 钢, 姬 乐. 陕西省2009-2013年胆囊癌临床流行病学调查报告. 中华肝胆外科杂志. 2015;21:5-8. |
| 4. | Wistuba II, Gazdar AF. Gallbladder cancer: lessons from a rare tumour. Nat Rev Cancer. 2004;4:695-706. [PubMed] |
| 5. | Misra S, Chaturvedi A, Misra NC, Sharma ID. Carcinoma of the gallbladder. Lancet Oncol. 2003;4:167-176. [PubMed] |
| 6. | Kiran RP, Pokala N, Dudrick SJ. Incidence pattern and survival for gallbladder cancer over three decades--an analysis of 10301 patients. Ann Surg Oncol. 2007;14:827-832. [PubMed] |
| 7. | Miyakawa S, Ishihara S, Horiguchi A, Takada T, Miyazaki M, Nagakawa T. Biliary tract cancer treatment: 5,584 results from the Biliary Tract Cancer Statistics Registry from 1998 to 2004 in Japan. J Hepatobiliary Pancreat Surg. 2009;16:1-7. [PubMed] [DOI] |
| 8. | Fong Y, Wagman L, Gonen M, Crawford J, Reed W, Swanson R, Pan C, Ritchey J, Stewart A, Choti M. Evidence-based gallbladder cancer staging: changing cancer staging by analysis of data from the National Cancer Database. Ann Surg. 2006;243:767-771; discussion 771-774. [PubMed] |
| 9. | Shirai Y, Wakai T, Hatakeyama K. Radical lymph node dissection for gallbladder cancer: indications and limitations. Surg Oncol Clin N Am. 2007;16:221-232. [PubMed] |
| 10. | Kondo S, Takada T, Miyazaki M, Miyakawa S, Tsukada K, Nagino M, Furuse J, Saito H, Tsuyuguchi T, Yamamoto M. Guidelines for the management of biliary tract and ampullary carcinomas: surgical treatment. J Hepatobiliary Pancreat Surg. 2008;15:41-54. [PubMed] [DOI] |
| 11. | Jensen EH, Abraham A, Jarosek S, Habermann EB, Al-Refaie WB, Vickers SA, Virnig BA, Tuttle TM. Lymph node evaluation is associated with improved survival after surgery for early stage gallbladder cancer. Surgery. 2009;146:706-711; discussion 711-713. [PubMed] [DOI] |
| 12. | Murakami Y, Uemura K, Sudo T, Hashimoto Y, Nakashima A, Kondo N, Sakabe R, Kobayashi H, Sueda T. Prognostic factors of patients with advanced gallbladder carcinoma following aggressive surgical resection. J Gastrointest Surg. 2011;15:1007-1016. [PubMed] [DOI] |
| 13. | Zaydfudim V, Feurer ID, Wright JK, Pinson CW. The impact of tumor extent (T stage) and lymph node involvement (N stage) on survival after surgical resection for gallbladder adenocarcinoma. HPB (Oxford). 2008;10:420-427. [PubMed] [DOI] |
| 14. | Kim WS, Choi DW, You DD, Ho CY, Heo JS, Choi SH. Risk factors influencing recurrence, patterns of recurrence, and the efficacy of adjuvant therapy after radical resection for gallbladder carcinoma. J Gastrointest Surg. 2010;14:679-687. [PubMed] [DOI] |
| 15. | 耿 智敏, 王 林, 陈 晨, 慎 浩鑫, 宋 虎伟, 石 磊, 王 作仁, 赵 亚玲, 刘 青光. 438例胆囊癌外科治疗及预后因素分析. 中华消化外科杂志. 2016;15: 346-352. |
| 16. | Birnbaum DJ, Viganò L, Ferrero A, Langella S, Russolillo N, Capussotti L. Locally advanced gallbladder cancer: which patients benefit from resection? Eur J Surg Oncol. 2014;40:1008-1015. [PubMed] [DOI] |
| 17. | Ito M, Mishima Y, Sato T. An anatomical study of the lymphatic drainage of the gallbladder. Surg Radiol Anat. 1991;13:89-104. [PubMed] |
| 18. | Uesaka K, Yasui K, Morimoto T, Torii A, Yamamura Y, Kodera Y, Hirai T, Kato T, Kito T. Visualization of routes of lymphatic drainage of the gallbladder with a carbon particle suspension. J Am Coll Surg. 1996;183:345-350. [PubMed] |
| 19. | Shimada H, Endo I, Togo S, Nakano A, Izumi T, Nakagawara G. The role of lymph node dissection in the treatment of gallbladder carcinoma. Cancer. 1997;79:892-899. [PubMed] |
| 20. | Kishi Y, Shimada K, Hata S, Oguro S, Sakamoto Y, Nara S, Esaki M, Hiraoka N, Kosuge T. Definition of T3/4 and regional lymph nodes in gallbladder cancer: which is more valid, the UICC or the Japanese staging system? Ann Surg Oncol. 2012;19:3567-3573. [PubMed] [DOI] |
| 21. | Chijiiwa K, Noshiro H, Nakano K, Okido M, Sugitani A, Yamaguchi K, Tanaka M. Role of surgery for gallbladder carcinoma with special reference to lymph node metastasis and stage using western and Japanese classification systems. World J Surg. 2000;24:1271-1276; discussion 1277. [PubMed] |
| 24. | Oh TG, Chung MJ, Bang S, Park SW, Chung JB, Song SY, Choi GH, Kim KS, Lee WJ, Park JY. Comparison of the sixth and seventh editions of the AJCC TNM classification for gallbladder cancer. J Gastrointest Surg. 2013;17:925-930. [PubMed] [DOI] |
| 25. | Duffy A, Capanu M, Abou-Alfa GK, Huitzil D, Jarnagin W, Fong Y, D'Angelica M, Dematteo RP, Blumgart LH, O'Reilly EM. Gallbladder cancer (GBC): 10-year experience at Memorial Sloan-Kettering Cancer Centre (MSKCC). J Surg Oncol. 2008;98:485-489. [PubMed] [DOI] |
| 26. | Kondo S, Nimura Y, Hayakawa N, Kamiya J, Nagino M, Uesaka K. Regional and para-aortic lymphadenectomy in radical surgery for advanced gallbladder carcinoma. Br J Surg. 2000;87:418-422. [PubMed] |
| 27. | Sikora SS, Singh RK. Surgical strategies in patients with gallbladder cancer: nihilism to optimism. J Surg Oncol. 2006;93:670-681. [PubMed] |
| 28. | Sasaki R, Itabashi H, Fujita T, Takeda Y, Hoshikawa K, Takahashi M, Funato O, Nitta H, Kanno S, Saito K. Significance of extensive surgery including resection of the pancreas head for the treatment of gallbladder cancer--from the perspective of mode of lymph node involvement and surgical outcome. World J Surg. 2006;30:36-42. [PubMed] |
| 29. | Kai M, Chijiiwa K, Ohuchida J, Nagano M, Hiyoshi M, Kondo K. A curative resection improves the postoperative survival rate even in patients with advanced gallbladder carcinoma. J Gastrointest Surg. 2007;11:1025-1032. [PubMed] |
| 30. | Nishio H, Nagino M, Ebata T, Yokoyama Y, Igami T, Nimura Y. Aggressive surgery for stage IV gallbladder carcinoma; what are the contraindications? J Hepatobiliary Pancreat Surg. 2007;14:351-357. [PubMed] |
| 31. | Regimbeau JM, Fuks D, Bachellier P, Le Treut YP, Pruvot FR, Navarro F, Chiche L, Farges O. Prognostic value of jaundice in patients with gallbladder cancer by the AFC-GBC-2009 study group. Eur J Surg Oncol. 2011;37:505-512. [PubMed] [DOI] |
| 32. | Kelly KJ, Dukleska K, Kuk D, Kingham TP, D'Angelica MI, DeMatteo RP, Allen PJ, Jarnagin WR, Fong Y. Prognostic significance of the highest peripancreatic lymph node in biliary tract adenocarcinoma. Ann Surg Oncol. 2014;21:979-985. [PubMed] [DOI] |
| 33. | Tran TB, Nissen NN. Surgery for gallbladder cancer in the US: a need for greater lymph node clearance. J Gastrointest Oncol. 2015;6:452-458. [PubMed] [DOI] |
| 34. | Shimizu H, Kimura F, Yoshidome H, Ohtsuka M, Kato A, Yoshitomi H, Nozawa S, Furukawa K, Mitsuhashi N, Takeuchi D. Aggressive surgical approach for stage IV gallbladder carcinoma based on Japanese Society of Biliary Surgery classification. J Hepatobiliary Pancreat Surg. 2007;14:358-365. [PubMed] |
| 35. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 36. | Shirai Y, Sakata J, Wakai T, Ohashi T, Ajioka Y, Hatakeyama K. Assessment of lymph node status in gallbladder cancer: location, number, or ratio of positive nodes. World J Surg Oncol. 2012;10:87. [PubMed] [DOI] |
| 37. | Endo I, Shimada H, Tanabe M, Fujii Y, Takeda K, Morioka D, Tanaka K, Sekido H, Togo S. Prognostic significance of the number of positive lymph nodes in gallbladder cancer. J Gastrointest Surg. 2006;10:999-1007. [PubMed] |
| 38. | Sakata J, Shirai Y, Wakai T, Ajioka Y, Hatakeyama K. Number of positive lymph nodes independently determines the prognosis after resection in patients with gallbladder carcinoma. Ann Surg Oncol. 2010;17:1831-1840. [PubMed] [DOI] |
| 39. | Pawlik TM, Gleisner AL, Cameron JL, Winter JM, Assumpcao L, Lillemoe KD, Wolfgang C, Hruban RH, Schulick RD, Yeo CJ. Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer. Surgery. 2007;141:610-618. [PubMed] |
| 40. | Bando E, Yonemura Y, Taniguchi K, Fushida S, Fujimura T, Miwa K. Outcome of ratio of lymph node metastasis in gastric carcinoma. Ann Surg Oncol. 2002;9:775-784. [PubMed] |
| 41. | Negi SS, Singh A, Chaudhary A. Lymph nodal involvement as prognostic factor in gallbladder cancer: location, count or ratio? J Gastrointest Surg. 2011;15:1017-1025. [PubMed] [DOI] |
| 42. | Birnbaum DJ, Viganò L, Russolillo N, Langella S, Ferrero A, Capussotti L. Lymph node metastases in patients undergoing surgery for a gallbladder cancer. Extension of the lymph node dissection and prognostic value of the lymph node ratio. Ann Surg Oncol. 2015;22:811-818. [PubMed] [DOI] |
| 43. | Murakami Y, Uemura K, Sudo T, Hayashidani Y, Hashimoto Y, Nakashima A, Yuasa Y, Kondo N, Ohge H, Sueda T. Number of metastatic lymph nodes, but not lymph node ratio, is an independent prognostic factor after resection of pancreatic carcinoma. J Am Coll Surg. 2010;211:196-204. [PubMed] [DOI] |
| 44. | Lee JH, Lee KG, Ha TK, Jun YJ, Paik SS, Park HK, Lee KS. Pattern analysis of lymph node metastasis and the prognostic importance of number of metastatic nodes in ampullary adenocarcinoma. Am Surg. 2011;77:322-329. [PubMed] |
| 45. | Sierzega M, Nowak K, Kulig J, Matyja A, Nowak W, Popiela T. Lymph node involvement in ampullary cancer: the importance of the number, ratio, and location of metastatic nodes. J Surg Oncol. 2009;100:19-24. [PubMed] [DOI] |
| 48. | Eitan R, Sabah G, Krissi H, Raban O, Ben-Haroush A, Goldschmit C, Levavi H, Peled Y. Robotic blue-dye sentinel lymph node detection for endometrial cancer - Factors predicting successful mapping. Eur J Surg Oncol. 2015;41:1659-1663. [PubMed] [DOI] |
| 49. | Cozzaglio L, Bottura R, Di Rocco M, Gennari L, Doci R. Sentinel lymph node biopsy in gastric cancer: possible applications and limits. Eur J Surg Oncol. 2011;37:55-59. [PubMed] [DOI] |
| 50. | Wu X, Lin Q, Chen G, Lu J, Zeng Y, Chen X, Yan J. Sentinel Lymph Node Detection Using Carbon Nanoparticles in Patients with Early Breast Cancer. PLoS One. 2015;10:e0135714. [PubMed] [DOI] |
| 51. | Li Y, Jian WH, Guo ZM, Li QL, Lin SJ, Huang HY. A Meta-analysis of Carbon Nanoparticles for Identifying Lymph Nodes and Protecting Parathyroid Glands during Surgery. Otolaryngol Head Neck Surg. 2015;152:1007-1016. [PubMed] [DOI] |
| 54. | Handgraaf HJ, Verbeek FP, Tummers QR, Boogerd LS, van de Velde CJ, Vahrmeijer AL, Gaarenstroom KN. Real-time near-infrared fluorescence guided surgery in gynecologic oncology: a review of the current state of the art. Gynecol Oncol. 2014;135:606-613. [PubMed] [DOI] |
| 55. | How J, Gotlieb WH, Press JZ, Abitbol J, Pelmus M, Ferenczy A, Probst S, Gotlieb R, Brin S, Lau S. Comparing indocyanine green, technetium, and blue dye for sentinel lymph node mapping in endometrial cancer. Gynecol Oncol. 2015;137:436-442. [PubMed] [DOI] |
| 56. | van der Vorst JR, Schaafsma BE, Hutteman M, Verbeek FP, Liefers GJ, Hartgrink HH, Smit VT, Löwik CW, van de Velde CJ, Frangioni JV. Near-infrared fluorescence-guided resection of colorectal liver metastases. Cancer. 2013;119:3411-3418. [PubMed] [DOI] |
| 57. | Miyata A, Ishizawa T, Kamiya M, Shimizu A, Kaneko J, Ijichi H, Shibahara J, Fukayama M, Midorikawa Y, Urano Y. Photoacoustic tomography of human hepatic malignancies using intraoperative indocyanine green fluorescence imaging. PLoS One. 2014;9:e112667. [PubMed] [DOI] |
| 58. | Stacker SA, Williams SP, Karnezis T, Shayan R, Fox SB, Achen MG. Lymphangiogenesis and lymphatic vessel remodelling in cancer. Nat Rev Cancer. 2014;14:159-172. [PubMed] [DOI] |
| 59. | Tammela T, Alitalo K. Lymphangiogenesis: Molecular mechanisms and future promise. Cell. 2010;140:460-476. [PubMed] [DOI] |
| 60. | Longatto Filho A, Martins A, Costa SM, Schmitt FC. VEGFR-3 expression in breast cancer tissue is not restricted to lymphatic vessels. Pathol Res Pract. 2005;201:93-99. [PubMed] |
| 61. | Stacker SA, Caesar C, Baldwin ME, Thornton GE, Williams RA, Prevo R, Jackson DG, Nishikawa S, Kubo H, Achen MG. VEGF-D promotes the metastatic spread of tumor cells via the lymphatics. Nat Med. 2001;7:186-191. [PubMed] |
| 62. | Xu Y, Yuan L, Mak J, Pardanaud L, Caunt M, Kasman I, Larrivée B, Del Toro R, Suchting S, Medvinsky A. Neuropilin-2 mediates VEGF-C-induced lymphatic sprouting together with VEGFR3. J Cell Biol. 2010;188:115-130. [PubMed] [DOI] |
| 63. | Karnezis T, Shayan R, Caesar C, Roufail S, Harris NC, Ardipradja K, Zhang YF, Williams SP, Farnsworth RH, Chai MG. VEGF-D promotes tumor metastasis by regulating prostaglandins produced by the collecting lymphatic endothelium. Cancer Cell. 2012;21:181-195. [PubMed] [DOI] |
| 64. | Nakashima T, Kondoh S, Kitoh H, Ozawa H, Okita S, Harada T, Shiraishi K, Ryozawa S, Okita K. Vascular endothelial growth factor-C expression in human gallbladder cancer and its relationship to lymph node metastasis. Int J Mol Med. 2003;11:33-39. [PubMed] |
| 65. | Lin W, Jiang L, Chen Y, She F, Han S, Zhu J, Zhou L, Tang N, Wang X, Li X. Vascular endothelial growth factor-D promotes growth, lymphangiogenesis and lymphatic metastasis in gallbladder cancer. Cancer Lett. 2012;314:127-136. [PubMed] [DOI] |
| 66. | Du Q, Jiang L, Wang X, Wang M, She F, Chen Y. Tumor necrosis factor-α promotes the lymphangiogenesis of gallbladder carcinoma through nuclear factor-κB-mediated upregulation of vascular endothelial growth factor-C. Cancer Sci. 2014;105:1261-1271. [PubMed] [DOI] |
| 67. | Kato S, Shimoda H, Ji RC, Miura M. Lymphangiogenesis and expression of specific molecules as lymphatic endothelial cell markers. Anat Sci Int. 2006;81:71-83. [PubMed] |
| 68. | Breiteneder-Geleff S, Soleiman A, Kowalski H, Horvat R, Amann G, Kriehuber E, Diem K, Weninger W, Tschachler E, Alitalo K. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 1999;154:385-394. [PubMed] |
| 69. | Wilting J, Papoutsi M, Christ B, Nicolaides KH, von Kaisenberg CS, Borges J, Stark GB, Alitalo K, Tomarev SI, Niemeyer C. The transcription factor Prox1 is a marker for lymphatic endothelial cells in normal and diseased human tissues. FASEB J. 2002;16:1271-1273. [PubMed] |
| 70. | Kahn HJ, Bailey D, Marks A. Monoclonal antibody D2-40, a new marker of lymphatic endothelium, reacts with Kaposi's sarcoma and a subset of angiosarcomas. Mod Pathol. 2002;15:434-440. [PubMed] |
| 71. | Xiong Y, Cao LP, Rao HL, Cai MY, Liang LZ, Liu JH. Clinical significance of peritumoral lymphatic vessel density and lymphatic vessel invasion detected by D2-40 immunostaining in FIGO Ib1-IIa squamous cell cervical cancer. Cell Tissue Res. 2012;348:515-522. [PubMed] [DOI] |
| 72. | Wahal SP, Goel MM, Mehrotra R. Lymphatic vessel assessment by podoplanin (D2-40) immunohistochemistry in breast cancer. J Cancer Res Ther. 2015;11:798-804. [PubMed] [DOI] |
| 73. | 张 斌斌, 陈 义钢, 丁 厚中. 胆囊癌组织中微淋巴管密度的检测意义. 江苏大学学报(医学版). 2014;24:169-171. |
| 74. | Shimoda M, Mellody KT, Orimo A. Carcinoma-associated fibroblasts are a rate-limiting determinant for tumour progression. Semin Cell Dev Biol. 2010;21:19-25. [PubMed] [DOI] |
| 75. | Zhang Y, Tang H, Cai J, Zhang T, Guo J, Feng D, Wang Z. Ovarian cancer-associated fibroblasts contribute to epithelial ovarian carcinoma metastasis by promoting angiogenesis, lymphangiogenesis and tumor cell invasion. Cancer Lett. 2011;303:47-55. [PubMed] [DOI] |
| 76. | Folgueira MA, Maistro S, Katayama ML, Roela RA, Mundim FG, Nanogaki S, de Bock GH, Brentani MM. Markers of breast cancer stromal fibroblasts in the primary tumour site associated with lymph node metastasis: a systematic review including our case series. Biosci Rep. 2013;33:pii e00085. [PubMed] [DOI] |
| 77. | Garmy-Susini B, Avraamides CJ, Schmid MC, Foubert P, Ellies LG, Barnes L, Feral C, Papayannopoulou T, Lowy A, Blair SL. Integrin alpha4beta1 signaling is required for lymphangiogenesis and tumor metastasis. Cancer Res. 2010;70:3042-3051. [PubMed] [DOI] |
| 78. | Chen C, Shen H, Tao J, Song H, Ma L, Wang L, Geng Z. [Effect of cancer-associated fibroblasts on proliferation and invasion of gallbladder carcinoma cells]. Nanfang Yike Daxue Xuebao. 2015;35:1149-1154. [PubMed] |
| 80. | Anam MT, Ishika A, Hossain MB. A meta-analysis of hypoxia inducible factor 1-alpha (HIF1A) gene polymorphisms: association with cancers. Biomark Res. 2015;3:29. [PubMed] [DOI] |
| 81. | Giatromanolaki A, Sivridis E, Simopoulos C, Polychronidis A, Gatter KC, Harris AL, Koukourakis MI. Hypoxia inducible factors 1alpha and 2alpha are associated with VEGF expression and angiogenesis in gallbladder carcinomas. J Surg Oncol. 2006;94:242-247. [PubMed] |
| 83. | Wu W, Pan C, Yu H, Gong H, Wang Y. Heparanase expression in gallbladder carcinoma and its correlation to prognosis. J Gastroenterol Hepatol. 2008;23:491-497. [PubMed] |