修回日期: 2016-08-16
接受日期: 2016-10-08
在线出版日期: 2016-12-08
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性疾病, 病情迁延反复, 有癌变的风险. 目前UC的具体发病机制与发病原因尚不明确. 研究表明, 表观遗传修饰可介导UC的易感性基因与机体内、外环境间的相互影响, 在UC的始发及其疾病持续发展的过程中起重要的作用. 表观遗传修饰调控相关基因表达与UC患者的结肠黏膜免疫和防御密切相关. 因此, 本文对可能影响UC发病的表观遗传学机制进行综述, 探讨表观遗传修饰在UC发病中的作用.
核心提要: 目前溃疡性结肠炎(ulcerative colitis, UC)的具体发病机制与发病原因尚不明确. 而表观遗传修饰调控相关基因表达与UC患者的结肠黏膜免疫和防御密切相关. 通过表观遗传, 我们也许能对UC有更精准的把握, 使患者拥有更为精准的靶向治疗, 提高患者的生活质量.
引文著录: 张何骄子, 杨惠, 胡毓诗, 王祥, 吴巧凤. 表观遗传学在溃疡性结肠炎中的研究进展. 世界华人消化杂志 2016; 24(34): 4584-4588
Revised: August 16, 2016
Accepted: October 8, 2016
Published online: December 8, 2016
Ulcerative colitis (UC) is a nonspecific chronic disease that may relapse again and again and be associated with the risk of cancer. At present, the precise pathogenesis and etiology of UC are unclear. Research suggests that epigenetic modifications can mediate the mutual influence between susceptibility genes for ulcerative colitis and the internal and external environment of the body, and thus play an important part in the initial and sustainable development of UC. Regulation of expression of related genes by epigenetic modifications is closely linked to colonic mucosa immunity and defense in UC patients. In this paper, we will summarize the epigenetic mechanisms that may influence the pathogenesis of UC and discuss the role of epigenetic modifications in the pathogenesis of this disease.
- Citation: Zhang HJZ, Yang H, Hu YS, Wang X, Wu QF. Progress in epigenetic research of ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2016; 24(34): 4584-4588
- URL: https://www.wjgnet.com/1009-3079/full/v24/i34/4584.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i34.4584
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性结肠炎症, 病变累及结肠黏膜及黏膜下层, 多从结肠远段始发, 逐渐上行累及结肠近段, 甚至波及全结肠及末段回肠, 呈连续性分布. 病情迁延反复, 与克罗恩病(Crohn's disease, CD)一起被称为"不是癌症的癌症". 基于对UC的研究发现, 其发生、发展是一个相当复杂的过程, 涉及易感性基因响应肠道微生物内环境及其他外环境因素的变化, 既可引发对机体固有免疫、特异免疫的保护和耐受, 又可引起慢性炎症. 表观遗传学是指基因的DNA序列没有发生改变的情况下, 基因功能发生了可遗传的遗传信息变化, 并最终导致了表型的变化[1]. 经研究[2]发现, 表观遗传与人类的很多疾病相关, 环境压力诱导的一些分子也会引起表观遗传变异. 表观遗传修饰可介导炎症性肠病(inflammatory bowel disease, IBD)的易感性基因与机体内、外环境间的相互影响, 在IBD的始发及其持续发展过程中起重要作用, 随着高通量测序技术的出现, 全基因组相关研究和全表观基因组甲基化关联研究策略的相关研究证实IBD的163个易感基因, 有23个与单纯UC相关[3]. 表观遗传学在UC的发病机制中通过DNA甲基化、组蛋白修饰、非编码RNA(non-coding RNA, ncRNA)介导的基因沉默等方式, 扮演了一个关键的角色, 影响基因和环境因素之间的相互作用[4-6]. 因此, 本文对可能影响UC发病的表观遗传学机制进行综述, 探讨表观遗传修饰在UC发病中的.
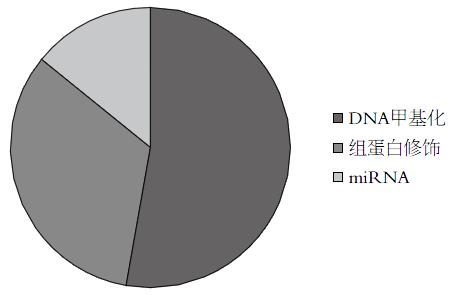
通过文献检索发现, 目前对表观遗传研究最广泛的是DNA甲基化和组蛋白修饰及微小RNA(microRNA, miRNA)等(图1), 其中DNA甲基化是目前研究得最多、最清楚的表观遗传修饰方式. DNA甲基化在生物体内有多方面的重要生理意义. 正常的甲基化对于维持细胞的生长及代谢是必需的, 有学者对新诊断的胎儿和儿童IBD人肠上皮细胞全基因组DNA甲基化图谱分层聚类, 证明大多数IBD样本中存在甲基化差异, 通过调节性差异甲基化区阵列数据, 结果表明在新诊断为IBD患者的肠上皮细胞中存在黏蛋白MUC2和聚合物免疫球蛋白受体的监管差异甲基化区域有改变, 在维恩图中胎儿和儿童中新确诊的IBD肠上皮细胞与健康组对比呈现出显著差异甲基化位置重叠, CPGs在IBD上皮细胞中显著改变, 在胎儿到小儿肠上皮细胞过渡期间40%发生显著DNA甲基化改变. 以上结果表明在人肠上皮细胞的功能开发上, DNA甲基化起关键作用. 因此, DNA甲基化具有调节人体肠上皮的功能性成熟的生理作用[7]. 而异常的DNA甲基化则会引发疾病DNA高度甲基化, 进而影响DNA结构, 进而阻遏基因转录, 引起基因沉默[8]. DNA甲基化在UC疾病发生、发展中是研究最早的一个表观遗传修饰机制. 在1996年, 第一次出现了UC和DNA甲基化有关的相关报道, 结果表明, 3H甲基的DNA的含量10倍高于对照组, 且在UC的活动期的含量也明显高于非活动期[9]. 1998年, Hsies等[10]发现, 在89例UC患者的结肠组织中的p16INK4a甲基化区域性的负增长, 不典型增生和癌变病灶呈渐进增加(12.07%、70.00%、100%), 证明UC中肿瘤的发展与DNA甲基化和炎症呈正相关. 2009年, 对83例UC患者直肠黏膜和17例正常远端直肠多药耐药基因MDR1启动子甲基化特异性聚合酶测定发现, 直肠黏膜炎症标本61.4%发生了甲基化, 与正常回肠末端相比直肠炎症黏膜甲基化显著增高(P = 0.021). MDR1基因甲基化与直肠结肠炎相比更频繁的发生在完全性结肠炎中(P = 0.001), 高甲基化水平与慢性持续性结肠炎(P = 0.034)和早期疾病发病(P = 0.038)有关. 说明MDR1基因甲基化与UC的临床表型有关[11]. 死亡相关蛋白激酶(death-associate dprotein kinase, DAPK)在UC患者炎症黏膜上的甲基化梯度与炎症从轻微到严重的梯度相似. 在DAPK黏膜为甲基化蛋白的表达与炎症严重程度呈正相关, 可能代表DAPK在UC慢性炎症过程中起保护作用[12,13]. 在发生了肿瘤的UC病例中, 肠道非肿瘤上皮的雌激素受体(oestrogen receptor, OR)基因甲基化发生率为77.0%, 而未发生肿瘤的UC病例中, OR的发生率为24.2%[14]. 长期重度UC患者肠道非肿瘤上皮的雌激素受体基因甲基化可预示结肠直肠癌肿瘤的发生. 2012年UC的功能性甲基化图谱被公布, 结果提示了61个与UC疾病相关的甲基化位点[4]. 另有研究[15]表明, UC患者ESR-1和N-33基因的启动子区域发生了甲基化, 尤其是N-33基因处于高甲基化状态, 可能促进了UC患者结直肠组织老化或者是端粒缩短. 基因组分析[16]表明, 严重的UC的炎症或肿瘤与CPG位点的超甲基化有关. 超甲基化的时间延长, 与癌症患者的病情关系显著. 以上研究表明, DNA甲基化在UC中是普遍现象, 尤其多发于有炎症的结肠黏膜组织中. DNA甲基化已经涉及到临床多个方面, 如病情严重程度、病程、疾病表型、疾病的程度、发病年龄、住院次数、活动性炎症及不典型增生等[17].
组蛋白是染色质的主要成分之一, 其氨基端的氨基酸残基可以被共价修饰, 进而改变染色质构型, 导致转录激活或基因沉默. 组蛋白修饰除了简单地调控基因表达, 更在于他可以招募蛋白复合体, 影响下游蛋白, 从而参与细胞分裂、细胞凋亡和记忆形成, 甚至影响免疫系统和炎症反应[18]. 组蛋白转录后修饰通常发生在精氨酸、赖氨酸、丝氨酸及苏氨酸的末端残基上, 主要包括乙酰化、甲基化、泛素化等[19]. 其中, H3和H4赖氨酸末端残基乙酰化是被研究较为明确的, 与基因活化呈正相关, 但具体作用机制尚未清楚. 研究[20]发现, 由H3K27去甲基化酶JMJD3介导的H3K27去甲基化, 可调控的Th17细胞的分化, 认为JMJD3可用于抑制自身免疫应答的新的治疗靶标. 也有学者提出多硫复合物可能对结肠组织的H3K4me3和H3K27me3获得甲基化具有一定的作用, 对结肠组织癌症的发展有一些作用[21]. 组蛋白乙酰化与去乙酰化状态主要受组蛋白乙酰转移酶和组蛋白去乙酰化酶相互作用调控. 两者之间的动态平衡决定着染色质的结构和基因的表达, 组蛋白乙酰化及去乙酰化修饰是最重要的方式, 是基因表达调控最主要的驱动力. 2013年研究[5]发现, 在大肠上皮细胞条件性敲除组蛋白去乙酰化酶(histone deacetylase, HDAC)3基因后结直肠出现了明显的表型, 结直肠明显缩短, 去乙酰化酶缺失后体内H3K9乙酰化水平增多, 而UC模型小鼠体质量下降, 有结直肠明显的炎症损害, 说明了HDAC3在UC疾病中具有重要的作用. 同年, 报道了黑树莓通过纠正抑癌基因启动子区域高甲基化, 从而抑制了葡聚糖硫酸钠诱导的结直肠的溃疡, 结肠组织HDAC1、HDAC2和甲基化结合区域2表达水平均出现下调[5]. 另有学者发现组蛋白去乙酰化酶9和抗衰老因子SIRT6在UC中的表达低于在CD的表达[22], 因此组蛋白去乙酰化酶可能可以作为区分UC和CD的标志物. 有学者利用组蛋白H1诊断UC亚型(核周中性粒细胞胞浆抗体阳性)并确定个体对UC的易感性[23]. 以上研究表明, 组蛋白乙酰化及去乙酰化的相关研究较多, 两者间的动态平衡决定着染色质的结构和基因的表达, 并影响着炎症的发生.
在复杂的生物体内, 基因表达受到很多因素影响. 在近期高通量基因组水平的分析中, 越来越多的证据表明ncRNA在调控基因表达过程中发挥了很大作用. 在所有输出的转录本中, 编码蛋白的RNA数量不足1.5%, 剩下的是ncRNA[19]. 根据长度分类, 介导表观遗传修饰的ncRNA可分为长链非编码RNA(long ncRNA, lncRNA)和小分子非编码RNA. 另有研究者从活动期UC患者结肠中提取总RNA[24], 使用miRNA微阵列绘制miRNA表达谱, 结果发现几个miRNA在UC患者肠黏膜上表达, 上调miRNA可能对UC的发展有影响. 有学者将60例活动期UC患者乙状结肠进行活检[25], 通过原位杂交检测定位的lncRNA和在细胞内的RNA. 确定了上调基因329个, 明显上调3个, 下调基因126个, 明显下调3个, 特别是bc012900表达在活动期显著增加, bc012900过表达对上皮细胞增殖有明显的抑制作用. lncRNA可能与IBD的整体调节有关, 也许可作为未来靶向治疗和诊断的标志物. 有学者对IBD患者结肠炎症和非炎症黏膜活检[26], 采用表达谱芯片平台对lncRNA和编码蛋白基因全基因组转录编码基因谱, IBD与正常对照组比lncRNA普遍失调, 其中UC有745个差异表达. 皮尔森χ2检验显示有96个差异表达的lncRNA和154个蛋白质编码基因在IBD易感基因位点上. 而相交和相邻的差异性表达IBD基因相关蛋白编码基因lncRNA成对出现强阳性表达. 结果表明, lncRNA表达谱可以用于分层IBD炎症和非炎症区域. 另外, lncRNA转录相关信号可能可以作为IBD潜在生物标志物.
表观遗传使人们更深刻的明白基因与表型的关系, 对在分子水平上表观遗传如何发挥作用有了一定的认识. 在UC炎症中, 分子水平的变化会引起相应的表型的变化, 并影响了易感基因、营养、肠道微生物及其他环境因素之间相互作用. 表观遗传信息容易受环境影响, 容易发生动态的可逆的变化.
目前UC的具体发病机制与发病原因尚不明确. 而表观遗传修饰调控相关基因表达与UC患者的结肠黏膜免疫和防御密切相关. 因此, 表观遗传修饰也许是一个突破点.
通过总结近年文献发现(图1), 组蛋白修饰和ncRNA的相关研究少. 通过进一步的研究, 我们也许能对UC的发病有更精准的把握, 可以在临床上通过人的粪便中DNA的检查, 更早的发现UC的发生, 能够通过潜在的生物标志物较准确的判断疾病的性质, 可以较准确的掌握UC的发展, 能够较详细的判断疾病的预后, 甚至判断患者再入院的可能, 使患者拥有更为精准的靶向治疗, 提高患者的生活质量.
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性结肠炎症. UC涉及易感性基因响应肠道微生物内环境及其他外环境因素的变化, 又可引起慢性炎症. 而表观遗传修饰调控相关基因表达与UC患者的结肠黏膜免疫和防御密切相关. 因此, 表观遗传修饰也许是一个突破点.
目前DNA甲基化, 组蛋白修饰, 非编码RNA(non-coding RNA, ncRNA)是研究热点, 近10年来以DNA甲基化最多, 近5年来表观遗传学的研究前沿主要为ncRNA.
本文总结综述多为近十年来表观遗传在UC中的研究, 并检索2006-2016年文献, 总结了近十年来已发表文章中DNA甲基化, 组蛋白修饰, ncRNA在UC中的研究分布, 并个别引用了相关专利. 通过对文献的总结发现, 在UC相关的研究中, ncRNA、组蛋白修饰的相关研究较DAN甲基化少. DNA甲基化在UC中是普遍现象, DNA甲基化已经涉及到临床多个方面, 如病情严重程度、病程、疾病表型、疾病的程度、发病年龄、住院次数等. 而对ncRNA、组蛋白修饰的进一步研究, 也许是UC发病机制及发病原因的突破口, 能对UC的发病有更精准的把握.
通过表观遗传, 大家也许能对UC有更精准的把握, 更早的发现UC的发生, 能够通过潜在的生物标志物较准确的判断疾病的性质, 可以较准确的掌握UC的发展, 能够较详细的判断疾病的预后, 甚至判断患者再入院的可能, 使患者拥有更为精准的靶向治疗, 提高患者的生活质量.
吴焕淦, 教授, 博士生导师, 上海市针灸经络研究所
本文从表观遗传学的角度综述了UC的发病机制, 分别从DNA甲基化、组蛋白修饰和ncRNA 3个层面进行了总结, 并综述了表观遗传的作用, 具有一定的新意.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Burnford J. Ulcerative Colitis: Its Treatment By Ionization: Summary of Twenty-Eight Cases. Br Med J. 1930;2:640-641. [PubMed] [DOI] |
| 2. | 黄 艳, 窦 传字, 黄 任佳, 吴 璐一, 王 硕硕, 翁 志军, 包 春辉, 刘 慧荣, 吴 焕淦. 从表观遗传修饰角度探讨艾灸对炎症性肠病的调控机制. 中国组织工程研究. 2015;2:294-299. |
| 3. | Jostins L, Ripke S, Weersma RK, Duerr RH, McGovern DP, Hui KY, Lee JC, Schumm LP, Sharma Y, Anderson CA. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 2012;491:119-124. [PubMed] [DOI] |
| 4. | Häsler R, Feng Z, Bäckdahl L, Spehlmann ME, Franke A, Teschendorff A, Rakyan VK, Down TA, Wilson GA, Feber A. A functional methylome map of ulcerative colitis. Genome Res. 2012;22:2130-2137. [PubMed] [DOI] |
| 5. | Alenghat T, Osborne LC, Saenz SA, Kobuley D, Ziegler CG, Mullican SE, Choi I, Grunberg S, Sinha R, Wynosky-Dolfi M. Histone deacetylase 3 coordinates commensal-bacteria-dependent intestinal homeostasis. Nature. 2013;504:153-157. [PubMed] [DOI] |
| 6. | Chen WX, Ren LH, Shi RH. Implication of miRNAs for inflammatory bowel disease treatment: Systematic review. World J Gastrointest Pathophysiol. 2014;5:63-70. [PubMed] [DOI] |
| 7. | Kraiczy J, Nayak K, Ross A, Raine T, Mak TN, Gasparetto M, Cario E, Rakyan V, Heuschkel R, Zilbauer M. Assessing DNA methylation in the developing human intestinal epithelium: potential link to inflammatory bowel disease. Mucosal Immunol. 2016;9:647-658. [PubMed] [DOI] |
| 9. | Glória L, Cravo M, Pinto A, de Sousa LS, Chaves P, Leitão CN, Quina M, Mira FC, Soares J. DNA hypomethylation and proliferative activity are increased in the rectal mucosa of patients with long-standing ulcerative colitis. Cancer. 1996;78:2300-2306. [PubMed] [DOI] |
| 10. | Hsieh CJ, Klump B, Holzmann K, Borchard F, Gregor M, Porschen R. Hypermethylation of the p16INK4a promoter in colectomy specimens of patients with long-standing and extensive ulcerative colitis. Cancer Res. 1998;58:3942-3945. [PubMed] |
| 11. | Tahara T, Shibata T, Nakamura M, Yamashita H, Yoshioka D, Okubo M, Maruyama N, Kamano T, Kamiya Y, Nakagawa Y. Effect of MDR1 gene promoter methylation in patients with ulcerative colitis. Int J Mol Med. 2009;23:521-527. [PubMed] [DOI] |
| 12. | Kuester D, Guenther T, Biesold S, Hartmann A, Bataille F, Ruemmele P, Peters B, Meyer F, Schubert D, Bohr UR. Aberrant methylation of DAPK in long-standing ulcerative colitis and ulcerative colitis-associated carcinoma. Pathol Res Pract. 2010;206:616-624. [PubMed] [DOI] |
| 13. | Cooke J, Zhang H, Greger L, Silva AL, Massey D, Dawson C, Metz A, Ibrahim A, Parkes M. Mucosal genome-wide methylation changes in inflammatory bowel disease. Inflamm Bowel Dis. 2012;18:2128-2137. [PubMed] [DOI] |
| 14. | Fujii S, Tominaga K, Kitajima K, Takeda J, Kusaka T, Fujita M, Ichikawa K, Tomita S, Ohkura Y, Ono Y. Methylation of the oestrogen receptor gene in non-neoplastic epithelium as a marker of colorectal neoplasia risk in longstanding and extensive ulcerative colitis. Gut. 2005;54:1287-1292. [PubMed] [DOI] |
| 15. | Arasaradnam RP, Khoo K, Bradburn M, Mathers JC, Kelly SB. DNA methylation of ESR-1 and N-33 in colorectal mucosa of patients with ulcerative colitis (UC). Epigenetics. 2010;5:422-426. [PubMed] [DOI] |
| 16. | Tahara T, Nakano N, Nagasaka M, Nakagawa Y, Shibata T, Ohmiya N, Hirata I. Abstract 1053: Potential utility of DNA methytlation as a biomarker for prediction of ulcerative colitis associated colitic cancer (UCAC). Cancer Res. 2015;75:1053-1053. [DOI] |
| 17. | Karatzas PS, Gazouli M, Safioleas M, Mantzaris GJ. DNA methylation changes in inflammatory bowel disease. Ann Gastroenterol. 2014;27:125-132. |
| 20. | Liu Z, Cao W, Xu L, Chen X, Zhan Y, Yang Q, Liu S, Chen P, Jiang Y, Sun X. The histone H3 lysine-27 demethylase Jmjd3 plays a critical role in specific regulation of Th17 cell differentiation. J Mol Cell Biol. 2015;7:505-516. [PubMed] [DOI] |
| 21. | Hahn MA, Li AX, Wu X, Yang R, Drew DA, Rosenberg DW, Pfeifer GP. Loss of the polycomb mark from bivalent promoters leads to activation of cancer-promoting genes in colorectal tumors. Cancer Res. 2014;74:3617-3629. [PubMed] [DOI] |
| 22. | P022. Histone deacetylases in inflammatory mucosa distinguish Crohn's disease from ulcerative colitis. J Crohns Colitis. 2015;9 Suppl 1:S87-88. [DOI] |
| 23. | Braun J, Targan S R, Eggena M. Diagnosis of ulcerative colitis, and clinical subtypes thereof, using histone H1. : EP0959900[P] 2008; 1-14. |
| 24. | Takagi T, Naito Y, Mizushima K, Hirata I, Yagi N, Tomatsuri N, Ando T, Oyamada Y, Isozaki Y, Hongo H. Increased expression of microRNA in the inflamed colonic mucosa of patients with active ulcerative colitis. J Gastroenterol Hepatol. 2010;25 Suppl 1:S129-S133. [PubMed] [DOI] |
| 25. | Wu F, Huang Y, Dong F, Kwon JH. Ulcerative Colitis-Associated Long Noncoding RNA, BC012900, Regulates Intestinal Epithelial Cell Apoptosis. Inflamm Bowel Dis. 2016;22:782-795. [PubMed] [DOI] |
| 26. | Mirza AH, Berthelsen CH, Seemann SE, Pan X, Frederiksen KS, Vilien M, Gorodkin J, Pociot F. Transcriptomic landscape of lncRNAs in inflammatory bowel disease. Genome Med. 2015;7:39. [PubMed] [DOI] |