修回日期: 2016-10-12
接受日期: 2016-10-24
在线出版日期: 2016-12-08
探讨CMTM7基因在肝细胞癌(hepatocellular carcinoma, HCC)及其癌旁正常组织中的表达及其临床意义.
采用组织芯片技术和免疫组织化学法检测75例HCC及其对应癌旁正常组织中CMTM7基因的表达, 分析其与HCC临床病理特征及与患者预后的关系.
CMTM7在HCC中的表达(20.00%, 15/75)明显低于其癌旁正常组织(81.33%, 61/75), 组间比较差异有统计学意义(P<0.05). CMTM7表达与HCC患者性别、年龄、吸烟史、饮酒史、乙型肝炎病毒感染、肿瘤家族史、肿瘤数目、病理分级、临床分期、是否合并肝硬化及远处转移等无关, 与肿瘤大小、TNM分期和甲胎蛋白水平有相关性(P<0.05). CMTM7阴性组患者的术后生存时间明显低于阳性组, 提示CMTM7阴性表达可能与HCC患者的预后有关.
CMTM7基因表达下调可能与HCC的发生、发展密切相关.
核心提要: 肝细胞癌(hepatocellular carcinoma, HCC)是多基因遗传因素与环境因素共同作用而引起的恶性肿瘤, 本研究首次报道了CMTM7表达与HCC发病及预后的关系, 发现CMTM7阴性表达是HCC不良预后的危险因素, 有望成为HCC不良预后预测的新指标.
引文著录: 曾文, 朱小年, 罗伟, 陈秋月, 张瑛, 谭盛葵. CMTM7基因在肝细胞癌中的表达及临床意义. 世界华人消化杂志 2016; 24(34): 4568-4575
Revised: October 12, 2016
Accepted: October 24, 2016
Published online: December 8, 2016
To detect the expression of CMTM7 in hepatocellular carcinoma (HCC) and to analyze its clinical significance.
Tissue microarray and immunohistochemistry method were used to detect 75 pairs of HCC tissues and tumor-adjacent normal tissues. The relationship of CMTM7 expression with clinical pathological features and overall survival of postoperative patients was analyzed statistically.
The expression rate of CMTM7 in HCC tissues (20.00%, 15/75) was significantly lower than that in paired para-carcinoma normal tissues (81.33%, 61/75; P < 0.05). The expression of CMTM7 in HCC had no obvious correlation with gender, age, smoking history, drinking history, family history of hepatitis B virus infection or tumor, tumor number, pathological classification, or clinical stage. However, CMTM7 expression had a significant correlation with liver cirrhosis, distant metastasis, tumor size, TNM stage, and α-fetoprotein levels (P < 0.05). The survival time of postoperative HCC patients in the CMTM7 negative group was obviously lower than that of patients in the CMTM7 positive group, suggesting that CMTM7 expression may be related to the prognosis of HCC patients.
The down-regulated expression of CMTM7 may be closely related with the occurrence and development of HCC.
- Citation: Zeng W, Zhu XN, Luo W, Chen QY, Zhang Y, Tan SK. Clinical significance of expression of CMTM7 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(34): 4568-4575
- URL: https://www.wjgnet.com/1009-3079/full/v24/i34/4568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i34.4568
CMTM7基因是CMTM家族成员之一, 位于第3号染色体(3p22.3), 是2003年北京大学人类疾病基因研究中心韩文玲博士等[1]在国际上首先克隆的人类新基因, 其结构和功能特点介于经典的趋化因子与4次跨膜蛋白之间, 定位于抑癌基因富集区, 其启动子区具有典型的CpG岛. 研究[2-7]发现, CMTM7基因在人类正常组织和上皮细胞中广泛表达, 而在多种肿瘤来源的细胞株和原发肿瘤组织中表达下调或缺失, 其启动子区存在甲基化修饰, 在肿瘤细胞中恢复其表达, 可抑制肿瘤细胞增殖、迁移, 甚至启动细胞凋亡, 提示CMTM7在肿瘤的临床诊断、个性化治疗以及预后分析中具有潜在的实用价值. 迄今, 国内外有关CMTM7与肿瘤的研究主要集中于食管癌和肺癌, 而有关在其他肿瘤的研究甚少, 特别是在肝癌发生发展中的研究目前尚未见报道. 本文应用免疫组织化学SP法检测CMTM7在肝细胞癌(hepatocellular carcinoma, HCC)和癌旁组织中的表达, 分析其与HCC临床病理特征及预后的关系, 为寻找早期诊断的分子标志物及分子靶向治疗的有效靶点提供参考.
收集桂林医学院附属医院病理科2007-2015年存档的HCC及相应的癌旁组织石蜡标本75例, 临床和病理诊断均为HCC, 选取的癌旁组织距癌灶距离>2 cm. 所有患者均行手术治疗, 术前均未进行放、化疗, 且有完整的临床资料; 男性61例, 女性14例, 年龄18-73岁, 均值为49.81岁±13.29岁; 肿瘤直径<5 cm者36例, 直径≥5 cm者39例; 肿瘤数目单发40例, 多发35例; 伴有转移24例(包括淋巴结转移、癌栓形成及远处转移等); TNM分期为T1+T2为43例, T3+T4为32例; 血清甲胎蛋白(α-fetoprotein, AFP)≥400 ng/mL者43例, AFP<400 ng/mL者32例. 所有患者通过门诊复查或电话进行随访. 自入组之日起, 每半年随访1次, 随访时间截至2015-06. 生存时间从术后第1天开始计算, 至患者出现转移、复发或死亡或随访结束日, 以月为单位计算生存期. 所有标本获取均征得患者及家属同意, 并通过医院伦理委员会批准. 由桂林泛谱公司将石蜡组织标本制成组织芯片, 包含HCC和癌旁组织的有效组织共150例. 一抗兔抗人CMTM7多克隆抗体购自美国SAB公司(Catalog No:#36884); 羊抗兔二抗购自福州迈新公司.
1.2.1 免疫组织化学SP法: 采用免疫组织化学SP法检测CMTM7表达, 具体步骤如下: 先将组织芯片放于60 ℃烘箱中烤片2 h后取出经二甲苯脱蜡, 梯度乙醇水化, 置于pH 8.0的EDTA缓冲液中高压加热抗原修复2 min, 浸泡于3%过氧化物溶液15 min去除内源性过氧化物酶, PBS缓冲液清洗后滴加羊血清封闭20 min, 甩干后滴加CMTM7一抗(工作浓度1:60), 4 ℃冰箱过夜; 第2天用PBS缓冲液清洗后滴加羊抗兔二抗, 室温下孵育30 min, PBS缓冲液清洗后滴加DAB显色, 显微镜下观察3-10 min至显色合适为止. 苏木精复染、1%的盐酸酒精分化、流水返蓝、梯度酒精脱水、透明、中性树胶封片固定. 全程无干片情况.
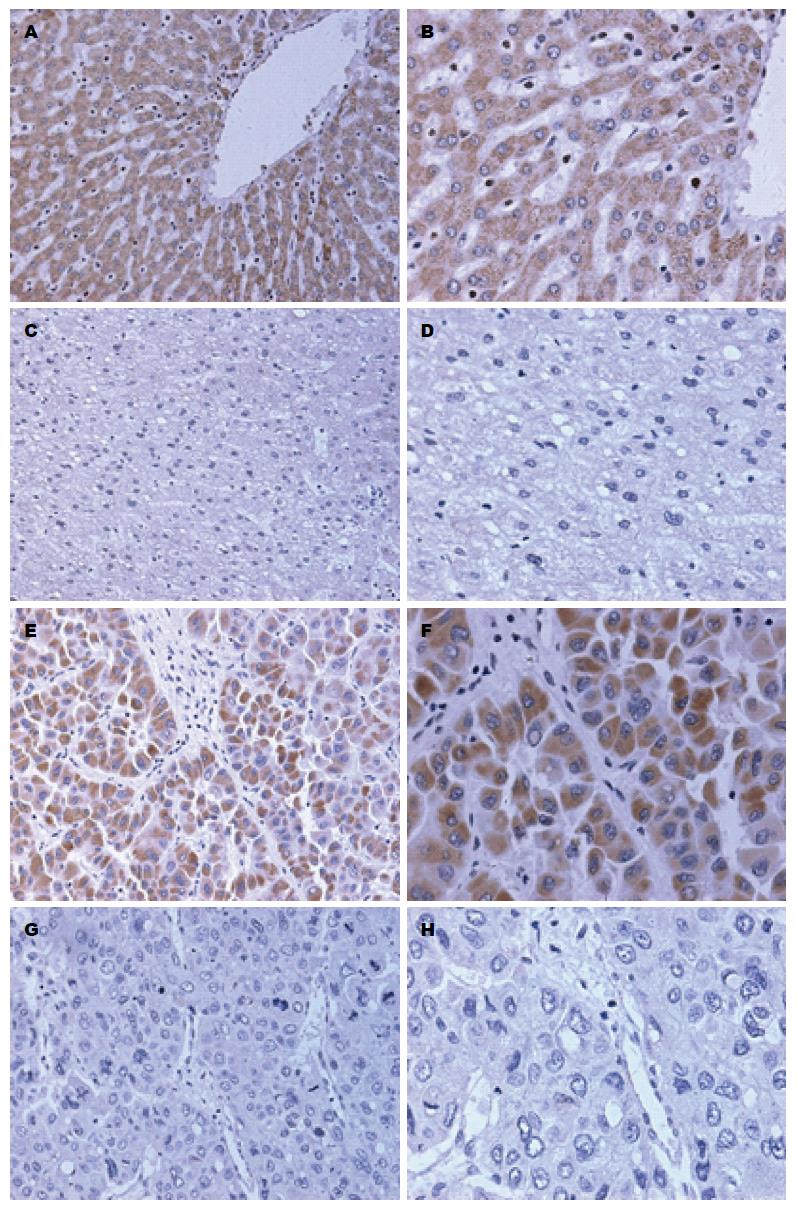
1.2.2 结果判定: (1)在400倍镜下随机选取5个不同的视野, 计数细胞总数及阳性细胞数按阳性细胞所占的百分比记分: 染色细胞≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; (2)按染色强弱程度计分: 未着色为0分, 浅黄色为1分, 棕黄色为2分, 黄褐色为3分. 最后将两项得分结果相乘: 0分为(-), 1-4分为(+), 5-8分为(++), 9-12分为(+++), 本组中总分≤4分为阴性, >4分为阳性.
统计学处理 所有数据均经SPSS19.0软件进行统计学处理, 各组间差异比较采用χ2检验, 生存概率采用Kaplan-Meier法估计, 组间生存曲线采用Log-rank检验. 以P<0.05为差异具有统计学意义.
HCC组织中CMTM7表达主要呈阴性; 癌旁组织中CMTM7表达主要呈阳性, 其阳性表达部位主要位于细胞质和细胞膜, 但在癌中可见少许的核表达(图1). CMTM7在HCC及其癌旁组织中的阳性率分别20.00%(15/75)、81.33%(61/75), CMTM7在HCC中阳性表达明显低于癌旁组织, 组间比较差异有统计学意义(χ2 = 54.74, P<0.05, 表1).
| HCC组织 | 癌旁组织 | 合计 | |
| + | - | ||
| + | 14 | 1 | 15 |
| - | 47 | 13 | 60 |
| 合计 | 61 | 14 | 75 |
CMTM7表达与HCC患者性别、年龄、吸烟、饮酒、是否合并乙型肝炎病毒感染、是否有肝癌家族史等均无明显相关性(P>0.05), 而与肿瘤大小、肿瘤数目、病理分级、临床分期、TNM分期、血清AFP水平及远处转移等则具有相关性(P<0.05, 表2). 多因素逻辑回归分析发现CMTM7表达与远处转移有关(P<0.05), 其OR值为5.291(95%CI: 1.021-27.418).
| 临床病理参数 | n | CMTM7 | χ2值 | P值 | |
| + | - | ||||
| 性别 | 0.351 | 0.553 | |||
| 男 | 61 | 13 | 48 | ||
| 女 | 14 | 2 | 12 | ||
| 年龄(岁) | 0.013 | 0.908 | |||
| <50 | 34 | 7 | 27 | ||
| ≥50 | 41 | 8 | 33 | ||
| 吸烟史 | 0.886 | 0.352 | |||
| 无 | 42 | 10 | 32 | ||
| 有 | 33 | 5 | 28 | ||
| 饮酒史 | 0.335 | 0.563 | |||
| 无 | 35 | 6 | 29 | ||
| 有 | 40 | 9 | 31 | ||
| HBV感染 | 0.521 | 0.470 | |||
| 无 | 15 | 2 | 13 | ||
| 有 | 60 | 13 | 47 | ||
| 肿瘤家族史 | 1.587 | 0.208 | |||
| 无 | 63 | 11 | 52 | ||
| 有 | 12 | 4 | 8 | ||
| 肿瘤大小 | 3.854 | 0.050 | |||
| <5 | 38 | 11 | 27 | ||
| ≥5 | 37 | 4 | 33 | ||
| 肿瘤数目 | 1.339 | 0.247 | |||
| 单发 | 40 | 10 | 30 | ||
| 多发(≥2) | 35 | 5 | 30 | ||
| 临床分期 | 2.286 | 0.131 | |||
| Ⅰ+Ⅱ期 | 42 | 11 | 31 | ||
| Ⅲ+Ⅳ期 | 33 | 4 | 29 | ||
| TNM分期 | 3.938 | 0.047 | |||
| T1+T2 | 43 | 12 | 31 | ||
| T3+T4 | 32 | 3 | 29 | ||
| 病理分级 | 1.616 | 0.204 | |||
| Ⅰ+Ⅱ | 33 | 10 | 29 | ||
| Ⅲ | 42 | 5 | 31 | ||
| 是否肝硬化 | 0.853 | 0.356 | |||
| 无 | 37 | 9 | 28 | ||
| 有 | 38 | 6 | 32 | ||
| 远处转移 | 4.181 | 0.041 | |||
| 无 | 51 | 13 | 35 | ||
| 有 | 24 | 2 | 25 | ||
| 血清AFP(ng/mL) | 4.415 | 0.036 | |||
| <400 | 32 | 10 | 22 | ||
| ≥400 | 43 | 5 | 38 | ||
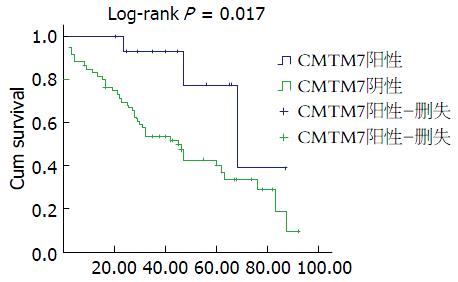
采用Kaplan-Meier模型分析CMTM7表达对HCC患者预后的影响发现: CMTM7阳性组患者的中位生存时间为68 mo(95%CI: 37.79-98.21); 而CMTM7阴性组患者的中位生存时间是45 mo(95%CI: 30.66-59.34), 进一步行Log-rank检验发现: CMTM7阴性组患者术后存活时间显著低于CMTM7阳性组(P = 0.017, 图2). 通过校正性别、年龄, 将肿瘤大小、TNM分期、远处转移、血清AFP水平及CMTM7进行COX比例风险模型预后多因素分析(纳入标准为α = 0.05, 剔除标准为β = 0.1), 发现CMTM7为HCC患者的独立预后因素(P = 0.028), 其OR值为3.750(95%CI: 1.156-12.162, 表3).
| 因素 | B | Wald | P值 | OR | 95%CI for OR | |
| Lower | Upper | |||||
| CMTM7 | 1.322 | 4.849 | 0.028 | 3.750 | 1.156 | 12.162 |
HCC, 简称肝癌, 是消化系统常见的恶性肿瘤, 是多基因遗传因素与环境因素共同作用而引起的复杂性疾病[8-10]. 中国每年约有36万新发病例和35万死亡病例[11,12], 据世界卫生组织《2014年世界癌症报告》显示目前中国HCC发患者数占全球HCC患者的55%. 广西是我国肝癌的高发区, 肝癌死亡率高居广西肿瘤死因谱首位, 约占全部恶性肿瘤死亡率的40%[8,13]. 尽管以手术切除和肝移植为主的综合治疗使肝癌的疗效有较大提高, 但肝癌临床治愈率和长期生存率无明显改善, 在我国术后5年内仍有60%-70%的患者出现转移复发, 甚至更高[13]. 目前国内外对肝癌的发病原因、预后标志物、分子靶点和癌变机制等进行了广泛的研究[14-19], 但肝癌确切的发病分子机制尚不完全清楚.
肿瘤的发生、发展与抑癌基因有关. 抑癌基因启动子区CpG岛序列被甲基化修饰后, 可改变基因的表达模式, 导致基因产物表达下调或缺失[20-22]. 研究[2,3]发现, 在原发食管癌组织中, CMTM7的CpG岛存在甲基化修饰, 其所在位点3p22.3存在杂合性缺失, 其表达下调或缺失, 与启动子甲基化修饰和杂合性缺失密切相关, 提示CMTM7是一个潜在的抑癌基因. 虽然Li等[3]初步报道了CMTM7蛋白在Liver cancer和Normal liver中表达比较, 但并未对其临床意义进行后续研究, 其结果还有待进一步验证. 北京大学人民医院胸外科Liu等[4]研究发现, CMTM7在非小细胞肺癌中起着重要的抑癌作用, 认为CMTM7是判断预后的独立因子. Liu等[5]发现通过敲减CMTM7可以显著促进细胞的增殖、迁移以及体内转移能力; 进一步研究发现, 敲减CMTM7通过抑制Rab5活性及早期内体融合, 导致表皮生长因子受体(epidermal growth factor receptor, EGFR)内化及降解减弱, 从而增加EGFR-AKT信号及肺癌细胞的致瘤性. 鉴于CMTM7基因表达下调与食管癌和肺癌的关系, 本实验采用免疫组织化学等方法检测75对肝癌手术患者的冻存癌和癌旁组织, 发现癌组织相比癌旁组织CMTM7的表达明显下调(P<0.05). 这与前面学者在食管癌、肺癌等肿瘤中研究的结果一致[3-5]. 当然, 有关CMTM7基因表达下调的分子机制以及CMTM7基因在肝癌发生发展中的作用还有待进一步研究探讨.
随着原发性肝癌早期诊断、早期治疗和肝外科手术技术的进步, 总体疗效有所提高. 但肝癌起病隐匿, 恶性程度高, 进展快, 预后很不理想[23-26]. 研究[27-31]发现, 肿瘤的临床病理特征与肿瘤的预后有着十分紧密的联系, 肿瘤大小、肿瘤数目、肿瘤分期、AFP水平及远处转移、癌栓、肝硬化、血管侵犯以及子灶等临床病理特征的出现则往往预示着肝癌预后不佳. 本实验结合临床病理资料分析发现CMTM7表达与肿瘤大小、TNM分期、AFP水平和远处转移有相关性(P<0.05), 多因素分析发现CMTM7阴性表达与远处转移有关; 进一步采用Kaplan-Meier模型分析发现CMTM7阴性组患者的术后生存时间明显低于阳性组, 提示CMTM7阴性表达可能与HCC患者的预后有关, 推测CMTM7表达与其他标志物联合可作为早期发现和诊断肝癌、并判断肝癌患者预后的新的分子标志物. 但是本次实验由于样本量小, 分析偏差大, 是否能作为单一指标来进行诊断或是否是肿瘤侵袭、转移性的标志物, 仍有待大样本的验证.
总之, 本研究首次报道了CMTM7表达与HCC发病及预后的关系, 发现CMTM7阴性表达是HCC不良预后的危险因素, 有望成为HCC不良预后预测的新指标. 至于CMTM7在肝癌发生、发展中的机制以及可能参与的分子信号通路, 能否成为肝癌早期诊断的分子标志物以及分子靶向治疗的有效靶点, 还需要全面地、大样本、多种族、前瞻性、结合相关通路深入基因分子水平探索其相关发病机制, 进一步验证CMTM7阴性表达在肿瘤防治中的指导作用.
中国每年约有36万新发病例和35万死亡病例, 广西是我国肝癌的高发区, 肝癌死亡率高居广西肿瘤死因谱首位. 尽管以手术切除和肝移植为主的综合治疗使肝癌的疗效有较大提高, 但肝癌临床治愈率和长期生存率无明显改善, 目前国内外对肝癌的发病原因、预后标志物、分子靶点和癌变机制等进行了广泛的研究, 已有相关报道CMTM7为潜在的抑癌基因的作用, 其在肝癌中的分子机制尚不完全清楚.
Li等初步报道了CMTM7蛋白在Liver cancer和Normal liver中表达比较, 但并未对其临床意义进行后续研究, 其结果还有待进一步验证. 本研究首次报道了CMTM7表达与HCC发病及预后的关系, 发现CMTM7阴性表达是肝细胞癌(hepatocellular carcinoma, HCC)不良预后的危险因素, 有望成为HCC不良预后预测的新指标. 至于CMTM7在肝癌发生、发展中的机制以及可能参与的分子信号通路, 能否成为肝癌早期诊断的分子标志物以及分子靶向治疗的有效靶点, 还需要全面地、大样本、多种族、前瞻性、结合相关通路深入基因分子水平探索其相关发病机制, 进一步验证CMTM7阴性表达在肿瘤防治中的指导作用
CMTM7基因是CMTM家族成员之一, 位于第3号染色体(3p22.3), 是2003年北京大学人类疾病基因研究中心韩文玲博士等在国际上首先克隆的人类新基因. 研究发现, CMTM7基因在人类正常组织和上皮细胞中广泛表达, 而在多种肿瘤来源的细胞株和原发肿瘤组织中表达下调或缺失, 其启动子区存在甲基化修饰, 在肿瘤细胞中恢复其表达, 可抑制肿瘤细胞增殖、迁移, 甚至启动细胞凋亡,提示CMTM7在肿瘤的临床诊断、个性化治疗以及预后分析中具有潜在的实用价值.
本文研究了CMTM7表达与HCC发病及预后的关系, 发现CMTM7阴性表达是HCC不良预后的危险因素, 有望成为HCC不良预后预测的新指标.
CpG岛(CpG island): CpG双核苷酸在人类基因组中的分布很不均一, 而在基因组的某些区段, CpG保持或高于正常概率. CpG岛主要位于基因的启动子和第一外显子区域, 约有60%以上基因的启动子含有CpG岛. CpG岛的GC含量>50%, 长度超过200 bp.
朱争艳, 研究员, 天津市第三中心医院; 李江涛, 主任医师, 浙江大学医学院附属第二医院外科
本文立意新颖, 书写规范, 实验结果可靠, 统计学处理得当, 结果风险较可信. 对肝癌发生发展机制探讨有一定意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Han W, Ding P, Xu M, Wang L, Rui M, Shi S, Liu Y, Zheng Y, Chen Y, Yang T. Identification of eight genes encoding chemokine-like factor superfamily members 1-8 (CKLFSF1-8) by in silico cloning and experimental validation. Genomics. 2003;81:609-617. [PubMed] [DOI] |
| 2. | Zhang Y, Wang JY, Han W. A role for CMTM7 in BCR expression and survival in B-1a but not B-2 cells. Int Immunol. 2014;26:47-57. [PubMed] [DOI] |
| 3. | Li H, Li J, Su Y, Fan Y, Guo X, Li L, Su X, Rong R, Ying J, Mo X. A novel 3p22.3 gene CMTM7 represses oncogenic EGFR signaling and inhibits cancer cell growth. Oncogene. 2014;33:3109-3118. [PubMed] [DOI] |
| 4. | Liu Q, Su Y, Jiang GC, Zhou ZL, Liu BC, Bu L, Yang F, Qiao F, Wang J. Change of CMTM7 expression, a potential tumor suppressor, is associated with poor clinical outcome in human non-small cell lung cancer. Chin Med J (Engl). 2013;126:3006-3012. [PubMed] |
| 5. | Liu B, Su Y, Li T, Yuan W, Mo X, Li H, He Q, Ma D, Han W. CMTM7 knockdown increases tumorigenicity of human non-small cell lung cancer cells and EGFR-AKT signaling by reducing Rab5 activation. Oncotarget. 2015;6:41092-41107. [PubMed] [DOI] |
| 6. | Delic S, Thuy A, Schulze M, Proescholdt MA, Dietrich P, Bosserhoff AK, Riemenschneider MJ. Systematic investigation of CMTM family genes suggests relevance to glioblastoma pathogenesis and CMTM1 and CMTM3 as priority targets. Genes Chromosomes Cancer. 2015;54:433-443. [PubMed] [DOI] |
| 7. | Miyazaki A, Yogosawa S, Murakami A, Kitamura D. Identification of CMTM7 as a transmembrane linker of BLNK and the B-cell receptor. PLoS One. 2012;7:e31829. [PubMed] [DOI] |
| 8. | Lin H, van den Esschert J, Liu C, van Gulik TM. Systematic review of hepatocellular adenoma in China and other regions. J Gastroenterol Hepatol. 2011;26:28-35. [PubMed] [DOI] |
| 9. | Nie W, Yan L, Lee YH, Guha C, Kurland IJ, Lu H. Advanced mass spectrometry-based multi-omics technologies for exploring the pathogenesis of hepatocellular carcinoma. Mass Spectrom Rev. 2016;35:331-349. [PubMed] [DOI] |
| 10. | 谭 盛葵, 余 红平, 王 志刚, 庞 伟毅, 韦 茜茜, 韦 佳如, 仇 小强. 错配修复系统MLH1基因rs1800734多态性与肝细胞癌的关联研究. 中华疾病控制杂志. 2014;18:401-404. |
| 11. | Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future. Semin Cancer Biol. 2011;21:59-69. [PubMed] [DOI] |
| 12. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 14. | Tan C, Liu S, Tan S, Zeng X, Yu H, Li A, Bei C, Qiu X. Polymorphisms in microRNA target sites of forkhead box O genes are associated with hepatocellular carcinoma. PLoS One. 2015;10:e0119210. [PubMed] [DOI] |
| 15. | Li J, Xu Y, Long XD, Wang W, Jiao HK, Mei Z, Yin QQ, Ma LN, Zhou AW, Wang LS. Cbx4 governs HIF-1α to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity. Cancer Cell. 2014;25:118-131. [PubMed] [DOI] |
| 16. | Xia L, Huang W, Tian D, Zhu H, Qi X, Chen Z, Zhang Y, Hu H, Fan D, Nie Y. Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma. Hepatology. 2013;57:610-624. [PubMed] [DOI] |
| 17. | 闫 萌, 谭 盛葵, 肖 胜军, 侯 巧燕. 肝细胞癌中PcG相关蛋白RYBP的表达及临床意义. 临床与实验病理学杂志. 2014;30:1294-1296. |
| 18. | Alkan C, Coe BP, Eichler EE. Genome structural variation discovery and genotyping. Nat Rev Genet. 2011;12:363-376. [PubMed] [DOI] |
| 19. | 谭 盛葵, 王 维伟, 刘 顺, 韦 茜茜, 韦 佳如, 王 志刚, 闫 萌, 仇 小强. hMSH2基因多态性和环境因素的交互作用与肝细胞癌的关系. 中华肝脏病杂志. 2014;22:676-679. |
| 20. | Stirzaker C, Song JZ, Ng W, Du Q, Armstrong NJ, Locke WJ, Statham AL, French H, Pidsley R, Valdes-Mora F. Methyl-CpG-binding protein MBD2 plays a key role in maintenance and spread of DNA methylation at CpG islands and shores in cancer. Oncogene. 2016;. [PubMed] [DOI] |
| 21. | Thomson JP, Ottaviano R, Unterberger EB, Lempiäinen H, Muller A, Terranova R, Illingworth RS, Webb S, Kerr AR, Lyall MJ. Loss of Tet1-Associated 5-Hydroxymethylcytosine Is Concomitant with Aberrant Promoter Hypermethylation in Liver Cancer. Cancer Res. 2016;76:3097-3108. [PubMed] [DOI] |
| 22. | Raynal NJ, Lee JT, Wang Y, Beaudry A, Madireddi P, Garriga J, Malouf GG, Dumont S, Dettman EJ, Gharibyan V. Targeting Calcium Signaling Induces Epigenetic Reactivation of Tumor Suppressor Genes in Cancer. Cancer Res. 2016;76:1494-1505. [PubMed] [DOI] |
| 23. | Dong QZ, Zhang XF, Zhao Y, Jia HL, Zhou HJ, Dai C, Sun HJ, Qin Y, Zhang WD, Ren N. Osteopontin promoter polymorphisms at locus -443 significantly affect the metastasis and prognosis of human hepatocellular carcinoma. Hepatology. 2013;57:1024-1034. [PubMed] [DOI] |
| 24. | OuYang HY, Xu J, Luo J, Zou RH, Chen K, Le Y, Zhang YF, Wei W, Guo RP, Shi M. MEP1A contributes to tumor progression and predicts poor clinical outcome in human hepatocellular carcinoma. Hepatology. 2016;63:1227-1239. [PubMed] [DOI] |
| 25. | Zhang Y, Liu Y, Duan J, Yan H, Zhang J, Zhang H, Fan Q, Luo F, Yan G, Qiao K. Hippocalcin-like 1 suppresses hepatocellular carcinoma progression by promoting p21(Waf/Cip1) stabilization by activating the ERK1/2-MAPK pathway. Hepatology. 2016;63:880-897. [PubMed] [DOI] |
| 26. | Tang B, Qi G, Sun X, Tang F, Yuan S, Wang Z, Liang X, Li B, Yu S, Liu J. HOXA7 plays a critical role in metastasis of liver cancer associated with activation of Snail. Mol Cancer. 2016;15:57. [PubMed] [DOI] |
| 27. | Jin J, Niu X, Zou L, Li L, Li S, Han J, Zhang P, Song J, Xiao F. AFP mRNA level in enriched circulating tumor cells from hepatocellular carcinoma patient blood samples is a pivotal predictive marker for metastasis. Cancer Lett. 2016;378:33-37. [PubMed] [DOI] |
| 28. | Xiao S, Chang RM, Yang MY, Lei X, Liu X, Gao WB, Xiao JL, Yang LY. Actin-like 6A predicts poor prognosis of hepatocellular carcinoma and promotes metastasis and epithelial-mesenchymal transition. Hepatology. 2016;63:1256-1271. [PubMed] [DOI] |
| 29. | Zhu AX, Chen D, He W, Kanai M, Voi M, Chen LT, Daniele B, Furuse J, Kang YK, Poon RT. Integrative biomarker analyses indicate etiological variations in hepatocellular carcinoma. J Hepatol. 2016;65:296-304. [PubMed] [DOI] |