修回日期: 2016-09-27
接受日期: 2016-10-08
在线出版日期: 2016-11-28
通过探讨木香对溃疡性结肠炎(ulcerative colitis, UC)大鼠的干预作用机制, 阐释胃肠安丸"芳香化浊"药物作用靶点.
清洁级Wistar♂大鼠40只随机分为4组, 分别为空白对照组(N)、模型组(C)、中药饮片高、低剂量组(MX20、MX10)每组10只, 采用2,4,6-三硝基苯磺酸/乙醇混合液灌肠法诱导实验性UC, 空白对照组和模型组以蒸馏水灌胃, 中药组以木香水煎剂灌胃, 2 mL/只, 1次/d, 连续7 d. 观察UC大鼠疾病活动指数(disease activity index, DAI)、结肠黏膜损伤指数(colon macroscopic damage index, CMDI)及组织病理学变化、血清超氧化物歧化酶(superoxide dismutase, SOD)、血浆丙二醛(malondialdehyde, MDA)、前列腺素E2(prostaglandin E2, PGE2)、表皮生长因子(epidermal growth factor, EGF)含量及结肠肠三叶因子(intestinal trefoil factor, TFF3)表达.
木香可有效减轻UC大鼠腹泻次数及黏液脓血便, 降低DAI、CMDI积分. 光镜下可见病变结肠上皮呈不同程度修复, 溃疡面积缩小. 血清SOD、EGF、结肠TFF3含量显著升高, 血浆MDA、PGE2含量显著性降低.
木香对UC的干预作用是胃肠安丸芳香化浊作用机制的科学阐释.
核心提要: 木香辛苦而温, 能升降诸气, 治一切气痛、呕逆反胃, 霍乱泻痢后重, 是胃肠安丸中理气止痛、芳香化浊的要药之一. 本实验选择其作为胃肠安丸君药的代表药物, 拟通过对其药理作用机制研究, 阐释胃肠安丸行气止痛、芳香化浊的药效物质基础.
引文著录: 刘海荣, 马露, 唐方, 张勇, 杨瑾. 木香对溃疡性结肠炎大鼠干预作用的影响. 世界华人消化杂志 2016; 24(33): 4467-4473
Revised: September 27, 2016
Accepted: October 8, 2016
Published online: November 28, 2016
To investigate whether Radix Aucklandiae has a protective effect against ulcerative colitis in rats to explain the action target of aromatic drugs in Weichangan pill.
Forty male Wistar rats were randomly and equally divided into four groups: normal control group, 2,4,6-trinitrobenzenesulfonic acid (TNBS) group, high dosage Radix Aucklandiae (MX20) group, and low dosage Radix Aucklandiae (MX10) group. Experimental colitis was induced in rats with TNBS and ethanol. The rats in the normal and TNBS groups were given distilled water by intragastric administration, while the rats in the MX20 and MX10 groups were given Radix Aucklandiae by intragastric administration, once a day, for 7 d. Disease activity index (DAI), colon macroscopic damage index (CMDI), histopathological changes, serum superoxide dismutase (SOD), plasma malondialdehyde (MDA), prostaglandin E2 (PGE2), and epidermal growth factor (EGF) contents, and intestinal trefoil factor (TFF3) expression in the colon were compared between different groups.
Radix Aucklandiae significantly reduced the incidence of diarrhea and mucous, purulent, bloody stool and lowered DAI and CMDI scores compared with the TNBS group. After Radix Aucklandiae treatment, varying degrees of repair of lesions in the colon epithelium occurred and ulcer area became narrower under a light microscope. In addition, Radix Aucklandiae increased the contents of SOD, EGF, and TFF3, and lowered the contents of MDA and PGE2 significantly.
Protective effect of Radix Aucklandiae against ulcerative colitis in rats interprets the efficacy of aromatic drugs in Weichangan pill.
- Citation: Liu HR, Ma L, Tang F, Zhang Y, Yang J. Protective effect of Radix Aucklandiae against ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(33): 4467-4473
- URL: https://www.wjgnet.com/1009-3079/full/v24/i33/4467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i33.4467
溃疡性结肠炎(ulcerative colitis, UC)属于炎症性肠病, 是一种病因尚不十分清楚的以侵犯直肠和结肠黏膜及黏膜下层为主的非特异性炎症性病变, 临床以腹痛腹泻、里急后重、黏液脓血便为主要症状, 多呈持续性或反复性发作. 目前, 现代医学对于UC病因及发病机制尚未完全明确, 可能与遗传、免疫、感染、环境及精神等多种因素密切相关. 多种细胞因子参与结肠黏膜的炎症免疫反应, 与UC的发病及转归密切相关[1], 但越来越多的研究[2,3]表明, UC与氧自由基(oxygen free radical, OFR)损伤、炎症递质激活、肠黏膜屏障受损等有密切的关系. 由于传统的西医治疗药物价格昂贵不良反应多, 相对于单纯西医治疗, 中药、中西医结合疗法更具有优势[4]. 课题组前期实验[5-8]证实, 胃肠安丸可改善2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid, TNBS)诱导结肠炎大鼠血清促炎因子肿瘤坏死因子-α、白介素(interleukin, IL)-6水平, 升高抑炎因子IL-10水平, 参与UC细胞因子网络的调控. 通过有效缓解UC大鼠结肠组织MUC2 mRNA高表达, 加强结肠表皮生长因子(epidermal growth factor, EGF)表达, 刺激结肠黏蛋白合成与分泌, 提高黏蛋白硫酸化程度, 发挥对肠黏膜屏障保护作用. 有效抑制模型大鼠结肠组织相关炎症介质髓过氧化物酶、单核细胞趋化蛋白-1、诱导型一氧化氮合酶和环氧合酶2的含量, 显示了良好的抗炎效果.
作为胃肠安丸君药的芳香化浊类代表药物木香所具有的调整胃肠动力与镇痛等作用靶点已得以证实[9-12], 但其在UC治疗中芳香化浊功效的科学内涵尚有待进一步明确. 为此在明确实验药物木香主要成分及含量基础上, 采用TNBS/乙醇混合液灌肠法诱导实验性UC, 拟通过研究: (1)木香对UC大鼠症状的干预作用; (2)木香对UC大鼠血清SOD、血浆MDA含量的影响; (3)木香对UC大鼠血浆PGE2、EGF含量的影响; (4)木香对UC大鼠结肠肠三叶因子(intestinal trefoil factor, TFF3)表达的影响, 解析木香干预UC的作用机制, 用以阐释胃肠安丸"芳香化浊"药物作用靶点.
清洁级♂Wistar大鼠40只, 体质量为200 g±20 g, 许可证号SCXK-(军)2009-003, 由中国人民解放军军事医学科学院动物实验中心提供. 云木香饮片购自安徽亳州市中药饮片厂, 由天津医科大学总医院中药房提供; 5%TNBS: 美国Sigma公司产品, 批号为109K5008; 无水乙醇(色谱纯): 天津市光复科技发展有限公司; 便潜血试剂: 珠海贝索生物技术有限公司产品; 冰醋酸: 天津市赢达稀贵化学试剂厂, 执行标准CB/T676 2007; MDA测试盒: 南京建成生物工程研究所; SOD测试盒: 南京建成生物工程研究所; 大鼠PGE2酶联免疫分析试剂盒: EIAab公司; 大鼠EGF酶联免疫分析试剂盒: NeoBioscience公司; 兔抗大鼠TFF3多克隆抗体: 美国Pro sci公司; 两步法免疫组织化学检测试剂盒: 武汉博士德生物工程有限公司. 石蜡切片机: 德国LEICARM2235; 光学显微镜: 日本OLYMPUS; 数字显微照相系统: 德国LEICADM3000B; EDTA-K2真空采血管: 湖北金杏科技发展有限公司产品; TL-18M台式高速冷冻离心机: 上海市离心机械研究所; SHY-2A水浴恒温振荡器: 江苏金坛市金城国胜实验仪器厂; 全自动酶标仪: Tecan-5082 Sunrise(Austria).
1.2.1 动物模型制备: 40只大鼠随机分为空白对照组(N)、模型组(C)、木香高、低剂量组(MX20、MX10)4组, 每组各10只. 依据文献[8]模型制备方法, 于造模前禁食24 h, 自由饮水. 腹腔注射10%水合氯醛3 mL/kg, 麻醉后倒悬位下将8号导尿管自肛门缓慢插入直肠约8 cm, 向肛管中缓慢注入TNBS混合溶液4 mL/kg, 继而注入空气0.5 mL, 实验大鼠取头低臀高位仰卧放置自然苏醒.
1.2.2 实验用药制备: TNBS溶液: 首先将无水乙醇与灭菌生理盐水等体积混合配制成50%乙醇溶液, 然后再将5%TNBS原液与50%的乙醇按等体积混合即得到含25 g/L TNBS和250 mL/ L乙醇的混合溶液. 灌胃液: 100 g木香饮片以1:10加入蒸馏水, 常温浸泡30 min, 煎煮30 min, 100目过滤, 残渣加5倍量的蒸馏水, 复煎30 min, 100目过滤; 合并滤液, 浓缩至0.2 g/mL作为原液, 4 ℃冰箱储存备用. 自造模后第1天开始, 木香低、高剂量组分别灌胃给药1 g/kg•d、2 g/kg•d[相当于人体剂量(0.1 g/kg•d)的10倍、20倍]. 每日一次, 2 mL/只. 空白对照组、模型组给予等量蒸馏水灌胃. 连续7 d.
1.2.3 观察指标及检测: (1)疾病活动指数(disease activity index, DAI)评分: 自实验第1天, 每日观察并记录大鼠体质量、大便性状及隐血状况, 按表1进行评分[13,14]; 并记录大鼠的精神状态, 活动度, 皮毛光泽度, 食欲等一般情况; (2)结肠黏膜损伤指数(colon macroscopic damage index, CMDI)评分: 模型制备第7天, 实验大鼠禁食24 h, 10%水合氯醛麻醉处死. 分离肛门至盲肠末端的结肠段, 沿肠系膜纵轴剖开, 4 ℃生理盐水冲洗肠内容物, 迅速平铺于滤纸上. 按照表2[15]进行肉眼大体损伤评分; (3)标本采集: 腹腔注射麻醉后, 经腹主动脉采血10 mL, 4 ℃静置3 h, 4 ℃ 3000 r/min离心10 min, 分离血浆及血清. -20 ℃保存待测; (4)组织病理标本制备及观察: 取大鼠结肠病变处组织, 4%甲醛溶液固定, 石蜡包埋, 切片, 常规脱水, HE染色, 于光镜下观察结肠组织病理形态.
| 观察指标 | DAI 计算 | ||||
| 0分 | 1分 | 2分 | 3分 | 4分 | |
| 体质量 | 不下降 | 1%-5% | 5%-10% | 10%-15% | >15% |
| 大便性状 | 正常 | 松散但不黏肛周 | 腹泻 | ||
| 大便隐血 | 阴性 | 阳性 | 肉眼血便 | ||
| DAI | 以上3项得分的平均值 | ||||
| 大体形态表现 | 评分 |
| 无损伤 | 0分 |
| 轻度充血, 水肿, 表面光滑, 无糜烂或溃疡 | 1分 |
| 充血水肿, 黏膜粗糙呈颗粒状, 有糜烂或肠黏连 | 2分 |
| 高度充血水肿, 黏膜表面有坏死及溃疡形成, 溃疡最大纵径<1.0 cm, 肠壁增厚或表面有坏死及炎症 | 3分 |
| 在3分基础上溃疡最大纵径>1.0 cm或全肠壁坏死 | 4分 |
统计学处理 本实验应用SPSS17.0统计软件包进行数据分析处理, 所得结果用表示, 采用单因素方差分析及独立样本t检验, 比较各组资料间的差异, 方差齐组间两两比较采用LSD检验进行, 方差不齐组间比较用Tamhane'sT2 检验, P<0.05为具有统计学意义.
N组大鼠精神状态及活动正常, 反应灵活, 皮毛光泽, 饮食自如, 颗粒样便, 便隐血阴性, 体质量有所增加. C组大鼠自实验开始进食量逐渐减少、腹泻、肉眼下黏液血便, 粪质稀薄、肛周污秽, 体质量呈不同程度下降, 伴有反应迟钝、蜷卧拱背、毛耸色转黄少光泽等症状. MX20、MX10干预后, UC大鼠腹泻及便血较模型组减轻, 体质量增加, 精神倦怠、毛耸等症状得到改善.
肉眼观察可见, N 组大鼠结肠黏膜光滑. C组大鼠结肠肠壁增厚; 黏膜充血、溃疡部位呈线状或灶状, 局部黏膜水肿、糜烂、坏死、增厚, 伴不同程度肠黏连及肠腔扩张. 与N组相比, C组DAI、MCDI评分显著性升高, 差异具有统计学意义(P<0.01)(表3).
MX20、MX10干预后, UC大鼠结肠充血水肿减轻, 肠黏连程度有所改善. 与C相比, MX20、MX10组DAI、MCDI评分降低, 具有统计学差异(P<0.05). MX20、MX10组比较, 未见显著量效差异(表3).
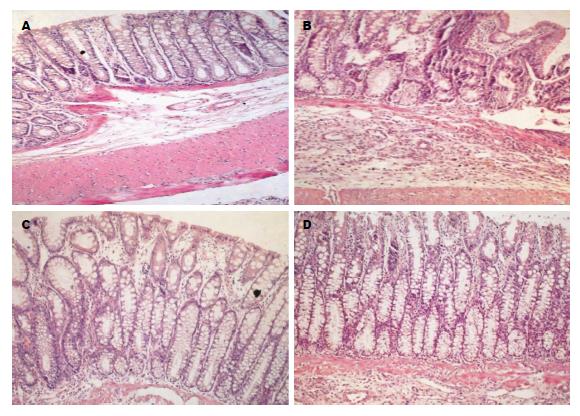
光镜下(图1所示), N组结肠结构完整, 黏膜表面光滑, 腺体排列整齐, 未见炎性渗出; C组结肠黏膜层、黏膜下层甚至肌层大量炎性细胞浸润, 腺体结构紊乱、破坏, 杯状细胞减少, 腺体扩张, 腺上皮细胞增生, 黏膜层、黏膜下层充血水肿. MX20、MX10干预后结肠黏膜炎性病变特征较模型组明显减轻, 但未恢复至N组大鼠结肠黏膜形态. MX20、MX10组间结肠黏膜形态未见明显差异.
与N组相比, C组血清SOD含量显著性降低, MDA含量显著性升高, 差异具有统计学意义(P<0.01). 与C组相对应, MX20、MX10干预后SOD含量的升高, MDA含量降低的差异, 具有统计学意义(P<0.05). 2组间未见统计学差异(P>0.05)(表4).
| 分组 | SOD(U/mL) | MDA(μmol/g) | PGE2(pg/mL) | EGF(pg/mL) | TFF3(IOD值) |
| N组 | 137.41±31.51 | 24.81±1.51 | 278.65±133.65 | 3.45±2.78 | 3839.22±932.48 |
| C组 | 107.90±8.86b | 37.91±15.64b | 573.97±68.44b | 4.80±5.56 | 4462.89±537.37b |
| MX20 | 125.78±30.76d | 29.76±11.24d | 407.70±219.45c | 13.09±4.49d | 20275.18±1883.19d |
| MX10 | 122.89±26.77c | 28.04±20.05c | 417.27±211.60c | 9.41±3.16c | 17431.28±2789.69c |
与N组相比, C组血浆PGE2含量显著升高, 具有统计学差异(P<0.05), 但血浆EGF含量未见显著性变化. MX20、MX10干预后, PGE2含量显著性降低, EGF含量显著性升高, 与C组相比, 差异具有统计学意义(P<0.05). 2剂量组比较, PGE2含量未见统计学差异, EGF含量差异具有统计学意义(表4).
本研究选用TNBS/乙醇混合液建立UC大鼠模型, 并给予木香水煎剂干预, 观察大鼠腹泻及黏液脓血便等症状的变化、结肠黏膜损伤程度及组织病理学改变情况. 由实验结果显示, 木香水煎剂干预后, UC模型大鼠腹泻及黏液脓血便等症状减轻, 二剂量组均呈现显著疗效(P<0.01); 结肠肠壁溃疡及充血水肿病变显著恢复. 证实: 木香能有效改善UC大鼠症状及结肠黏膜损伤程度, 且以高剂量疗效突出(P<0.01).
UC时, 肠黏膜中大量的吞噬细胞从血液循环进入肠黏膜层和黏膜下层, 部分浸入肠道, 当其在吞噬异物或被激活后, 耗氧量增加, 产生的O2直接导致黏膜细胞脂质过氧化损伤, 使黏膜通透性增加, 吞噬细胞活动加强, 从而导致OFR增加, 而OFR又能引起脂质过氧化而导致组织和细胞的进一步损伤.
本实验模型大鼠外周血中MDA含量显著升高, SOD活性显著降低(P<0.01), 提示UC大鼠体内清除氧自由基的能力下降, 该结果与相关报道相一致[16-18], 进一步证实UC的免疫紊乱和自由基损伤发病学说. 各组给予木香后, MDA含量的降低, SOD活性的升高(P<0.01), 表明木香改善结肠黏膜上皮细胞的损伤, 是通过增强SOD活力, 促进机体对氧自由基的清除, 减轻或阻断组织的脂质过氧化反应, 从而减少氧自由基所实现.
当肠黏膜上皮屏障、肠道的免疫系统及肠道正常微生物的平衡遭到破坏, 肠黏膜受损后修复不当, 就会导致UC的发生[19-21]. 有研究发现, EGF在肠道黏膜损伤和修复中发挥着重要作用[22]已有临床实验证实EGF可刺激溃疡部位细胞代谢, 加速溃疡部皮肤的修复[23]. PGE2是花生四烯酸代谢产物, 是重要的炎症因子, 可增加血管通透性而引起组织水肿, 致炎细胞浸润, 造成结肠黏膜炎症、组织破坏及溃疡形成[24]. 研究[25]显示, UC患者肠黏膜PGE2含量显著增高, 且结肠黏膜PGE2含量与黏膜炎症程度相关.
本实验结果显示模型大鼠血浆EGF含量虽未见显著降低, 但伴随血浆PGE2含量显著性升高, 结肠黏膜炎症与损伤明显存在. 木香能够下调大鼠血浆中PGE2表达水平, 而抑制炎性细胞, 减轻肠道炎症; 给予木香干预治疗, 血浆EGF含量显著提高, 提示, 其可能通过启动UC结肠黏膜组织的防御机制, 增强结肠黏膜屏障的防御机能, 刺激肠黏膜上皮细胞内DNA、RNA以及蛋白质的合成, 从而修复损伤的肠黏膜, 促进溃疡愈合, 减轻UC症状.
三叶肽(trefoil peptide, TFF)又名黏液结合肽, 是近年来发现的一簇新型生长因子, 主要由乳癌相关肽(PS2或TFF1)、解痉多肽(SP或TFF2)和肠三叶因子(ITF或TFF3)组成. TFF因其抗蛋白酶的特性和对黏液糖蛋白的高亲和力, 而被认为在上皮细胞的重组、修复过程中发挥重要的作用. 根据目前的研究[26-28], TFF对胃肠黏膜可能的保护机制为: 形成并稳定黏膜屏障、调控黏膜上皮分化、调节免疫反应和促进胃肠黏膜重建.
本实验结果显示, 模型大鼠结肠黏膜TFF3表达未见显著性增高. 提示: TNBS造模后8 d, 大鼠结肠黏膜可能处于修复早期, 自身的黏膜修复机制启动, 部分有利于修复的因素, 如TFF3分泌开始增多. 给予木香治疗后, 结肠黏膜TFF3表达明显上调(P<0.05), 提示药物的治疗作用可能在于增加结肠上皮细胞TFF3的分泌从而促进受损区域上皮细胞的重建, 加快上皮细胞移行速度, 促进结肠炎损伤愈合.
总之, 胃肠安丸具有芳香化浊、行气止痛等功效, 临床常用于治疗各种感染性、非感染性腹泻所造成的恶心、呕吐、腹胀、腹泻等症状. 前期药效试验证实其具有综合性多靶点止泻和杀菌作用. 而木香作为胃肠安丸君药的芳香化浊类代表药物可作用于结肠黏膜, 改善结肠黏膜上皮细胞的损伤, 增强结肠黏膜屏障的防御机能, 从而阐释了胃肠安丸芳香化浊药物的作用机制.
本实验应用TNBS/乙醇法制备大鼠UC模型, 通过木香水煎剂干预治疗, 解析木香干预UC的作用机制, 明确在UC治疗中芳香化浊功效的科学内涵. 但实验中存在一些不足, 我们采用的是早在1989年Morris就已发明的经典模型, 其中TNBS致病机制是: 乙醇灼伤结肠黏膜后, TNBS与组织蛋白的赖氨酸ε-氨基团结合形成抗原, 使T淋巴细胞致敏, 导致与半抗原结合的动物自身细胞破坏, 从而引起肠道炎症[29]. 模型死亡率较高、灌肠液易漏出、动物个体差异较大, 以至部分数据SD较大. 实验组进行多次实验对比结果仍与前相似, 于是针对不足进行了改进: 以5%TNBS与50%乙醇溶液等体积混合后按4 mL/kg灌肠造模, 并在灌肠结束后使大鼠头低臀高位防止液体漏出. 改进后死亡率降低, 成模率升高, 但仍旧存在部分数据SD偏大问题, 有待后期实验进一步的完善.
溃疡性结肠炎(ulcerative colitis, UC)是一种非特异性炎症性病变, 以结肠黏膜慢性炎症和溃疡形成为主要病理特点, 被世界卫生组织公认为临床难治性疾病之一. 传统的西医治疗方法临床治疗效果欠佳, 而中医中药因可以发挥整体治疗优势且价格低廉近年来得到广泛研究, 并不断取得阶段性成果.
现代医学对于UC的病因及发病机制尚未完全明确, 但近阶段研究表明, 其发病可能与氧自由基(oxygen free radical, OFR)损伤、炎症递质激活、肠黏膜屏障受损等有密切的关系. 前期实验证实胃肠安丸通过发挥对肠黏膜屏障的保护作用显示了良好的抗炎效果, 且木香作为胃肠安丸代表药物在复方中所具有的调整胃肠动力与镇痛等作用靶点已得以证实, 但其在UC治疗中芳香化浊功效的科学内涵尚待进一步明确.
一些研究者认为木香在胃肠安丸抗腹泻治疗中发挥着重要作用, 离体肠平滑肌运动实验及体内小肠推进实验研究结果均显示木香提取物对正常及运动亢进的肠离体平滑肌均具有显著的抑制作用, 其机制与胃肠安丸抗腹泻作用一致.
本文从明确胃肠安丸的药效基础和临床应用依据出发, 阐述了木香作为胃肠安丸君药的芳香化浊类代表药物的作用靶点及机制, 为胃肠安丸的临床应用提供实验基础和科学依据.
本研究发现木香作为胃肠安丸君药的芳香化浊类代表药物可作用于结肠黏膜, 改善结肠黏膜上皮细胞的损伤, 增强结肠黏膜屏障的防御机能, 从而阐释了胃肠安丸芳香化浊药物的作用机制, 可用于科学指导胃肠安丸的临床推广.
氧自由基(OFR): 是一类具有高度化学反应活性的含氧基团, 其氧化作用强, 能引起脂质过氧化而导致组织和细胞的损伤. 在生理情况下, OFR不断生成, 体内抗氧化物质能及时将其清除, 保持其生成和降解处于动态平衡. 病理情况下, OFR产生过多或抗氧化系统功能减低, 均可使氧化作用增强, 过多的OFR作用于生物膜上的不饱和脂肪酸, 发生脂质过氧化反应, 使脂质过氧化物产生增多, 导致组织损伤进一步加重.
刘杰民, 主任医师, 贵州省人民医院消化内镜科; 王学美, 研究员, 北京大学第一医院中西医结合研究室; 钟英强, 教授, 主任医师, 中山大学孙逸仙纪念医院消化内科
本研究探讨木香对UC大鼠的干预作用机制, 结果发现木香可有效减轻UC大鼠腹泻次数及黏液脓血便, 降低疾病活动指数、结肠黏膜损伤指数积分. 光镜下可见病变结肠上皮呈不同程度修复, 溃疡面积缩小. 血清超氧化物歧化酶、表皮生长因子、结肠肠三叶因子含量显著升高, 血浆丙二醛、前列腺素E2含量显著性降低, 对临床推广应用胃肠安丸提供了科学依据.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 11. | Bian ZX, Zhang GS, Wong KL, Hu XG, Liu L, Yang Z, Li M. Inhibitory effects of magnolol on distal colon of guinea pig in vitro. Biol Pharm Bull. 2006;29:790-795. [PubMed] |
| 12. | 王 本祥. 现代中药药理与临床. 第1版. 天津: 天津科技翻译出版公司, 2004; 263-265. . |
| 13. | Steidler L, Hans W, Schotte L, Neirynck S, Obermeier F, Falk W, Fiers W, Remaut E. Treatment of murine colitis by Lactococcus lactis secreting interleukin-10. Science. 2000;289:1352-1355. [PubMed] |
| 15. | Myers KJ, Murthy S, Flanigan A, Witchell DR, Butler M, Murray S, Siwkowski A, Goodfellow D, Madsen K, Baker B. Antisense oligonucleotide blockade of tumor necrosis factor-alpha in two murine models of colitis. J Pharmacol Exp Ther. 2003;304:411-424. [PubMed] [DOI] |
| 17. | 庞 艳华, 郑 长青, 王 轶淳, 李 晓东, 李 丰. IL-4和IL-13 在溃疡性结肠炎中的表达. 胃肠病学和肝病学杂志. 2005;14:410-412. |
| 18. | Oikonomou KA, Kapsoritakis AN, Kapsoritaki AI, Manolakis AC, Tsiopoulos FD, Germenis AE, Potamianos SP. Downregulation of serum epidermal growth factor in patients with inflammatory bowel disease. Is there a link with mUCosal damage? Growth Factors. 2010;28:461-466. [PubMed] [DOI] |
| 19. | Caprilli R, Viscido A, Latella G. Current management of severe ulcerative colitis. Nat Clin Pract Gast roenterol Hepatol. 2007;4:92-101. [PubMed] [DOI] |
| 21. | Hecht G. Innate mechanisems of epithelial host defense; spotlight on intestine. Am J Physiol. 1999;277:C351-C358. [PubMed] |
| 23. | Hui WM, Chen BW, Kung AW, Cho CH, Luk CT, Lam SK. Effect of epidermal growth factor on gastric blood flow in rats: possible role in mucosal protection. Gastroenterology. 1993;104:1605-1610. [PubMed] |