修回日期: 2016-05-28
接受日期: 2016-06-06
在线出版日期: 2016-11-28
质子泵抑制剂(proton pump inhibitors, PPIs)作为目前抑酸性作用最强的一类药物, 特异性高、持续时间长久, 广泛应用于消化系统疾病治疗. 但是对PPI不良反应认识的不足导致目前全球PPI滥用. 由于用药的个体间差异大, PPI的使用受到约束, 如何在临床合理使用PPI一直是广大学者关注的热点. CYP2C19是细胞色素P450酶家族中十分重要的一种, 超过10%的药物主要通过CYP2C19酶代谢. 因PPI在药代动力学和药效学等方面高度依赖肝脏细胞色素P450同工酶系统, 影响到多种药物的代谢, 从而在临床上表现为联合用药产生的不良反应. PPI的生物利用度和代谢主要受药物代谢酶CYP2C19的影响, 部分受CYP3A4的影响, 而个体遗传因素所致CYP3A4和CYP2C19酶活性差异是造成PPI疗效差异的分子机制之一. CYP2C19编码基因的突变, 可造成CYP2C19酶代谢活性的改变, 进而出现不同患者服用以CYP2C19为关键代谢酶的药物后, 体内血药浓度差异, 甚至产生不同临床反应. 此外, 合并用药、饮食结构等非遗传因素也是影响PPI疗效的重要原因. 本文参考了近年来国内、外涉及CYP2C19酶与PPI药物基因组学研究进展的文献, 对其进行归纳总结予以综述, 为临床个体化用药提供参考依据.
核心提要: 质子泵抑制剂(proton pump inhibitors, PPIs)是目前应用最多的抑酸药物, 其代谢主要受代谢酶CYP2C19的影响. CYP2C19酶分为四种类型: 超快代谢型、快代谢型、中间代谢型、慢代谢型. 本文PPI的药物基因组学研究进展, 结合影响其疗效的其他因素予以综述.
引文著录: 黄雯, 季春梅, 郭苗, 倪玮玮, 孟玲, 魏继福. 质子泵抑制剂类药物基因组学的研究进展. 世界华人消化杂志 2016; 24(33): 4458-4466
Revised: May 28, 2016
Accepted: June 6, 2016
Published online: November 28, 2016
At present, proton pump inhibitors (PPIs), as a class of strong antacid agents, are widely used in the clinical treatment of gastrointestinal diseases. PPIs achieved a strong effect of acid suppression with high specificity and long duration. However, the issue of PPI abuse exists worldwide because of the lack of relevant knowledge. Due to tremendous inter-individual differences in uptake, the clinical application of PPIs appears to be limited. Therefore, rational use of PPIs in daily clinical practice is an important research topic. In addition, PPIs were found with many side effects. CYP2C19, as one of the most important enzymes in cytochrome P450 enzyme family, is responsible for the metabolism of over 10% of drugs. The bioavailability and metabolism of PPIs are mainly affected by drug-metabolizing enzymes CYP2C19 and CYP3A4, which are located in the liver. By suppressing cytochrome P450 isoenzyme, PPIs may affect the metabolism of multiple drugs, thus leading to unwanted side effects in case of combined medication. What's more, the individual difference in PPI administration is derived from distinct molecular mechanisms mediated by CYP3A4 and/or CYP2C19. Non-genetic factors, such as combined medication and food pyramid, also impact on the effectiveness of PPIs. Gene mutations can also alter the enzymatic activity of CY2C19, thereby resulting in different blood concentrations of drugs metabolized by CYP2C19. In conclusion, PPIs have the advantages of safety and effectiveness; however, the problem of drug resistance still exists, which indicates their selective application in clinical practice. In this paper, we review the advances in pharmacogenomics of PPIs, with an aim to provide reference to individualized clinical medication.
- Citation: Huang W, Ji CM, Guo M, Ni WW, Meng L, Wei JF. Pharmacogenomics of proton pump inhibitors. Shijie Huaren Xiaohua Zazhi 2016; 24(33): 4458-4466
- URL: https://www.wjgnet.com/1009-3079/full/v24/i33/4458.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i33.4458
质子泵抑制剂(proton pump inhibitors, PPIs)的临床药物包括奥美拉唑、兰索拉唑、泮托拉唑、雷贝拉唑、埃索拉唑及右兰索拉唑[1], 主要是用于治疗非溃疡性消化不良、回流性食管炎、胃食管反流疾病、清除幽门螺杆菌(Helicobacter pylori, H. pylori)感染、胃溃疡、十二指肠溃疡, 预防和治疗相关的非甾体抗炎药物伤害, 佐林格-埃利森综合征(胃泌素瘤)和其他强酸性治疗[2]. PPI作为治疗消化性溃疡疗效最好的噻吩吡啶类衍生药物, 通过在胃内酸性环境中转化为活性衍生物, 能够高效快速抑制胃酸分泌, 清除H. pylori, 促进胃蛋白酶活性的降低从而快速治愈溃疡. 同时, PPI能够促进胃内pH值升高, 促进胃黏膜凝血机制的激活从而加强血小板聚集, 有效降低溃疡再出血发生率, 因此对酸性类胃病具有良好的治疗效果. 但是, 在应用PPI的过程中还存在着用药剂量过大、用药时间过长、药物配伍等问题.
临床试验表明, PPI药物的治疗效果存在明显的个体差异, 药物反应的遗传多态性即是产生这些差异的决定性因素. 随着药物基因组学(pharmacogenomics, PGx)的发展, 越来越多的学者意识到编码药物代谢酶、药物转运体以及药物靶分子相关基因的单核苷酸多态性是影响药物的药代动力学(pharmacokinetics, PK)、药效学和导致不同种族不同个体间对同一药物产生不同代谢能力的主要原因. PPI的代谢主要通过细胞色素P450途径, CYP450超家族依次可分为18个家族、44个亚家族. 涉及药物代谢的CYP450酶系主要是CYP1、CYP2及CYP3家族, 各有8-10个亚家族同工酶, 共占肝内CYP450总量的70%, 介导人体内绝大多数药物(外源性化合物)的代谢, 其中CYP2C19基因突变对PPI治疗效果有较大影响[3,4]. CYP2C19存在于肝微粒体中, 约占肝脏酶系的3.4%, 由490个氨基酸组成. 其次, CYP3A4酶也参与代谢部分PPI药物[5]. 本文就近年来PPI的PGx研究进展, 结合影响其疗效的非遗传因素予以综述.
PPI是由两个杂环连接一个甲基亚磺酰基的苯并咪唑类衍生物. 主要分类有: 奥美拉唑, 兰索拉唑, 埃索拉唑, 泮托拉唑, 雷贝拉唑和右兰索拉唑, 六种PPI的生物特性如表1[1].
| 质子泵抑制剂 | 特征 |
| 右兰索拉唑 | 兰索拉唑对应体(右旋兰索拉唑); 分2次释药的双重控释; 24 h症状控制; 口服不受食物影响; 肝脏代谢酶: CYP2C19,CYP3A4; CYP2C19弱代谢; 临床上没有报道与氯吡格雷合用会产生严重的不良反应. |
| 埃索美拉唑 | 奥美拉唑的纯左旋异构体; 随着时间的推移, 口服生物利用度提高; 肝脏代谢酶: CYP2C19, CYP3A4; CYP2C19强抑制; 与氯吡格雷合用有交叉反应; 与食物合用会延迟吸收. |
| 兰索拉唑 | 正常剂量长效高效生物利用度; 快速产生最大酸抑制; 与食物合用延缓吸收; 合并抗酸治疗会减少生物利用度; 可增强茶碱代谢; 肝脏代谢酶: CYP2C19, CYP3A4; CYP2C19弱抑制; 临床上没有报道与氯吡格雷合用会产生严重的不良反应. |
| 奥美拉唑 | 随时间推移, 低起始口服生物利用度从35%-40%增高到65%; 肝脏代谢酶: CYP2C19; CYP2C19强抑制; 剂量依赖药代动力学; 与食物合用延缓吸收. |
| 泮多拉唑 | 稳定的生物利用度77%; 与食物合用延缓吸收; 肝脏代谢酶: CYP2C19, CYP3A4; CYP2C19弱抑制; 临床上没有发现与氯吡格雷合用会产生严重不良反应. |
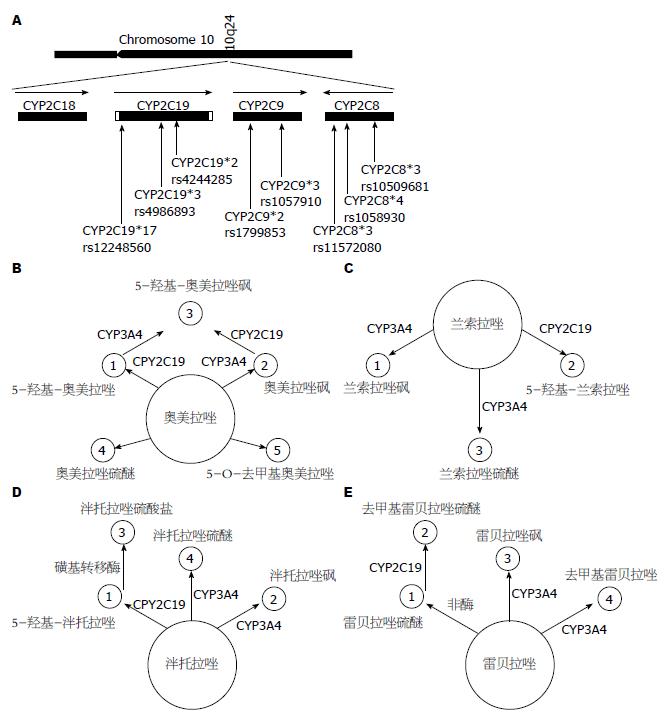
PPI主要代谢酶为CYP2C19, 具有遗传多态性. 目前, 发现的CYP2C19等位基因超过25个[6,7], 但是在药物代谢中起作用的主要是CYP2C19*2, CYP2C19*3, 均为功能缺失型等位基因[8]. 另外, CYP2C19*17也在PPI代谢过程中起到些微作用[9,10](图1), 其他等位基因发生突变的概率极小[11]. 除已有大量报道的CYP2C19*2和CYP2C19*3外, CYP2C19*17为近两年来首先发现在白种人中与消化性溃疡有关的基因[9], 在欧洲约有18-28%的人携带CYP2C19*17基因, 为功能增强型等位基因, 突变率约为7%, 表现为超强代谢[12].
CYP2C19同工酶被分为四种不同的代谢类型: 超快代谢型(ultrarapid metabolizers, UM)(*1/*17, *17/*17), 可能由于功能区基因的非正常复制或非正常扩增造成酶活性明显增高; 快代谢型(extensive metabolizer, EM)(*1/*1), 功能区基因正常表达, 表达正常活性酶, EM也是正常人群的代谢表型; 中间代谢型(intermediate metabolizer, IM)(*1/*2, *1/*3, *17/*2, *17/*3), 可能携带有一个功能缺陷的等位基因或无功能的等位基因, 表达的药物代谢酶的活性较正常稍有降低; 慢代谢型(poor metabolizer, PM)(*2/*2, *2/*3, *3/*3), 可能携带有两个无效的等位基因, 致使表达的药物代谢酶的活性显著降低[13,14]. PM型的同工酶基因出现突变, 产生终止密码, 使蛋白合成过早终止, 从而产生无活CYP2C19酶, 失去对物质的羟化代谢能力[15,16]. 在亚洲人群中CYP2C19*2和CYP2C19*3中的PM型约有13%-23%, EM型则相对较少, 只有4%[1,17,18].
瑞典学者认为, 5种PPI(奥美拉唑、兰索拉唑, 埃索拉唑、泮托拉唑, 雷贝拉唑)均可竞争性抑制肝脏细胞色素P450同工酶CYP2C19, 且以奥美拉唑>兰索拉唑>埃索拉唑>泮托拉唑>雷贝拉唑. 但是, 最近有韩国学者认为PPI抑制CYP2C19的能力是奥美拉唑>埃索拉唑>兰索拉唑>右兰索拉唑>泮多拉唑>雷贝拉唑[1,19]. 不过, 也有学者认为由于雷贝拉唑的代谢产物雷贝拉唑硫醚对CYP450同工酶的抑制作用也较强, 所以最终泮托拉唑对此酶的抑制作用最小[3].
1.2.1 奥美拉唑的药物基因组学: 奥美拉唑是目前针对消化道溃疡应用最早且最广泛的有效药物, 服用奥美拉唑治疗胃十二指肠溃疡的效果与其基因型相吻合, 遗传突变引起药物反应差异主要来自于编码CYP2C19基因的基因多态性. 以胃内pH值作为药效观察指标的研究[20]显示, 奥美拉唑在体内经肝细胞微粒体中CYP2C19代谢, 催化生成羟基奥美拉唑而失去活性, 对CYP2C19酶具有抑制作用PM患者使用奥美拉唑效果及pH值提高时间明显优于快代谢组EM, CYP2C19基因EM型患者24 h平均胃内pH值低于PM型患者的胃内pH值. PK研究[21,22]表明单次口服奥美拉唑20 mg后血浆奥美拉唑的药时曲线下面积(area under curve, AUC)在CYP2C19基因EM型和PM型有明显差异, PM型的AUC约为EM组的13倍[23]; 所以PM使用奥美拉唑效果更好.
1.2.2 兰索拉唑的药物基因组学: 兰索拉唑主要在肝脏中被CYP2C19代谢生成5-羟基兰索拉唑. 临床给药后血药浓度个体差异较大, 峰值浓度可相差10倍左右. Zhang等[24]学者实验证明兰索拉唑在亚洲人体内药动学的个体差异与CYP2C19基因型关系密切, CYP2C19基因多态性是导致兰索拉唑体内血药浓度个体差异性的重要因素之一, 且与兰索拉唑5-羟基代谢通路之间存在更好的相关性. 由基因多态性所导致的兰索拉唑的PK特性的改变很可能会引起其抑酸疗效的个体差异和不良反应发生频率的改变, 有实验证实不同基因型患者服用兰索拉唑后不良反应发生情况有显著差异. 因此在临床应用时应关注CYP2C19基因突变人群服用兰索美拉唑的合适剂量, 比如PM人群使用兰索拉唑时应使用正常剂量或减少剂量[25-27].
1.2.3 埃索拉唑的药物基因组学: 埃索美拉唑是新一代PPI抑制剂, 为奥美拉唑的单S型异构体(左旋异构体), 通过CYP2C19及CYP3A4代谢, 但是更多的是经由CYP3A4途径代谢, 因此, 理论上CYP2C19基因多态性在埃索美拉唑的代谢中作用应远小于其他PPI抑制剂. 近年来, 国内外对CYP2C19基因多态性与埃索美拉唑的代谢作用研究[28-30]也证实了此观点, 日本学者研究表明, 埃美拉唑与氯吡格雷合用不增加心血管疾病风险, 也不会影响氯吡格雷对剩余血小板抑制率的影响.
1.2.4 泮托拉唑的药物基因组学: 泮托拉唑是一种新型苯并咪唑类PPI抑制剂, 有2种代谢途径, 泮托拉唑肠溶剂口服给药后被迅速吸收, 避免了胃酸对其的消除, 这样几乎不经过首关代谢, 且不靠药物剂量和食物的摄取生物利用度就可达77%, 仅剩余的少量经CYP2C19和CYP3A4代谢, 而且药物在肝脏内不与细胞色素P450相互作用, 不影响其他药物在肝脏的代谢[31,32]. 经国内学者研究证实, CYP2C19基因型对中国人群泮托拉唑代谢作用较低[33]. 虽也有研究[21]报道, 不同个体使用泮托拉唑后胃H. pylori的治愈率不同, 受CYP2C19基因多态性的影响较大, 但推测是患者使用的抗生素等对耐药性造成了影响.
1.2.5 雷贝拉唑的药物基因组学: 雷贝拉唑为第二代PPI, 主要经过非酶途径代谢为雷贝拉唑硫醚, 少量经CYP2C19和CYP3A4作用分别转化为脱甲基雷贝拉唑和雷贝拉唑砜. 姜英杰等对幽门螺旋杆菌阳性的慢性胃炎患者实施雷贝拉唑联合阿莫西林和克拉霉素治疗, 发现雷贝拉唑治疗组不受CYP2C19基因型的影响, 原因是雷贝拉唑仅部分经CYP2C19代谢[21]. 梁嘉碧等用胃镜检查结果作为药效判断指标, 也进一步确证了雷贝拉唑代谢不受CYP2C19的影响[34]. 但是Furuta等[35]给予97例H. pylori感染胃炎的患者雷贝拉唑和阿莫西林持续2 wk治疗, 发现与纯合子强代谢者的H. pylori根除率相比, 弱代谢和杂合子强代谢者的H. pylori根除率更高, 推测经非酶途径产生的雷贝拉唑硫醚很可能进一步经CYP2C19催化代谢导致了临床差异. 所以目前CYP2C19基因多态性对雷贝拉唑疗效的影响尚有争议.
1.2.6 右兰索拉唑: 右兰索拉唑是一种近几年才引进到亚太地区的PPI抑制剂, 是兰索拉唑的对应体, 右旋兰索拉唑和左旋兰索拉唑的外消旋混合物(图2)[36]. 右兰索拉唑对CYP2C19代谢作用极微小, 如必要, 可合用氯吡格雷.
CYP2C19活性与肝病严重程度呈负相关. 有研究证实终末期肝病患者泮托拉唑钠血药浓度明显升高, 尤其是CYP2C19弱代谢者. 临床使用泮托拉唑钠时需注意患者的肝脏病变情况, 对于肝功能有损害者, 应适当减少用药剂量: 对终末期肝病的CYP2C19弱代谢者, 更应根据血药浓度调整剂量, 以确保药物使用的安全性和有效性[17].
虽然男性更容易得消化性溃疡疾病, 但是研究[9]表明, 年龄和性别与CYP2C19几乎没有相关性.
以CYP2C19为主要代谢酶的药物谱较广泛, 包括PPI、三环类抗抑郁药、抗癫痫药、抗精神病药、抗凝药、抗真菌药及抗肿瘤药物等.
奥美拉唑和氯吡格雷均经CYP2C19代谢, 且奥美拉唑对CYP2C19具有抑制作用. 因此, 理论上奥美拉唑与氯吡格雷的联用会导致氯吡格雷体内的有效代谢物降低, 从而影响疗效. 研究[38]发现, 奥美拉唑会显著降低氯吡格雷的抗血小板活性, 而泮托拉唑或埃索美拉唑则不会.
2009年, 美国食品药品管理局规定, 氯吡格雷不能和奥美拉唑或埃索拉唑合用, 因为: "避免氯吡格雷与奥美拉唑或埃索拉唑合并用药, 以免过度降低氯吡格雷的抗血小板作用"[39]. 但是当氯吡格雷与阿司匹林合用作为抗血小板治疗时, 为了防止消化道出血, 应该加用奥美拉唑[40].
奥美拉唑和伏立康唑都经CYP2C19代谢, 且奥美拉唑作为CYP2C19的抑制剂, 同时应用这2种药物可能产生相互作用. 在国内外均有因伏立康唑与奥美拉唑合用导致药物不良反应的报道[41,42]. 所以奥美拉唑等PPI不应与经CYP2C19代谢的抗真菌药合用.
苯妥英钠和丙戊酸是临床上常用的抗癫痫药物之一, 由于他们抗癫谱比较广, 疗效比较确切, 价格比较低廉, 因此在癫痫患者中得到了广泛的应用. 随着PGx的发展, 研究[43]发现临床中常用的抗癫痫药物丙戊酸和苯妥英钠等主要CYP2C19代谢. 最近的一项研究[44]通过检测丙戊酸钠、氯巴占及其活性代谢物N-氯巴占的血药浓度, 证实了两者的血药浓度与CYP2C19基因多态性有关. 长期使用苯妥英钠药物的癫痫患者, 如果使用常规剂量的PPI抑制剂, 可能导致血栓性不良事件.
抗抑郁药特别是三环类抗抑郁药主要经CYP2C19代谢, 部分药经CYP3A4代谢. 研究证实奥美拉唑与氯氮平合用后能降低氯氮平与去甲氯氮平的血药浓度. 研究表明氯氮平血药浓度变化与CYP3A4有关. 随着氯氮平给药剂量的增加, 氯氮平在体内几乎完全在肝脏经CYP3A4代谢, 生成N-去甲基氯氮平、氯氮平的N-氧化代谢物等. 而奥美拉唑等PPI能诱导CYP3A4, 因此当奥美拉唑等PPI与氯氮平合用时, 奥美拉哇通过诱导CYP3A4代谢活性, 加快氯氮平在体内的氧化代谢, 降低其血药浓度[45,46].
研究表明, CYP2C19、CYP3A4参与部分抗肿瘤药物的代谢, 例如少量服用环磷酰胺与异环磷酰胺时, 其主要经CYP2C19酶4位羟基化后才具有活性. Choi等[47]发现CYP2C19基因多态性影响肿瘤药物阿托西汀的血药浓度. Beelen等[48]和Ruiter等[49]学者的研究表明, CYP2C19*2等位基因有利于患者接受TAM治疗的预后. 另外多个研究[50]表明: CYP3A4*1B对肿瘤化疗后的生存期有显著影响. 同时服用这类抗肿瘤药物和PPI会产生相互作用, 影响血药浓度和代谢活性. 加拿大卫生部在不久前发布了通知: 禁止同时使用大剂量甲氨蝶呤和PPI, 避免增加甲氨蝶呤的血药浓度, 从而导致不良反应的发生(加拿大卫生部网站). 因此, 对于这类经CYP2C19或CYP3A4代谢的抗肿瘤药物, 由于其治疗窗较窄, 毒性大, 用药易引起严重不良反应, 且患者的个体差异性大, 与PPI同时服用时个体化给药显得尤为重要. 总之, 对患者用药时, 应综合考虑患者的用药史, 疾病史, 合理用药, 避免药物相互作用.
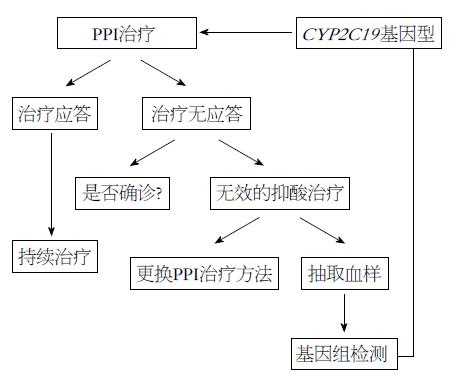
我国是一个多民族国家, CYP450的遗传多态性具有显著的民族和种族差异. 以PPI为例(图3), 识别药物代谢的基因型可以为医生提供科学依据, 从而充分应用高剂量快速代谢或低剂量慢代谢达到更有效的治疗以节省成本和时间. 鉴于该因素对PPI血药浓度的重要性, 目前南京医科大学第一附属医院临床药研室已经面向临床常规开展CYP2C19基因型的检测工作, 针对不同的检测结果向医生以及患者给予相应的给药方案的建议: 如患者为PM型或IM型时, 建议按常规剂量给药, 但需密切观察血药浓度, 如浓度过低, 则需及时增加剂量; 为EM型时, 可加用H2受体阻断剂; 为UM型时, 则建议患者加大剂量或者不使用PPI类第一代药物. 在使用PPI类药物之前检测患者的CYP2C19基因型, 既可以提高药物疗效, 降低药物不良反应, 又可以避免无效用药造成的浪费, 确保个体化治疗指导下的合理使用, 具有重大的指导意义.
质子泵抑制剂(proton pump inhibitors, PPIs)目前应用最广泛的抑酸药物. 由于用药的个体间差异大, 如何在临床合理使用PPI一直是广大学者关注的热点. 近年来药物基因组学(pharmacogenomics, PGx)迅速发展, PPI PGx也得到广泛研究, 对药物临床应用产生巨大指导意义, 故对其进行综述.
质子泵抑制剂抑制胃酸效果显著, 临床应用广泛, 遗传因素影响研究比较明确. 合理使用PGx可以为临床医生和临床药师提供用药指导, 在治疗上根据基因信息的指导进行给药, 可以避免其毒性并使治疗效果达到最优化. 但是基因多态性和同种基因介导的药物相互作用可能引起药物使用不良反应.
兰冰等对CYP2C19的多态性分布以及其与药物代谢和疾病易感性的研究进展进行综述.
本文系统阐述了P450 2C19对PPI类药物的代谢和影响, 由CYP 2C19酶介导的药物相互作用, 对PPI类药物的使用有很好的引导作用.
本文对PPI PGx研究进展进行综述, 总结了目前常用PPI药物代谢酶相关研究进展. 同时本文还讨论了药物基因组与临床用药不良反应的关系及CYP2C19介导的药物相互作用, 对临床PPI正确应用及个体化治疗提供理论基础.
李树德, 副教授, 昆明医科大学基础医学院生物化学与分子生物学系; 李铮, 教授, 西北大学; 周南进, 研究员, 江西省医学科学研究所
本文阐述质子泵抑制剂类PGx及与临床的关系, 观点较新颖.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 郭鹏 电编:李瑞芳
| 1. | Goh KL, Choi MG, Hsu PI, Chun HJ, Mahachai V, Kachintorn U, Leelakusolvong S, Kim N, Rani AA, Wong BC. The Pharmacological and Safety Profile of Dexlansoprazole: a New Proton Pump Inhibitor - Implications for Treatment of Gastroesophageal Reflux Disease in the Asia Pacific Region. J Neurogastroenterol Motil. 2016; Mar 1. [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Furuta T, Sugimoto M, Shirai N, Ishizaki T. CYP2C19 pharmacogenomics associated with therapy of Helicobacter pylori infection and gastro-esophageal reflux diseases with a proton pump inhibitor. Pharmacogenomics. 2007;8:1199-1210. [PubMed] |
| 6. | Seripa D, Pilotto A, Panza F, Matera MG, Pilotto A. Pharmacogenetics of cytochrome P450 (CYP) in the elderly. Ageing Res Rev. 2010;9:457-474. [PubMed] [DOI] |
| 8. | Yin T, Miyata T. Pharmacogenomics of clopidogrel: evidence and perspectives. Thromb Res. 2011;128:307-316. [PubMed] [DOI] |
| 9. | Musumba CO, Jorgensen A, Sutton L, Van Eker D, Zhang E, O'Hara N, Carr DF, Pritchard DM, Pirmohamed M. CYP2C19*17 gain-of-function polymorphism is associated with peptic ulcer disease. Clin Pharmacol Ther. 2013;93:195-203. [PubMed] [DOI] |
| 10. | Robinson M, Horn J. Clinical pharmacology of proton pump inhibitors: what the practising physician needs to know. Drugs. 2003;63:2739-2754. [PubMed] |
| 11. | Xie HG, Huang SL, Xu ZH, Xiao ZS, He N, Zhou HH. Evidence for the effect of gender on activity of (S)-mephenytoin 4'-hydroxylase (CYP2C19) in a Chinese population. Pharmacogenetics. 1997;7:115-119. [PubMed] |
| 12. | Pedersen RS, Brasch-Andersen C, Sim SC, Bergmann TK, Halling J, Petersen MS, Weihe P, Edvardsen H, Kristensen VN, Brøsen K. Linkage disequilibrium between the CYP2C19*17 allele and wildtype CYP2C8 and CYP2C9 alleles: identification of CYP2C haplotypes in healthy Nordic populations. Eur J Clin Pharmacol. 2010;66:1199-1205. [PubMed] [DOI] |
| 13. | Grosdidier C, Quilici J, Loosveld M, Camoin L, Moro PJ, Saut N, Gaborit B, Pankert M, Cohen W, Lambert M. Effect of CYP2C19*2 and *17 genetic variants on platelet response to clopidogrel and prasugrel maintenance dose and relation to bleeding complications. Am J Cardiol. 2013;111:985-990. [PubMed] [DOI] |
| 14. | 兰 冰, 康 龙丽. 细胞色素P450 2C19遗传多态性的研究进展. 国外医学医学医学地理分册. 2015;36:159-164. |
| 15. | Levêque D, Nivoix Y, Jehl F, Herbrecht R. Clinical pharmacokinetics of voriconazole. Int J Antimicrob Agents. 2006;27:274-284. [PubMed] [DOI] |
| 16. | Saari TI, Laine K, Leino K, Valtonen M, Neuvonen PJ, Olkkola KT. Effect of voriconazole on the pharmacokinetics and pharmacodynamics of zolpidem in healthy subjects. Br J Clin Pharmacol. 2007;63:116-120. [PubMed] [DOI] |
| 17. | Oates NS, Shah RR, Idle JR, Smith RL. Influence of oxidation polymorphism on phenformin kinetics and dynamics. Clin Pharmacol Ther. 1983;34:827-834. [PubMed] |
| 18. | Xiao ZS, Goldstein JA, Xie HG, Blaisdell J, Wang W, Jiang CH, Yan FX, He N, Huang SL, Xu ZH. Differences in the incidence of the CYP2C19 polymorphism affecting the S-mephenytoin phenotype in Chinese Han and Bai populations and identification of a new rare CYP2C19 mutant allele. J Pharmacol Exp Ther. 1997;281:604-609. [PubMed] |
| 19. | Wedemeyer RS, Blume H. Pharmacokinetic drug interaction profiles of proton pump inhibitors: an update. Drug Saf. 2014;37:201-211. [PubMed] [DOI] |
| 20. | Furuta T, Ohashi K, Kosuge K, Zhao XJ, Takashima M, Kimura M, Nishimoto M, Hanai H, Kaneko E, Ishizaki T. CYP2C19 genotype status and effect of omeprazole on intragastric pH in humans. Clin Pharmacol Ther. 1999;65:552-561. [PubMed] |
| 21. | McNicholl AG, Linares PM, Nyssen OP, Calvet X, Gisbert JP. Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther. 2012;36:414-425. [PubMed] [DOI] |
| 22. | Chaudhry AS, Kochhar R, Kohli KK. Genetic polymorphism of CYP2C19 & amp; therapeutic response to proton pump inhibitors. Indian J Med Res. 2008;127:521-530. [PubMed] |
| 23. | Sahara S, Sugimoto M, Uotani T, Ichikawa H, Yamade M, Iwaizumi M, Yamada T, Osawa S, Sugimoto K, Umemura K. Twice-daily dosing of esomeprazole effectively inhibits acid secretion in CYP2C19 rapid metabolisers compared with twice-daily omeprazole, rabeprazole or lansoprazole. Aliment Pharmacol Ther. 2013;38:1129-1137. [PubMed] [DOI] |
| 24. | Zhang D, Yang M, Liu M, Zhang Y, Wang X, Xiao X, Liu H. Pharmacokinetics of lansoprazole and its main metabolites after single intravenous doses in healthy Chinese subjects. Xenobiotica. 2012;42:1156-1162. [PubMed] [DOI] |
| 25. | Miura M, Tada H, Yasui-Furukori N, Uno T, Sugawara K, Tateishi T, Suzuki T. Pharmacokinetic differences between the enantiomers of lansoprazole and its metabolite, 5-hydroxylansoprazole, in relation to CYP2C19 genotypes. Eur J Clin Pharmacol. 2004;60:623-628. [PubMed] [DOI] |
| 26. | 严 非, 夏 春华, 熊 玉卿. CYP2C19基因多态性对中国人体内兰索拉唑药代动力学及其5-羟基代谢通路的影响. 中国临床药理学和治疗学. 2011;16:1397-1402. |
| 27. | 张 韬, 辛 汉, 矫 正, 辛 永宁, 张 红, 夏 春华, 徐 文炜, 熊 玉卿. CYP2C19基因多态性对兰索拉唑治疗胃溃疡临床疗效及不良反应的影响. 实用临床医学. 2015;16:7-9. |
| 28. | Hokimoto S, Akasaka T, Tabata N, Arima Y, Tsujita K, Sakamoto K, Kaikita K, Morita K, Kumagae N, Yamamoto E. Impact of esomeprazole on platelet reactivity and clinical outcome according to CYP2C19 genotype in coronary heart disease patients during dual antiplatelet therapy. Thromb Res. 2015;135:1081-1086. [PubMed] [DOI] |
| 31. | Kuo CH, Hsu PI, Kuo FC, Wang SS, Hu HM, Liu CJ, Chuah SK, Chen YH, Hsieh MC, Wu DC. Comparison of 10 day bismuth quadruple therapy with high-dose metronidazole or levofloxacin for second-line Helicobacter pylori therapy: a randomized controlled trial. J Antimicrob Chemother. 2013;68:222-228. [PubMed] [DOI] |
| 32. | Klotz U. Pharmacokinetic considerations in the eradication of Helicobacter pylori. Clin Pharmacokinet. 2000;38:243-270. [PubMed] |
| 35. | Furuta T, Shirai N, Takashima M, Xiao F, Hanai H, Nakagawa K, Sugimura H, Ohashi K, Ishizaki T. Effects of genotypic differences in CYP2C19 status on cure rates for Helicobacter pylori infection by dual therapy with rabeprazole plus amoxicillin. Pharmacogenetics. 2001;11:341-348. [PubMed] |
| 36. | Behm BW, Peura DA. Dexlansoprazole MR for the management of gastroesophageal reflux disease. Expert Rev Gastroenterol Hepatol. 2011;5:439-445. [PubMed] [DOI] |
| 37. | Żochowska D, Wyzgał J, Pączek L. Impact of CYP3A4*1B and CYP3A5*3 polymorphisms on the pharmacokinetics of cyclosporine and sirolimus in renal transplant recipients. Ann Transplant. 2012;17:36-44. [PubMed] |
| 38. | Vardi M, Cryer BL, Cohen M, Lanas A, Schnitzer TJ, Lapuerta P, Goldsmith MA, Laine L, Doros G, Liu Y. The effects of proton pump inhibition on patient-reported severity of dyspepsia when receiving dual anti-platelet therapy with clopidogrel and low-dose aspirin: analysis from the Clopidogrel and the Optimization of Gastrointestinal Events Trial. Aliment Pharmacol Ther. 2015;42:365-374. [PubMed] [DOI] |
| 39. | US Food and Drug Administration. Plavix (clopidogrel bisulfate) tablet. Detailed View: Safety Labeling Changes Approved By FDA Center for Drug Evaluation and Research (CDER). July 2015. Available from: http:/www.fda.gov/Safety/MedWatch/SafetyInformation/ucm225843.htm.. |
| 40. | Tantry US, Kereiakes DJ, Gurbel PA. Clopidogrel and proton pump inhibitors: influence of pharmacological interactions on clinical outcomes and mechanistic explanations. JACC Cardiovasc Interv. 2011;4:365-380. [PubMed] [DOI] |
| 41. | Kim DY, Park HJ, Lee YJ. Factors affecting voriconazole plasma concentrations in patients with invasive fungal infections. Int J Clin Pharmacol Ther. 2014;52:209-216. [PubMed] [DOI] |
| 42. | 梁 峰华, 孟 冬梅, 谢 慧, 肖 翔林, 吕 碧君, 陈 文瑛. CYP2C19基因多态性对侵袭性真菌感染重症患者伏立康唑血药浓度的影响. 中国医院药学杂志. 2015;35:1456-1461. |
| 43. | Yamamoto Y, Takahashi Y, Imai K, Miyakawa K, Nishimura S, Kasai R, Ikeda H, Takayama R, Mogami Y, Yamaguchi T. Influence of CYP2C19 polymorphism and concomitant antiepileptic drugs on serum clobazam and N-desmethyl clobazam concentrations in patients with epilepsy. Ther Drug Monit. 2013;35:305-312. [PubMed] [DOI] |
| 44. | Kouga T, Shimbo H, Iai M, Yamashita S, Ishii A, Ihara Y, Hirose S, Yamakawa K, Osaka H. Effect of CYP2C19 polymorphisms on stiripentol administration in Japanese cases of Dravet syndrome. Brain Dev. 2015;37:243-249. [PubMed] [DOI] |
| 45. | Uotani T, Sugimoto M, Nishino M, Kodaira C, Yamade M, Sahara S, Yamada T, Osawa S, Sugimoto K, Tanaka T. Ability of rabeprazole to prevent gastric mucosal damage from clopidogrel and low doses of aspirin depends on CYP2C19 genotype. Clin Gastroenterol Hepatol. 2012;10:879-885.e2. [PubMed] [DOI] |
| 46. | Mookhoek EJ, Loonen AJ. Retrospective evaluation of the effect of omeprazole on clozapine metabolism. Pharm World Sci. 2004;26:180-182. [PubMed] |
| 47. | Choi CI, Bae JW, Lee YJ, Lee HI, Jang CG, Lee SY. Effects of CYP2C19 genetic polymorphisms on atomoxetine pharmacokinetics. J Clin Psychopharmacol. 2014;34:139-142. [PubMed] [DOI] |
| 48. | Beelen K, Opdam M, Severson TM, Koornstra RH, Vincent AD, Hauptmann M, van Schaik RH, Berns EM, Vermorken JB, van Diest PJ. CYP2C19 2 predicts substantial tamoxifen benefit in postmenopausal breast cancer patients randomized between adjuvant tamoxifen and no systemic treatment. Breast Cancer Res Treat. 2013;139:649-655. [PubMed] [DOI] |
| 49. | Ruiter R, Bijl MJ, van Schaik RH, Berns EM, Hofman A, Coebergh JW, van Noord C, Visser LE, Stricker BH. CYP2C19*2 polymorphism is associated with increased survival in breast cancer patients using tamoxifen. Pharmacogenomics. 2010;11:1367-1375. [PubMed] [DOI] |
| 50. | Assis J, Pereira D, Gomes M, Marques D, Marques I, Nogueira A, Catarino R, Medeiros R. Influence of CYP3A4 genotypes in the outcome of serous ovarian cancer patients treated with first-line chemotherapy: implication of a CYP3A4 activity profile. Int J Clin Exp Med. 2013;6:552-561. [PubMed] |