修回日期: 2016-05-30
接受日期: 2016-06-06
在线出版日期: 2016-11-18
近年来, 肠道微生态在疾病中的作用日益得到关注, 尤其是在作为肠道微生态载体的结直肠(大肠)中的研究, 更是取得了一定进展, 肠道微生态在结直肠癌(colorectal cancer, CRC)发生、发展过程中的作用逐步被阐明. 越来越多的研究表明肠道微生态在临床已取得一定疗效的CRC相关精准治疗方式如肿瘤免疫疗法、肿瘤化学疗法、肿瘤益生菌干预等方法中发挥关键作用, 其机制仍有待进一步探索. 本文就CRC中与微生态相关的精准治疗方式及其潜在机制进行简要综述.
核心提要: 近来研究表明肠道微生态在结直肠癌(colorectal cancer, CRC)相关精准治疗方式如肿瘤免疫疗法、肿瘤化学疗法、肿瘤益生菌干预等方法中发挥关键作用, 其机制有待进一步探索. 本文就CRC中与微生态相关的精准治疗方式及其潜在机制进行简要综述.
引文著录: 李豪, 张鹏. 肠道微生态在大肠癌精准治疗中作用的研究进展. 世界华人消化杂志 2016; 24(32): 4354-4361
Revised: May 30, 2016
Accepted: June 6, 2016
Published online: November 18, 2016
Recently, the role of intestinal microecology in diseases has attracted increasing attention. Some progress has been achieved in the study of the colorectum, which is the carrier of intestinal microecology, and the role of intestinal microecology in colorectal cancer (CRC) formation and progression has been clarified gradually. More and more studies show that intestinal microecology plays a key role in CRC related precision treatments, such as tumor immunotherapy, chemotherapy and probiotic intervention, which have achieved certain curative effects in clinical treatment, although the mechanism still needs further study. This review briefly discusses the intestinal microecology related precision treatments for CRC and their potential mechanisms.
- Citation: Li H, Zhang P. Role of intestinal microecology in precision treatment of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(32): 4354-4361
- URL: https://www.wjgnet.com/1009-3079/full/v24/i32/4354.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i32.4354
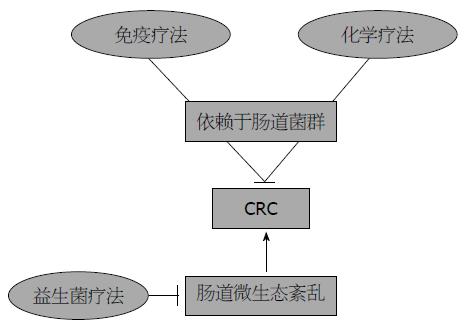
结直肠癌(colorectal cancer, CRC)目前在全世界恶性肿瘤发病率中排在第3位, 全世界每年有超过140万新发病例[1]. 随着患者对术后生活质量的要求越来越高, 对CRC的研究也一直是医学热点. 近年来, 大量研究揭示了肠道微生态在CRC发生发展中的作用[2-5], 同时也有部分研究发现在CRC相关精准治疗中, 肠道微生态起到了关键作用[6-11], 但机制仍未完全理清. CRC的精准治疗包括免疫疗法、化学疗法、益生菌疗法等[12-14]. 近来有研究报道抗肿瘤免疫疗法中免疫哨卡抑制剂效用的发挥有赖于肠道微生态. 而化学疗法中常用药物铂类化疗药物的抗癌疗效受到肠道菌群的调节. 另外, 5-氟尿嘧啶(5-fluorouridine, 5-Fu)在肠道菌群代谢产物的影响下, 能加强对CRC细胞的杀灭作用. 益生菌的使用则通过多种途径防治CRC(图1). 本文就上述微生态相关精准治疗方式及相关机制进行一综述, 旨在引起读者对该领域的兴趣.
现代肿瘤免疫疗法主要包括非特异性的免疫调节剂治疗、肿瘤疫苗治疗、过继性免疫治疗以及免疫结合点阻断治疗等方法[15-20]. 而经由微生物治疗癌症的免疫治疗早在19世纪末就有研究报道: 用热灭活化脓性链球菌和沙雷氏菌的混合物治疗肉瘤患者能有效增加其生存率, 1000例患者中80%患者5年生存率增加. 研究者猜测该混合物诱导了持久免疫反应从而发挥抗肿瘤作用[1]. 最近则有研究表明肠道菌群的组成可以很好地预测同种异体干细胞移植的疗效[21], 证实肠道微生物在形成全身免疫应答过程中扮演了重要角色[22-24]. 以上研究皆显示, 通过微生物来调控患者的免疫系统从而治疗肿瘤是肿瘤免疫疗法的关键机制途径之一.
目前的肿瘤免疫研究治疗研究更多聚焦在免疫结合点阻断治疗, 较为成熟的干预机制包括针对细胞毒T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)的抗体, 以及针对CD8+ T细胞程序性死亡因子PD-1/PD-L1的抗体, 两者常被称为免疫哨卡抑制剂[25]. 虽然已经确认微生物在肿瘤免疫中存在有利影响, 但对于共生微生物是否会影响自发免疫反应来抵抗肿瘤, 从而影响诸如免疫哨卡抑制剂此类免疫干预物治疗活性的问题直到最近才逐渐被阐明. 近日, Science上的两篇研究从不同角度给出了类似答案.
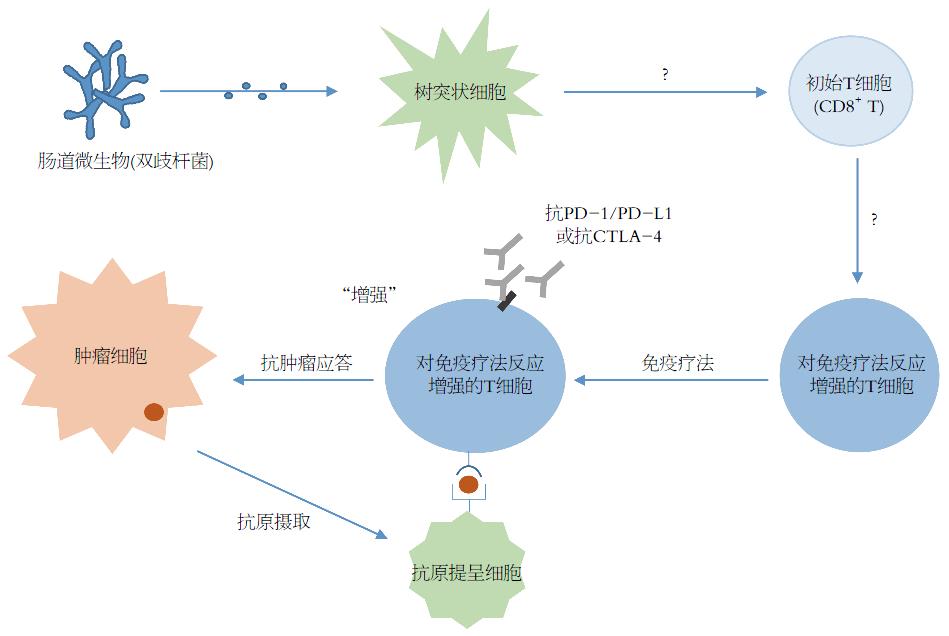
Sivan等[26]研究发现在小鼠中, 双歧杆菌与抗肿瘤效果有关: 单独口服双歧杆菌就能达到相当于使用PD-L1抑制剂的肿瘤控制效果, 联合双歧杆菌及PD-L1抑制剂治疗则几乎完全抑制肿瘤生长. 进一步研究发现是功能增强的树突状细胞提高了CD8+ T细胞的启动以及在肿瘤微环境聚集从而介导了上述效果(图2), 但其中的具体机制仍有待探索. 本研究证实了双歧杆菌能增强抗肿瘤免疫力, 促进抗PD-L1免疫疗法的效率. 研究者进一步提出假设: 实体瘤中, 增强T细胞渗透的一个可能要素是肠道菌群.
Vétizou等[27]研究证实CTLA-4抑制剂抗肿瘤作用依赖拟杆菌. 在小鼠和人中, T细胞对于多形拟杆菌或脆弱拟杆菌的响应同CTLA-4抑制剂的抗癌效率有关. 另外, 用抗生素处理过的小鼠或者无菌鼠体内的肿瘤对CTLA-4抑制剂不响应, 而填喂脆弱类拟杆菌、使用多糖免疫或移植特异性T细胞后, 肿瘤对CTLA-4抑制剂恢复响应. 最后, 研究者将黑色素瘤患者粪菌移植给小鼠, 证明CTLA-4抑制剂促进脆弱类拟杆菌生长. 本研究说明了肠道菌之一拟杆菌在CTLA-4抑制剂疗法中的免疫刺激作用.
以上研究皆显示肠道微生物在免疫哨卡抑制剂治疗癌症中作用关键, 但我们认为仍有值得商榷改进之处. 首先, 研究未讨论其他除双歧杆菌和拟杆菌之外的肠道菌群对于抗肿瘤免疫是否具有调节作用, 相似的研究可以在PD-1/PD-L1及CTLA-4通路中展开. 其次, 小鼠模型中的实验结果无法直接应用于临床治疗, 相关结论有待在临床试验中加以验证并逐步过渡至临床实际应用. 最后, 以上研究目标肿瘤多为黑色素瘤, 而非本文关注焦点CRC, 究其主要原因是因为一直以来都认为CRC对免疫治疗不敏感. 但近来, Lee等[28]的研究证实有基因错配修复缺陷的癌症对PD-1抑制剂有良好反应, 其中就包括CRC: 基因错配修复缺陷的CRC患者使用PD-1抑制剂肿瘤控制率达到62%, 相比之下, 基因错配修复完善的CRC患者只有16%. 因此, 以上研究确实为利用肠道微生物进行癌症治疗提供思路-改变肠道菌群的组成可能提升肿瘤免疫疗法的疗效, 为含有基因错配修复缺陷的CRC患者的免疫精准治疗打下基础, 显示良好前景.
CRC化学疗法常用于术后辅助治疗或CRC晚期患者的治疗, 常用药物包括铂类药物、氟尿嘧啶及其衍生物等. 近来, 越来越多研究证明各类化疗药物的抗肿瘤活性受到肠道微生物影响. 如Viaud等[29]及Iida[30]近期在Science杂志分别发表的两个研究证明在癌症环境中, 肠道微生物可对常用于其他肿瘤化疗的烷基化抗癌剂环磷酰胺和CRC常用铂类化疗药物奥沙利铂产生应答从而介导免疫激活影响药物抗肿瘤活性. 另有González-Sarrías等[31]研究则提示, 肠道菌群代谢产物能加强5-Fu对CRC细胞的杀灭作用.
化学药物环磷酰胺通过刺激抗肿瘤免疫应答来介导其抗肿瘤活性[32], 其通过诱导免疫源性癌症细胞死亡[33,34]、破坏免疫抑制性T细胞[35]、促进Th1和Th17细胞[36]来控制肿瘤生长. Viaud等[29]进一步研究了环磷酰胺对小肠菌群的影响以及对抗肿瘤免疫反应的后续影响. 通过老鼠模型实验, 研究者证实环磷酰胺能够改变小鼠小肠中菌群的组成并诱导某些革兰氏阳性菌向次级淋巴器官转移, 而这些在次级淋巴器官处的细菌能够刺激宿主产生一群特殊的"致病性"的Th17细胞(pTh17)以及Th1记忆细胞的免疫应答. 最后, 在无菌小鼠或用抗生素杀死革兰氏阳性菌的小鼠中, 研究者发现存在pTh17反应减弱现象, 同时这些小鼠的肿瘤对环磷酰胺治疗产生抵抗, 而当研究者将pTh17过继转移到这些小鼠中则改善了环磷酰胺的抗肿瘤疗效. 以上研究[29]表明肠道菌群有助于化疗药物环磷酰胺的抗肿瘤免疫应答.
Noriho Iida的研究则显示破坏肠道菌群会导致奥沙利铂治疗皮下肿瘤的疗效受损. 奥沙利铂的作用机制虽然尚未完全阐明, 但有研究[37]表明, 奥沙利铂通过作用于DNA形成加合物和链内交联, 从而抑制DNA合成, 产生细胞毒作用和抗肿瘤活性. 另外, 在奥沙利铂使用后, 活性氧产物的生成也是DNA损伤和细胞凋亡的原因之一[38]. 通过小鼠实验, 研究者发现抗生素鸡尾酒疗法能在已经形成部分DNA加合物后, 通过减少活性氧产物阻止奥沙利铂诱发的DNA损伤和细胞凋亡, 需要指出的是, 实验数据表明: 在体内, 奥沙利铂的基因毒性所需的活性氧大多是来自肿瘤相关炎性细胞. 这表明, 肠道菌群通过影响相关炎性细胞, 进一步影响活性氧的生成, 从而影响奥沙利铂的抗肿瘤活性. 除了铂类化疗药物, 研究者推测, 以生成活性氧作为部分抗肿瘤活性的其他化疗药物, 如蒽环类化疗剂、烷化剂类药物、足叶草毒素、喜树碱等可能受到同样的调控. 因此, 本研究得出结论: 共生菌通过调节肿瘤微环境以控制癌症对治疗响应[30].
González-Sarrías等[31]发现由人体肠道菌群分解膳食中多酚鞣花酸产生的尿石素A能增强5-Fu对CRC细胞的影响. 这表明, 使用更低剂量的5-Fu就能达到相似的疗效, 减少了可能产生的不良反应.
上述研究虽然有许多机制仍未阐明, 但从不同角度阐述了肠道菌群在癌症化学精准治疗中的可能作用. 值得注意的是, 对于环磷酰胺和奥沙利铂, 其疗效都是通过免疫途径与肠道微生物相关联, 与上文已经提到的肠道菌群在免疫疗法中的作用有相似之处, 即"肠道菌群-免疫应答-相关干预(如使用化疗药物、免疫哨卡抑制剂等)抑癌效应增强"这一通路. 这提示免疫可能在肠道微生态与各种癌症干预手段之间起到桥梁作用. 另外, 鉴于5-Fu、奥沙利铂是CRC临床治疗常用化疗药物, 肠道微生态稳定在使用化疗药物过程中所起的作用需引起临床医生的关注, 并由此加强扰乱肠道微生态药物如抗生素的规范使用.
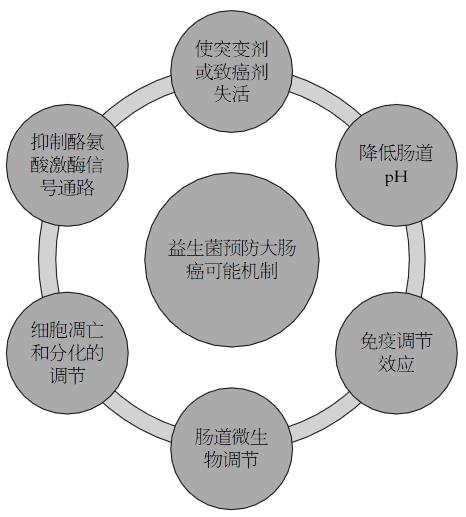
益生菌及益生元国际科学协会将益生菌定义为"活的微生物, 适量服用给予宿主健康益处"[39]. 服用益生菌的益处包括抵抗肠道病原微生物、调节免疫系统、降低血液胆固醇水平、减少肠道炎症、预防CRC、调节宿主能量代谢等[11,40]. 相比于免疫及化学疗法, 益生菌疗法更多侧重于CRC的预防. 其预防CRC作用可以总结于以下几点: (1)使突变剂或致癌剂失活; (2)降低肠道pH; (3)免疫调节效应; (4)肠道微生物调节; (5)细胞凋亡和分化的调节; (6)抑制酪氨酸激酶信号通路[41](图3).
益生菌疗法防治CRC的效用已在相关试验中得到证实. Ishikawa等[42]证实口服活代田菌(L. casei Shirota, LcS)能抑制CRC患者肿瘤异型性. 同时, Aso等[43]的研究证实LcS能够阻止表浅性膀胱癌的复发. Hatakka等[44]则报道了使用L. rhamnosus LC705和P. freudenreichii sp. shermanii JS能降低粪便中β-葡萄糖苷酶活性并调控肠道微生态, 有利于防治CRC.
此外, 最新研究[45-48]表明肠道致病菌具核梭杆菌(fusobacterium nucleatum, Fn)同CRC发生发展乃至预后都息息相关, 但关于是否可以通过针对Fn进行干预从而防治CRC的研究暂时还未见报道, 同时, 如何进行Fn干预也是难点之一. Fn作为口腔常见致病菌会导致口臭问题, 运用益生菌对其进行干预从而防治口臭的研究国内外均已有报道. 研究者[49,50]研究发现运用益生菌Weissella cibaria可以减少Fn所产生的挥发性硫化物, 而可能原因就是Weissella cibaria产生的过氧化氢产物能有效抑制Fn. 另外, 杨雯洁等[51]发现益生菌Lactobacillus delbrueckii subsp和Streptococcus salivarius对Fn的生长有显著拮抗作用, 能有效抑制口臭. 以上研究提示: 针对Fn进行益生菌干预是CRC防治的可能措施之一, 显示了益生菌在CRC防治中潜在机制的多样性.
免疫疗法和化学疗法是部分抗肿瘤效果依赖于肠道微生态, 不同的是, 益生菌疗法本身就是对肠道微生态的直接改变. 在健康人群中, 益生菌的服用在CRC中主要起到预防效果, 但在CRC患者中, 直接补充益生菌一方面能调节肠道微生态, 另一方面能促进CRC相关治疗方式的效果, 如双歧杆菌的摄入能加强PD-L1抑制剂的肿瘤控制功效. 因此, 益生菌疗法也是CRC微生态相关精准治疗方式之一.
经典的临床指南已明确CRC的肿瘤本身治疗方式以手术治疗为主, 而肿瘤的全身治疗方案不一而足. 本文主要讨论肠道微生态在CRC精准治疗方法中作用及应用. 纵观目前研究, 肠道微生态在CRC的常见相关精准治疗作用机制中起到关键作用, 肠道微生态的失调会影响到免疫疗法、化学疗法等主要精准治疗手段及药物的疗效, 导致免疫制剂、或者化学药物用量的增加, 不仅会增加患者出现不良反应的可能, 更会加重患者经济负担, 降低患者依从性, 甚至导致治疗失败. 因此, 肠道微生态在CRC及其他肿瘤治疗过程中发挥的关键作用及机制研究不仅提示临床医生在诊疗CRC患者时, 可尝试将充分评估患者的肠道微生态情况纳入诊疗范围, 并且在治疗过程中谨慎、严格用药, 包括规范使用抗生素等辅助治疗手段, 避免使用可能破坏、影响肠道微生态正常平衡的药物; 而且进一步提示临床医师尝试使用益生菌制剂等维护和改善肠道微生态, 以期通过多种作用机制途径预防CRC, 同时可能通过免疫、细菌代谢产物这些桥梁对免疫疗法、化学疗法起到推波助澜的功效, 甚至可能直接在肠道黏膜癌变过程中起消灭肿瘤细胞的效用. 此外, 针对诸如Fn等肠道致病菌的微生态精准治疗有望成为CRC防治手段之一.
目前, 结直肠癌(colorectal cancer, CRC)在全世界恶性肿瘤发病率中排在第3位, 全世界每年有超过140万新发病例. 近来, 大量研究揭示了肠道微生态在CRC发生发展中的作用. 同时也有部分研究发现在CRC相关精准治疗中, 肠道微生态起到了关键作用, 但机制仍未完全厘清.
热点、重点: 抗肿瘤免疫疗法中免疫哨卡抑制剂效用的发挥有赖于肠道微生态; 化学疗法中常用药物如铂类化疗药物的抗癌疗效受到肠道菌群的调节; 益生菌的使用则通过多种途径防治CRC. 亟待研究的问题: 是否可以通过针对诸如具核梭杆菌等肠道致病菌的干预从而防治CRC, 以及如何进行干预.
2015年Science上报道了Ayelet Sivan的研究. 研究发现在小鼠中, 双歧杆菌与抗肿瘤效果有关: 单独口服双歧杆菌就能达到相当于使用PD-L1抑制剂的肿瘤控制效果, 联合双歧杆菌及PD-L1抑制剂治疗则几乎完全抑制肿瘤生长. 这对益生菌在CRC肿瘤免疫疗法中的作用作了新的探索.
本文较为全面的总结了近年来与肠道微生态相关的精准治疗方式, 结合全世界最新的研究进展, 对各类治疗方式的潜在机制进行了简要综述, 在同类文章中尚有较好的创新性和可读性.
临床医生在诊疗CRC患者时, 可尝试将评估患者肠道微生态情况纳入诊疗范围; 在治疗过程中谨慎、严格用药: 规范使用可能破坏、影响肠道微生态正常平衡的药物, 如抗生素; 可使用益生菌制剂维护和改善肠道微生态从而防治CRC.
精准治疗: 精准治疗属于精准医疗的一部分, 常包括分子靶向药物、抗体药物和抗体偶联药物等, 本文精准治疗指与CRC治疗相关的肿瘤免疫疗法、肿瘤化学疗法、肿瘤益生菌干预等治疗方法.
邱成志, 教授, 主任医师, 福建医科大学附属第二医院普外科
本文对肠道微生态的变化影响CRC的免疫治疗、化学治疗效果及机制进行专题综合描述, 具有一定的深度, 能反映出该课题的研究现状和发展趋势, 具有较高的学术价值, 有助于临床医生提高CRC治疗的理论水平.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:胡珊
| 2. | Zitvogel L, Galluzzi L, Viaud S, Vétizou M, Daillère R, Merad M, Kroemer G. Cancer and the gut microbiota: an unexpected link. Sci Transl Med. 2015;7:271ps1. [PubMed] [DOI] |
| 4. | Nakatsu G, Li X, Zhou H, Sheng J, Wong SH, Wu WK, Ng SC, Tsoi H, Dong Y, Zhang N. Gut mucosal microbiome across stages of colorectal carcinogenesis. Nat Commun. 2015;6:8727. [PubMed] [DOI] |
| 5. | Flemer B, Lynch DB, Brown JM, Jeffery IB, Ryan FJ, Claesson MJ, O'Riordain M, Shanahan F, O'Toole PW. Tumour-associated and non-tumour-associated microbiota in colorectal cancer. Gut. 2016; Mar 18. [Epub ahead of print]. [PubMed] [DOI] |
| 6. | Ohtani N. Microbiome and cancer. Semin Immunopathol. 2015;37:65-72. [PubMed] [DOI] |
| 7. | Zhong L, Zhang X, Covasa M. Emerging roles of lactic acid bacteria in protection against colorectal cancer. World J Gastroenterol. 2014;20:7878-7886. [PubMed] [DOI] |
| 8. | Underwood MA. Intestinal dysbiosis: novel mechanisms by which gut microbes trigger and prevent disease. Prev Med. 2014;65:133-137. [PubMed] [DOI] |
| 9. | Tojo R, Suárez A, Clemente MG, de los Reyes-Gavilán CG, Margolles A, Gueimonde M, Ruas-Madiedo P. Intestinal microbiota in health and disease: role of bifidobacteria in gut homeostasis. World J Gastroenterol. 2014;20:15163-15176. [PubMed] [DOI] |
| 10. | Irrazábal T, Belcheva A, Girardin SE, Martin A, Philpott DJ. The multifaceted role of the intestinal microbiota in colon cancer. Mol Cell. 2014;54:309-320. [PubMed] [DOI] |
| 11. | Raman M, Ambalam P, Kondepudi KK, Pithva S, Kothari C, Patel AT, Purama RK, Dave JM, Vyas BR. Potential of probiotics, prebiotics and synbiotics for management of colorectal cancer. Gut Microbes. 2013;4:181-192. [PubMed] [DOI] |
| 12. | Ciombor KK, Wu C, Goldberg RM. Recent therapeutic advances in the treatment of colorectal cancer. Annu Rev Med. 2015;66:83-95. [PubMed] [DOI] |
| 13. | Amin M, Lockhart AC. The potential role of immunotherapy to treat colorectal cancer. Expert Opin Investig Drugs. 2015;24:329-344. [PubMed] [DOI] |
| 14. | Dinu D, Birla R, Caragui A, Constantinoiu S. Therapeutic strategies in colonic cancer. Chirurgia (Bucur). 2014;109:741-746. [PubMed] |
| 15. | Wang L, Ren F, Wang Q, Baldridge LA, Monn MF, Fisher KW, Sheng W, Zhou X, Du X, Cheng L. Significance of Programmed Death Ligand 1 (PD-L1) Immunohistochemical Expression in Colorectal Cancer. Mol Diagn Ther. 2016;20:175-181. [PubMed] [DOI] |
| 16. | Morita R, Hirohashi Y, Torigoe T, Ito-Inoda S, Takahashi A, Mariya T, Asanuma H, Tamura Y, Tsukahara T, Kanaseki T. Olfactory Receptor Family 7 Subfamily C Member 1 Is a Novel Marker of Colon Cancer-Initiating Cells and Is a Potent Target of Immunotherapy. Clin Cancer Res. 2016;22:3298-3309. [PubMed] [DOI] |
| 17. | Xiao Y, Freeman GJ. The microsatellite instable subset of colorectal cancer is a particularly good candidate for checkpoint blockade immunotherapy. Cancer Discov. 2015;5:16-18. [PubMed] [DOI] |
| 18. | Suri A, Jagadish N, Saini S, Gupta N. Targeting cancer testis antigens for biomarkers and immunotherapy in colorectal cancer: Current status and challenges. World J Gastrointest Oncol. 2015;7:492-502. [PubMed] [DOI] |
| 19. | Stern C, Kasnitz N, Kocijancic D, Trittel S, Riese P, Guzman CA, Leschner S, Weiss S. Induction of CD4(+) and CD8(+) anti-tumor effector T cell responses by bacteria mediated tumor therapy. Int J Cancer. 2015;137:2019-2028. [PubMed] [DOI] |
| 20. | Singh PP, Sharma PK, Krishnan G, Lockhart AC. Immune checkpoints and immunotherapy for colorectal cancer. Gastroenterol Rep (Oxf). 2015;3:289-297. [PubMed] [DOI] |
| 21. | Snyder A, Pamer E, Wolchok J. IMMUNOTHERAPY. Could microbial therapy boost cancer immunotherapy? Science. 2015;350:1031-1032. [PubMed] [DOI] |
| 22. | Hooper LV, Littman DR, Macpherson AJ. Interactions between the microbiota and the immune system. Science. 2012;336:1268-1273. [PubMed] [DOI] |
| 23. | Ivanov II, Honda K. Intestinal commensal microbes as immune modulators. Cell Host Microbe. 2012;12:496-508. [PubMed] [DOI] |
| 24. | McAleer JP, Kolls JK. Maintaining poise: commensal microbiota calibrate interferon responses. Immunity. 2012;37:10-12. [PubMed] [DOI] |
| 25. | Hoos A. Development of immuno-oncology drugs - from CTLA4 to PD1 to the next generations. Nat Rev Drug Discov. 2016;15:235-247. [PubMed] [DOI] |
| 26. | Sivan A, Corrales L, Hubert N, Williams JB, Aquino-Michaels K, Earley ZM, Benyamin FW, Lei YM, Jabri B, Alegre ML. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science. 2015;350:1084-1089. [PubMed] [DOI] |
| 27. | Vétizou M, Pitt JM, Daillère R, Lepage P, Waldschmitt N, Flament C, Rusakiewicz S, Routy B, Roberti MP, Duong CP. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science. 2015;350:1079-1084. [PubMed] [DOI] |
| 28. | Lee V, Le DT. Efficacy of PD-1 blockade in tumors with MMR deficiency. Immunotherapy. 2016;8:1-3. [PubMed] [DOI] |
| 29. | Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D, Enot DP, Pfirschke C, Engblom C, Pittet MJ. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013;342:971-976. [PubMed] [DOI] |
| 30. | Iida N, Dzutsev A, Stewart CA, Smith L, Bouladoux N, Weingarten RA, Molina DA, Salcedo R, Back T, Cramer S. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment. Science. 2013;342:967-970. [PubMed] [DOI] |
| 31. | González-Sarrías A, Tomé-Carneiro J, Bellesia A, Tomás-Barberán FA, Espín JC. The ellagic acid-derived gut microbiota metabolite, urolithin A, potentiates the anticancer effects of 5-fluorouracil chemotherapy on human colon cancer cells. Food Funct. 2015;6:1460-1469. [PubMed] [DOI] |
| 32. | Kroemer G, Galluzzi L, Kepp O, Zitvogel L. Immunogenic cell death in cancer therapy. Annu Rev Immunol. 2013;31:51-72. [PubMed] [DOI] |
| 33. | Schiavoni G, Sistigu A, Valentini M, Mattei F, Sestili P, Spadaro F, Sanchez M, Lorenzi S, D'Urso MT, Belardelli F. Cyclophosphamide synergizes with type I interferons through systemic dendritic cell reactivation and induction of immunogenic tumor apoptosis. Cancer Res. 2011;71:768-778. [PubMed] [DOI] |
| 34. | Sistigu A, Viaud S, Chaput N, Bracci L, Proietti E, Zitvogel L. Immunomodulatory effects of cyclophosphamide and implementations for vaccine design. Semin Immunopathol. 2011;33:369-383. [PubMed] [DOI] |
| 35. | Ghiringhelli F, Larmonier N, Schmitt E, Parcellier A, Cathelin D, Garrido C, Chauffert B, Solary E, Bonnotte B, Martin F. CD4+CD25+ regulatory T cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative. Eur J Immunol. 2004;34:336-344. [PubMed] [DOI] |
| 36. | Viaud S, Flament C, Zoubir M, Pautier P, LeCesne A, Ribrag V, Soria JC, Marty V, Vielh P, Robert C. Cyclophosphamide induces differentiation of Th17 cells in cancer patients. Cancer Res. 2011;71:661-665. [PubMed] [DOI] |
| 37. | Siddik ZH. Cisplatin: mode of cytotoxic action and molecular basis of resistance. Oncogene. 2003;22:7265-7279. [PubMed] [DOI] |
| 38. | Ozben T. Oxidative stress and apoptosis: impact on cancer therapy. J Pharm Sci. 2007;96:2181-2196. [PubMed] [DOI] |
| 39. | Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani RB, Flint HJ, Salminen S. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11:506-514. [PubMed] [DOI] |
| 40. | Liévin-Le Moal V, Servin AL. Anti-infective activities of lactobacillus strains in the human intestinal microbiota: from probiotics to gastrointestinal anti-infectious biotherapeutic agents. Clin Microbiol Rev. 2014;27:167-199. [PubMed] [DOI] |
| 41. | Ambalam P, Raman M, Purama RK, Doble M. Probiotics, prebiotics and colorectal cancer prevention. Best Pract Res Clin Gastroenterol. 2016;30:119-131. [PubMed] [DOI] |
| 42. | Ishikawa H, Akedo I, Otani T, Suzuki T, Nakamura T, Takeyama I, Ishiguro S, Miyaoka E, Sobue T, Kakizoe T. Randomized trial of dietary fiber and Lactobacillus casei administration for prevention of colorectal tumors. Int J Cancer. 2005;116:762-767. [PubMed] [DOI] |
| 43. | Aso Y, Akaza H, Kotake T, Tsukamoto T, Imai K, Naito S. Preventive effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer in a double-blind trial. The BLP Study Group. Eur Urol. 1995;27:104-109. [PubMed] |
| 44. | Hatakka K, Holma R, El-Nezami H, Suomalainen T, Kuisma M, Saxelin M, Poussa T, Mykkänen H, Korpela R. The influence of Lactobacillus rhamnosus LC705 together with Propionibacterium freudenreichii ssp. shermanii JS on potentially carcinogenic bacterial activity in human colon. Int J Food Microbiol. 2008;128:406-410. [PubMed] [DOI] |
| 45. | Mima K, Sukawa Y, Nishihara R, Qian ZR, Yamauchi M, Inamura K, Kim SA, Masuda A, Nowak JA, Nosho K. Fusobacterium nucleatum and T Cells in Colorectal Carcinoma. JAMA Oncol. 2015;1:653-661. [PubMed] [DOI] |
| 46. | Mima K, Nishihara R, Qian ZR, Cao Y, Sukawa Y, Nowak JA, Yang J, Dou R, Masugi Y, Song M. Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis. Gut. 2015; Aug 26. [Epub ahead of print]. [PubMed] [DOI] |
| 47. | Kostic AD, Chun E, Robertson L, Glickman JN, Gallini CA, Michaud M, Clancy TE, Chung DC, Lochhead P, Hold GL. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host Microbe. 2013;14:207-215. [PubMed] [DOI] |
| 48. | Bashir A, Miskeen AY, Bhat A, Fazili KM, Ganai BA. Fusobacterium nucleatum: an emerging bug in colorectal tumorigenesis. Eur J Cancer Prev. 2015;24:373-385. [PubMed] [DOI] |
| 49. | Kang MS, Kim BG, Chung J, Lee HC, Oh JS. Inhibitory effect of Weissella cibaria isolates on the production of volatile sulphur compounds. J Clin Periodontol. 2006;33:226-232. [PubMed] [DOI] |
| 50. | Flichy-Fernández AJ, Alegre-Domingo T, Peñarrocha-Oltra D, Peñarrocha-Diago M. Probiotic treatment in the oral cavity: an update. Med Oral Patol Oral Cir Bucal. 2010;15:e677-e680. [PubMed] |