修回日期: 2016-06-02
接受日期: 2016-06-06
在线出版日期: 2016-11-18
慢性炎症是结肠癌发病的重要机制之一, 而肿瘤相关性炎症(cancer related inflammation, CRI)在肿瘤发生发展中的重要作用是近年来研究的热点问题. 因此, 明确CRI在结肠癌中的作用及调控具有重要意义. 转录因子、细胞因子、趋化因子、环氧合酶-2以及微小RNA等是CRI中重要的信号通路. 本文仅就上述信号通路在结肠癌中的研究进展进行述评.
核心提要: 慢性炎症是结肠癌发病的重要机制之一, 而肿瘤相关性炎症(cancer related inflammation, CRI)在肿瘤发生发展中的重要作用是近年来研究的热点问题. 因此, 明确CRI在结肠癌中的作用及调控具有重要意义.
引文著录: 崔曼莉, 张明鑫, 张超, 王景杰. 肿瘤相关性炎症与结肠癌. 世界华人消化杂志 2016; 24(32): 4343-4353
Revised: June 2, 2016
Accepted: June 6, 2016
Published online: November 18, 2016
Chronic inflammation is one of the important mechanisms for the development of colon cancer, and the role of cancer-related inflammation (CRI) in tumor development is a hot research topic in recent years. Therefore, it is very important to clarify the effect and regulation of CRI in colon cancer. Accumulating evidence indicates that transcription factors, cytokines, chemokines, cyclooxygenase-2 and microRNAs play key roles in CRI. This review focuses on the research progress about these molecules in colon cancer.
- Citation: Cui ML, Zhang MX, Zhang C, Wang JJ. Role of cancer-related inflammation in colon cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(32): 4343-4353
- URL: https://www.wjgnet.com/1009-3079/full/v24/i32/4343.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i32.4343
结肠癌是威胁人类健康的常见恶性肿瘤之一. 随着生活水平的提高、饮食结构的变化, 近年我国结直肠癌发病率呈上升趋势, 故研究其发病机制对提高生存率、改善预后意义重大[1]. 众所周知, 慢性炎症是结肠癌发病的重要机制之一, 而肿瘤相关性炎症(cancer related inflammation, CRI)在肿瘤发生发展中的重要作用是近年来研究的热点问题[2]. 炎症与肿瘤之间的关系最先由Rudolf Virchow提出, 经过一个多世纪的不断研究证实, CRI被认为是长期炎性刺激(炎性因子或炎性细胞)所致细胞内的信号通路异常[3]. CRI的揭示及明确意义重大, 既完善了人类对肿瘤特征的认知, 又进一步为改进肿瘤诊断、治疗、预后提供了新的靶点. CRI在多种肿瘤如食管癌、胃癌、肝癌、乳腺癌发挥重要作用, CRI在结肠癌中研究亦有报道[4]. 炎症指标升高的炎症性肠病患者罹患结直肠癌的风险显著增加[5]; 而在没有肠道炎症的原发性结肠癌研究中发现, 肿瘤组织仍有炎性细胞的浸润, 炎症因子表达水平明显升高, 且炎症性肠病明显增加了罹患结肠癌的风险, 故炎症与结肠癌的发生、发展及预后高度相关[6]. 本文对CRI在结肠癌中作用进行综述, 以期为结肠癌的诊治提供研究思路和靶点.
炎症与肿瘤相互关系的研究始于19世纪, 流行病学研究证实25%的肿瘤由炎症发展而来. 近年来, 越来越多的证据表明炎症与肿瘤的发生具有相关性: (1)炎症性疾病能够增加多种肿瘤的发生风险; (2)非类固醇类抗炎药物可以降低某些肿瘤的发病率和死亡率; (3)所有早期肿瘤微环境中均可以发现炎性细胞、细胞因子及趋化因子; (4)靶向炎症相关的炎性介质、转录因子可以降低肿瘤的发生及扩散; (5)增加炎症相关因子的表达可以促进肿瘤进展. 基于上述发现, 2009年Colotta等[7]将CRI定义为继自给自足的生长信号、抗生长信号的不敏感、回避凋亡、潜力无限的复制能力、持续的血管生成、组织浸润和转移后等6大特征后, 肿瘤的第七个特征. 2011年CRI被Hanahan等[8]纳入重新定义的肿瘤十大特征之一.
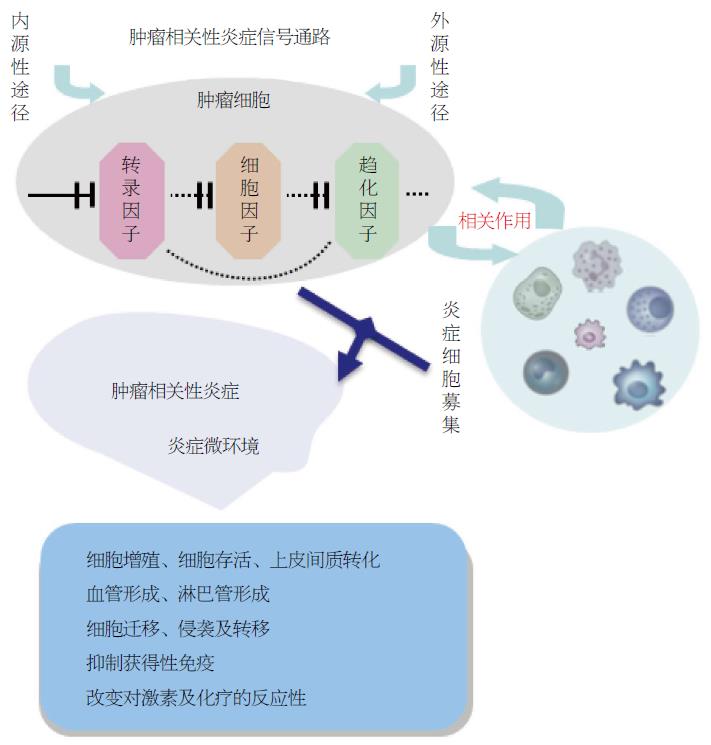
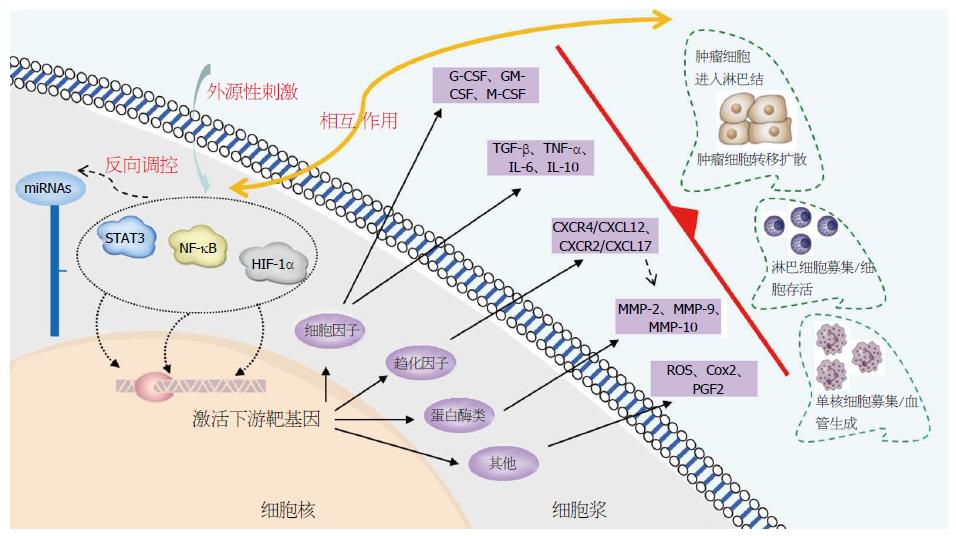
CRI有两个明确的通路, 即外源性通路和内源性通路. 外源性通路由增加特定器官肿瘤进展发生风险的炎症或感染所介导; 内源性通路主要由导致肿瘤的癌基因激活, 包括致癌基因突变、染色体重排或扩增、肿瘤抑制基因的失活等(图1). 两种途径均可以导致肿瘤细胞中一系列转录因子的转录激活, 进而导致细胞因子、趋化因子以及其他炎症相关因子的表达增加, 这些转录因子主要包括核因子-κB(nuclear factor-κB, NF-κB)、信号传导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)、低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α). 激活的转录因子进一步诱导生长因子、细胞因子、趋化因子、环氧合酶-2(cyclooxygenase-2, COX-2)、前列腺素E2(prostaglandin E2, PGE2). 进而募集异常炎性细胞[如肿瘤相关性巨噬细胞(tumour-associated macrophages, TAM); 肿瘤浸润性白细胞; 肿瘤相关树突状细胞], 从而激活炎症细胞、基质细胞和同样在肿瘤细胞中发挥作用的转录因子, 进一步引起炎症介质的产生, 与上述转录因子相关作用、级联放大, 形成肿瘤相关的炎症微环境, 发挥促癌作用(图2)[3].
近年来的研究提示, 除了炎性细胞和各种炎症因子外, CRI更多的是炎性介质所致的遗传不稳定性, 这些炎性介质除了本身就是致癌原外, 很多都参与了DNA损伤修复途径和细胞周期检测点途径, 导致肿瘤基因组失稳, 从而继发的肿瘤信号通路异常. 这些异常的信号通路在结肠癌的发生发展中亦发挥重要作用.
转录因子是一组能够调控基因表达的蛋白: 活化后从胞质转位至胞核, 通过识别和结合基因启动子区的顺式作用元件, 启动和调控基因表达. 在CRI中, NF-κB、STAT3、HIF1α是最为重要的转录因子, 通过调控一系列炎症相关基因的表达, 调控CRI信号通路.
作为调控炎症反应的关键转录因子, NF-κB在炎症相关性肿瘤中的作用也十分明确. 在肿瘤细胞中, NF-κB调控的一系列基因发挥促进增殖、抑制凋亡、增加转移以及诱导耐药的作用[9]. 在慢性结肠炎及炎症性肠病中, NF-κB的表达上调[10], 从息肉到结肠腺癌的进展过程中, NF-κB的表达水平持续上调, 且通过抑制凋亡参与了结肠癌的发展[11]. 此外, NF-κB还和结肠癌的治疗反应相关, 其既可降低结肠癌细胞对化疗药物的敏感性, 还可以介导对肿瘤坏死因子-α(tumor-necrosis factor-α, TNF-α)诱导凋亡的耐受[12-14]. 同时, 抑制NF-κB的激活可抑制结肠癌的转移, 还可以影响TAMs由促癌的M2型向抑癌的M1型转化, 并在动物实验中抑制了结肠癌的腹膜转移; 而激活NF-κB则可以促进基质金属蛋白酶的表达及结肠癌的转移[15-17]. 在对炎症相关性结肠癌研究中发现, 通过不同物质抑制炎症反应后炎症因子表达下降, 而NF-κB失活, 最终抑制肿瘤细胞的生长[18,19]; 而抑制NF-κB活化后, 观察到细胞凋亡启动, 明显减低结肠炎向结肠癌转换的概率[20].
STAT3是STAT家族的一员, 在细胞对细胞因子及生长因子的反应中发挥重要作用. 常规情况下, STAT3定位于细胞质, 一旦激活, 磷酸化的STAT3移位至细胞核, 激活一系列靶基因的表达参与多种生物学过程, 主要包括细胞周期(如CyclinD1/D2)、细胞存活(如Survivin)、血管生成(如血管内皮生长因子)以及细胞凋亡(如B淋巴细胞瘤-2)[21]. STAT3还是肿瘤诱导的免疫耐受中的关键调控因子, 一方面调控一系列基因表达参与免疫耐受, 另一方面负性调节Th1细胞介导的炎症反应[22]. STAT3在结肠癌中持续激活, 并能够促进细胞增殖, 且是不良预后的独立风险因子[23-25]. 抑制STAT3活性可以抑制结肠癌细胞的细胞活力、克隆形成及迁徙能力, 调控STAT3/白介素(interleukin, IL)-6信号途径可以抑制结肠炎相关的结肠癌发生[26,27]. 结肠癌中STAT3调控的炎症指标主要有IL-6、ROS、IL-22等, 但STAT3在结肠炎相关的肿瘤中的精确作用还有待进一步的研究[28-30]. 而且, STAT3与NF-κB相互作用, 在结肠癌中发挥重要作用[31,32].
乏氧是肿瘤最常见的特征, 常激活HIF-1的过度表达, 从而激活一系列下游基因表达, 使肿瘤适应乏氧环境, 进一步增殖、生长、转移及化疗耐受[33]. 乏氧和肠道炎症关系密切, 而肠道炎症可以促进结肠癌, 故HIF-1在炎症与结肠癌中发挥桥梁作用, 通过调控代谢、血管发生、上皮间质转化(epithelial to mesenchymal transition, EMT)、侵袭、治疗耐受参与CRI[34,35]. HIF1是由氧调节的α亚基和非氧调节的β亚基组成的异二聚体, 人类共有三种α亚基成员(HIF-1α、HIF-2α、HIF-3α), 各自在肿瘤中的功能因肿瘤类型各异[36]. HIF-1α可以促进结肠癌细胞株SW480的生长, 而HIF-2α则抑制其生长[37]. 研究[38,39]发现, 在结肠癌发生早期便有HIF-1α的表达, 在侵袭阶段表达达到顶峰, 且参与了炎性调控, 而HIF-1α缺乏鼠结肠癌模型中炎症水平明显下调, 均说明了HIF-1α参与了CRI的调控. HIF-1α参与了结肠癌的化疗耐药、增殖、转移, 且能够调控TAMs发挥促癌作用[40-42]. 越来越多的研究发现, HIF-1α、STAT3以及NF-κB在肿瘤中相关关联, 共同发挥作用, 尤其是在CRI中, 一方面是因为他们可能有共同的下游靶基因, 或者下游靶基因相关作用; 另外一方面可能是因为他们有共同的上游调控机制. 我们将在下面进一步阐述.
细胞因子分为促炎细胞因子和抗炎细胞因子, 在CRI中均发挥重要的作用. 在结肠癌中研究较为广泛的细胞因子, 又大致分为两类, 一类是集落刺激因子(colony-stimulating factor, CSF)家族, 主要包括粒细胞CSF(G-CSF)、巨噬细胞CSF(M-CSF)以及粒细胞-巨噬细胞CSF(GM-CSF), 另外一类是其他细胞因子, 主要有TNF-α、转化生长因子-β(transforming growth factor-β, TGF-β)以及IL家族(IL-6、IL-10、IL-17等). CSF可在部分结肠癌中高表达, 并通过调控骨髓来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)的迁徙、增殖及分化[43]; 通过免疫抑制在结肠炎相关的结肠癌中发挥促癌作用, 抗CSF治疗可诱导抗肿瘤免疫反应, 降低了AOM/DSS结肠癌造模的成瘤数量及大小[44]. 有关TNF-α、TGF-β以及IL在结肠癌细胞增殖、转移、EMT等发生发展中的作用已有过详细综述[45-47]. 这些细胞因子或为上述转录因子的下游靶基因, 或与上述转录因子相互作用, 在CRI中发挥重要的调节作用. 大量研究尝试通过抑制上述细胞因子(如抗TNF单抗、抗IL-6R抗体以及IL-23、IL-17A抗体)抑制炎症反应, 从而抑制肿瘤的发生[48-50]. 尤其是抗TNF单抗, 在IBD中的作用已明确且应用广泛, 但是他们在肿瘤中的作用却较弱, 应与化疗药物或者抗VEGF抗体、抗EFG抗体联合应用.
趋化因子受体及配体在炎性环境下大量表达, 越来越多的证据表明, 趋化因子在CRI参与了肿瘤增殖、血管生成、凋亡、转移等的调控, 并可作为治疗靶点. 在众多趋化因子中, 以CXCR4/CXCL12和CXCR2/CXCL17在结肠癌中研究最为广泛. CXCR4/CXCL12参与了淋巴细胞的募集, 因此, 其在结肠癌微转移中的发挥作用[51]. CXCR4/CXCL12的表达比例以及CXCL12的表达水平是TNM分期Ⅱ期结肠癌5年无进展生存期的独立预后因子; 低分子肝素可通过作用于CXCR4/CXCL12降低结肠癌肝转移的发生率[52,53]. 此外, LPS可诱导CXCR4的表达上调, 进一步通过NF-κB途径诱导结肠癌细胞EMT, 进而促进转移; 而化疗药物则可通过降低结肠癌细胞细胞表面CXCR4的表达, 抑制CXCL12依赖的转移[54,55]. 下调CXCR4/CXCL12可通过激活Wnt/β-catenin途径抑制结肠癌的生长及转移[56]. 与CXCR4/CXCL12一样, CXCR2/CXCL7在结肠癌具有预测预后的价值, 结肠癌肝转移中CXCR2/CXCL7高表达患者无病生存期及总生存期均缩短[57]. 表达CXCR2的MDSCs在结肠炎相关的结肠进展中起关键作用, 可通过抑制CD8+ T细胞的细胞毒活性促进结肠癌生长[58].
在正常结肠上皮中, COX-2并不是持续表达的, 但是研究[59,60]发现, 在90%的结肠癌以及40-90%的结肠腺瘤息肉中COX-2过表达. COX-2的抑制使结肠息肉的产生减少, 应用COX-2选择性抑制剂, 还可以改变结肠息肉到结肠癌转变过程中一系列基因的表达, 从而可能发挥化学防癌的作用[61,62]. 应用姜黄素可通过抑制COX-的表达而化学预防结肠癌的发生, 并与NF-κB密切相关[63]. 进一步的研究[64]发现, COX-2和NF-κB均在结肠癌中同时表达上调, 此外, COX-2与STAT3、HIF1α信号通路均有一定的相关性, 但在结肠癌CRI中的作用及调控仍待进一步研究.
PGE2是在结肠癌CRI中发挥重要作用, 且与COX-2关系密切的一种因子, 他的产生依赖于COX-2, 所以常常和COX-2共同研究[65]. PGE2可激活结肠上皮细胞以及结肠癌中一系列细胞因子的表达, 从而调控炎症; 其与IL-6的相互作用可调控TAMs的M1与M2的相关转化, 在结肠炎相关性结肠癌中发挥作用[66,67]. PGE2在结肠癌组织中的含量与肿瘤细胞及基质细胞的生长关系密切[68], 并且参与了谷胱甘肽还原酶X2、Toll样受体4等介导的结肠炎相关性结肠癌的发生[69,70]; 还能够促进结肠癌干细胞的扩增与转移, 而选择性抑制PGE2可以抑制结肠癌并且调控黏膜免疫[71,72]. 近期Montrose等[73]详细探讨了PGE2在肠道炎症及结肠癌发生中的机制, 明确了其在肠道稳态中的意义, 进一步证实了CRI在结肠癌中的调控作用.
微小RNA(microRNAs, miRNAs)是近来发现的能够在转录后水平调控基因表达的非编码小分子RNA, miRNAs可以靶向多个靶基因, 因此在一系列生物过程及疾病中发挥重要作用, 尤其是在肿瘤中研究更为广泛, 发挥抑癌基因及癌基因功能. 如果miRNAs可以靶向CRI中多个重要的信号通路分子, 则可以实现对CRI的调控. Zhang等[74]探讨了miRNAs和炎症结直癌的最新进展, 但不够全面. 表1是不同miRNAs通过靶向多个基因通过影响不同的CRI信号通路在IBD相关性结肠癌、炎症相关性结肠癌、炎症细胞调控中发挥多种功能[75-92]. 而且, 进一步的研究还发现, CRI中的炎症因子或者转录因子亦可以影响miRNAs来进一步调控炎症在结肠癌发生发展发挥作用[76]. 所以miRNAs在肿瘤CRI中的调控是研究的热点和难点问题, 也是我们课题组研究的方向之一. 除此之外, 长链非编码RNA(long non-coding RNA, lncRNA)是长度>200个核苷酸的非编码RNA[93]. 研究[94]表明, lncRNA在表观遗传调控、细胞周期调控和细胞分化调控等众多生命活动中发挥重要作用: BC012900作为溃疡性结肠炎特异性的lncRNA, 可调控肠道上皮细胞的凋亡, 提示lncRNA在结肠癌CRI中亦可能发挥调控作用, 值得进一步研究.
| miRNAs | 结肠癌中的表达变化 | 功能/作用 | 可能/明确的炎症靶基因 | CRI通路 | 参考文献 |
| miRNA-21 | 高表达 | 预测预后 | IL-12A | / | [74] |
| miRNA-21/miRNA-181b-1 | / | 炎症相关性结肠癌死亡率 | PETN/CYLD | STAT3/NF-κB | [75] |
| miRNA-31 | 高表达 | IBD相关性肿瘤 | FIH1 | HIF-1α | [76] |
| miRNA-215/miRNA-708/miRNA-31/miRNA-135b | 低/高/高/高表达 | 结肠上皮细胞的恶性转化 | / | MAPK/PI3K/WNT/TGF-β | [77] |
| miRNA-143/miRNA-145 | 低表达 | 溃疡性结肠炎中调控炎症及癌基因 | IRS-1/K-RAS/API5/MEK-2 | / | [78] |
| miRNA-21/miRNA-155 | 高表达 | 促进结肠癌生长 | PTEN/SOCS1 | NF-κB | [79] |
| miRNA-224 | 高表达 | IBD相关性癌症 | p21 | / | [80] |
| miRNA-126 | / | 抗炎抑制结肠癌发生 | VCAM-1/PI3K | NF-κB | [81] |
| miRNA-133a/miRNA-143/miRNA-145 | 低表达 | 调控炎症向结肠癌的转化 | PI3K/Akt | / | [82] |
| miRNA-223 | 高表达 | 调控炎症向结肠癌的转化 | IGF-1R | / | [83] |
| miRNA-101b/miRNA-455 | / | 抗炎并抑制结肠癌发生 | / | IL-6/TNF-α/COX-2 | [83] |
| miRNA-324-5p | 高表达 | 巨噬细胞功能 | CUEDC2 | IL-4 | [84] |
| miRNA-138/miRNA-145/miRNA-146a/miRNA-150 | 低表达 | 调控结肠炎的恶性转化 | / | 细胞因子 | [85] |
| miRNA-1297 | 低表达 | 抑制增殖、侵袭及转移 | COX-2 | COX-2 | [86] |
| miRNA-128/miRNA-134/miRNA-330 | / | 抑制增殖、侵袭及转移 | MMP-3/MMP-10/MMP-13 | / | [87] |
| miRNA-124 | 高表达 | 促进溃疡性结肠炎向结肠癌进展 | PTEN/PDLIM2 | STAT3/NF-κB | [88] |
| miRNA-26b | 高表达 | 促进溃疡性结肠炎向结肠癌进展 | DIP1/MDM2/CREBBP/BRCA1 | / | [89] |
| miRNA-155 | 高表达 | 炎症相关性结肠癌的发生 | RPS6KA3/SGK3/RHEB/KRAS | TGF-β/SMAD | [90] |
| miRNA-34a | / | 炎性刺激诱导的结肠癌干细胞分化 | Numb | / | [91] |
结肠癌是炎症相关性肿瘤, 无论是从腺瘤到结肠癌的转变还是IBD到结肠癌的转变, CRI中的转录因子、细胞因子、趋化因子等均发挥重要作用, 涉及到结肠癌增殖、凋亡、侵袭、耐药, 还牵涉到信号通路的交互作用, 研究方法和作用模式已日渐清晰. 随着miRNAs研究的不断深入, 越来越多的miRNAs被发现参与了CRI的调控, miRNAs通过靶向多个参与CRI信号通路的靶基因, 实现对CRI的全面调控, 从而成为结肠癌CRI研究中的热点问题, 而lncRNA的研究也将不断深入, CRI中的信号通路又反过来影响miRNAs或者lncRNA的表达. 明确CRI在结肠癌中的作用、意义及调控, 将有助于结肠炎和IBD的药物选择、结肠癌的化学预防、结肠癌的早期筛查及治疗靶点选择, 从而改善不良预后.
肿瘤相关性炎症(cancer related inflammation, CRI)既完善了人类对肿瘤特征的认知, 又进一步为改进肿瘤诊断、治疗、预后提供了新的靶点. 而炎症与结肠癌的发生、发展及预后高度相关. 因此, 明确CRI在结肠癌中作用将为结肠癌的诊治提供研究思路和靶点.
炎症指标升高的炎症性肠病患者罹患结直肠癌的风险显著增加; 而在没有肠道炎症的原发性结肠癌研究中发现, 肿瘤组织仍有炎性细胞的浸润, 故炎症与结肠癌的关系密切, 研究意义重大.
CRI在多种肿瘤如结肠癌、胃癌、肝癌、乳腺癌发挥重要作用, CRI关键途径如转录因子、细胞因子、趋化因子等在结肠癌中的作用亦有相关综述, 但仍缺乏系统性归纳, 尤其是结肠癌中CRI的调控.
本文就CRI中重要信号通路如转录因子、细胞因子、趋化因子、Cox2以及miRNAs等在结肠癌中的研究进展进行总结和综述.
本文揭示了CRI中重要信号通路在结肠癌发生、发展、诊断、预后中的作用、意义及可能机制, 为结肠癌的诊治提供研究思路和靶点.
贾云鹤, 教授, 主任医师, 哈尔滨医科大学附属肿瘤医院结直肠外科; 周建奖, 教授, 贵阳医学院分子生物学重点实验室
文章述评了肠道慢性炎症与结肠癌发病之间的关系. 肿瘤相关炎症在结肠癌中的作用和调控机制. 文章内容详实, 全面系统地讲述了CRI的发生与发展和结肠癌的相关性. 选题科学, 具有一定前瞻性, 逻辑清晰, 语言表达明确.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:胡珊
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Diakos CI, Charles KA, McMillan DC, Clarke SJ. Cancer-related inflammation and treatment effectiveness. Lancet Oncol. 2014;15:e493-e503. [PubMed] [DOI] |
| 3. | Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. Nature. 2008;454:436-444. [PubMed] [DOI] |
| 4. | Balkwill FR, Mantovani A. Cancer-related inflammation: common themes and therapeutic opportunities. Semin Cancer Biol. 2012;22:33-40. [PubMed] [DOI] |
| 5. | Ananthakrishnan AN, Cheng SC, Cai T, Cagan A, Gainer VS, Szolovits P, Shaw SY, Churchill S, Karlson EW, Murphy SN. Serum inflammatory markers and risk of colorectal cancer in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol. 2014;12:1342-1348.e1. [PubMed] [DOI] |
| 6. | Ning Y, Manegold PC, Hong YK, Zhang W, Pohl A, Lurje G, Winder T, Yang D, LaBonte MJ, Wilson PM. Interleukin-8 is associated with proliferation, migration, angiogenesis and chemosensitivity in vitro and in vivo in colon cancer cell line models. Int J Cancer. 2011;128:2038-2049. [PubMed] [DOI] |
| 7. | Colotta F, Allavena P, Sica A, Garlanda C, Mantovani A. Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability. Carcinogenesis. 2009;30:1073-1081. [PubMed] [DOI] |
| 8. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 9. | Schmid RM, Adler G. NF-kappaB/rel/IkappaB: implications in gastrointestinal diseases. Gastroenterology. 2000;118:1208-1228. [PubMed] [DOI] |
| 10. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 11. | Hardwick JC, van den Brink GR, Offerhaus GJ, van Deventer SJ, Peppelenbosch MP. NF-kappaB, p38 MAPK and JNK are highly expressed and active in the stroma of human colonic adenomatous polyps. Oncogene. 2001;20:819-827. [PubMed] [DOI] |
| 12. | Han SY, Choung SY, Paik IS, Kang HJ, Choi YH, Kim SJ, Lee MO. Activation of NF-kappaB determines the sensitivity of human colon cancer cells to TNFalpha-induced apoptosis. Biol Pharm Bull. 2000;23:420-426. [PubMed] [DOI] |
| 13. | Chen Y, Wang Z, Chang P, Xiang L, Pan F, Li J, Jiang J, Zou L, Yang L, Bian Z. The effect of focal adhesion kinase gene silencing on 5-fluorouracil chemosensitivity involves an Akt/NF-kappaB signaling pathway in colorectal carcinomas. Int J Cancer. 2010;127:195-206. [PubMed] [DOI] |
| 14. | Kim SM, Lee SY, Yuk DY, Moon DC, Choi SS, Kim Y, Han SB, Oh KW, Hong JT. Inhibition of NF-kappaB by ginsenoside Rg3 enhances the susceptibility of colon cancer cells to docetaxel. Arch Pharm Res. 2009;32:755-765. [PubMed] |
| 15. | Scaife CL, Kuang J, Wills JC, Trowbridge DB, Gray P, Manning BM, Eichwald EJ, Daynes RA, Kuwada SK. Nuclear factor kappaB inhibitors induce adhesion-dependent colon cancer apoptosis: implications for metastasis. Cancer Res. 2002;62:6870-6878. [PubMed] |
| 16. | Ryan AE, Colleran A, O'Gorman A, O'Flynn L, Pindjacova J, Lohan P, O'Malley G, Nosov M, Mureau C, Egan LJ. Targeting colon cancer cell NF-κB promotes an anti-tumour M1-like macrophage phenotype and inhibits peritoneal metastasis. Oncogene. 2015;34:1563-1574. [PubMed] [DOI] |
| 17. | Zhang XW, Bu P, Liu L, Zhang XZ, Li J. Overexpression of long non-coding RNA PVT1 in gastric cancer cells promotes the development of multidrug resistance. Biochem Biophys Res Commun. 2015;462:227-232. [PubMed] [DOI] |
| 18. | Qian Z, Wu Z, Huang L, Qiu H, Wang L, Li L, Yao L, Kang K, Qu J, Wu Y. Mulberry fruit prevents LPS-induced NF-κB/pERK/MAPK signals in macrophages and suppresses acute colitis and colorectal tumorigenesis in mice. Sci Rep. 2015;5:17348. [PubMed] [DOI] |
| 19. | Lin L, Sun Y, Wang D, Zheng S, Zhang J, Zheng C. Celastrol Ameliorates Ulcerative Colitis-Related Colorectal Cancer in Mice via Suppressing Inflammatory Responses and Epithelial-Mesenchymal Transition. Front Pharmacol. 2015;6:320. [PubMed] [DOI] |
| 20. | Kim SL, Liu YC, Seo SY, Kim SH, Kim IH, Lee SO, Lee ST, Kim DG, Kim SW. Parthenolide induces apoptosis in colitis-associated colon cancer, inhibiting NF-κB signaling. Oncol Lett. 2015;9:2135-2142. [PubMed] [DOI] |
| 21. | Hirao A, Oiso N, Tsurutani J, Kimura M, Watatani M, Nakagawa K, Kawada A. Transient effectiveness of an oral 5-Fluorouracil derivative, s-1, for epirubicin, cyclophosphamide and Paclitaxel refractory skin metastases from possible occult breast cancer in a male. Case Rep Dermatol. 2011;3:42-48. [PubMed] [DOI] |
| 22. | Yu H, Kortylewski M, Pardoll D. Crosstalk between cancer and immune cells: role of STAT3 in the tumour microenvironment. Nat Rev Immunol. 2007;7:41-51. [PubMed] [DOI] |
| 23. | Corvinus FM, Orth C, Moriggl R, Tsareva SA, Wagner S, Pfitzner EB, Baus D, Kaufmann R, Huber LA, Zatloukal K. Persistent STAT3 activation in colon cancer is associated with enhanced cell proliferation and tumor growth. Neoplasia. 2005;7:545-555. [PubMed] [DOI] |
| 24. | Endo F, Nishizuka SS, Kume K, Ishida K, Katagiri H, Ishida K, Sato K, Iwaya T, Koeda K, Wakabayashi G. A compensatory role of NF-κB to p53 in response to 5-FU-based chemotherapy for gastric cancer cell lines. PLoS One. 2014;9:e90155. [PubMed] [DOI] |
| 25. | Artaş G, Ozercan HI. The expression of STAT3, BCL-XL and MMP-2 proteins in colon adenocarcinomas and their relationship with prognostic factors. Turk Patoloji Derg. 2014;30:178-183. [PubMed] [DOI] |
| 26. | Zhao C, Wang W, Yu W, Jou D, Wang Y, Ma H, Xiao H, Qin H, Zhang C, Lü J. A novel small molecule STAT3 inhibitor, LY5, inhibits cell viability, colony formation, and migration of colon and liver cancer cells. Oncotarget. 2016;7:12917-12926. [PubMed] [DOI] |
| 27. | Do EJ, Hwang SW, Kim SY, Ryu YM, Cho EA, Chung EJ, Park S, Lee HJ, Byeon JS, Ye BD. Suppression of colitis-associated carcinogenesis through modulation of IL-6/STAT3 pathway by balsalazide and VSL#3. J Gastroenterol Hepatol. 2016;31:1453-1461. [PubMed] [DOI] |
| 28. | Kim DH, Park KW, Chae IG, Kundu J, Kim EH, Kundu JK, Chun KS. Carnosic acid inhibits STAT3 signaling and induces apoptosis through generation of ROS in human colon cancer HCT116 cells. Mol Carcinog. 2016;55:1096-1110. [PubMed] [DOI] |
| 29. | Jiang R, Wang H, Deng L, Hou J, Shi R, Yao M, Gao Y, Yao A, Wang X, Yu L. IL-22 is related to development of human colon cancer by activation of STAT3. BMC Cancer. 2013;13:59. [PubMed] [DOI] |
| 30. | Han J, Theiss AL. Stat3: friend or foe in colitis and colitis-associated cancer? Inflamm Bowel Dis. 2014;20:2405-2411. [PubMed] [DOI] |
| 31. | Fan Y, Mao R, Yang J. NF-κB and STAT3 signaling pathways collaboratively link inflammation to cancer. Protein Cell. 2013;4:176-185. [PubMed] [DOI] |
| 32. | De Simone V, Franzè E, Ronchetti G, Colantoni A, Fantini MC, Di Fusco D, Sica GS, Sileri P, MacDonald TT, Pallone F. Th17-type cytokines, IL-6 and TNF-α synergistically activate STAT3 and NF-kB to promote colorectal cancer cell growth. Oncogene. 2015;34:3493-3503. [PubMed] [DOI] |
| 33. | Monti E, Gariboldi MB. HIF-1 as a target for cancer chemotherapy, chemosensitization and chemoprevention. Curr Mol Pharmacol. 2011;4:62-77. [PubMed] [DOI] |
| 34. | Liu X, Ru J, Zhang J, Zhu LH, Liu M, Li X, Tang H. miR-23a targets interferon regulatory factor 1 and modulates cellular proliferation and paclitaxel-induced apoptosis in gastric adenocarcinoma cells. PLoS One. 2013;8:e64707. [PubMed] [DOI] |
| 35. | Balamurugan K. HIF-1 at the crossroads of hypoxia, inflammation, and cancer. Int J Cancer. 2016;138:1058-1066. [PubMed] [DOI] |
| 36. | Keith B, Johnson RS, Simon MC. HIF1α and HIF2α: sibling rivalry in hypoxic tumour growth and progression. Nat Rev Cancer. 2011;12:9-22. [PubMed] [DOI] |
| 37. | Imamura T, Kikuchi H, Herraiz MT, Park DY, Mizukami Y, Mino-Kenduson M, Lynch MP, Rueda BR, Benita Y, Xavier RJ. HIF-1alpha and HIF-2alpha have divergent roles in colon cancer. Int J Cancer. 2009;124:763-771. [PubMed] [DOI] |
| 38. | Simiantonaki N, Taxeidis M, Jayasinghe C, Kurzik-Dumke U, Kirkpatrick CJ. Hypoxia-inducible factor 1 alpha expression increases during colorectal carcinogenesis and tumor progression. BMC Cancer. 2008;8:320. [PubMed] [DOI] |
| 39. | Mladenova DN, Dahlstrom JE, Tran PN, Benthani F, Bean EG, Ng I, Pangon L, Currey N, Kohonen-Corish MR. HIF1α deficiency reduces inflammation in a mouse model of proximal colon cancer. Dis Model Mech. 2015;8:1093-1103. [PubMed] [DOI] |
| 40. | Krishnamachary B, Berg-Dixon S, Kelly B, Agani F, Feldser D, Ferreira G, Iyer N, LaRusch J, Pak B, Taghavi P. Regulation of colon carcinoma cell invasion by hypoxia-inducible factor 1. Cancer Res. 2003;63:1138-1143. [PubMed] |
| 41. | Mu L, Wang J, Chen Y, Li L, Guo X, Zheng S, Jing C. Hypoxia-inducible factor-1α and semaphorin4D genes involved with tumor-associated macrophage-induced metastatic behavior and clinical significance in colon cancer. Chin Med J (Engl). 2014;127:3568-3575. [PubMed] |
| 42. | Chen J, Ding Z, Peng Y, Pan F, Li J, Zou L, Zhang Y, Liang H. HIF-1α inhibition reverses multidrug resistance in colon cancer cells via downregulation of MDR1/P-glycoprotein. PLoS One. 2014;9:e98882. [PubMed] [DOI] |
| 43. | Li W, Zhang X, Chen Y, Xie Y, Liu J, Feng Q, Wang Y, Yuan W, Ma J. G-CSF is a key modulator of MDSC and could be a potential therapeutic target in colitis-associated colorectal cancers. Protein Cell. 2016;7:130-140. [PubMed] [DOI] |
| 44. | Geng R, Li J. Apatinib for the treatment of gastric cancer. Expert Opin Pharmacother. 2015;16:117-122. [PubMed] [DOI] |
| 45. | Wang K, Karin M. Tumor-Elicited Inflammation and Colorectal Cancer. Adv Cancer Res. 2015;128:173-196. [PubMed] [DOI] |
| 46. | Francescone R, Hou V, Grivennikov SI. Cytokines, IBD, and colitis-associated cancer. Inflamm Bowel Dis. 2015;21:409-418. [PubMed] [DOI] |
| 47. | Antoniou E, Margonis GA, Angelou A, Zografos GC, Pikoulis E. Cytokine networks in animal models of colitis-associated cancer. Anticancer Res. 2015;35:19-24. [PubMed] |
| 48. | Palladino MA, Bahjat FR, Theodorakis EA, Moldawer LL. Anti-TNF-alpha therapies: the next generation. Nat Rev Drug Discov. 2003;2:736-746. [PubMed] [DOI] |
| 49. | Miossec P, Kolls JK. Targeting IL-17 and TH17 cells in chronic inflammation. Nat Rev Drug Discov. 2012;11:763-776. [PubMed] [DOI] |
| 50. | Kishimoto T. IL-6: from its discovery to clinical applications. Int Immunol. 2010;22:347-352. [PubMed] [DOI] |
| 51. | Zeelenberg IS, Ruuls-Van Stalle L, Roos E. The chemokine receptor CXCR4 is required for outgrowth of colon carcinoma micrometastases. Cancer Res. 2003;63:3833-3839. [PubMed] |
| 52. | Stanisavljević L, Aßmus J, Storli KE, Leh SM, Dahl O, Myklebust MP. CXCR4, CXCL12 and the relative CXCL12-CXCR4 expression as prognostic factors in colon cancer. Tumour Biol. 2016;37:7441-7452. [PubMed] |
| 53. | Ma L, Qiao H, He C, Yang Q, Cheung CH, Kanwar JR, Sun X. Modulating the interaction of CXCR4 and CXCL12 by low-molecular-weight heparin inhibits hepatic metastasis of colon cancer. Invest New Drugs. 2012;30:508-517. [PubMed] [DOI] |
| 54. | Liu WT, Jing YY, Yan F, Han ZP, Lai FB, Zeng JX, Yu GF, Fan QM, Li R, Zhao QD. LPS-induced CXCR4-dependent migratory properties and a mesenchymal-like phenotype of colorectal cancer cells. Cell Adh Migr. 2016;10:1-11. [PubMed] [DOI] |
| 55. | Cutler MJ, Lowthers EL, Richard CL, Hajducek DM, Spagnuolo PA, Blay J. Chemotherapeutic agents attenuate CXCL12-mediated migration of colon cancer cells by selecting for CXCR4-negative cells and increasing peptidase CD26. BMC Cancer. 2015;15:882. [PubMed] [DOI] |
| 56. | Song ZY, Gao ZH, Chu JH, Han XZ, Qu XJ. Downregulation of the CXCR4/CXCL12 axis blocks the activation of the Wnt/β-catenin pathway in human colon cancer cells. Biomed Pharmacother. 2015;71:46-52. [PubMed] [DOI] |
| 57. | Desurmont T, Skrypek N, Duhamel A, Jonckheere N, Millet G, Leteurtre E, Gosset P, Duchene B, Ramdane N, Hebbar M. Overexpression of chemokine receptor CXCR2 and ligand CXCL7 in liver metastases from colon cancer is correlated to shorter disease-free and overall survival. Cancer Sci. 2015;106:262-269. [PubMed] [DOI] |
| 58. | Katoh H, Wang D, Daikoku T, Sun H, Dey SK, Dubois RN. CXCR2-expressing myeloid-derived suppressor cells are essential to promote colitis-associated tumorigenesis. Cancer Cell. 2013;24:631-644. [PubMed] [DOI] |
| 59. | Eberhart CE, Coffey RJ, Radhika A, Giardiello FM, Ferrenbach S, DuBois RN. Up-regulation of cyclooxygenase 2 gene expression in human colorectal adenomas and adenocarcinomas. Gastroenterology. 1994;107:1183-1188. [PubMed] [DOI] |
| 60. | Chapple KS, Cartwright EJ, Hawcroft G, Tisbury A, Bonifer C, Scott N, Windsor AC, Guillou PJ, Markham AF, Coletta PL. Localization of cyclooxygenase-2 in human sporadic colorectal adenomas. Am J Pathol. 2000;156:545-553. [PubMed] [DOI] |
| 61. | Oshima M, Dinchuk JE, Kargman SL, Oshima H, Hancock B, Kwong E, Trzaskos JM, Evans JF, Taketo MM. Suppression of intestinal polyposis in Apc delta716 knockout mice by inhibition of cyclooxygenase 2 (COX-2). Cell. 1996;87:803-809. [PubMed] [DOI] |
| 62. | Galamb O, Spisák S, Sipos F, Tóth K, Solymosi N, Wichmann B, Krenács T, Valcz G, Tulassay Z, Molnár B. Reversal of gene expression changes in the colorectal normal-adenoma pathway by NS398 selective COX2 inhibitor. Br J Cancer. 2010;102:765-773. [PubMed] [DOI] |
| 63. | Plummer SM, Holloway KA, Manson MM, Munks RJ, Kaptein A, Farrow S, Howells L. Inhibition of cyclo-oxygenase 2 expression in colon cells by the chemopreventive agent curcumin involves inhibition of NF-kappaB activation via the NIK/IKK signalling complex. Oncogene. 1999;18:6013-6020. [PubMed] [DOI] |
| 64. | Abdullah M, Rani AA, Sudoyo AW, Makmun D, Handjari DR, Hernowo BS. Expression of NF-kB and COX2 in colorectal cancer among native Indonesians: the role of inflammation in colorectal carcinogenesis. Acta Med Indones. 2013;45:187-192. [PubMed] |
| 65. | Xue X, Shah YM. Hypoxia-inducible factor-2α is essential in activating the COX2/mPGES-1/PGE2 signaling axis in colon cancer. Carcinogenesis. 2013;34:163-169. [PubMed] [DOI] |
| 66. | Yu Y, Chadee K. Prostaglandin E2 stimulates IL-8 gene expression in human colonic epithelial cells by a posttranscriptional mechanism. J Immunol. 1998;161:3746-3752. [PubMed] |
| 67. | Zhao H, Zhang X, Chen X, Li Y, Ke Z, Tang T, Chai H, Guo AM, Chen H, Yang J. Isoliquiritigenin, a flavonoid from licorice, blocks M2 macrophage polarization in colitis-associated tumorigenesis through downregulating PGE2 and IL-6. Toxicol Appl Pharmacol. 2014;279:311-321. [PubMed] [DOI] |
| 68. | Cahlin C, Lönnroth C, Arvidsson A, Nordgren S, Lundholm K. Growth associated proteins in tumor cells and stroma related to disease progression of colon cancer accounting for tumor tissue PGE2 content. Int J Oncol. 2008;32:909-918. [PubMed] [DOI] |
| 69. | Banning A, Florian S, Deubel S, Thalmann S, Müller-Schmehl K, Jacobasch G, Brigelius-Flohé R. GPx2 counteracts PGE2 production by dampening COX-2 and mPGES-1 expression in human colon cancer cells. Antioxid Redox Signal. 2008;10:1491-1500. [PubMed] [DOI] |
| 70. | Hernandez Y, Sotolongo J, Breglio K, Conduah D, Chen A, Xu R, Hsu D, Ungaro R, Hayes LA, Pastorini C. The role of prostaglandin E2 (PGE 2) in toll-like receptor 4 (TLR4)-mediated colitis-associated neoplasia. BMC Gastroenterol. 2010;10:82. [PubMed] [DOI] |
| 71. | Nakanishi M, Menoret A, Tanaka T, Miyamoto S, Montrose DC, Vella AT, Rosenberg DW. Selective PGE(2) suppression inhibits colon carcinogenesis and modifies local mucosal immunity. Cancer Prev Res (Phila). 2011;4:1198-1208. [PubMed] [DOI] |
| 72. | Wang D, Fu L, Sun H, Guo L, DuBois RN. Prostaglandin E2 Promotes Colorectal Cancer Stem Cell Expansion and Metastasis in Mice. Gastroenterology. 2015;149:1884-1895.e4. [PubMed] [DOI] |
| 73. | Montrose DC, Nakanishi M, Murphy RC, Zarini S, McAleer JP, Vella AT, Rosenberg DW. The role of PGE2 in intestinal inflammation and tumorigenesis. Prostaglandins Other Lipid Mediat. 2015;116-117:26-36. [PubMed] [DOI] |
| 74. | Zhang L, Fan XM. The pathological role of microRNAs and inflammation in colon carcinogenesis. Clin Res Hepatol Gastroenterol. 2015;39:174-179. [PubMed] [DOI] |
| 75. | Schetter AJ, Nguyen GH, Bowman ED, Mathé EA, Yuen ST, Hawkes JE, Croce CM, Leung SY, Harris CC. Association of inflammation-related and microRNA gene expression with cancer-specific mortality of colon adenocarcinoma. Clin Cancer Res. 2009;15:5878-5887. [PubMed] [DOI] |
| 76. | Iliopoulos D, Jaeger SA, Hirsch HA, Bulyk ML, Struhl K. STAT3 activation of miR-21 and miR-181b-1 via PTEN and CYLD are part of the epigenetic switch linking inflammation to cancer. Mol Cell. 2010;39:493-506. [PubMed] [DOI] |
| 77. | Olaru AV, Selaru FM, Mori Y, Vazquez C, David S, Paun B, Cheng Y, Jin Z, Yang J, Agarwal R. Dynamic changes in the expression of MicroRNA-31 during inflammatory bowel disease-associated neoplastic transformation. Inflamm Bowel Dis. 2011;17:221-231. [PubMed] [DOI] |
| 78. | Necela BM, Carr JM, Asmann YW, Thompson EA. Differential expression of microRNAs in tumors from chronically inflamed or genetic (APC(Min/+)) models of colon cancer. PLoS One. 2011;6:e18501. [PubMed] [DOI] |
| 79. | Pekow JR, Dougherty U, Mustafi R, Zhu H, Kocherginsky M, Rubin DT, Hanauer SB, Hart J, Chang EB, Fichera A. miR-143 and miR-145 are downregulated in ulcerative colitis: putative regulators of inflammation and protooncogenes. Inflamm Bowel Dis. 2012;18:94-100. [PubMed] [DOI] |
| 80. | Bakirtzi K, Hatziapostolou M, Karagiannides I, Polytarchou C, Jaeger S, Iliopoulos D, Pothoulakis C. Neurotensin signaling activates microRNAs-21 and -155 and Akt, promotes tumor growth in mice, and is increased in human colon tumors. Gastroenterology. 2011;141:1749-1761.e1. [PubMed] [DOI] |
| 81. | Olaru AV, Yamanaka S, Vazquez C, Mori Y, Cheng Y, Abraham JM, Bayless TM, Harpaz N, Selaru FM, Meltzer SJ. MicroRNA-224 negatively regulates p21 expression during late neoplastic progression in inflammatory bowel disease. Inflamm Bowel Dis. 2013;19:471-480. [PubMed] [DOI] |
| 82. | Banerjee N, Kim H, Talcott S, Mertens-Talcott S. Pomegranate polyphenolics suppressed azoxymethane-induced colorectal aberrant crypt foci and inflammation: possible role of miR-126/VCAM-1 and miR-126/PI3K/AKT/mTOR. Carcinogenesis. 2013;34:2814-2822. [PubMed] [DOI] |
| 83. | Josse C, Bouznad N, Geurts P, Irrthum A, Huynh-Thu VA, Servais L, Hego A, Delvenne P, Bours V, Oury C. Identification of a microRNA landscape targeting the PI3K/Akt signaling pathway in inflammation-induced colorectal carcinogenesis. Am J Physiol Gastrointest Liver Physiol. 2014;306:G229-G243. [PubMed] [DOI] |
| 84. | Altamemi I, Murphy EA, Catroppo JF, Zumbrun EE, Zhang J, McClellan JL, Singh UP, Nagarkatti PS, Nagarkatti M. Role of microRNAs in resveratrol-mediated mitigation of colitis-associated tumorigenesis in Apc(Min/+) mice. J Pharmacol Exp Ther. 2014;350:99-109. [PubMed] [DOI] |
| 85. | Chen Y, Wang SX, Mu R, Luo X, Liu ZS, Liang B, Zhuo HL, Hao XP, Wang Q, Fang DF. Dysregulation of the miR-324-5p-CUEDC2 axis leads to macrophage dysfunction and is associated with colon cancer. Cell Rep. 2014;7:1982-1993. [PubMed] [DOI] |
| 86. | Bao Y, Guo Y, Li Z, Fang W, Yang Y, Li X, Li Z, Xiong B, Chen Z, Wang J. MicroRNA profiling in Muc2 knockout mice of colitis-associated cancer model reveals epigenetic alterations during chronic colitis malignant transformation. PLoS One. 2014;9:e99132. [PubMed] [DOI] |
| 87. | Chen P, Wang BL, Pan BS, Guo W. MiR-1297 regulates the growth, migration and invasion of colorectal cancer cells by targeting cyclo-oxygenase-2. Asian Pac J Cancer Prev. 2014;15:9185-9190. [PubMed] [DOI] |
| 88. | Ai F, Zhang X, Li X, Qin Z, Ye Q, Tian L, Tang A, Li N, Li G, Ma J. Up-regulation of matrix metalloproteinases in a mouse model of chemically induced colitis-associated cancer: the role of microRNAs. Oncotarget. 2015;6:5412-5425. [PubMed] [DOI] |
| 89. | Polytarchou C, Hommes DW, Palumbo T, Hatziapostolou M, Koutsioumpa M, Koukos G, van der Meulen-de Jong AE, Oikonomopoulos A, van Deen WK, Vorvis C. MicroRNA214 Is Associated With Progression of Ulcerative Colitis, and Inhibition Reduces Development of Colitis and Colitis-Associated Cancer in Mice. Gastroenterology. 2015;149:981-992.e11. [PubMed] [DOI] |
| 90. | Benderska N, Dittrich AL, Knaup S, Rau TT, Neufert C, Wach S, Fahlbusch FB, Rauh M, Wirtz RM, Agaimy A. miRNA-26b Overexpression in Ulcerative Colitis-associated Carcinogenesis. Inflamm Bowel Dis. 2015;21:2039-2051. [PubMed] [DOI] |
| 91. | Velázquez KT, Enos RT, McClellan JL, Cranford TL, Chatzistamou I, Singh UP, Nagarkatti M, Nagarkatti PS, Fan D, Murphy EA. MicroRNA-155 deletion promotes tumorigenesis in the azoxymethane-dextran sulfate sodium model of colon cancer. Am J Physiol Gastrointest Liver Physiol. 2016;310:G347-G358. [PubMed] [DOI] |
| 92. | Bu P, Wang L, Chen KY, Srinivasan T, Murthy PK, Tung KL, Varanko AK, Chen HJ, Ai Y, King S. A miR-34a-Numb Feedforward Loop Triggered by Inflammation Regulates Asymmetric Stem Cell Division in Intestine and Colon Cancer. Cell Stem Cell. 2016;18:189-202. [PubMed] [DOI] |
| 93. | Yang G, Lu X, Yuan L. LncRNA: a link between RNA and cancer. Biochim Biophys Acta. 2014;1839:1097-1109. [PubMed] [DOI] |
| 94. | Wu F, Huang Y, Dong F, Kwon JH. Ulcerative Colitis-Associated Long Noncoding RNA, BC012900, Regulates Intestinal Epithelial Cell Apoptosis. Inflamm Bowel Dis. 2016;22:782-795. [PubMed] [DOI] |