修回日期: 2016-08-29
接受日期: 2016-09-07
在线出版日期: 2016-10-28
探讨重金属污染物镉(cadmium, Cd)对人结肠癌细胞株HCT-116的恶性生物学行为的影响及其相关机制.
选用低浓度Cd诱导的人类结肠癌稳定细胞株HCT-116和未诱导的细胞株HCT-116为研究对象. 通过MTT实验、平板克隆形成实验、黏附实验、Transwell细胞迁移和侵袭实验等, 观察HCT-116细胞的恶性生物学行为的变化; 蛋白免疫印迹法检测E-cadherin、Vimentin、E-盒结合锌指蛋白1、MMP-3、MMP-9等上皮-间质转化(epithelial-mesenchymal transition, EMT)相关蛋白的表达水平.
与对照组相比, Cd诱导组细胞的恶性生物学行为增强(P<0.05), 且转化后的细胞间呈间充质样链接; 相较于对照组, Cd诱导24 h后, 间质样标志物Vimentin蛋白的相对表达量明显增加(2.20±0.11 vs 1.03±0.08, P<0.01)、MMP-3(5.76±0.20 vs 1.00±0.09, P<0.01)、MMP-9(3.46±0.05 vs 0.99±0.04, P<0.01)的蛋白相对表达量也上升, 而上皮样标志物E-cadherin蛋白的相对表达显著下降(0.30±0.03 vs 1.01±0.05, P<0.01), 且他们均呈现时间依赖性.
形态学和分子生物学都提示HCT-116细胞在慢性低剂量Cd暴露后会引起EMT机制.
核心提要: 环境污染水平的镉(cadmium, Cd)慢性暴露可促进结肠癌细胞的恶性生物学行为, 其分子机制可能与重金属污染物Cd诱导结肠癌细胞发生上皮-间质转化有关.
引文著录: 钱燕, 陈丹蕾, 任海风, 王仕清, 于丹丹, 汪思应. 重金属污染物镉通过EMT机制加强结肠癌细胞株HCT-116的恶性生物学行为. 世界华人消化杂志 2016; 24(30): 4185-4192
Revised: August 29, 2016
Accepted: September 7, 2016
Published online: October 28, 2016
To investigate the influence of cadmium on the malignant biological behavior of HCT-116 cells and the mechanism involved.
After HCT-116 cells were treated with cadmium, the changes in cell malignant biological behavior were assessed by MTT assay, colony forming assay, cell adhesion assay, and transwell migration and invasion assays. Western blot was used to detect the expression of E-cadherin, Vimentin, Zinc finger E-box binding homeobox1, MMP-3, MMP-9 and other proteins in cadmium treated cells.
Chronic exposure to cadmium enhanced the malignant biological behavior of HCT-116 cells, and the transformed cells formed mesenchymal-like intercellular junctions. The protein expression of vimentin, MMP3, and MMP9 was increased, while the expression of E-cadherin was decreased in a time-dependent manner. Overall, morphological and molecular changes suggested that HCT-116 cells underwent an epithelial-mesenchymal transition (EMT) process after chronic cadmium exposure.
Cadmium enhances the malignant biologic behavior of HCT-116 cells possibly by inducing EMT.
- Citation: Qian Y, Chen DL, Ren HF, Wang SQ, Yu DD, Wang SY. Heavy metal pollutant cadmium enhances malignant biological behavior of human colorectal carcinoma HCT-116 cells via inducing epithelial-mesenchymal transition. Shijie Huaren Xiaohua Zazhi 2016; 24(30): 4185-4192
- URL: https://www.wjgnet.com/1009-3079/full/v24/i30/4185.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i30.4185
结肠癌是全球最常见的恶性消化系肿瘤之一, 其发病率仅次于胃癌[1], 在我国的发生率和死亡率也逐年上升. 肿瘤发展是一个动态过程, 包含肿瘤细胞的分化、增殖和转移, 三者相互影响, 并和周围基质环境相作用[2]. 除遗传因素外, 环境因素是调控肿瘤的另一要素[3-5], 而重金属污染在环境污染中所占比例较大, 尤其是砷(arsenic, As)和镉(cadmium, Cd)[6-8]. Cd是一种广泛分布于土壤、空气和水中的重金属污染物[9], 早在1993年Cd及其化合物即被国际癌症研究机构列为人类的Ⅰ类致癌物. Cd暴露的主要来源是食物、香烟烟雾和工业污染. 其生物半衰期很长, 可在机体累积毒性并致癌[10,11].
上皮-间质转化(epithelial- mesenchymal transition, EMT)是上皮细胞经特定程序转化为具有间质表型细胞的生物学过程. 其在胚胎发育、炎症、纤维化疾病中发挥重要作用[12], 同时也是肿瘤恶性进展的重要推手[13,14]. 众多研究[15-18]表明Cd涉及多种肿瘤(肺癌、前列腺癌、膀胱癌、肾癌等)的发生发展, 但对于Cd诱发结肠癌恶变的分子机制知之甚少. 本文旨在探究通过低浓度Cd对人结肠癌细胞株HCT-116进行慢性诱导, 建立诱导后的稳定细胞株, 以观察结肠癌细胞株HCT-116的恶性生物学行为的变化, 探究其机制是否与EMT相关.
人结肠癌细胞株HCT-116获自中科院上海细胞生物学研究所; Dulbecco改良Eagle即DMEM高糖(标准)培养基、胎牛血清、胰酶(购自Gibco公司); 100 U/mL青霉素和100 μg/mL链霉素(购自Hyclone公司); MTT细胞增殖及细胞毒性试剂盒(购自KeyGEN BioTECH公司); 蛋白酶抑制剂(购自Roche公司); 过硫酸铵AP、丙烯酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷Tris、十二烷基磺酸钠SDS(购自上海生工生物公司); 一抗: β-actin单抗、抗E-cadherin、抗Vimentin、抗ZEB-1(购自Proteintech公司); 抗β-catenin、抗MMP-3(购自Abcam公司); 二抗: HRP偶联的山羊抗鼠、HRP偶联的山羊抗兔(购自Proteintech公司); PVDF膜(购自Millipore公司); 蛋白印迹法高灵敏度化学发光检测试剂盒(购自北京康为世纪生物科技有限公司); Transwell小室(购自BD公司); 琼脂糖粉剂(购自Biowest公司)等, 本文中所用化学品均为分析纯.
1.2.1 细胞培养与分组: 将HCT-116细胞接种于60 mm×15 mm小培养皿, 用DMEM-高糖型(含10%胎牛血清+1%青霉素-链霉素), 放于一定湿度下, 37 ℃、50 mL/L CO2的恒温培养箱中培养. 细胞为上皮样贴壁生长, 每2-3 d传代一次, 取生长对数期细胞, 随机分组(对照组、诱导组), 每皿按1×105个细胞接种, 待细胞贴壁后, 分别使用含0、15 nmol/L CdCl2的DMEM培养基对对照组和诱导组进行处理、传代、重复, 持续至40代. 将对照组、经Cd诱导20、40代的细胞扩大培养进行观察研究
1.2.2 细胞增殖检测-MTT实验: 取对数期生长细胞(对照组、诱导20代组、诱导40代组), 常规消化计数, 用完全培养液重悬细胞, 调整浓度为1×104/mL, 然后按200 μL/孔取细胞悬液接种于96孔板, 培养0、24、48 h后, 每孔加0.02 mL的5 mg/mL MTT溶液, 37 ℃孵育. 4 h后, 吸弃上清, 再按0.15 mL/孔的量加二甲基亚砜, 孵育10 min. 使用酶标仪, 选择490 nm波长, 检测吸光度. 实验至少重复3次, 对结果统计后分析.
1.2.3 细胞群体依赖性、克隆形成能力检测-平板克隆形成实验: 取对数期生长细胞(对照组、诱导20代组、诱导40代组), 消化、重悬细胞后, 按500个/孔接种于6孔板, 置37 ℃, 50 mL/L CO2培养箱培养2 wk, 至出现肉眼可见的克隆, 培养终止. 弃上清, 冷PBS清洗后无水甲醇固定15 min, 0.1%结晶紫染色2 h, 脱色干燥后, 拍照、计数克隆形成数. 实验至少重复3次.
1.2.4 检测肿瘤细胞黏附能力-黏附实验: 实验细胞分别按2×105个/孔接种于包被Matrigel(人工基底膜胶)的96孔板, 0.5、1、2 h后用PBS轻轻冲洗2次, 并用70%乙醇室温下固定15 min. 使用细胞计数试剂盒CCK-8(使用遵说明书), 利用WST-8水解贴壁细胞进行评估(黏附率 = Cd慢性诱导组平均OD值/对照组细胞平均OD值×100%). 实验至少重复3次.
1.2.5 检测细胞迁移能力-迁移实验: 分组实验细胞, 消化后用无血清培养基重悬细胞, 并将细胞浓度调整至2×105/mL, 将带有8 μm孔径微孔膜的Transwell小室小心放入24孔板的小孔中(放置小室时要保证小室的底层薄膜与培养液之间没有气泡), 细胞悬液按200 μL/孔接种于小室的上室, 下室提前加入含10%FBS的DMEM培养液500 μL. 常规培养12 h后, 收24孔板, 吸弃上清, PBS冲洗, 然后用40 g/L多聚甲醛固定, 再用0.1%结晶紫染色30 min, 清洗脱色后棉签轻拭上室未迁移细胞, 待晾干于倒置显微镜下随机观察每孔5个视野的细胞, 并照相、统计分析. 实验重复3次.
1.2.6 检测细胞周期-流式细胞仪检测: 收集细胞沉淀, 用预冷的PBS溶液重悬, 用70%乙醇(预冷)固定过夜. PBS洗涤后, 细胞用0.1 mL RNase透化处理, 37 ℃避光, 温浴30 min. 然后每管细胞样品中用0.5 mL的碘化丙啶染色30 min. 用流式细胞仪在激发波长488 nm、发射波长525 nm分析细胞周期. 实验至少重复3次.
1.2.7 蛋白印迹法检测EMT相关蛋白的表达: 取对数生长期HCT-116细胞, 分别用2.5 μmol/L CdCl2急性诱导0、12、24 h后, 收集细胞沉淀用RIPA裂解液(含蛋白酶抑制剂)裂解细胞提取总蛋白. 用BCA法测定蛋白质浓度, 以40 μg/孔加样, 根据目的蛋白大小配制SDS-PAGE凝胶(8%分离胶、5%浓缩胶), 进行电泳(浓缩胶80 V、分离胶120 V)分离目的蛋白. 完成后通过电转(200 mA, 2 h)将蛋白转移到PVDF膜上, 然后室温下, 用TBST溶液(含5%脱脂奶粉)封闭2 h后, 对应加入稀释过的一抗中(按说明书稀释1000-2000倍), 4 ℃摇床孵育(过夜), 次日用TBST洗膜, 4次×10 min/次, 常温下用二抗(含5%脱脂奶粉的TBST溶液稀释过2000倍的辣根过氧化物酶)孵育1 h, 再洗膜10 min×3次. 利用增强的化学发光试剂盒进行ECL检测目的蛋白, 对凝胶成像仪成像的条带利用Quantity One软件测灰度做定量分析(目的蛋白相对量=目的蛋白的条带光密度/β-actin条带的光密度). 实验至少重复3次.
统计学处理 使用SPSS19.0软件进行分析, 数据以mean±SD表示, 用单因素方差(ANOVA)分析、t检验, 对不同诱导时间的Cd处理组和对照组进行组间比较. P<0.05为差异显著, 具有统计学意义.
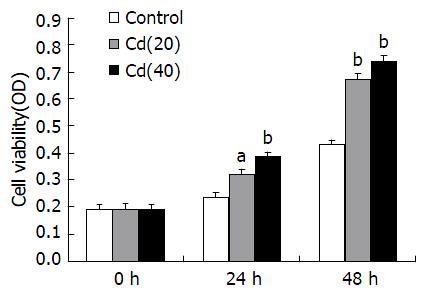
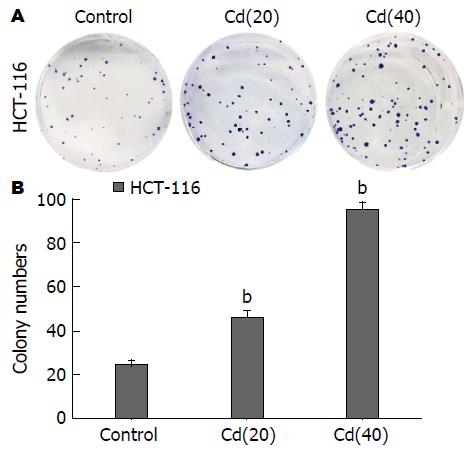
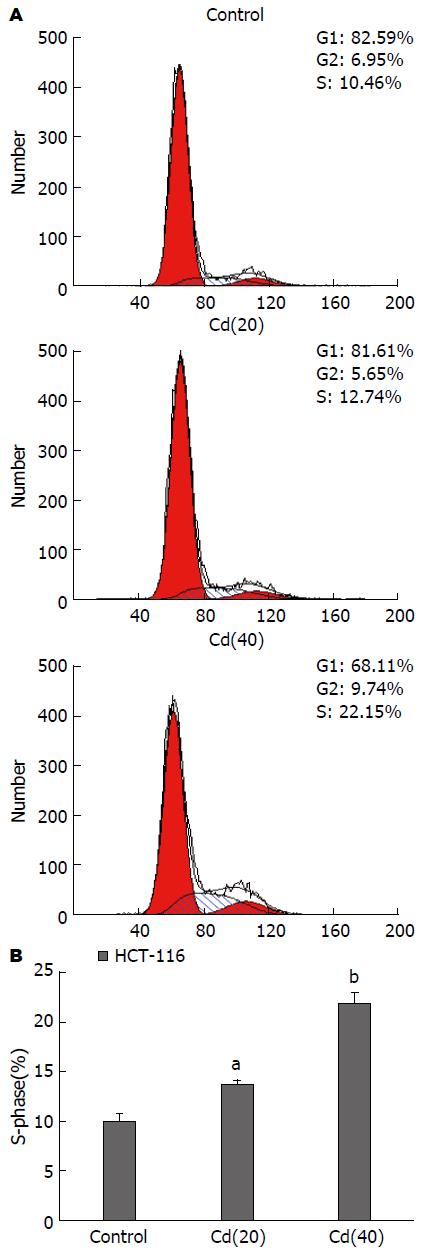
MTT实验结果显示, 实验细胞经培养0、12、24 h后, Cd慢性诱导组细胞的增殖能力增强(P<0.05, P<0.01)(图1); 平板克隆形成实验发现2 wk后, Cd诱导组(40代)的克隆形成数为95.67个±4.93个, Cd诱导组(20代)的细胞克隆数为46.33个±4.73个, 而对照组克隆形成数为24.67个±3.51个, 且Cd诱导组集落的大小也明显大与对照组, 提示Cd诱导转化的HCT-116细胞的克隆形成能力增强, 且变化呈现时间依赖性(图2), 各实验组相较对照组有显著差异(P<0.01); 细胞周期分析结果(图3)显示Cd诱导组细胞DNA合成期(S期)在细胞周期中的比例明显升高, 与细胞的Cd暴露时间成正变关系, 结果有统计学意义(P<0.05, P<0.01).
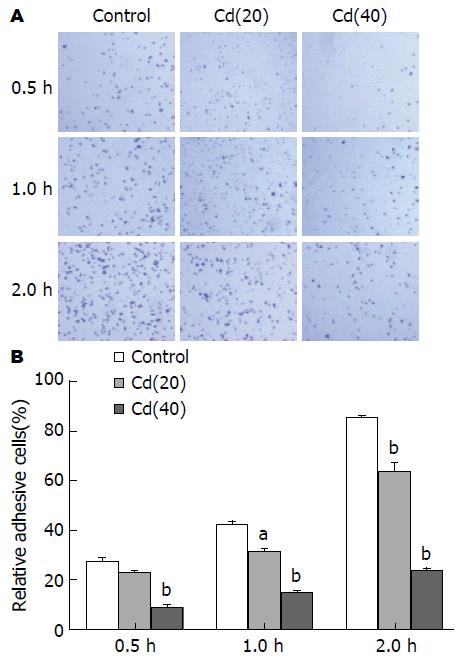
随着结肠癌细胞在Cd中暴露时间的增加, 诱导组细胞间的连接松散, 细胞黏附能力下降(图4), 变化有统计学意义(P<0.05, P<0.01).
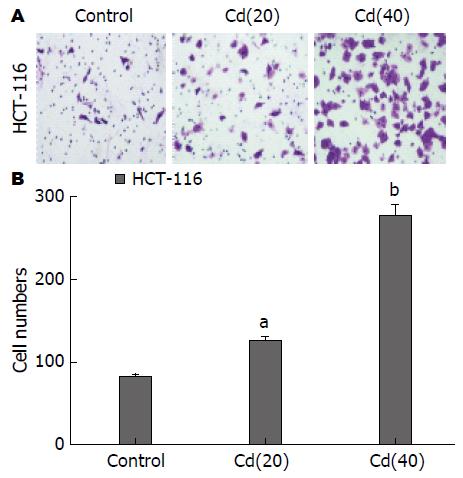
倒置显微镜下观察、计数穿过Transwell小室底膜的迁移细胞数目. 与对照组相比, 随着Cd暴露时间的增加, 诱导组细胞的迁移数量增多, 迁移能力明显增强(图5), 有统计学意义(P<0.05, P<0.01).
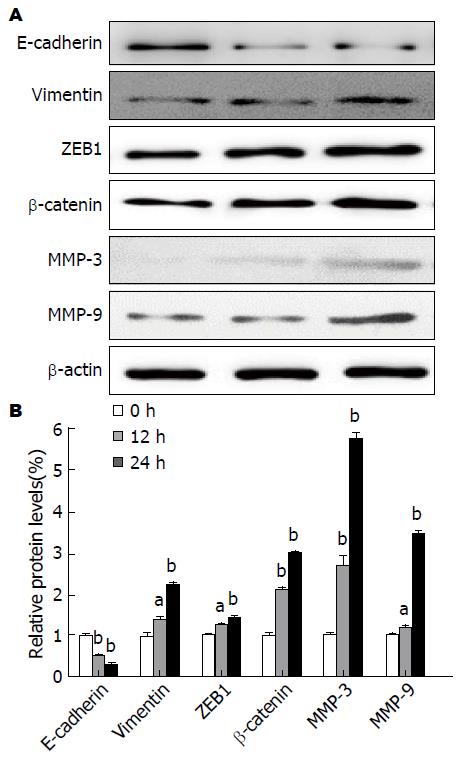
以β-actin做内参, 对Cd诱导组和对照组细胞进行E-cadherin、Vimentin、E-盒结合锌指蛋白1(Zinc finger E-box binding homeobox1, ZEB1)、MMP-3、MMP-9和β-catenin蛋白表达的检测. 相较对照组, Cd诱导组见间质样标志物蛋白Vimentin、MMP-3、MMP-9的表达上升, 同时, 上皮标志物E-cadherin蛋白的表达下降, 提示EMT的发生, 蛋白表达的灰度分析(P<0.05, P<0.01), 有统计学差异(图6).
目前, 在中国, 结直肠癌已严重威胁我国人民的健康[18]. 研究[6-8,19,20]表明, 结直肠癌是遗传因素和环境因素共同作用的结果, 而重金属污染在环境污染中发挥关键作用, 尤其是重金属污染物As、Cd. Cd是一种已知的环境致癌物质, 主要来自相关工业(如电池生产、颜料制造等)的熔炼释放、化石燃料燃烧、金属精炼和吸烟等, 被Cd污染的空气及大米也会被人摄取[21,22], 因此, 人体暴露于Cd的风险长期存在. 令人担忧的是, 一些研究证实Cd与多种肿瘤的发生密切相关, 包括结直肠癌[15-18,23-25]. 但是, 关于Cd对结直肠癌细胞恶性进展的影响及其相关机制的研究在国内外鲜有报道. 而肿瘤的恶性转化及90%以上癌症相关的死亡原因是癌细胞侵袭到周围组织, 向全身传播, 并转移至远处器官形成继发性肿瘤[26-28]. 所以, 了解肿瘤恶性进展及其分子机制非常必要, 其中EMT发挥重要作用, 是目前人们对肿瘤恶性发展机制研究的热点之一.
本课题组前期曾报道重金属污染物As慢性暴露可以通过EMT机制促进结肠癌细胞株HT-29的恶性进展[29]. 而本次研究试图通过低浓度Cd暴露, 建立诱导后的稳定结肠癌细胞株HCT-116, 以探究环境污染浓度的Cd慢性暴露是否会加强结肠癌细胞的恶性生物学行为. 以下数据支持了我们的想法. 我们对实验组HCT-116细胞进行了慢性低剂量的Cd暴露, 从而建立Cd诱导后稳定转化的HCT-116细胞, 对其和对照组(未诱导)的细胞进行行为学实验比较. MTT实验、平板克隆形成实验等结果均表明, 经Cd慢性诱导后, HCT-116细胞的增殖能力、克隆形成能力比对照组显著增强; Transwell迁移和侵袭实验证明, Cd诱导组的细胞迁移能力和侵袭力也随着Cd慢性暴露的时间明显增强, 但诱导组细胞的黏附能力却明显下降. 这些肿瘤细胞行为学的变化提示在环境污染浓度的Cd慢性暴露后, 结肠癌细胞株HCT-116的恶性生物学行为加强, 且发生了EMT. 接下来, 我们从蛋白水平对EMT进行了验证: 用2.5 μmol/L CdCl2分别急性诱导了HCT-116细胞0、12、24 h, 用蛋白印迹法方法检测Cd急性处理后, HCT-116细胞中与EMT相关的E-cadherin和Vimentin蛋白的表达. 结果发现上皮标志物E-cadherin蛋白的表达下降, 与之相反, 间质型标志物Vimentin蛋白等的表达增加. 这些变化提示EMT发生.
关于EMT的发生机制, 各国科学家做了大量研究. Kim等[30]研究发现, 低强度辐射处理后的乳腺癌细胞的恶性生物学行为增强, 并发生了EMT, 其机制可能与其经IL-6/JAK/STAT3信号轴激活Notch信号通路有关. Gu等[31]研究表明结直肠癌中的TUSC3基因通过调节MAPK、PI3K/AKT及Wnt/β-catenin信号通路改变癌细胞的增殖、侵袭及转移能力, 从而促进肿瘤的发展和EMT的发生. 陈晓敏等[32]指出NF-κB等信号通路, 也可通过调控转录因子(Twist1、Twist2、ZEB1及ZEB2等), 诱导EMT进程. Robichaud等[33]研究新发现, 能特异性识别mRNA的帽结合蛋白-真核起始因子eIF4E在肿瘤的发生发展中起重要作用. 磷酸化后的eIF4E可以促进肿瘤的发展, 且转化TGF-β诱导eIF4E的磷酸化, 从而促进了Snail、MMP-3的表达升高, 以致EMT的发生. 此外, 最新的一些研究提出miRNA、lnc RNA等大量非编码RNA也可调控EMT[34-36]. 另有研究提出新发现: miR-150是Wnt/β-catenin通路的效应分子, 可能通过靶向抑制CREB信号通路增强结直肠癌细胞的EMT[37]. 可见, EMT的发生是多因素、多环节复杂作用的结果.
我们感兴趣的是, Sánchez-Tilló等[38]研究发现ZEB1是结直肠癌细胞发生EMT的关键因素, 通过经典的Wnt/β-catenin信号通路提高肿瘤细胞的侵袭性和转移能力. 此外, 肿瘤的侵袭还需要肿瘤周围基质蛋白的重塑, 其中基质金属蛋白酶MMP家族(如MMP-3、MMP-9等)可降解、重塑细胞外基质, 为EMT的发生提供了微环境. 为进一步验证EMT的产生机制, 我们也检测了这些标志物蛋白(核蛋白β-catenin、ZEB-1、MMP-3、MMP-9)的表达, 令我们惊喜的是随着Cd的诱导时间的推移(0、12、24 h), 这些标志物蛋白的表达都有增加, 且有统计学意义.
本文的形态学和分子生物学实验结果提示: HCT-116细胞在慢性低剂量Cd暴露后, 可使肿瘤细胞的恶性生物学行为加强, 其机制可能与Cd诱导肿瘤细胞后引起ZEB1表达上调, 并通过经典的Wnt/β-catenin信号通路, 促发EMT有关. 由于我们的实验是肿瘤细胞体外诱导的结果, 在接下来的实验中我们将利用裸鼠成瘤实验进行进一步的验证. Cd诱导肿瘤细胞发生EMT的分子机制值得我们继续深入研究.
本文试图寻找一些EMT相关的分子标志物(如E-cadherin、vimentin、ZEB1等), 去评估Cd暴露人群的肿瘤恶性进展的风险. 这些观点可能为结肠癌的临床防治提供新思路[39,40].
结肠癌是全球最常见的恶性消化系肿瘤之一, 其发病率仅次于胃癌. 环境污染不仅导致结肠癌等肿瘤的发病率明显上升, 且其死亡率也呈现上升趋势, 但机制不清.
重金属污染物与肿瘤发生发展关系的研究是国内外研究的热点之一, 但关于重金属污染物镉(cadmium, Cd)通过上皮-间质转化(epithelial- mesenchymal transition, EMT)机制影响结肠癌细胞恶性生物学行为的研究在国内外鲜有报道. 本文通过环境污染浓度的Cd慢性暴露, 观察其对结肠癌细胞恶性生物学行为的影响并探讨其机制, 对肿瘤防治具有重要意义.
研究表明重金属污染物As、Cd可能参与多种恶性肿瘤(如肺癌、前列腺癌、膀胱癌、肾癌等)的发生发展, 本课题组前期也曾报道重金属污染物As慢性暴露可以促进肠癌细胞HT-29的恶性进展.
本文首先发现环境污染物中重金属Cd慢性暴露可以促进肠癌细胞的恶性进展, 进一步发现其机制与诱导结肠癌细胞发生EMT有关. 具有一定的创新性.
本文揭示结肠癌发展的相关机制, 试图寻找一些分子机制中相关标志物(如E-cadherin、vimentin、E-盒结合锌指蛋白1等)的变化, 去评估Cd暴露人群的肿瘤恶性生物学进展的风险. 这对于肿瘤的防治也具有重要意义.
上皮-间质转化(EMT): 是上皮细胞经特定程序转化为具有间质表型细胞的生物学过程. 其主要特征有细胞黏附分子(如E-cadherin)的表达减少、细胞骨架波形蛋白(vimentin)的表达增加, 且形态上具有间充质细胞的特征等. 其在胚胎发育、炎症、纤维化疾病中发挥重要作用, 同时也是肿瘤恶性进展的重要推动力.
贾云鹤, 教授, 主任医师, 哈尔滨医科大学附属肿瘤医院结直肠外科
本文从细胞、蛋白水平对Cd与结肠癌细胞的恶性生物学行为进行了相关性研究, 并针对其可能机制进行探讨, 有利于揭示结肠癌发生发展的机制, 这对于肿瘤的防治具有重要意义. 研究有一定的深度和新颖性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 安徽省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Alemany-Ribes M, Semino CE. Bioengineering 3D environments for cancer models. Adv Drug Deliv Rev. 2014;79-80:40-49. [PubMed] [DOI] |
| 3. | Herceg Z, Vaissière T. Epigenetic mechanisms and cancer: an interface between the environment and the genome. Epigenetics. 2011;6:804-819. [PubMed] [DOI] |
| 4. | Cogliano VJ, Baan R, Straif K, Grosse Y, Lauby-Secretan B, El Ghissassi F, Bouvard V, Benbrahim-Tallaa L, Guha N, Freeman C. Preventable exposures associated with human cancers. J Natl Cancer Inst. 2011;103:1827-1839. [PubMed] [DOI] |
| 5. | Zhitkovich A. Chromium in drinking water: sources, metabolism, and cancer risks. Chem Res Toxicol. 2011;24:1617-1629. [PubMed] [DOI] |
| 6. | Somji S, Garrett SH, Toni C, Zhou XD, Zheng Y, Ajjimaporn A, Sens MA, Sens DA. Differences in the epigenetic regulation of MT-3 gene expression between parental and Cd+2 or As+3 transformed human urothelial cells. Cancer Cell Int. 2011;11:2. [PubMed] [DOI] |
| 7. | Sandquist EJ, Somji S, Dunlevy JR, Garrett SH, Zhou XD, Slusser-Nore A, Sens DA. Loss of N-Cadherin Expression in Tumor Transplants Produced From As+3- and Cd+2-Transformed Human Urothelial (UROtsa) Cell Lines. PLoS One. 2016;11:e0156310. [PubMed] [DOI] |
| 8. | Kossowska B, Dudka I, Bugla-Płoskońska G, Szymańska-Chabowska A, Doroszkiewicz W, Gancarz R, Andrzejak R, Antonowicz-Juchniewicz J. Proteomic analysis of serum of workers occupationally exposed to arsenic, cadmium, and lead for biomarker research: a preliminary study. Sci Total Environ. 2010;408:5317-5324. [PubMed] [DOI] |
| 9. | Faroon O, Ashizawa A, Wright S, Tucker P, Jenkins K, Ingerman L, Rudisill C. Toxicological Profile for Cadmium. Atlanta (GA): Agency for Toxic Substances and Disease Registry (US); 2012; Sep. [PubMed] |
| 10. | Ye X, Weinberg RA. Epithelial-Mesenchymal Plasticity: A Central Regulator of Cancer Progression. Trends Cell Biol. 2015;25:675-686. [PubMed] [DOI] |
| 11. | Kang Y, Massagué J. Epithelial-mesenchymal transitions: twist in development and metastasis. Cell. 2004;118:277-279. [PubMed] [DOI] |
| 12. | Sun L, Fang J. Epigenetic regulation of epithelial-mesenchymal transition. Cell Mol Life Sci. 2016; Jul 8. [Epub ahead of print]. [PubMed] [DOI] |
| 13. | De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression. Nat Rev Cancer. 2013;13:97-110. [PubMed] [DOI] |
| 14. | Saika K, Sobue T. Cancer statistics in the world. Gan To Kagaku Ryoho. 2013;40:2475-2480. [PubMed] |
| 15. | Chen C, Xun P, Nishijo M, He K. Cadmium exposure and risk of lung cancer: a meta-analysis of cohort and case-control studies among general and occupational populations. J Expo Sci Environ Epidemiol. 2016;26:437-444. [PubMed] [DOI] |
| 16. | Eriksen KT, Halkjær J, Meliker JR, McElroy JA, Sørensen M, Tjønneland A, Raaschou-Nielsen O. Dietary cadmium intake and risk of prostate cancer: a Danish prospective cohort study. BMC Cancer. 2015;15:177. [PubMed] [DOI] |
| 17. | Feki-Tounsi M, Hamza-Chaffai A. Cadmium as a possible cause of bladder cancer: a review of accumulated evidence. Environ Sci Pollut Res Int. 2014;21:10561-10573. [PubMed] [DOI] |
| 18. | Pinzani M. Epithelial-mesenchymal transition in chronic liver disease: fibrogenesis or escape from death? J Hepatol. 2011;55:459-465. [PubMed] [DOI] |
| 19. | He C, Chen M, Liu J, Yuan Y. Host genetic factors respond to pathogenic step-specific virulence factors of Helicobacter pylori in gastric carcinogenesis. Mutat Res Rev Mutat Res. 2014;759:14-26. [PubMed] [DOI] |
| 20. | Huang HH, Huang JY, Lung CC, Wu CL, Ho CC, Sun YH, Ko PC, Su SY, Chen SC, Liaw YP. Cell-type specificity of lung cancer associated with low-dose soil heavy metal contamination in Taiwan: an ecological study. BMC Public Health. 2013;13:330. [PubMed] [DOI] |
| 22. | Hu Y, Cheng H, Tao S. The Challenges and Solutions for Cadmium-contaminated Rice in China: A Critical Review. Environ Int. 2016;92-93:515-532. [PubMed] [DOI] |
| 23. | Hossain MB, Vahter M, Concha G, Broberg K. Low-level environmental cadmium exposure is associated with DNA hypomethylation in Argentinean women. Environ Health Perspect. 2012;120:879-884. [PubMed] [DOI] |
| 24. | Freitas M, Fernandes E. Zinc, cadmium and nickel increase the activation of NF-κB and the release of cytokines from THP-1 monocytic cells. Metallomics. 2011;3:1238-1243. [PubMed] [DOI] |
| 25. | Humphries B, Wang Z, Yang C. The role of microRNAs in metal carcinogen-induced cell malignant transformation and tumorigenesis. Food Chem Toxicol. 2016; Feb 20. [Epub ahead of print]. [PubMed] [DOI] |
| 26. | Gupta GP, Massagué J. Cancer metastasis: building a framework. Cell. 2006;127:679-695. [PubMed] [DOI] |
| 27. | Chockley PJ, Keshamouni VG. Immunological Consequences of Epithelial-Mesenchymal Transition in Tumor Progression. J Immunol. 2016;197:691-698. [PubMed] [DOI] |
| 28. | Davis FM, Stewart TA, Thompson EW, Monteith GR. Targeting EMT in cancer: opportunities for pharmacological intervention. Trends Pharmacol Sci. 2014;35:479-488. [PubMed] [DOI] |
| 29. | Sun JL, Chen DL, Hu ZQ, Xu YZ, Fang HS, Wang XY, Kan L, Wang SY. Arsenite promotes intestinal tumor cell proliferation and invasion by stimulating epithelial-to-mesenchymal transition. Cancer Biol Ther. 2014;15:1312-1319. [PubMed] [DOI] |
| 30. | Kim RK, Kaushik N, Suh Y, Yoo KC, Cui YH, Kim MJ, Lee HJ, Kim IG, Lee SJ. Radiation driven epithelial-mesenchymal transition is mediated by Notch signaling in breast cancer. Oncotarget. 2016; Jul 23. [Epub ahead of print]. [PubMed] [DOI] |
| 31. | Gu Y, Wang Q, Guo K, Qin W, Liao W, Wang S, Ding Y, Lin J. TUSC3 promotes colorectal cancer progression and epithelial-mesenchymal transition (EMT) through WNT/β-catenin and MAPK signalling. J Pathol. 2016;239:60-71. [PubMed] [DOI] |
| 33. | Robichaud N, del Rincon SV, Huor B, Alain T, Petruccelli LA, Hearnden J, Goncalves C, Grotegut S, Spruck CH, Furic L. Phosphorylation of eIF4E promotes EMT and metastasis via translational control of SNAIL and MMP-3. Oncogene. 2015;34:2032-2042. [PubMed] [DOI] |
| 34. | Raza U, Saatci Ö, Uhlmann S, Ansari SA, Eyüpoğlu E, Yurdusev E, Mutlu M, Ersan PG, Altundağ MK, Zhang JD. The miR-644a/CTBP1/p53 axis suppresses drug resistance by simultaneous inhibition of cell survival and epithelial-mesenchymal transition in breast cancer. Oncotarget. 2016; Jul 8. [Epub ahead of print]. [PubMed] [DOI] |
| 35. | Kwak SY, Yoo JO, An HJ, Bae IH, Park MJ, Kim J, Han YH. miR-5003-3p promotes epithelial-mesenchymal transition in breast cancer cells through Snail stabilization and direct targeting of E-cadherin. J Mol Cell Biol. 2016; Jun 9. [Epub ahead of print]. [PubMed] [DOI] |
| 36. | Li W, Kang Y. A new Lnc in metastasis: long noncoding RNA mediates the prometastatic functions of TGF-β. Cancer Cell. 2014;25:557-559. [PubMed] [DOI] |
| 37. | Guo YH, Wang LQ, Li B, Xu H, Yang JH, Zheng LS, Yu P, Zhou AD, Zhang Y, Xie SJ. Wnt/β-catenin pathway transactivates microRNA-150 that promotes EMT of colorectal cancer cells by suppressing CREB signaling. Oncotarget. 2016; Jun 7. [Epub ahead of print]. [PubMed] [DOI] |
| 38. | Sánchez-Tilló E, de Barrios O, Siles L, Amendola PG, Darling DS, Cuatrecasas M, Castells A, Postigo A. ZEB1 Promotes invasiveness of colorectal carcinoma cells through the opposing regulation of uPA and PAI-1. Clin Cancer Res. 2013;19:1071-1082. [PubMed] [DOI] |
| 39. | Tsai JH, Yang J. Epithelial-mesenchymal plasticity in carcinoma metastasis. Genes Dev. 2013;27:2192-2206. [PubMed] [DOI] |
| 40. | Nieto MA. The ins and outs of the epithelial to mesenchymal transition in health and disease. Annu Rev Cell Dev Biol. 2011;27:347-376. [PubMed] [DOI] |