修回日期: 2016-08-12
接受日期: 2016-08-23
在线出版日期: 2016-10-28
研究绞股蓝皂苷对2型糖尿病合并非酒精性脂肪性肝病(type 2 diabetes mellitus and nonalcoholic fatty liver disease, T2DM-NAFLD)大鼠的作用机制.
将60只SD大鼠随机分成5个实验组: 空白对照组(Ⅰ组), T2DM-NAFLD模型组(Ⅱ组), T2DM-NAFLD模型绞股蓝皂苷(gypenosides, GPS)小剂量治疗组(Ⅲ组), T2DM-NAFLD模型GPS中剂量治疗组(Ⅳ组), T2DM-NAFLD模型GPS大剂量治疗组(Ⅴ组). 肝组织病理学检查了解GPS治疗的效果, 免疫组织化学分析肝组织中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α), 核因子-κB(nuclear factor-κB, NF-κB)表达情况, PCR对过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)和细胞色素P4501A1(cytochrome P4501A1, CYP4501A1)的mRNA表达进行定量分析.
GPS治疗组能显著降低血糖, 具有剂量依赖性. 免疫组织化学分析发现, GPS治疗显著降低大鼠肝组织中细胞因子TNF-α和NF-κB的表达, 并有剂量依赖关系. 肝组织PCR检测发现, GPS治疗能下调肝组织PPARγ和CYP4501A1的mRNA表达. GPS治疗能减轻治疗组大鼠肝脏脂肪浸润程度, 通过剂量依赖关系方式逆转脂肪肝程度.
GPS通过下调细胞因子TNF-α、NF-κB以及PPARγ和CYP4501A1 mRNA的表达对T2DM-NAFLD大鼠肝组织产生保护作用.
核心提要: 本文通过动物实验的方法, 探索绞股蓝皂苷治疗2型糖尿病并非酒精性脂肪性肝病(type 2 diabetes mellitus and nonalcoholic fatty liver disease, T2DM-NAFLD)的机制, 研究发现绞股蓝皂苷通过下调肝组织细胞因子肿瘤坏死因子-α, 核因子-κB表达情况, PCR对过氧化物酶体增殖物激活受体γ和细胞色素P4501A1 mRNA的表达对T2DM-NAFLD大鼠肝细胞产生保护作用.
引文著录: 雷飞飞, 李云静, 李儒贵, 李刚, 李金科, 李芳, 谭华炳. 绞股蓝皂苷干预2型糖尿病合并非酒精性脂肪肝病的机制. 世界华人消化杂志 2016; 24(30): 4169-4176
Revised: August 12, 2016
Accepted: August 23, 2016
Published online: October 28, 2016
To explore the mechanism underlying protective effect of gypenosides (GPS) against type 2 diabetes mellitus and nonalcoholic fatty liver disease (T2DM-NAFLD) in rats.
Sixty rats were randomly divided into five groups: blank control group, T2DM-NAFLD model group, low dose GPS group, medium dose GPS group, and high dose GPS group. The efficacy was confirmed by histopathology, and the expression of tumor necrosis factor-α (TNF-α) and nuclear factor-κB (NF-κB) in the liver was analyzed by immunohistochemistry. In addition, the expression of peroxisome proliferator activated receptor gamma (PPARγ) and cytochrome P4501A1 (CYP4501A1) mRNAs was detected by RT-PCR.
Immunohistochemical study showed that the expression of TNF-α and NF-κB was significantly reduced by GPS, in a dose-dependent manner. The expression of PPARγ and CYP4501A1 mRNAs measured by RT-PCR was also significantly down-regulated by GPS. Moreover, GPS decreased the infiltration of liver fats and reversed the histopathological changes in a dose-dependent manner.
GPS protects against T2DM-NAFLD by down-regulating the expression of TNF-α, NF-κB, PPARγ and CYP4501A1.
- Citation: Lei FF, Li YJ, Li RG, Li G, Li JK, Li F, Tan HB. Mechanism underlying protective effect of gypenosides against type 2 diabetes mellitus and nonalcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(30): 4169-4176
- URL: https://www.wjgnet.com/1009-3079/full/v24/i30/4169.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i30.4169
长期高营养、高脂饮食诱发胰岛素抵抗(insulin resistance, IR)、2型糖尿病(type 2 diabetes mellitus, T2DM)、非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD). 目前, 人群中NAFLD患者比例约为20%-40%, 其中约30%的NAFLD患者病情进展成为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)患者[1]. NAFLD是最常见的慢性肝脏疾病, 与血脂异常、高血压、IR、肥胖等代谢性综合征关系密切[2-4]. 一般来说, IR及其后续的严重后果与NAFLD的发生与发展关系密切, 被认为是导致NAFLD的独立风险因子[5-7]. 2型糖尿病合并非酒精性脂肪肝(type 2 diabetes mellitus and nonalcoholic fatty liver disease, T2DM-NAFLD)是一组代谢性疾病综合征, 相关的临床症状还包括IR、高血压和内脏肥胖[8]. T2DM和NAFLD是导致全球肥胖人群最主要的健康问题[9]. IR在T2DM-NAFLD的发病机制上扮演着主要角色, 被认为是导致NASH开始出现和病情进展的关键原因[10]. 目前有一些改善糖尿病患者IR的药物, 但没有批准用于NAFLD或NASH患者的专用药物[11]. 研究和发现用于治疗NAFLD或NASH的药物显得十分必要, 国内外肝病学界均将寻找治疗NAFLD或NASH的期望寄托在中药及其提取物上, 其中绞股蓝及提取物绞股蓝皂苷(gypenosides, GPS)是被寄予较大希望的中药. 绞股蓝是葫芦科多年生攀援草本植物, 其主要活性成分是GPS. 既往研究[12]表明GPS可以增加免疫力, 改善高脂血症和保护心血管系统. 近年来的药理学研究也证实GPS的药理学效应包括调节血脂代谢[13,14], 抗高脂血症[13,15], 抗肿瘤[16-18], 抗炎[19], 抗氧化[20,21], 抗糖尿病[22], 护肝[23]等作用. 为临床推广应用, 需对GPS的作用机制深入研究. 本研究通过检测肝组织肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α), 核因子-κB(nuclear factor-κB, NF-κB)、细胞色素P4501A1(cytochrome 4501A1, CYP4501A1) mRNA、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor gamma, PPARγ)的表达, 探讨GPS治疗T2DM-NAFLD的机制.
(1)实验动物: 60只SPF级♂SD大鼠, 体质量180-200 g, 湖北医药学院动物实验中心提供[合格证号: No.scxk(湘)2009-0004]. 实验场地湖北省十堰市实验动物中心(设施合格证号: 0015644). 大鼠每6只/笼, 12 h光暗循环, 实验前1 wk适应性饲养. 动物处于环境受控状态, 维持24 ℃, 湿度45%, 提供充足的食物和水供, 动物实验方法和目的符合人类的道德伦理标准和国际惯例, 湖北医药学院实验动物伦理委员会审查合规. 取动物实验样本前12 h禁食; (2)主要实验试剂: 血糖(blood sugar, BS)检测试剂为设备原厂试剂; GPS(含量>98%)购自西安天丰生物科技有限公司; 链脲霉素(streptozotocin, STZ)购自美国Sigma公司; 蛋白分析试剂盒购自北京中山生物技术研究院; 鼠抗TNF-α、鼠抗NF-κB、HRP标记的羊抗鼠IgG购自美国Proteintech公司; RNAiso Plus(Total RNA extraction reagent)RNA提取试剂盒购自日本Takara公司; StarScriptⅡFirst-strand cDNA Synthesis Kit逆转录试剂盒和StarScriptⅡSYBR Two-Step qRT-PCR Synthesis Kit实时荧光定量核酸扩增试剂盒购自美国Invitrogen公司; 高脂高糖饮食(high fat and sugar diet, HFSD)由湖北医药学院动物实验中心制备(83.25%基础饲料+10%猪油+5%糖+1.5%胆固醇+0.2%去氢胆酸钠+0.05%丙基硫氧嘧啶); (3)主要实验仪器: ZOlympus AU 2700全自动生化分析仪为日本Olympus公司产品; C1000 TouchTM 96孔快速PCR仪和CFX 385TM Real Time PCR扩增仪为美国Bio-Rad公司产品; Accu-Chek快速血糖仪为瑞士Roche公司产品; DL-45R-L冷冻低温离心机为上海中科生物医学高科技开发有限公司产品; 光学显微镜Olympus BX-50 Microscope为日本Olympus公司产品; 显微镜照相系统Leica Microsystems为德国Leica公司产品.
1.2.1 实验设计: 适应性饲养1 wk后, 将60只SPF SD大鼠随机分为2组: 正常组(Ⅰ组, n = 8), 正常饲料喂养; 模型组(n = 52), HFSD喂养. HFSD喂养4 wk后, SD大鼠隔夜空腹腹腔注射STZ 40 mg/kg, 48 h后尾静脉取血, 血糖>11.1 mmol/L, 纳入实验组, 造模成功率为100%, 继续HFSD喂养4 wk. 第9周第1天开始, 将T2DM-NAFLD模型大鼠分为模型组(Ⅱ组)和3个GPS治疗组(Ⅲ组、Ⅳ组、Ⅴ组). Ⅲ组、Ⅳ组、Ⅴ组分别给予200、400、800 mg/(kg•d)灌胃干预, 同时继续HFSD喂养, 实验周期14 wk. 实验结束后, 通过眼窝静脉取血. 右肝叶取出后立即用甲醛固定进行组织病理学检查和免疫组织化学分析. 余下的肝脏组织和血液样本储存于-80 ℃冰箱用于后续的生物化学分析.
1.2.2 血清生化检测: 按设备操作常规检测BS.
1.2.3 肝脏病理学检测: 肝组织常规固定、石蜡包埋、切片. HE染色, Olympus BX-50光学显微镜检测, 分析脂肪肝变性程度评分并用Leica Microsystems显微镜照相系统选取典型图片保存.
1.2.4 免疫组织化学检测: 将1.2.3制备的切片脱蜡后用3%H2O2浸泡10 min猝灭细胞内的过氧物酶活性. 处理后的切片分别用鼠抗TNF-α和鼠抗NF-κB单克隆抗体4 ℃孵育过夜, 然后用羊血清封闭20 min, 接着用二抗(HRP标记的羊抗鼠抗体)37 ℃孵育30 min, 最后与DAB-H2O2室温孵育放置10 min, Olympus BX-50光学显微镜放大400倍观察并用Leica Microsystems显微镜照相系统留存图片.
1.2.5 PCR检测: Ⅰ组-Ⅴ组肝脏样本总RNA的提取按照RNAiso Plus reagent试剂盒说明书进行操作, 使用StarScriptⅡFirst-strand cDNA Synthesis Kit逆转录试剂盒进行反转录操作, RNA通过C1000 PCR仪反转录得到cDNA. 在CFX 385TM Real Time PCR扩增仪上使用StarScriptⅡSYBR Two-Step qRT-PCR Synthesis Kit定量核酸扩增试剂盒检测mRNA的表达水平. PPARγ引物: 上游引物: 5'-GGAGCCTAAGTTTGAGTTTGCTGTG-3'; 下游引物: 5'-TGCAGCAGGTTGTCTTGGATG-3'(GenBank: NM_0131-24.3). 细胞色素P4501A1(cytochrome P4501A1, CYP4501A1)引物: 上游引物: 5'-CTGGTTCTGGATACCCAGCTG-3'; 下游引物: 5'-CCTAGGGTTGGTTACCAGG-3'(GenBank: HO_0047-97.1). GAPDH基因作为内参, 分别扩增并分析样本中各基因的表达情况. Ⅰ组和Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组之间的倍数变化用2-ΔΔCt法[24]计算.
统计学处理 所有数据采用SPSS23.0统计学软件处理, 数据以mean±SD的方式表示, 用one-way ANOVA法进行数据分析, 治疗前后组内及组间比较用Dunnett's t-test检验. P<0.05为差异具有统计学意义.
GPS治疗组BS水平显著低于Ⅱ组, 呈剂量依赖性. 数据将在其他论文发表, 本文不再赘述.
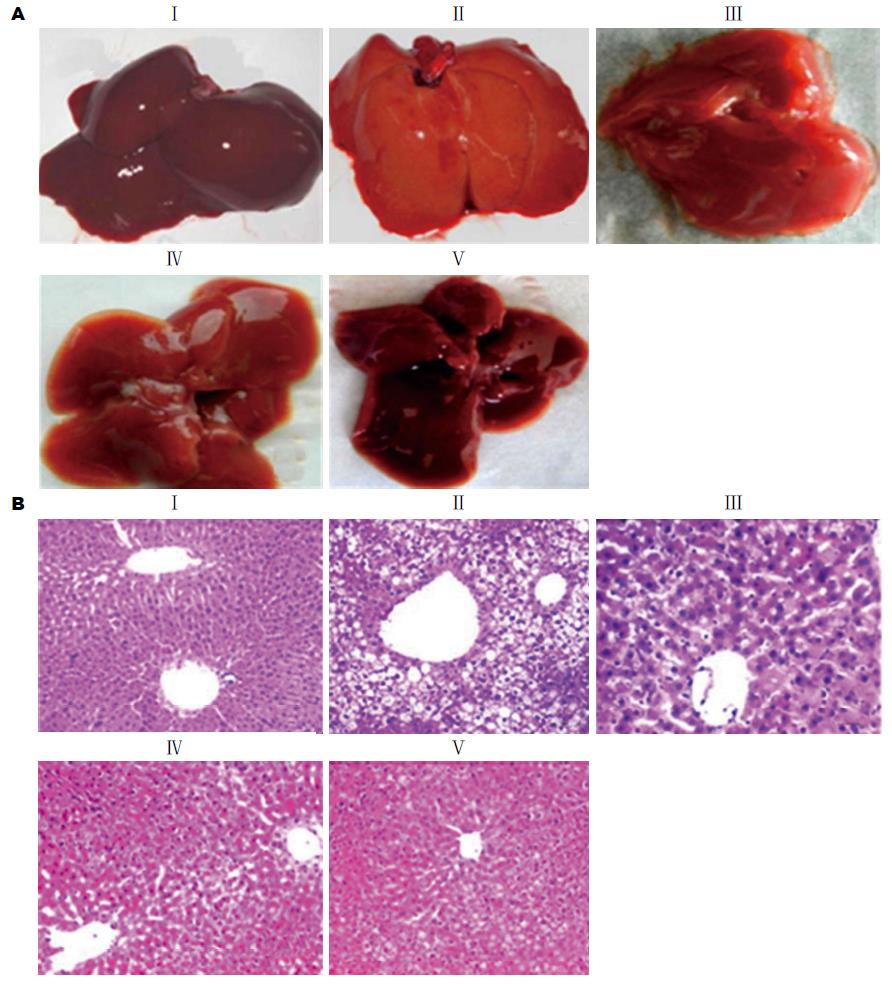
肉眼观Ⅰ组肝脏呈深红色, 表面光滑湿润, 富有弹性(图1AⅠ). Ⅱ组肝脏体积增大, 表面可见黄色坏死病灶(图1AⅡ). 干预组肝脏损伤明显减轻, 并呈剂量依赖性(图1AⅢ-V). 显微镜观, Ⅰ组见正常、清晰和规则的肝小叶组织结构, 及围绕中央静脉的肝细胞单层结构, 细胞质中含有丰富的嗜碱颗粒(图1BⅠ), Ⅱ组肝细胞中严重且广泛存在的脂质空泡, 肝小叶内灶状坏死并出现淋巴细胞浸润(图1BⅡ). 干预组肝脏损伤明显减轻, 呈剂量依赖性(图1BⅢ-V).
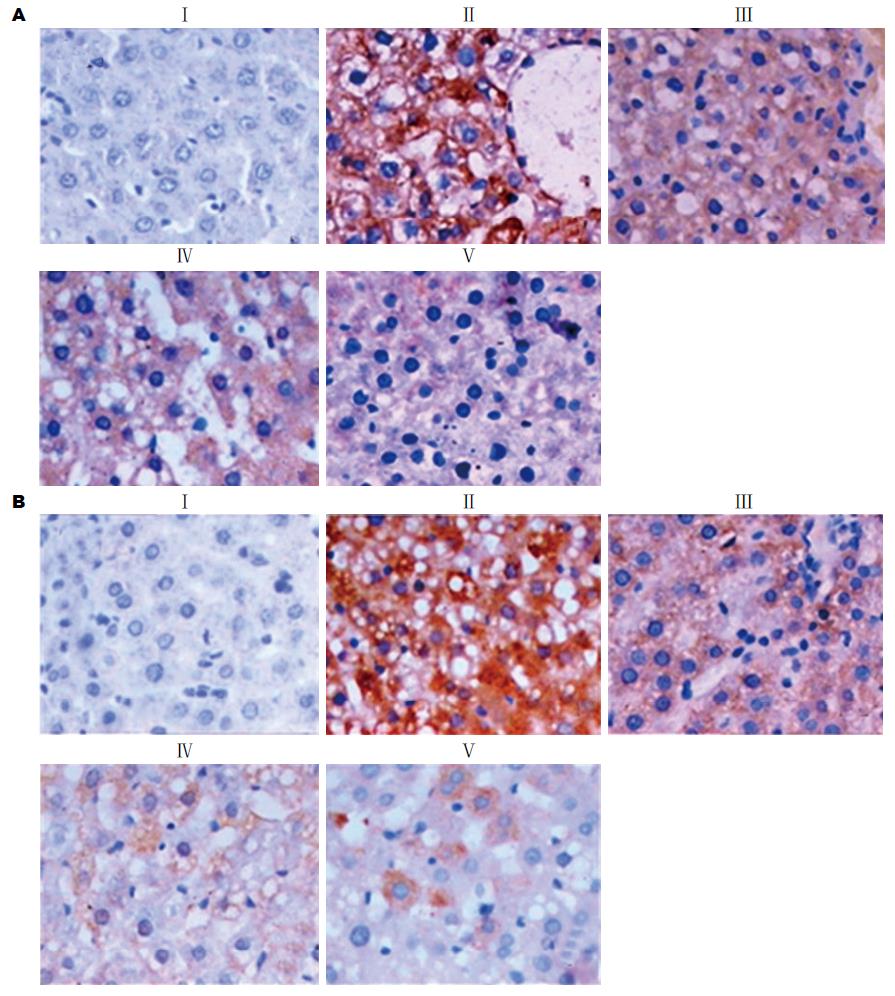
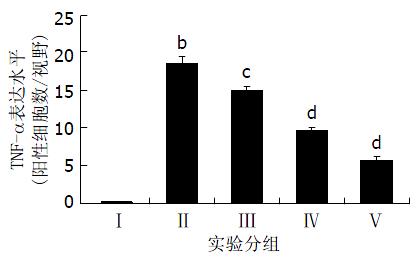
2.3.1 肝组织TNF-α表达检测: 免疫组织化学分析正常组显示最低的TNF-α表达水平(图2AⅠ), 其他各个实验组都显示显著增高的TNF-α表达水平(图2AⅡ-V), Ⅱ组TNF-α表达水平最高(图2AⅡ). 尽管GPS治疗组(200、400和800 mg/kg)TNF-α表达水平明显低于Ⅱ组, 但仍然高于Ⅰ组(图2AⅢ-V). 对SD大鼠肝脏中的TNF-α表达细胞进行定量分析, 结果以mean±SD表示, Ⅱ组与Ⅰ组比较, 有显著差异; 治疗组与Ⅱ组比较, 有显著差异, 且呈剂量依赖性(图3).
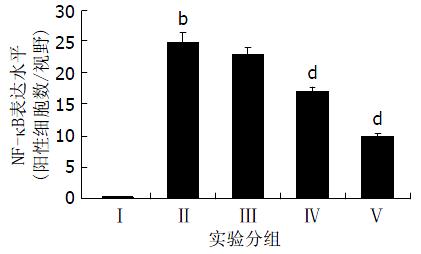
2.3.2 肝组织NF-κB检测: Ⅰ组肝组织显示最低的NF-κB表达水平(图2BⅠ), Ⅱ组NF-κB表达水平最高(P<0.01, 图2BⅡ). GPS治疗组(200、400和800 mg/kg)NF-κB表达水平明显低于Ⅱ组(图2BⅢ-V). 对SD大鼠肝脏中的NF-κB表达细胞进行定量分析, 结果以mean±SD表示, Ⅱ组与Ⅰ组比较, 有显著差异; 治疗组与Ⅱ组比较, 有显著差异, 且呈剂量依赖性(图4).
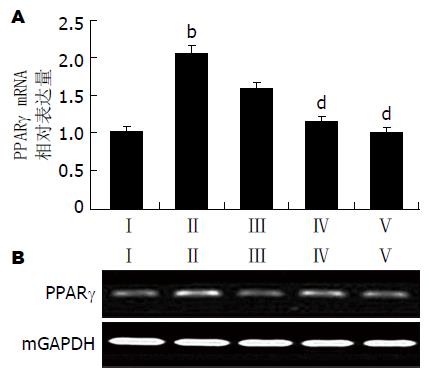
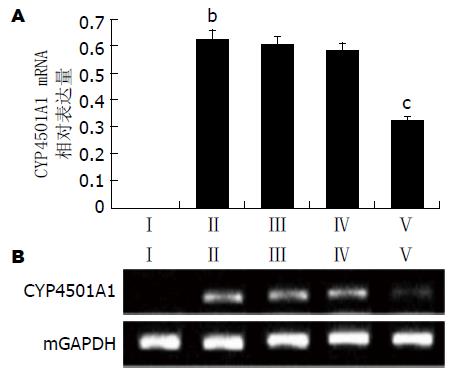
为研究GPS治疗对T2DM-NAFLD模型大鼠的作用机制, 对大鼠GPS治疗前后肝组织PPARγ mRNA和CYP4501A1 mRNA表达变化进行检测. 与Ⅱ组比较, GPS治疗组PPARγ mRNA的表达明显减少, 尤其是Ⅴ组(P<0.01, 图5). 与Ⅰ组比较, Ⅱ组CYP4501A1 mRNA的表达明显上调(P<0.01, 图6). 与Ⅱ组比较, GPS治疗组CYP4501A1 mRNA的表达明显下调, 尤其是Ⅴ组(P<0.05, 图6).
通过HFSD联合胰岛素注射的方法建立SD大鼠T2DM-NAFLD模型是国内外常规的方法, 本研究应用这种得到国内外学术界认同的方法建立T2DM-NAFLD模型. 在此基础上观察不同剂量GPS对T2DM-NAFLD大鼠脂肪肝程度的影响, 并通过检测肝组织有关因子探讨其干预T2DM-NAFLD的机制.
合理膳食, 适量锻炼和必要的药物干预(二甲双胍, 他汀类和贝特类)是治疗NAFLD的主要方法. 但是, 这些方法并没有达到治疗NAFLD的理想效果, 其均有不良反应或有禁忌证, 且无公认的最有效药物疗法[25]. 因此, 寻找治疗NAFLD或NASH有效方法且不良反应轻微的新药物疗法显得尤为迫切. 皂苷被认为是一些民间医药或天然植物药的主要成分, 是天然存在的三萜烯糖苷或类固醇, 具有多种药理学作用或生物学效应. 尤其要指出的是皂苷具有调节动物免疫系统的作用, 具有成为有效疫苗佐剂的潜能[26]. 既往研究证明GPS具有降低T2DM-NAFLD大鼠模型血糖、血脂作用, 并有抑制脂肪肝程度的作用[27-29], 本研究在既往研究的基础上探讨GPS干预T2DM-NAFLD的机制.
TNF-α是一种促炎细胞因子, 在HFSD法诱导T2DM-NAFLD大鼠模型的建立中起主要作用. 肝脏中单核巨噬细胞系统的主要成员枯否细胞是产生TNF-α的主要细胞, 激活枯否细胞能增加TNF-α的表达, 与NAFLD的产生发展密切相关. 既往研究[30]发现T2DM-NAFLD大鼠模型中抑制TNF-α能降低肝中的脂肪存储. 本研究中用TNF-α的免疫组织化学分析评估肝脏的损伤程度, 与对照组相比, 模型组TNF-α表达水平上升, 而GPS治疗组能下调TNF-α的表达. 说明GPS通过抑制TNF-α的表达达到降低T2DM-NAFLD大鼠脂肪肝程度的目的.
NF-κB是一种可被致炎因子和反应性氧介导物激活的转录因子, 调控多种基因产物参与肝脏炎症、肝纤维化及干细胞的再生和凋亡等进程[31], 同时氧自由基又反过来诱导NF-κB的活化, NAFLD大鼠模型NF-κB表达增加, 通过药物干预可以使TNF-α、NF-κB表达水平下降[32]. 本研究与上述结果相似, 且其下降程度呈剂量依赖性.
PPARγ是核激素受体超家族成员, 位于染色体的3p25, 编码核转录因子影响上百种基因的标志物. 之前的研究[33]发现, NASH患者肝脏中PPARγ的水平都出现了升高. PPARγ能增加脂蛋白脂肪酶的表达, 后者分配脂肪到达肝脂肪细胞, 限制脂肪酸流动到肝脏. 在本研究中, 与模型组对比, GPS治疗组PPARγ的表达下调, 证实GPS的护肝机制可能与改善PPARγ的表达密切相关.
CYP4501A1是一种导致活性氧产生的最有效微粒体细胞色素同工酶, 肝脏中的CYP4501A1表达是判断氧化应激程度的主要指标[34]. 本研究发现, 模型组CYP4501A1的表达水平相比于对照组明显升高; 与模型组相比, 小剂量、中剂量的GPS干预虽然可以降低CYP4501A1的表达, 但差异无统计学意义; 大剂量GPS治疗组中CYP4501A1的表达量明显下降, 差异具有统计学意义. 说明抑制CYP4501A1的表达存在剂量依赖性, 抑制机体过氧化需要大剂量的GPS才能实现.
总之, TNF-α、NF-κB、PPARγ、CYP4501A1的表达水平与T2DM-NAFLD的发生发展关系密切, 且TNF-α、NF-κB、PPARγ、CYP4501A1之间相互影响. GPS通过影响这些因子在肝脏的表达, 从而达到干预T2DM-NAFLD脂肪肝程度的作用, 其有望成为治疗该病的专用药物, 值得进一步开展临床试验, 观察临床疗效及不良反应.
由于高营养、高脂饮食、运动量下降, 2型糖尿病并非酒精性脂肪肝(type 2 diabetes mellitus and nonalcoholic fatty liver disease, T2DM-NAFLD)发病率上升, 其导致的终末期肝病、心脑血管病已经成为影响人类健康的重要原因之一. 但到目前为止, 没有治疗非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的专用药物, 寻找和发现用于治疗NAFLD的药物显得十分迫切.
本文显示绞股蓝皂苷(gypenosides, GPS)作为NAFLD治疗药物机制明确, 可作为治疗NAFLD的候选药物. 及时开展毒理和药理研究、临床试验, 确定该药能否可应用于临床, 造福于NAFLD患者是亟待解决的问题.
既往药理研究发现GPS具有调节血脂代谢、抗高脂血症、抗炎、抗氧化、抗糖尿病、护肝等与NAFLD治疗相关作用. 本研究从分子水平进一步明确了GPS治疗NAFLD的机制, 为进一步开展临床毒理和药理研究打下了基础.
本文应用国际上成熟的T2DM-NAFLD模型, 发现GPS通过下调肝组织细胞因子TNF-α、核因子-κB, 以及过氧化物酶体增殖物激活受体γ和细胞色素P4501A1 mRNA的表达对T2DM-NAFLD大鼠肝细胞产生保护作用, 为开展临床研究打下了基础.
GPS是临床常用药物, 本研究在分子水平探索了GPS治疗NAFLD的机制, 为临床应用该药治疗NAFLD打下了基础, 具有广泛的临床应用前景. 研究发现TNF-α与脂肪肝程度相关, 对临床观察NAFLD治疗效果具有重要意义.
2型糖尿病合并非酒精性脂肪肝(T2DM-NAFLD): 一组代谢性疾病综合征, 相关的临床症状还包括胰岛素抵抗、高血压和内脏肥胖, 是在T2DM基础上发生的NAFLD.
刘长征, 副教授, 中国医学科学院基础医学研究所; 刘金钢, 教授, 中国医科大学附属第四医院党政办公室
本文通过动物实验的方法, 探讨了GPS治疗T2DM-NAFLD的机制, 对指导临床应用GPS应用具有指导意义, 对应用TNF-α观察药物疗效也有一定的指导意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Sanyal AJ. NASH: A global health problem. Hepatol Res. 2011;41:670-674. [PubMed] [DOI] |
| 2. | Jou J, Choi SS, Diehl AM. Mechanisms of disease progression in nonalcoholic fatty liver disease. Semin Liver Dis. 2008;28:370-379. [PubMed] [DOI] |
| 3. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 4. | Angulo P. NAFLD, obesity, and bariatric surgery. Gastroenterology. 2006;130:1848-1852. [PubMed] [DOI] |
| 5. | Marchesini G, Brizi M, Morselli-Labate AM, Bianchi G, Bugianesi E, McCullough AJ, Forlani G, Melchionda N. Association of nonalcoholic fatty liver disease with insulin resistance. Am J Med. 1999;107:450-455. [PubMed] [DOI] |
| 6. | Marchesini G, Marzocchi R, Agostini F, Bugianesi E. Nonalcoholic fatty liver disease and the metabolic syndrome. Curr Opin Lipidol. 2005;16:421-427. [PubMed] [DOI] |
| 7. | Park SH, Kim BI, Yun JW, Kim JW, Park DI, Cho YK, Sung IK, Park CY, Sohn CI, Jeon WK. Insulin resistance and C-reactive protein as independent risk factors for non-alcoholic fatty liver disease in non-obese Asian men. J Gastroenterol Hepatol. 2004;19:694-698. [PubMed] [DOI] |
| 8. | Farrell GC. The liver and the waistline: Fifty years of growth. J Gastroenterol Hepatol. 2009;24 Suppl 3:S105-S118. [PubMed] [DOI] |
| 9. | Feneberg A, Malfertheiner P. Epidemic trends of obesity with impact on metabolism and digestive diseases. Dig Dis. 2012;30:143-147. [PubMed] [DOI] |
| 10. | Larter CZ, Chitturi S, Heydet D, Farrell GC. A fresh look at NASH pathogenesis. Part 1: the metabolic movers. J Gastroenterol Hepatol. 2010;25:672-690. [PubMed] [DOI] |
| 11. | Dowman JK, Armstrong MJ, Tomlinson JW, Newsome PN. Current therapeutic strategies in non-alcoholic fatty liver disease. Diabetes Obes Metab. 2011;13:692-702. [PubMed] [DOI] |
| 12. | Bai MS, Gao JM, Fan C. Bioactive dammarane-type triterpenoids derived from the acid hydrolysate of Gynostemma pentaphyllum saponins. Food Chem. 2010;119:306-310. [DOI] |
| 13. | Megalli S, Aktan F, Davies NM, Roufogalis BD. Phytopreventative anti-hyperlipidemic effects of gynostemma pentaphyllum in rats. J Pharm Pharm Sci. 2005;8:507-515. [PubMed] |
| 14. | Shen N, Xu WP, Li M, Ouyang X, Ma J, Luo HZ, Li WD. Effect of five leaf gynostemma herb saponin on lipid metabolism in hyperlipidemia rats. Zhongxiyi Jiehe Xinnaoxueguanbing Zazhi. 2011;9:1081-1083. |
| 15. | la Cour B, Mølgaard P, Yi Z. Traditional Chinese medicine in treatment of hyperlipidaemia. J Ethnopharmacol. 1995;46:125-129. [PubMed] [DOI] |
| 16. | Wang QF, Chen JC, Hsieh SJ, Cheng CC, Hsu SL. Regulation of Bcl-2 family molecules and activation of caspase cascade involved in gypenosides-induced apoptosis in human hepatoma cells. Cancer Lett. 2002;183:169-178. [PubMed] [DOI] |
| 17. | Chen JC, Lu KW, Tsai ML, Hsu SC, Kuo CL, Yang JS, Hsia TC, Yu CS, Chou ST, Kao MC. Gypenosides induced G0/G1 arrest via CHk2 and apoptosis through endoplasmic reticulum stress and mitochondria-dependent pathways in human tongue cancer SCC-4 cells. Oral Oncol. 2009;45:273-283. [PubMed] [DOI] |
| 18. | Lin JJ, Hsu HY, Yang JS, Lu KW, Wu RS, Wu KC, Lai TY, Chen PY, Ma CY, Wood WG. Molecular evidence of anti-leukemia activity of gypenosides on human myeloid leukemia HL-60 cells in vitro and in vivo using a HL-60 cells murine xenograft model. Phytomedicine. 2011;18:1075-1085. [PubMed] [DOI] |
| 19. | Quan Y, Qian MZ. [Effect and mechanism of gypenoside on the inflammatory molecular expression in high-fat induced atherosclerosis rats]. Zhongguo Zhongxiyi Jiehe Zazhi. 2010;30:403-406. [PubMed] |
| 20. | Li L, Jiao L, Lau BH. Protective effect of gypenosides against oxidative stress in phagocytes, vascular endothelial cells and liver microsomes. Cancer Biother. 1993;8:263-272. [PubMed] [DOI] |
| 21. | Aktan F, Henness S, Roufogalis BD, Ammit AJ. Gypenosides derived from Gynostemma pentaphyllum suppress NO synthesis in murine macrophages by inhibiting iNOS enzymatic activity and attenuating NF-kappaB-mediated iNOS protein expression. Nitric Oxide. 2003;8:235-242. [PubMed] [DOI] |
| 22. | Yeo J, Kang YJ, Jeon SM, Jung UJ, Lee MK, Song H, Choi MS. Potential hypoglycemic effect of an ethanol extract of Gynostemma pentaphyllum in C57BL/KsJ-db/db mice. J Med Food. 2008;11:709-716. [PubMed] [DOI] |
| 23. | Chen JC, Tsai CC, Chen LD, Chen HH, Wang WC. Therapeutic effect of gypenoside on chronic liver injury and fibrosis induced by CCl4 in rats. Am J Chin Med. 2000;28:175-185. [PubMed] [DOI] |
| 24. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 25. | Raszeja-Wyszomirska J, Lawniczak M, Marlicz W, Miezyńska-Kurtycz J, Milkiewicz P. [Non-alcoholic fatty liver disease--new view]. Pol Merkur Lekarski. 2008;24:568-571. [PubMed] |
| 26. | Kukhetpitakwong R, Hahnvajanawong C, Homchampa P, Leelavatcharamas V, Satra J, Khunkitti W. Immunological adjuvant activities of saponin extracts from the pods of Acacia concinna. Int Immunopharmacol. 2006;6:1729-1735. [PubMed] [DOI] |
| 28. | 闵 怀臻, 贺 琴, 李 金科, 任 永生, 谭 华炳. 绞股蓝皂苷对2型糖尿病并NAFLD大鼠肝组织TNF-αmRNA表达和血硫化氢的影响. 湖北医药学院学报. 2013;32:317-324. |
| 30. | Gao HY, Huang J, Wang HY, Du XW, Cheng SM, Han Y, Wang LF, Li GY, Wang JH. Protective effect of Zhuyeqing liquor, a Chinese traditional health liquor, on acute alcohol-induced liver injury in mice. J Inflamm (Lond). 2013;10:30. [PubMed] [DOI] |
| 31. | Malaguarnera M, Di Rosa M, Nicoletti F, Malaguarnera L. Molecular mechanisms involved in NAFLD progression. J Mol Med (Berl). 2009;87:679-695. [PubMed] [DOI] |
| 33. | Wang J, Guo X, Wu P, Song J, Ye C, Yu S, Zhang J, Dong W. Association between the Pro12Ala polymorphism of PPAR-γ gene and the non-alcoholic fatty liver disease: a meta-analysis. Gene. 2013;528:328-334. [PubMed] [DOI] |
| 34. | Weltman MD, Farrell GC, Hall P, Ingelman-Sundberg M, Liddle C. Hepatic cytochrome P450 2E1 is increased in patients with nonalcoholic steatohepatitis. Hepatology. 1998;27:128-133. [PubMed] [DOI] |