修回日期: 2015-12-19
接受日期: 2015-12-29
在线出版日期: 2016-01-28
目的: 探讨肝硬化门静脉高压症伴血小板重度降低患者行脾切除并贲门周围血管离断术的可行性.
方法: 回顾性分析郑州大学第一附属医院肝胆胰外科2009-09/2014-09收治的脾切除并贲门周围血管离断术患者的临床资料. 根据术前血小板降低程度分为重度、中度、轻度3组, 对比分析3组患者的临床资料.
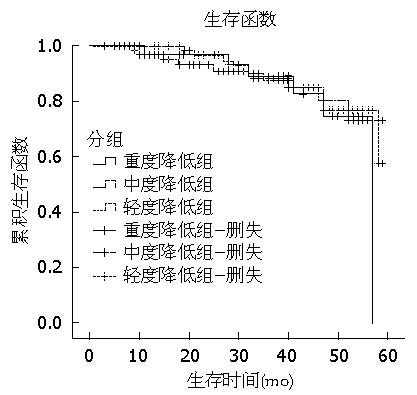
结果: 184例患者的临床资料纳入分析, 3组患者基线临床资料匹配(P>0.05); 血小板重度降低组术后血小板计数恢复至正常范围内所用时间为10 d, 较轻度、重度组长; 血小板重度降低组患者术后3 d日平均引流量(950 mL±279 mL)、血红蛋白丢失量(46.6 g±7.4 g)、住院天数(16.0 d±3.5 d), 均大于中度组与轻度组, 且差异均有统计学意义(P<0.01); 血小板重度降低组患者再出血率、Ⅰ/Ⅱ级及Ⅲ/Ⅳ级门静脉血栓形成率分别为11.62%、23.26%和4.65%, 3组之间差异无统计学意义(P>0.05); 血小板重度降低组患者术后1年、3年和5年的生存率分别为95.3%、88.4%和76.7%, 3组之间差异无统计学意义(P>0.05).
结论: 肝硬化门静脉高压症并重度血小板降低的患者, 通过积极的围手术期处理, 脾切除并贲门周围血管离断术可能是安全可行的.
核心提示: 在门静脉高压症并血小板重度降低患者中, 药物或内镜治疗效果不佳, 再次出血风险仍然较大的情况下, 通过充分的术前评估及积极的围手术期处理, 脾切除并贲门周围血管离断术仍是可行的临床治疗选择.
引文著录: 何淑赛, 李德旭, 王扬, 马正来, 金俊硕. 肝硬化门静脉高压症并血小板重度降低患者行脾切断流术的可行性. 世界华人消化杂志 2016; 24(3): 436-442
Revised: December 19, 2015
Accepted: December 29, 2015
Published online: January 28, 2016
AIM: To evaluate the feasibility of splenectomy with pericardial de-vascularization in patients with intra-hepatic portal hypertension and severe thrombocytopenia.
METHODS: We retrospectively analyzed the clinical data of patients who had undergone splenectomy with pericardial de-vascularization from September 2009 to September 2014 at the Department of Hepatopancreatobiliary Surgery, the First Affiliated Hospital of Zhengzhou University. According to the severity of thrombocytopenia, patients were divided into three groups: severe, moderate and mild groups.
RESULTS: A total of 184 patients were included in the analysis; the baseline characteristics of the three groups were matched (P > 0.05). For the severe group, it took 10 days for platelet return to normal range after surgery, and the time was longer than that for the moderate and mild groups. The average drainage volume within 3 days after surgery, intraoperatve blood loss and length of hospital stay in the severe group were 950 mL ± 279 mL, 46.6 g ± 7.4 g and 16.0 d ± 3.5 d, respectively; these values were significantly higher than those in the other two groups (P < 0.01). The bleeding rate and the rates of grade Ⅰ/Ⅱ and grade Ⅲ/Ⅳ portal vein thrombosis in the severe group were 11.62%, 23.26% and 4.65%, respectively, and these value were significantly higher than those in the other two groups (P > 0.05). The cumulative survival rates at 1 year, 3 years, and 5 years were 95.3%, 88.4% and 76.7%, respectively, and there were no significant differences in the three groups (P > 0.05).
CONCLUSION: Through aggressive perioperative management, splenectomy and pericardial de-vascularization may be feasible in patients with portal hypertension and severe thrombocytopenia.
- Citation: He SS, Li DX, Wang Y, Ma ZL, Jin JS. Feasibility of splenectomy with pericardial devascularization in patients with cirrhosis portal hypertension and severe thrombocytopenia. Shijie Huaren Xiaohua Zazhi 2016; 24(3): 436-442
- URL: https://www.wjgnet.com/1009-3079/full/v24/i3/436.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i3.436
门静脉高压症并发上消化道出血严重威胁肝硬化患者的生命, 目前指南推荐的治疗方式以药物与内镜为主, 对于内镜治疗后反复出血或难治性出血的病例, 外科手术干预仍为最有效的选择[1]. 目前手术方式最常见的即为脾切除+贲门周围血管离断术[2,3], 但血小板重度降低患者行此手术的出血程度、渗血风险尚无确切结论, 国内外有学者认为, 患者血小板计数低于50×109/L时, 剖腹手术极易出血, 甚至对手术治疗提出质疑[4], 我们通过对近年来行手术治疗的门静脉高压症并血小板重度降低患者的临床资料进行回顾性分析, 初步探讨脾切除并贲门周围血管离断术在此类患者中的可行性.
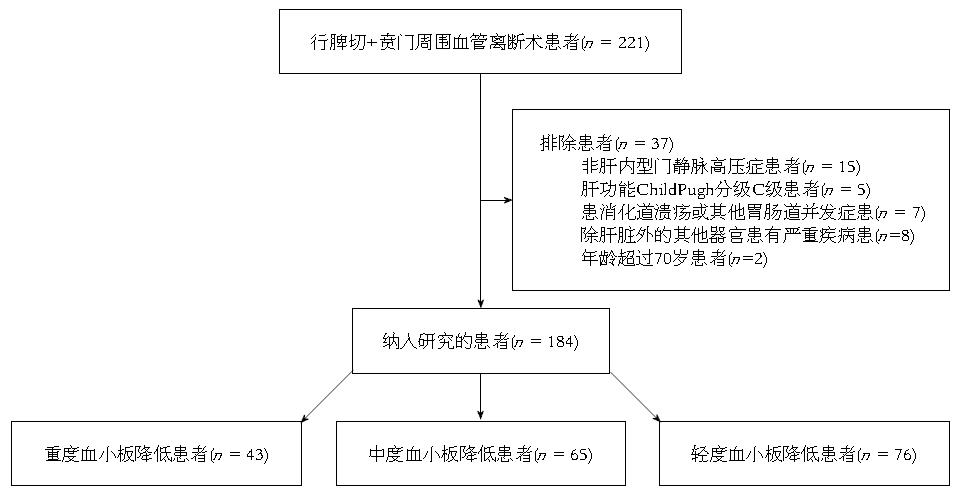
收集2009-09/2014-09郑州大学第一附属医院肝胆胰外科肝硬化门静脉高压症行脾切除并贲门周围血管离断术患者的221例临床资料. 纳入分析的标准包括门静脉高压合并食管胃底静脉中重度曲张、脾肿大并脾功能亢进患者. 所有病例均经胃镜检查, 明确食管胃底静脉曲张诊断及严重程度分级. 依据患者术前腹部计算机断层扫描(computed tomography, CT)平扫和增强、白细胞及血小板水平确定脾功能亢进诊断. 依据影像检查及生化指标确定肝功能Child-Pugh分级、APRI评分及FIB4评分. 排除标准: (1)非肝硬化原因引起的门静脉高压症患者; (2)肝功能ChildPugh分级为C级的患者; (3)患有消化道溃疡或其他胃肠道并发症的患者; (4)除肝脏外其他重要器官患有严重疾病的患者; (5)年龄超过70岁. 筛选流程如图1所示, 共184例患者纳入研究, 其中男性119例, 女性65例, 平均年龄48岁±2.1岁; 乙型肝炎肝硬化128例, 丙型肝炎肝硬化48例, 酒精性肝硬化8例; 食管胃底静脉曲张程度中, 重度108例, 中度71例, 轻度5例, 其中伴红色征179例.
1.2.1 手术方式及术后抗凝: 所有患者均行经典标准化的脾切除+贲门周围血管离断术[5]. 所有患者均于术后24 h判断无活动性出血后给予抗凝治疗, 方案为低分子右旋糖酐500 mL/L静脉滴注, 48 h后应用低分子肝素钙, 每12 h皮下注射4100 U, 应用710 d.
1.2.2 血小板分层及检测: 血小板减少程度分级: 根据术前血小板减少程度分为重度(<30×109/L)、中度(30×109/L-50×109/L)、轻度(>50×109/L)3组[6]. 血小板检测均采用Sysmex XE-2100血液分析仪(希森美康公司, 日本).
1.2.3 门静脉血栓分型: 根据Yeld分型[7]将血栓分为以下四个等级: Ⅰ级, 血栓面积<50%门静脉管腔面积的微小血栓或附壁血栓, 且未蔓延至肠系膜上静脉; Ⅱ级, 血栓面积>50%门静脉管腔面积的有或没有蔓延至肠系膜上静脉的血栓, 包括门静脉完全闭塞型; Ⅲ级, 门静脉全段及肠系膜上静脉近端血栓形成且完全闭塞, 但肠系膜上静脉远端通畅; Ⅳ级, 门静脉全段、肠系膜上静脉近端及远端血栓形成且完全闭塞.
1.2.4 术后随访: 经手术治疗后进行1-5年随访, 随访主要通过门诊复查及电话问讯, 以患者死亡、再出血、门静脉血栓形成记为终点事件发生, 失访患者记为数据的删失.
1.2.5 观察指标: 3组患者术前及术后第1、3、5、7、10天的血小板计数; 3组患者术中出血量、手术时间、术后3 d平均引流量、血红蛋白丢失量及住院天数; 3组患者术后再出血率、Yeld分级中Ⅰ/Ⅱ级及Ⅲ/Ⅳ级门静脉血栓形成率和术后1、3、5年的累积生存率.
统计学处理 连续型变量采用mean±SD的表达方式, 如果数据符合正态分布且方差齐, 采用t检验, 如果正态方差不齐采用校正的t检验, 如果非正态分布采用秩和检验; 计数资料采用百分率的表达方式, 比较采用χ2检验(其中两两比较采用Fisher确切概率法); 3组定量资料间的比较采用单因素方差分析(其中两两比较采用LSD-t检验); 累积生存率的计算采用Kaplan-Meier法并行Log-rank检验. 所有数据使用SPSS18.0统计软件分析, 行双侧检验, P<0.05为差异具有统计学意义.
共184例患者纳入分析, 3组患者临床特征匹配. 血小板重度降低组43例, 血小板术前最低值为14×109/L, 其中37例为择期手术, 即经药物及内镜治疗效果不佳反复出血, 6例为上消化道出血急诊手术(表1).
| 分组 | 重度组(n = 43) | 中度组(n = 65) | 轻度组(n = 76) | 统计量 | P值 |
| 年龄(岁) | 46.4±7.4 | 49.9±10.1 | 47.6±6.9 | F = 0.316 | 0.792 |
| 男:女 | 27:16 | 44:21 | 51:25 | χ2 = 0.079 | 0.778 |
| BMI(<25 kg/m2) | 11(25.6) | 16(24.6) | 19(25) | χ2 = 0.013 | 0.908 |
| 最近呕血距本次手术时间(d) | 25.5±17.0 | 20.5±18.0 | 21.3±17.7 | F = 0.642 | 0.559 |
| ALT(U/L) | 49.3±30.0 | 48.8±23.9 | 56.8±23.6 | F = 0.363 | 0.698 |
| AST(U/L) | 41.1±16.3 | 37.1±16.0 | 37.6±7.5 | F = 0.295 | 0.747 |
| PT(s) | 15.1±1.2 | 15.7±4.2 | 14.7±4.3 | F = 0.075 | 0.928 |
| TBiL(μmol/L) | 21.6±5.5 | 22.2±3.3 | 22.3±4.4 | F = 0.084 | 0.920 |
| ALB(g/L) | 34.8±2.9 | 35.8±3.4 | 35.2±4.3 | F = 0.216 | 0.807 |
| PA(g/L) | 142.1±42.6 | 145.8±24.6 | 147.1±14.0 | F = 0.135 | 0.874 |
| CP分值 | 8.8±0.5 | 9.0±0.7 | 8.8±0. 6 | F = 0.012 | 0.912 |
| APRI评分 | 2.63±1.54 | 2.35±1.73 | 2.5±1.91 | F = 0.744 | 0.519 |
| FIB4评分 | 2.6±1.9 | 2.1±1.5 | 2.3±1.4 | F = 0.732 | 0.524 |
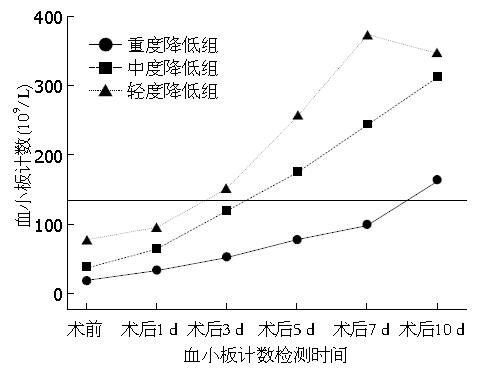
血小板重度、中度、轻度降低组, 血小板计数分别于术后第3天、第5天和第10天上升至正常范围(>135×109/L). 重度组患者术后血小板计数恢复至正常范围所需时间为最长, 轻度组患者所需时间最短; 3组患者术后血小板计数比较中, 第1天和第3天3组之间均无差异(P>0.05), 术后第5、7、10天3组之间均出现差异(P<0.05). 亚组分析表明, 术后第5天和第7天, 重度与中度、重度与轻度、中度与轻度组间差异均具有统计学意义(P<0.05); 术后第10天, 重度与中度、重度与轻度组间差异均具有统计学意义(P<0.05), 中度与轻度组间差异无统计学意义(P>0.05)(图2).
血小板重度、中度和轻度降低3组患者, 术后3 d平均引流量分别为469 mL±84 mL、442 mL±81 mL和443 mL±72 mL, 血红蛋白丢失量分别为46.6 g±7.4 g、27.9 g±4.2 g和25.9 g±3.1 g, 住院天数分别为16.0 d±3.5 d、11.9 d±1.7 d和12.3 d±2.0 d; 重度降低组术后3 d平均引流量、血红蛋白减少量及住院天数显著多于中度和轻度降低组, 3组患者之间进行比较, 其差异有统计学意义(F = 20.761、56.617、9.539, P<0.01); 亚组分析显示, 重度与中度、重度与轻度组间术后3 d平均引流量、血红蛋白减少量及住院天数的差异均具有统计学意义(P<0.01), 中度与轻度组比较差异无统计学意义(P>0.05); 3组间比较术中出血量及手术时间差异无统计学意义(P>0.05)(表2).
随访期间术后再次发生呕血或黑便者共20例, 其中重度组11.62%(5/43), 中度组10.76%(7/65), 轻度组10.52%(8/76), 3组之间对比差异无统计学意义(F = 0.035, P>0.05). 重度、中度和轻度3组患者术后Ⅰ/Ⅱ级门静脉血栓形成率分别为23.26%(8/43)、20.00%(13/65)和21.05%(16/76), 3组之间差异无统计学意义(F = 0.103, P>0.05); Ⅲ/Ⅳ级门静脉血栓形成率分别为4.65%(2/43)、3.07%(2/65)和2.63%(2/76), 3组之间差异无统计学意义(F = 0.059, P>0.05)(表3).
| 临床指标 | 重度组(n = 43) | 中度组(n = 65) | 轻度组(n = 76) | F值 | P值 |
| 再出血率 | 11.62(5/43) | 10.76(7/65) | 10.52(8/76) | 0.035 | 0.982 |
| Ⅰ/Ⅱ级门静脉血栓形成率 | 23.26(8/43) | 20.00(13/65) | 21.05(16/76) | 0.103 | 0.950 |
| Ⅲ/Ⅳ级门静脉血栓形成率 | 4.65(2/43) | 3.07(2/65) | 2.63(2/76) | 0.059 | 0.971 |
现肝硬化门静脉高压症并发症治疗策略的选择已呈现多样化的趋势. 我国慢性肝炎后肝硬化是门静脉高压的主要发病原因, 其并发症中上消化道静脉曲张破裂出血最为凶险, 且治疗后再出血率高, 尽管70%-80%的患者可以通过非选择性β受体阻滞剂联合内镜套扎术使出血得到有效控制, 但20%-30%的患者却仍然需要进一步的临床治疗[8]. 近年来, 经颈静脉肝内门体静脉分离术(transjugular intrahepatic portosystemic stent shunt, TIPS)得到迅速的推广[9], 但止血失败率为10%-20%, 且TIPS术后30%的患者可并发肝性脑病[10,11]. 在中国, 由于肝源的短缺, 多数难治性上消化道出血患者没有机会行肝移植术, 因此, 在这种情况下, 开放外科手术是必要的, 并且可能是唯一有效控制出血的方法, 目前国内开展最多的即为脾切断流术, 该术式能够在直视下确切地控制出血, 维持营养肝细胞的向肝血流, 对患者肝功能储备要求相对较低, 适用于急诊手术并且在临床实践中广泛应用[12,13].
血小板重度降低患者的手术治疗饱受争议. 有国外学者认为患者血小板计数重度降低时不宜行外科手术治疗[14,15], 他们提出血小板下降程度直接影响术后并发症的发生率, 但是也有学者认为血小板重度降低患者在积极术前准备的前提下可行开腹手术治疗[16]. 我们的研究显示, 通过手术治疗后3组患者术后10 d内血小板均上升至正常范围, 脾功能亢进均在一定程度上得到改善, 但血小板重度降低组患者上升至正常范围所需时间较长, 这可能提示我们, 在临床实践中, 血小板重度降低患者术后抗凝或抗血小板治疗的起始时间需要相对后延. 血小板重度降低组患者术后3 d平均引流量、术中血红蛋白丢失量、住院天数均较中度组和轻度组差, 由此可以推测, 术前病情准确评估及围手术期积极对症治疗对于术后的恢复至关重要[17], 如肝功能不良的患者应加强护肝治疗, 改善肝功能, 凝血机制障碍者需要积极对症支持治疗. 同时可能间接反映了血小板重度降低并非脾切断流的绝对禁忌.
门静脉血栓形成被认为是脾切断流术后的一个潜在致命并发症, 在术后评估中占有很重要的地位. 门静脉血栓的临床表现可以是无症状、发热、腹痛、恶心、呕吐及肠梗阻[18,19], 门静脉血栓形成及其延展会进一步提高门静脉压力以及恶化肝功能[20]. 目前关于深静脉血栓和肺栓塞的防治已趋于完善[21], 而针对门静脉血栓的研究仍尚无明确定论; 此外, 有研究[22]表明, 未经临床干预治疗的门静脉高压症并发上消化道出血的患者, 2年内再次出血概率为65%. 我们的研究结果显示, 血小板重度降低患者术后再出血率、附壁血栓形成率与中度、轻度降低组相比无差异, 这可能提示血小板重度降低患者行脾切断流术后不会反跳性引起血栓形成而导致风险上升. 5年累积生存率差异无统计学意义, 可能也说明患者术后生存时间并没有明显受到血小板重度降低的影响. 即便如此, 但并不提倡把脾切断流术作为门脉高压伴血小板重度降低患者出血的首选措施, 而强调在现有医疗资源可用的情况下, 在保守及内镜治疗无效时采用. 同样, 我们的研究也有一些局限性, 不同地区的疗效受医疗资源可用性的影响, 并且回顾性研究设计的局限并没有涉及到门静脉血流速度及门静脉压力的测定.
总之, 在门静脉高压症并血小板重度降低患者中, 药物或内镜治疗效果不佳, 再次出血风险仍然较大的情况下, 通过充分的术前评估及积极的围手术期处理, 脾切除并贲门周围血管离断术仍是可行的临床治疗选择; 虽然最佳的治疗策略尚需进一步的研究探讨, 但仅仅以血小板重度降低而放弃手术治疗可能还有待商榷.
对于门静脉高压症并发上消化道出血且内镜治疗后反复出血患者, 目前外科手术干预可能为最有效的选择, 但血小板重度降低患者行此手术的出血程度、渗血风险尚无确切结论, 国内外有学者认为, 患者血小板计数较低时, 剖腹手术极易出血, 甚至对手术治疗提出质疑.
褚海波, 主任医师, 中国人民解放军第89医院普外中心; 谢敏, 主任医师, 南京大学医学院附属鼓楼医院普外科
目前对于门静脉高压症伴血小板重度降低患者是否行手术治疗仍饱受争议, 且针对脾切除并贲门周围血管离断术后门静脉血栓形成的研究尚无明确定论, 本文回顾性对比探讨了患者行手术治疗的预后情况, 具有一定的前瞻性.
据国内外文献报道, 在药物及内镜治疗效果不佳时, 开放外科手术是必要的, 可能是唯一有效控制出血的方法, 并且外科手术方法对患者肝功能储备要求相对较低.
本次临床研究依据患者血小板减少程度分为重度组、中度组及轻度组3组, 重点对比分析3组患者的临床数据, 对门静脉高压症伴重度血小板降低患者的手术可行性评估更为直观.
目前对于门静脉高压症患者, 血小板计数的重度降低仍对临床治疗方式的选择影响较大, 甚至有学者认为在反复或难以控制出血的情况下仍规避外科手术治疗, 本文对临床治疗具有一定的导向作用.
本文题涉及门静脉高压症血小板减少脾切除术的安全性及切脾后门静脉血栓的发生率, 本组研究没涉及门静脉压力与脾亢程度的相关性是一缺憾.
编辑: 于明茜 电编: 都珍珍
| 1. | Tripathi D, Stanley AJ, Hayes PC, Patch D, Millson C, Mehrzad H, Austin A, Ferguson JW, Olliff SP, Hudson M. U.K. guidelines on the management of variceal haemorrhage in cirrhotic patients. Gut. 2015;64:1680-1704. [PubMed] [DOI] |
| 3. | Zhang Y, Wen TF, Yan LN, Yang HJ, Deng XF, Li C, Wang C, Liang GL. Preoperative predictors of portal vein thrombosis after splenectomy with periesophagogastric devascularization. World J Gastroenterol. 2012;18:1834-1839. [PubMed] [DOI] |
| 4. | Maithel SK, Kneuertz PJ, Kooby DA, Scoggins CR, Weber SM, Martin RC, McMasters KM, Cho CS, Winslow ER, Wood WC. Importance of low preoperative platelet count in selecting patients for resection of hepatocellular carcinoma: a multi-institutional analysis. J Am Coll Surg. 2011;212:638-648; discussion 648-650. [PubMed] [DOI] |
| 6. | Djordjević J, Svorcan P, Vrinić D, Dapcević B. [Splenomegaly and thrombocytopenia in patients with liver cirrhosis]. Vojnosanit Pregl. 2010;67:166-169. [PubMed] [DOI] |
| 7. | Yerdel MA, Gunson B, Mirza D, Karayalçin K, Olliff S, Buckels J, Mayer D, McMaster P, Pirenne J. Portal vein thrombosis in adults undergoing liver transplantation: risk factors, screening, management, and outcome. Transplantation. 2000;69:1873-1881. [PubMed] [DOI] |
| 8. | Henderson JM, Boyer TD, Kutner MH, Galloway JR, Rikkers LF, Jeffers LJ, Abu-Elmagd K, Connor J. Distal splenorenal shunt versus transjugular intrahepatic portal systematic shunt for variceal bleeding: a randomized trial. Gastroenterology. 2006;130:1643-1651. [PubMed] [DOI] |
| 9. | Bari K, Garcia-Tsao G. Treatment of portal hypertension. World J Gastroenterol. 2012;18:1166-1175. [PubMed] [DOI] |
| 10. | Peter P, Andrej Z, Katarina SP, Manca G, Pavel S. Hepatic encephalopathy after transjugular intrahepatic portosystemic shunt in patients with recurrent variceal hemorrhage. Gastroenterol Res Pract. 2013;2013:398172. [PubMed] [DOI] |
| 11. | Funes FR, Silva Rde C, Arroyo PC, Duca WJ, Silva AA, Silva RF. Mortality and complications in patients with portal hypertension who underwent transjugular intrahepatic portosystemic shunt (TIPS) - 12 years experience. Arq Gastroenterol. 2012;49:143-149. [PubMed] [DOI] |
| 12. | Murata K, Ito K, Yoneda K, Shiraki K, Sakurai H, Ito M. Splenectomy improves liver function in patients with liver cirrhosis. Hepatogastroenterology. 2008;55:1407-1411. [PubMed] |
| 14. | Burcham P, Blais D, Firstenberg MS. Platelet inhibition and surgical bleeding. A plea for more science and evidence-based guidelines. Circ J. 2011;75:2751-2752. [PubMed] [DOI] |
| 15. | Delaney M, Meyer E, Cserti-Gazdewich C, Haspel RL, Lin Y, Morris A, Pavenski K, Dzik WH, Murphy M, Slichter S. A systematic assessment of the quality of reporting for platelet transfusion studies. Transfusion. 2010;50:2135-2144. [PubMed] [DOI] |
| 16. | Yoneoka Y, Tokita K, Yamauchi JI, Takeda N, Ohta H, Shindo T. Successful management for spontaneous intracranial haemorrhage under critical thrombocytopenia (platelets & lt; 1000/mm(3)) due to adolescence-onset idiopathic thrombocytopenic purpura. Acta Neurochir (Wien). 2004;146:199-201. [PubMed] [DOI] |
| 17. | Witters P, Freson K, Verslype C, Peerlinck K, Hoylaerts M, Nevens F, Van Geet C, Cassiman D. Review article: blood platelet number and function in chronic liver disease and cirrhosis. Aliment Pharmacol Ther. 2008;27:1017-1029. [PubMed] [DOI] |
| 18. | Li MX, Zhang XF, Liu ZW, Lv Y. Risk factors and clinical characteristics of portal vein thrombosis after splenectomy in patients with liver cirrhosis. Hepatobiliary Pancreat Dis Int. 2013;12:512-519. [PubMed] [DOI] |
| 19. | Rattner DW, Ellman L, Warshaw AL. Portal vein thrombosis after elective splenectomy. An underappreciated, potentially lethal syndrome. Arch Surg. 1993;128:565-569; discussion 565-569. [PubMed] [DOI] |
| 20. | D'Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology. 2003;38:599-612. [PubMed] [DOI] |
| 21. | Bates SM, Jaeschke R, Stevens SM, Goodacre S, Wells PS, Stevenson MD, Kearon C, Schunemann HJ, Crowther M, Pauker SG. Diagnosis of DVT: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141:e351S-e418S. [PubMed] [DOI] |
| 22. | Sharara AI, Rockey DC. Gastroesophageal variceal hemorrhage. N Engl J Med. 2001;345:669-681. [PubMed] [DOI] |