修回日期: 2015-10-21
接受日期: 2015-12-21
在线出版日期: 2016-01-28
目的: 研究血管内皮生长因子165b(vascular endothelial growth factor 165b, VEGF165b)在肝细胞癌和正常肝组织中的表达情况, 初步探讨其与肝细胞癌的关系和作用机制.
方法: 用免疫组织化学法检测28例肝细胞癌组织和30例正常肝组织中VEGF165b蛋白的表达情况; 用RT-PCR法分别检测肝细胞癌和正常肝组织中VEGF165b和VEGF165 mRNA的表达情况. 用Western blot法检测上述肝细胞癌组织和正常肝组织中VEGF165b和VEGF165蛋白的表达情况. 用Western blot法检测上述肝细胞癌和正常肝组织中FAK和P-Akt蛋白的表达情况.
结果: 正常肝脏组织中VEGF165b蛋白表达率为96.67%(29/30), 肝细胞癌组织中VEGF165b蛋白的表达率为21.4%(6/28), 表达差异有统计学意义(P<0.05). VEGF165b mRNA和蛋白在肝癌组织中的表达明显低于正常肝脏组织的表达(P<0.01). VEGF165 mRNA和蛋白在肝癌组织中的表达明显高于正常肝脏组织的表达(P<0.01). FAK和P-Akt蛋白在肝癌组织中的表达明显高于正常肝脏组织的表达(P<0.01).
结论: VEGF165b在肝细胞癌组织中的表达明显低于正常肝组织的表达, 而VEGF165和FAK、P-Akt在肝细胞癌组织中的表达明显高于正常肝组织的表达. 提示VEGF165b与肝癌发生、发展有关, 其机制可能是VEGF165b抑制VEGF165、FAK和P-Akt表达及他们的促进血管生成、肿瘤生长作用.
核心提示: 目前对血管内皮生长因子(vascular endothelial growth factor, VEGF)165b和肿瘤相关性的研究不是很多, 还未见对VEGF165b和肝癌的相关研究的报道. 本文对VEGF165b在肝癌和正常肝组织中表达差异进行了研究, 同时对其信号传导通路中的蛋白进行的检测, 初步阐述了VEGF165b和肝癌的关系以及其作用机制.
引文著录: 赵燕颖, 李亚刚, 颜波群, 刘志忠, 秦国涛, 孙远杰. VEGF165b在肝细胞癌中的表达及其作用机制. 世界华人消化杂志 2016; 24(3): 355-361
Revised: October 21, 2015
Accepted: December 21, 2015
Published online: January 28, 2016
AIM: To detect the expression of vascular endothelial growth factor 165b (VEGF165b) in hepatocellular carcinoma (HCC), and to investigate the relationship between VEGF165b and HCC.
METHODS: Expression of VEGF165b protein in 28 HCC specimens and 30 normal liver tissue specimens was detected by immunohistochemistry. The expression of VEGF165 and VEGF165b mRNAs was detected by RT-PCR. The expression of VEGF165, VEGF165b, FAK and P-Akt proteins in HCC and normal liver tissues was detected by Western blot.
RESULTS: The positive rate of VEGF165b protein expression in normal liver tissues was significantly higher than that in HCC tissues [96.67% (29/30) vs 21.4% (6/28), P < 0.05]. VEGF165b mRNA and protein expression in HCC tissues was significantly lower than that in normal liver tissues (P < 0.01). The expression of VEGF165 mRNA and protein in HCC tissues was significantly higher than that in normal liver tissues (P < 0.01). The expression of FAK and P-Akt proteins in HCC tissues was significantly higher than that in normal liver tissues (P < 0.01).
CONCLUSION: The expression of VEGF165b in HCC tissues is significantly lower than that in normal liver tissues, and the expression of VEGF165, FAK and P-Akt in HCC tissues is significantly higher than that in normal liver tissues. These findings suggest that VEGF165b may be related to the occurrence and development of HCC possibly by inhibiting the expression of VEGF165, FAK and P-Akt and their effects on angiogenesis and tumor growth.
- Citation: Zhao YY, Li YG, Yan BQ, Liu ZZ, Qin GT, Sun YJ. Expression of vascular endothelial growth factor 165b in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(3): 355-361
- URL: https://www.wjgnet.com/1009-3079/full/v24/i3/355.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i3.355
肿瘤的生长和转移依赖于血管的形成, 促血管生成因子中作用最强的就是血管内皮生长因子(vascular endothelial growth factor, VEGF). VEGF165是体内最多而且生物活性最强的亚型[1,2], 近年来又发现一种内源性剪接变构体-VEGF165b[3], 他因具有抑制VEGF165介导的血管生成和肿瘤生长作用而受到关注[4]. 本研究通过检测肝细胞癌和正常肝组织中的VEGF165b和VEGF165表达差异, VEGF和VEGFR结合后可使局部黏着斑激酶(focal adhesion kinase, FAK)磷酸化, 同时可促进PI3K发生酪氨酸磷酸化. 配体与受体结合亦可激活PI3-K, 从而使Akt/PKB发生磷酸化. 同时对其传导途径中的FAK和P-Akt表达进行检测, 初步探讨VEGF165b在肝癌的发生和发展中的作用及机制.
收集吉林大学第四医院2005-01/2014-06手术肝细胞癌标本共28例, 病理确诊, 全部病例术前均未行放射、化学治疗; 其中男性18例, 女性10例. 年龄51-86岁, 平均68岁. 肝正常组织30例, 为肝良性疾病患者的正常肝组织或取自肝癌患者远离癌组织的正常肝组织. 每例取新鲜标本2块, 于离体后立即放入液氮速冻待检. 鼠抗人VEGF165b、VEGF165和P-AKt单克隆抗体购自Abcam公司, FAK抗体、辣根酶标记抗生物素IgG抗体、Western blot Luminol Reagent和PVDF膜均购自美国Santa Cruz公司. DAB显色试剂盒购自中杉公司. 总RNA提取试剂RNAisoReagent及RT-PCR试剂盒购自大连宝生物(TaKaRa)公司. 引物由上海生工生物工程公司合成.
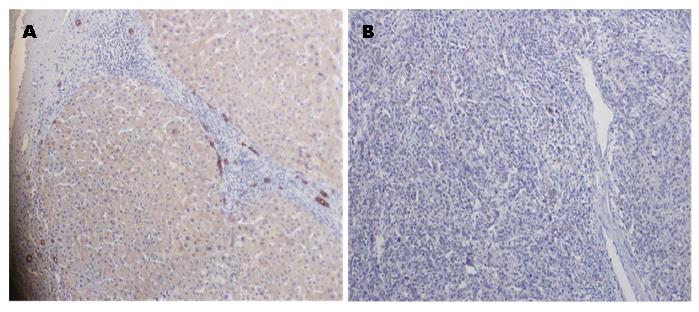
1.2.1 免疫组织化学法检测: (1)免疫组织化学染色: VEGF165b检测采用免疫组织化学SP法: 石蜡4 μm切片后常规脱蜡、水化, 3%过氧化氢孵育20 min后PBS冲洗2次, 切片置入枸橼酸缓冲液100 ℃加热15 min, 自然冷却后PBS液洗2次; 山羊血清封闭, 37 ℃温育20 min; 滴加VEGF165b一抗工作浓度为1:200, 4 ℃过夜孵育, 加二抗37 ℃孵育30 min, PBS冲洗, DAB显色5 min, 苏木精复染, 中性树胶封片; (2)结果判定: VEGF165b阳性表现为胞质内呈棕黄色颗粒为阳性. 判定标准: 每例标本随机选取10个高倍视野, 计数100个细胞中阳性反应细胞数, 阳性表达率(PI) = (阳性细胞数/100)×100%, 取其表达率平均值, PI>5%为阳性, PI<5%为阴性.
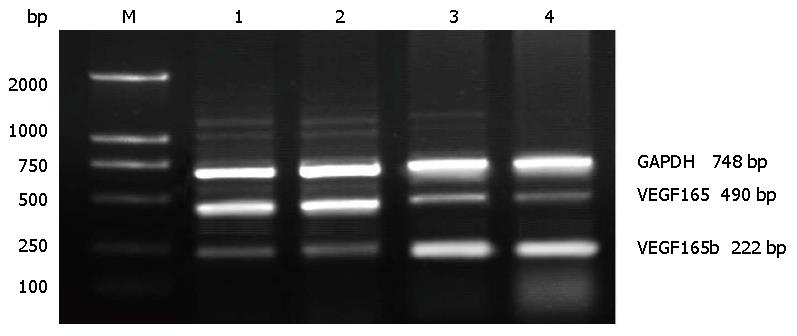
1.2.2 RT-PCR法检测: (1)引物设计: 按照GenBank中已发表的VEGF165和VEGF165b基因序列设计引物. VEGF165b上游引物: 5'-GAGATGAGCTTCCTACAGCAC-3', 下游引物: 5'-TCAGTCTTTCCTGGTGAGAGATCTGCA-3', 产物大小为222 bp. VEGF165上游引物: 5'-GGATCCGCACCCATGGCAGAAGGAGGAGGGCAG-3', 下游引物: 5'-CTCGAGTCACCGCCTCGGCTTGTCACATCTG-3', 产物大小为490 bp, GAPDH上游引物5'-GGTCGGAGTCAACGGATTTGGTCG-3', 下游引物5'-CCTCCGACGCCTGCTTCACCAC-3', 产物大小为748 bp; (2)组织总RNA提取: 采用总RNA提取试剂RNAisoReagent提取总RNA, 按试剂说明书操作. 所提取总RNA完整性经1.5%琼脂糖凝胶电泳, 可见明显18S和28S条带. 用紫外分光光度计定量并检测其纯度, A260/280比值为1.8-2.0者可用于逆转录反应, -80 ℃保存备用; (3)检测: 所有操作均按照TaKaRa公司RT-PCR试剂盒操作步骤进行. PCR产物经1.5%琼脂糖凝胶电泳验证, 条带位于222 bp为VEGF165b mRNA表达产物, 条带位于490 bp为VEGF165 mRNA表达阳性, 条带位于748 bp为GAPDH mRNA表达产物. 以GAPDH作为内参, 比较各组产物表达情况. 目的条带灰度值应用图像分析软件进行分析比较, 以VEGF165, VEGF165b/GAPDH比值为最终结果, 实验重复3次.
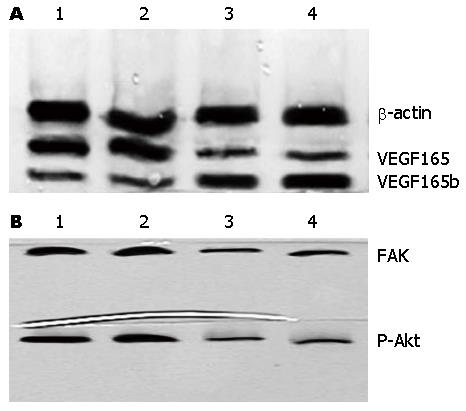
1.2.3 Western blot检测VEGF165b和VEGF165, FAK, P-Akt蛋白表达情况: 用4 ℃预冷的PBS洗净培养液, 吸干后加入含PMSF的裂解液, 于冰上裂解l h; 4 ℃下12000 r/min离心30 min; 取上清BCA法进行蛋白质定量. 煮沸10 min使蛋白变性; SDS-聚丙烯酰胺凝胶电泳(130 V)2 h; 在80 V电流下转膜2 h至PVDF膜上; 用5%脱脂奶粉/TBST室温封闭30 min; 分别加入VEGF165b、VEGF165、FAK和P-Akt一抗和β-actin一抗(稀释比例均为1:500), 4 ℃培育过夜后, TBST洗膜3次, 每次10 min; 加入二抗IgG(稀释比例均为1:5000), 室温振摇培育2 h后, TBST洗膜3次, 每次10 min; DAB显色, 膜拍照记录; 观察结果. 以β-actin作为内参, 光密度分析显影照片上的蛋白条带. 目的条带灰度值应用图像分析软件进行分析比较,以VEGF165b、VEGF165、FAK和P-Akt/β-actin的比值为最终结果, 实验重复3次.
统计学处理 运用统计分析软件SPSS13.0对资料进行统计学分析, 实验结果中计量和计数资料以mean±SD表示, 均数间比较采用t检验. P<0.05为差异有统计学意义.
VEGF165b阳性表达表现为细胞质内均匀分布棕褐色颗粒. VEGF165b蛋白在绝大多数正常肝脏组织中表达, 阳性率为96.67%(29/30), 而在肝癌组织中表达明显降低, 其阳性率为21.4%(6/28), 两者间差异有统计学意义(P<0.01)(图1).
各组引物的扩增基因片段经电泳和EB染色后显示扩增片段大小与所设计的大小完全一致. 对VEGF165 mRNA和VEGF165b mRNA进行定性定量分析, 将VEGF165b和GAPDH的DNA条带进行灰度扫描, 肝癌组织和正常肝脏组织中VEGF165b和GAPDH的灰度比值分别为0.25和0.975. 肝癌组织和正常肝脏组织中VEGF165和GAPDH的灰度比值分别为1.009和0.310(图2). 肝癌组织中VEGF165b mRNA表达水平明显低于正常肝脏组织, 而肝癌组织中VEGF165 mRNA表达水平明显高于正常肝脏组织(P<0.01).
肝癌组织和正常肝脏组织中VEGF165b和β-actin的灰度比值分别为0.199和0.806. 肝癌组织和正常肝脏组织中VEGF165和β-actin的灰度比值分别为0.899和0.207, 肝癌组织中VEGF165b蛋白表达水平明显低于正常肝脏组织, 而肝癌组织中VEGF165蛋白表达水平明显高于正常肝脏组织(P<0.01). 肝癌组织和正常肝脏组织中FAK和β-actin的灰度比值分别为0.672和0.187; P-Akt和β-actin的灰度比值分别为0.727和0.191, 肝癌组织中FAK和P-Akt蛋白表达水平明显高于正常肝脏组织, 差异均具有统计学差异(P<0.01)(图3).
肿瘤的生长和转移的形态学基础是肿瘤血管生成, VEGF是促血管新生的关键因子, 其中VEGF165在血管形成过程中起着重大作用[5-7]. 由VEGF mRNA前体的8号外显子的近端剪切, 产生刺激血管新生的VEGF剪切异构体; 远端剪切, 产生抑制血管新生的VEGF异构体. 最新发现了一些可以抑制肿瘤新生血管形成的抑制性VEGF异构体, 其中主要是VEGF165b, 其是一种内源性的血管生成抑制因子[8-10]. 研究[11,12]发现, VEGF165b在正常组织中高水平表达, 而在肾细胞癌、前列腺癌、膀肤癌、结直肠癌、恶性黑色素瘤等多种肿瘤组织中表达下调, 具有拮抗血管生成和抑制肿瘤组织生成的作用.
VEGF165可以与VEGF受体2(VEGFR2)结合, 而受体胞浆区的酪氨酸残基发生自主磷酸化, 进而导致胞浆区的信号转导蛋白的磷酸化. 这就可以促进血管生成、细胞增殖及增加细胞迁移的能力[13-16]. VEGF165b与VEGFR2结合的亲和力与VEGF165相同,但激活受体的能力明显下降, VEGF165b不依赖VEGFR2下游的信号通路[17-19], 与VEGF165竞争性结合VEGFR2, 导致抑制下游信号传导通路发挥肿瘤增殖和血管生成作用[20,21]. 而起到抑制VEGF165介导的内皮细胞的增殖、迁移和血管舒张及血管形成作用.
FAK介导的信号转导系统是影响细胞的黏附、运动与迁移最为重要的细胞信号转导途径之一[22]. FAK亦是VEGF165信号转导途径中关键因子之一, VEGFR2和VEGF结合后的C末端区域所介导FAK激活后促进细胞迁移. ECM-整合蛋白介导的, FAK参与的RAS-MAPK信号转导途径可引起的促进细胞铺展、移动、增殖和分化等细胞生物学变化[23]. 另外, 阻断FAK表达或活性可使细胞增殖受到显著抑制, 这种抑制主要体现在G2/M期细胞比率的增加及S期细胞比率的下降[24,25]. VEGF165信号转导中另一主要的是Ras-Raf-MEK途径, 被激活的酶可磷酸化一系列胞浆蛋白, 可以使Akt/PKB发生磷酸化, 从而促进细胞的增殖和基因表达[26-28]. 同时, 上述通路可以介导VEGF表达上调[29], 活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白Bad、Caspase9、核因子-κB(nuclear factor-κB, NF-κB)、糖原合成酶激酶-3(glycogen synthesis kinase-3, GSK-3)、FKHR、p21Cip1和p27 Kip1等, 进而调节细胞的增殖、分化、凋亡以及迁移等[30-32].
本研究探讨了VEGF165b和VEGF165在肝癌组织和正常肝脏组的表达情况, 同时对磷酸化的Akt和FAK进行了检测, 从而进一步明确VEGF165b与肝癌的发生和发展的关系和作用机制. Western blot和RT-PCR结果显示, 肝癌组织中VEGF165b mRNA和蛋白表达明显低于肝正常组织中的表达, 与之相反, 肝癌组织中VEGF165 mRNA和蛋白表达明显高于正常肝组织中的表达. 同时, 肝癌组织中P-Akt和FAK蛋白表达明显高于正常肝组织中的表达. 我们的结果提示, 肝癌组织中VEGF165b蛋白表达明显降低, 这一结果与既往VEGF165b在其他肿瘤组织中的表达情况的研究结果相同[33]. 同时, 正常肝脏组织中磷酸化的Akt和FAK表达明显低于肝癌组织, 考虑可能是VEGF165b信号途径可以抑制磷酸化的Akt和FAK活性, 这和既往VEGF165b在其他细胞中的相关研究结果也相一致. 这可能是VEGF165b抑制VEGF165作用的机制之一, 亦是VEGF165b抑制肝癌生长和转移的机制之一.
总之, VEGF165b在肝癌中表达明显下调,具有抑制肿瘤生长的作用, 将成为肝癌诊断、治疗和预后重要的靶点. 其机制可能与VEGF165、P-Akt和FAK表达下调以及相关作用被抑制有关, 但还需要进一步的研究和探讨.
近年来发现的血管内皮生长因子(vascular endothelial growth factor, VEGF)165b具有抑制VEGF165介导的血管生成和肿瘤生长作用. FAK参与的RAS-MAPK信号转导途径可引起的促进细胞铺展、移动、增殖和分化等细胞生物学变化. 他们都是VEGF信号传导通路中的关键蛋白.
黄成, 副主任医师, 复旦大学附属中山医院肝外科
目前抑制肿瘤血管生成和肿瘤转移是抗肿瘤治疗的研究热点, 对VEGF165b作用以及机制的研究期望可以为抗肿瘤增殖及转移的治疗提供新的方法. 本研究组已经对VEGF165b和VEGF165的相关作用的体内和体外实验做进一步的研究, 还将再对转染VEGF165b和干扰VEGF165的体内外实验做进一步的研究, 并对其信号传导通路中的关键蛋白进行进一步的研究.
目前已经有VEGF165和VEGF165b在肾癌, 膀胱癌, 食管癌, 结肠癌的研究, 都证实了VEGF165b在肿瘤组织中的表达和肿瘤的生长抑制有关, 但是对细胞传导通路的研究很少. 有部分研究对缺氧诱导因子做了初步的研究, 但研究得不够深入. 但是研究者已经注意到了VEGF家族的这个抑制性的异构体, 期望可以提供给大家新的抗肿瘤策略.
目前还未见对VEGF165b和肝癌的相关研究的报道, 尤其是对其作用传导通路的蛋白的研究. 本文对VEGF165b在肝癌和正常肝组织中表达差异进行了研究, 同时对其信号传导通路中的蛋白进行的检测. 联合了RT-PCR和Western blot等方法, 初步阐述了VEGF165b和肝癌的关系以及其作用机制, 从基因和蛋白方面分别阐述了本文观点.
本文思路尚清晰, 行文可, 具有一定的研究意义.
编辑: 郭鹏 电编: 都珍珍
| 1. | Panoilia E, Schindler E, Samantas E, Aravantinos G, Kalofonos HP, Christodoulou C, Patrinos GP, Friberg LE, Sivolapenko G. A pharmacokinetic binding model for bevacizumab and VEGF165 in colorectal cancer patients. Cancer Chemother Pharmacol. 2015;75:791-803. [PubMed] [DOI] |
| 2. | Zhu D, Li W, Wen HM, Yu S, Miao ZY, Kang A, Zhang A. Silver nanoparticles-enhanced time-resolved fluorescence sensor for VEGF(165) based on Mn-doped ZnS quantum dots. Biosens Bioelectron. 2015;74:1053-1060. [PubMed] [DOI] |
| 3. | Zhu RY, Xin X, Dai HY, Li Q, Lei JY, Chen Y, Jin J. Expression and purification of recombinant human serum albumin fusion protein with VEGF165b in Pichia pastoris. Protein Expr Purif. 2012;85:32-37. [PubMed] [DOI] |
| 4. | Tayama M, Furuhata T, Inafuku Y, Okita K, Nishidate T, Mizuguchi T, Kimura Y, Hirata K. Vascular endothelial growth factor 165b expression in stromal cells and colorectal cancer. World J Gastroenterol. 2011;17:4867-4874. [PubMed] [DOI] |
| 5. | Amouzadeh Tabrizi M, Shamsipur M, Farzin L. A high sensitive electrochemical aptasensor for the determination of VEGF(165) in serum of lung cancer patient. Biosens Bioelectron. 2015;74:764-769. [PubMed] [DOI] |
| 6. | Miuma S, Ichikawa T, Arima K, Takeshita S, Muraoka T, Matsuzaki T, Ootani M, Shibata H, Akiyama M, Ozawa E. Branched-chain amino acid deficiency stabilizes insulin-induced vascular endothelial growth factor mRNA in hepatocellular carcinoma cells. J Cell Biochem. 2012;113:3113-3121. [PubMed] [DOI] |
| 7. | Shi C, Gao F, Gao X, Liu Y. A novel anti-VEGF165 monoclonal antibody-conjugated liposomal nanocarrier system: physical characterization and cellular uptake evaluation in vitro and in vivo. Biomed Pharmacother. 2015;69:191-200. [PubMed] [DOI] |
| 8. | Afkhami F, Durocher Y, Prakash S. Investigation of antiangiogenic tumor therapy potential of microencapsulated HEK293 VEGF165b producing cells. J Biomed Biotechnol. 2010;2010:645610. [PubMed] [DOI] |
| 9. | Hua J, Spee C, Kase S, Rennel ES, Magnussen AL, Qiu Y, Varey A, Dhayade S, Churchill AJ, Harper SJ. Recombinant human VEGF165b inhibits experimental choroidal neovascularization. Invest Ophthalmol Vis Sci. 2010;51:4282-4288. [PubMed] [DOI] |
| 10. | Rennel ES, Hamdollah-Zadeh MA, Wheatley ER, Magnussen A, Schüler Y, Kelly SP, Finucane C, Ellison D, Cebe-Suarez S, Ballmer-Hofer K. Recombinant human VEGF165b protein is an effective anti-cancer agent in mice. Eur J Cancer. 2008;44:1883-1894. [PubMed] [DOI] |
| 11. | Díaz R, Peña C, Silva J, Lorenzo Y, García V, García JM, Sánchez A, Espinosa P, Yuste R, Bonilla F. p73 Isoforms affect VEGF, VEGF165b and PEDF expression in human colorectal tumors: VEGF165b downregulation as a marker of poor prognosis. Int J Cancer. 2008;123:1060-1067. [PubMed] [DOI] |
| 12. | Rennel E, Waine E, Guan H, Schüler Y, Leenders W, Woolard J, Sugiono M, Gillatt D, Kleinerman E, Bates D. The endogenous anti-angiogenic VEGF isoform, VEGF165b inhibits human tumour growth in mice. Br J Cancer. 2008;98:1250-1257. [PubMed] [DOI] |
| 13. | Zhang L, Wang JN, Tang JM, Kong X, Yang JY, Zheng F, Guo LY, Huang YZ, Zhang L, Tian L. VEGF is essential for the growth and migration of human hepatocellular carcinoma cells. Mol Biol Rep. 2012;39:5085-5093. [PubMed] [DOI] |
| 14. | Wang D, Hu L, Su M, Wang J, Xu T. Preparation and functional characterization of human vascular endothelial growth factor-melittin fusion protein with analysis of the antitumor activity in vitro and in vivo. Int J Oncol. 2015;47:1160-1168. [PubMed] [DOI] |
| 15. | Beckouche N, Bignon M, Lelarge V, Mathivet T, Pichol-Thievend C, Berndt S, Hardouin J, Garand M, Ardidie-Robouant C, Barret A. The interaction of heparan sulfate proteoglycans with endothelial transglutaminase-2 limits VEGF165-induced angiogenesis. Sci Signal. 2015;8:ra70. [PubMed] [DOI] |
| 16. | Henry L, Labied S, Fransolet M, Kirschvink N, Blacher S, Noel A, Foidart JM, Nisolle M, Munaut C. Isoform 165 of vascular endothelial growth factor in collagen matrix improves ovine cryopreserved ovarian tissue revascularisation after xenotransplantation in mice. Reprod Biol Endocrinol. 2015;13:12. [PubMed] [DOI] |
| 17. | Bohlmann MK, Hoerster JC, Bundschuh D, Boemicke P, Luedders DW, Köster F. Growth-modulatory effects of heparin and VEGF165 on the choriocarcinoma cell-line JEG-3 and its expression of heparanase. Anticancer Res. 2014;34:7071-7076. [PubMed] |
| 18. | Bunni J, Shelley-Fraser G, Stevenson K, Oltean S, Salmon A, Harper SJ, Carter JG, Bates DO. Circulating levels of anti-angiogenic VEGF-A isoform (VEGF-Axxxb) in colorectal cancer patients predicts tumour VEGF-A ratios. Am J Cancer Res. 2015;5:2083-2089. [PubMed] |
| 19. | Carter JJ, Wheal AJ, Hill SJ, Woolard J. Effects of receptor tyrosine kinase inhibitors on VEGF165 a- and VEGF165 b-stimulated gene transcription in HEK-293 cells expressing human VEGFR2. Br J Pharmacol. 2015;172:3141-3150. [PubMed] [DOI] |
| 20. | Woolard J, Wang WY, Bevan HS, Qiu Y, Morbidelli L, Pritchard-Jones RO, Cui TG, Sugiono M, Waine E, Perrin R. VEGF165b, an inhibitory vascular endothelial growth factor splice variant: mechanism of action, in vivo effect on angiogenesis and endogenous protein expression. Cancer Res. 2004;64:7822-7835. [PubMed] |
| 22. | Baquero P, Jiménez-Mora E1, Santos A1, Lasa M2, Chiloeches A. TGFβ induces epithelial-mesenchymal transition of thyroid cancer cells by both the BRAF/MEK/ERK and Src/FAK pathways. Mol Carcinog. 2015; Sep 21. [Epub ahead of print]. [PubMed] [DOI] |
| 23. | Li WX, Chen LP, Sun MY, Li JT, Liu HZ, Zhu W. 3'3-Diindolylmethane inhibits migration, invasion and metastasis of hepatocellular carcinoma by suppressing FAK signaling. Oncotarget. 2015;6:23776-23792. [PubMed] |
| 24. | Moen I, Gebre M, Alonso-Camino V, Chen D, Epstein D, McDonald DM. Anti-metastatic action of FAK inhibitor OXA-11 in combination with VEGFR-2 signaling blockade in pancreatic neuroendocrine tumors. Clin Exp Metastasis. 2015;32:799-817. [PubMed] |
| 25. | Serrels A, Lund T, Serrels B, Byron A, McPherson RC, von Kriegsheim A, Gómez-Cuadrado L, Canel M, Muir M, Ring JE. Nuclear FAK controls chemokine transcription, Tregs, and evasion of anti-tumor immunity. Cell. 2015;163:160-173. [PubMed] [DOI] |
| 26. | Kitano H, Chung JY, Ylaya K, Conway C, Takikita M, Fukuoka J, Doki Y, Hanaoka J, Hewitt SM. Profiling of phospho-AKT, phospho-mTOR, phospho-MAPK and EGFR in non-small cell lung cancer. J Histochem Cytochem. 2014;62:335-346. [PubMed] [DOI] |
| 27. | Lozano-Santos C, Amigo-Jiménez I, Nova-Gurumeta S, Pérez-Sanz N, García-Pardo A, García-Marco JA. Arsenic trioxide synergistically potentiates the cytotoxic effect of fludarabine in chronic lymphocytic leukemia cells by further inactivating the Akt and ERK signaling pathways. Biochem Biophys Res Commun. 2015;461:243-248. [PubMed] [DOI] |
| 28. | Kim N, Jeong S, Jing K, Shin S, Kim S, Heo JY, Kweon GR, Park SK, Wu T, Park JI. Docosahexaenoic Acid Induces Cell Death in Human Non-Small Cell Lung Cancer Cells by Repressing mTOR via AMPK Activation and PI3K/Akt Inhibition. Biomed Res Int. 2015;2015:239764. [PubMed] [DOI] |
| 29. | Simonetti O, Lucarini G, Rubini C, Lazzarini R, DI Primio R, Offidani A. Clinical and prognostic significance of survivin, AKT and VEGF in primary mucosal oral melanoma. Anticancer Res. 2015;35:2113-2120. [PubMed] |
| 30. | Cerezo-Guisado MI, Zur R, Lorenzo MJ, Risco A, Martín-Serrano MA, Alvarez-Barrientos A, Cuenda A, Centeno F. Implication of Akt, ERK1/2 and alternative p38MAPK signalling pathways in human colon cancer cell apoptosis induced by green tea EGCG. Food Chem Toxicol. 2015;84:125-132. [PubMed] [DOI] |
| 31. | Henderson V, Smith B, Burton LJ, Randle D, Morris M, Odero-Marah VA. Snail promotes cell migration through PI3K/AKT-dependent Rac1 activation as well as PI3K/AKT-independent pathways during prostate cancer progression. Cell Adh Migr. 2015;9:255-264. [PubMed] [DOI] |
| 32. | Lin HP, Lin CY, Huo C, Jan YJ, Tseng JC, Jiang SS, Kuo YY, Chen SC, Wang CT, Chan TM. AKT3 promotes prostate cancer proliferation cells through regulation of Akt, B-Raf, and TSC1/TSC2. Oncotarget. 2015;6:27097-27112. [PubMed] [DOI] |