修回日期: 2016-08-24
接受日期: 2016-08-29
在线出版日期: 2016-10-18
探讨岩藻糖基转移酶2(fucosyltransferase 2, FUT2)在A385T位点和G428A位点的基因多态性与炎症性肠病(inflammatory bowel disease, IBD)易感性的关系.
计算机检索Embase、PubMed、EBM Reviews、Ovid、Springer、中国期刊全文数据库(CNKI)、万方数字化期刊全文数据库, 查找关于FUT2基因多态性与IBD相关性的研究, 对纳入文献进行质量评价, 提取有效数据, 使用Review Manager 5.3和Stata 12.0软件进行Meta分析, 并用Begg's漏斗图进行发表偏倚检测.
共纳入10篇文献, 病例组3682例, 对照组5470例. 各种遗传模型在溃疡性结肠炎(ulcerative colitis, UC)中, 显性遗传模型[(AA+AT) vs TT]中OR = 1.00 (95%CI: 0.83-1.21), [(GG+GA) vs AA]中OR = 1.05 (95%CI: 0.81-1.36); 隐性遗传模型[(AT+TT) vs AA]中OR = 0.96 (95%CI: 0.73-1.25), [(GA+AA) vs GG]中OR = 0.70 (95%CI: 0.36-1.36); 共显性遗传模型中(AA vs TT)中OR = 1.02 (95%CI: 0.82-1.27), (GG vs AA)中OR = 1.23 (95%CI: 0.93-1.63); 等位基因模型(A vs T)中OR = 1.06 (95%CI: 0.95-1.17), (G vs A)中OR = 1.18 (95%CI: 0.68-2.04). 各种遗传模型在克罗恩病(Crohn's disease, CD)中, 显性遗传模型[(AA+AT) vs TT]中OR = 0.60 (95%CI: 0.43-0.85), [(GG+GA) vs AA]中OR = 0.51 (95%CI: 0.38-0.70); 隐性遗传模型[(AT+TT) vs AA]中OR = 0.99 (95%CI: 0.73-1.35), [(GA+AA) vs GG]中OR = 1.49 (95%CI: 1.17-1.91); 共显性模型(AA vs TT)中OR = 1.37 (95%CI: 0.95-1.98), (GG vs AA)中OR = 0.46 (95%CI: 0.33-0.65); 等位基因模型(G vs A)中OR = 0.67 (95%CI: 0.57-0.79), (G vs A)中OR = 0.67 (95%CI: 0.57-0.79).
FUT2 A385T与G428A基因多态性与UC易感性无关. 亚洲人群中FUT2 A385T上基因型TT会增加CD的发病风险. FUT2 G428A多态性与CD相关, 携带等位基因A会增加CD的易感性.
核心提要: 近年来有许多国内外关于岩藻糖基转移酶2的A385T位点与G428A位点基因多态性与炎症性肠病易感性的研究的结论不一致, 且对A385T位点的多态性的研究研究样本量较少. 故本文通过Meta分析明确两者的关系.
引文著录: 刘进, 李林青, 曾俊, 曹国栋, 姜政. 岩藻糖基转移酶2基因多态性与炎症性肠病易感性Meta分析. 世界华人消化杂志 2016; 24(29): 4075-4084
Revised: August 24, 2016
Accepted: August 29, 2016
Published online: October 18, 2016
To explore the relationship between fucosyltransferase 2 (FUT2) A385T and G428A gene polymorphisms and susceptibility to inflammatory bowel disease(IBD).
Databases including Embase, PubMed, EBM Reviews, Ovid, Springer, CNKI, and WanFang were searched for articles evaluating the relationship between FUT2 gene polymorphism and susceptibility to IBD. Available data were extracted and quality of the included studies was evaluated. Meta-analysis was conducted by using Review Manager 5.3 and Stata 12.0. Begg's funnel plot was used to assess the published bias of articles.
Totally 10 articles were included, including 3682 cases and 5470 controls. Each genetic model in ulcerative colitis (UC) was as follows: dominant model [(AA + AT) vs TT: OR = 0.60 (95%CI: 0.43-0.85); (GG + GA) vs AA: OR = 0.51 (95%CI: 0.38-0.70)]; recessive model [(AT + TT) vs AA: OR = 0.96 (95%CI: 0.73-1.25); (GA + AA) vs GG: OR = 0.70 (95%CI: 0.36-1.36)]; codominant model [AA vs TT: OR = 1.02 (95%CI: 0.82-1.27); GG vs AA: OR = 1.23 (95%CI: 0.93-1.63)]; allele genetic model [A vs T: OR = 1.06 (95%CI: 0.95-1.17); G vs A: OR = 1.18 (95%CI: 0.68-2.04)]. Each genetic model in Crohn's disease (CD) was as follows: dominant model [(AA + AT) vs TT: OR = 0.60 (95%CI: 0.43-0.85); (GG + GA) vs AA: OR = 0.51 (95%CI: 0.38-0.70)]; recessive model [(AT + TT) vs AA]: OR = 0.99 (95%CI: 0.73-1.35); (GA + AA) vs GG: OR = 1.49 (95%CI: 1.17-1.91)]; codominant model [AA vs TT: OR = 1.37 (95%CI: 0.95-1.98); GG vs AA: OR = 0.46 (95%CI: 0.33-0.65)]; allele genetic model [G vs A: OR = 0.67 (95%CI: 0.57-0.79); G vs A: OR = 0.67 (95%CI: 0.57-0.79)].
FUT2 A385T and G428A polymorphisms are not significantly related with IBD. In Asians, the TT on A385T confers a significant risk for developing CD. FUT2 G428A polymorphism is related with CD, and the allele gene A confers a risk for developing CD.
- Citation: Liu J, Li LQ, Zeng J, Cao GD, Jiang Z. Associations of fucosyltransferase 2 gene polymorphism with susceptibility to inflammatory bowel disease: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2016; 24(29): 4075-4084
- URL: https://www.wjgnet.com/1009-3079/full/v24/i29/4075.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i29.4075
炎症性肠病(inflammatory bowel disease, IBD)是一组慢性肠道非特异性炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)与克罗恩病(Crohn's disease, CD). 近年来我国IBD的发病率病不断增高[1], 其病因尚不明确, 包括环境、遗传、免疫等多个因素[2-5], 其中肠道菌群失衡对IBD的发生至关重要[6]. 岩藻糖基转移酶2(fucosyltransferase 2, FUT2)的基因位于人类染色体19q13上, 决定组织血型抗原(histo-blood group antigens, HBGA)的表达[7]. 目前已证实, HBGA与多种病原体感染有关, 如霍乱、幽门螺杆菌(Helicobacter pylori, H. pylori)、诺瓦克病毒等[8-10]. FUT2的基因多态性决定HBGA在肠道组织是否表达, 可能对肠道菌群的构成、分布有重要影响. 目前对FUT2的基因多态性研究主要集中在转录起始位点下游第385位点(A385T)与下游第428位点(G428A). 如果FUT2基因在转录起始位点下游第385位点出现A→T纯合型突变(基因型TT)或第428位点出现G→A纯合型突变(基因型AA), 则肠黏膜上HBGA表达缺如, 约占普通人群的20%左右[7]. 近年来有许多国内外关于FUT2的A385T位点与G428A位点基因多态性与IBD易感性的研究, McGovern等[11]发现, G428A位点多态性与UC无关, 但基于芬兰人群的调查发现, G428A位点上等位基因A对UC有保护作用[12]. 许多研究结论不一致, 且对A385T位点的多态性的研究研究样本量较少, 故本文通过Meta分析明确FUT2在A385T位点和G428A位点的基因多态性与IBD的易感性的关系.
1.1.1 文献检索: 计算机检索Embase、PubMed、EBM Reviews、Ovid、Springer、中国期刊全文数据库(CNKI)、万方数字化期刊全文数据库, 中文检索词为: 炎症性肠病, 溃疡性结肠炎, 克罗恩病, 岩藻糖基转移酶2, 基因多态性, 英文检索词为: IBD, UC, CD, FUT2, polymorphism, 时间限定在建库至成文, 同时合并不同的检索方式检索.
1.2.1 纳入标准: (1)涉及FUT2基因多态性与IBD相关性的文献, 非会议文章或综述, 为病例对照研究; (2)研究对象病例组均为经肠镜或手术后病理学、组织学确诊的IBD病人, 所研究病例符合IBD诊断指南标准; (3)对照组为非肿瘤、无消化道症状、既往无消化道病史的健康人群; (4)对照组各基因型分布频率符合Hardy-Weinberg平衡(P<0.05认为不符合Hardy-Weinberg平衡); (5)基因型检测方法相似, 有足够的数据计算比值比(odds ratio, OR)和95%可信区间(95% confidence interval, 95%CI).
1.2.2 排除标准: (1)研究类型为非病例-对照研究或动物实验; (2)缺少原始数据或无法计算OR值的文献.
1.2.3 文献质量评价与资料提取: 采用纽卡斯尔-渥太华质量评价表(Newcastle-Ottawa scale, NOS)评价标准[13], 对研究对象的选择、组间可比性及暴露因素测量三方面进行评价, 得分≥7分研究为高质量研究. 由2名评价员独立对文献进行质量评价并提取资料, 交叉核对确保结果一致性, 通过协商或由第3位研究者解决分歧. 按照设计制定资料提取表, 主要包括: 作者, 发表年限, 国家, UC、CD、对照组人数及各组的基因型分布.
统计学处理 所有分析采用RevMan5.2和Stata12.0软件进行. 计数资料采用OR及其95%CI为分析指标, OR值及其95%CI的计算分别根据共显性遗传模型: (AA vs TT)、(GG vs AA), 显性遗传模型[(AA+AT) vs TT]、[(GG+GA) vs AA], 隐性遗传模型[(AT+TT) vs AA]、[(GA+AA) vs GG], 等位基因遗传模型(A vs T)、(G vs A). 使用I2检验分析各研究间的异质性, 检验水准设为α = 0.05, 若各研究结果间无异质性(P>0.05, I2<50%), 采用固定效应模型进行合并, 若各研究结果间有异质性(P<0.05, I2>50%), 则采用随机效应模型进行合并, 并进行亚组分析或敏感性分析寻找异质性来源, 绘制Begg's漏斗图来评估发表偏倚. P<0.05为差异具有统计学意义.
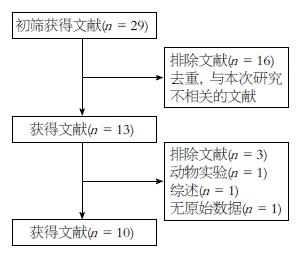
初筛出相关文献29篇, 阅读题目、摘要, 排除与本次研究不相关的文献16篇. 对剩余13篇文献阅读全文, 排除未达纳入标准的文献3篇. 最终共纳入10篇文献[11,12,14-21], 文献检索流程如图1, 病例组共3682例(UC 1852例, CD 1830例), 对照组共5470例, 纳入文献基本特征及质量评价如表1.
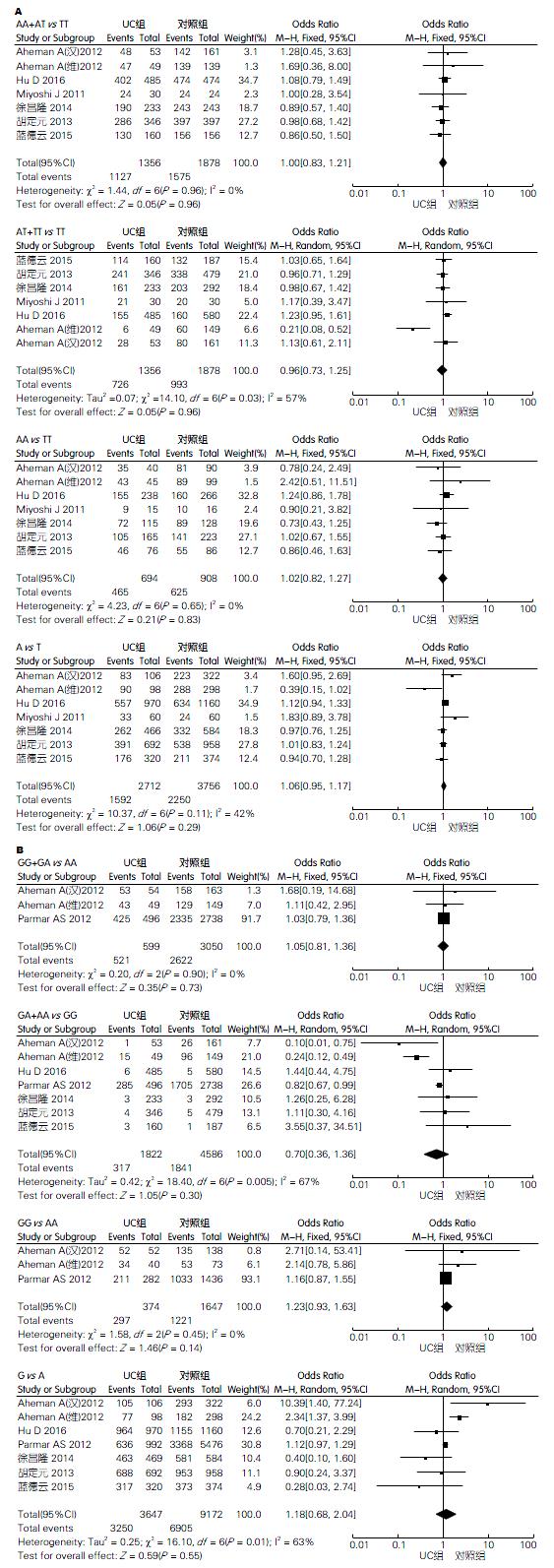
2.2.1 A385T多态性与UC: 显性遗传模型[(AA+AT) vs TT]中, 各项研究无统计学异质性(I2 = 0%, P = 0.96), 采用固定效应模型分析, OR = 1.00(95%CI: 0.83-1.21), 结果无统计学意义(P = 0.96). 隐性遗传模型[(AT+TT) vs AA]中, 各项研究存在统计学异质性(I2 = 57%, P = 0.03), 采用随机效应模型分析, OR = 0.96(95%CI: 0.73-1.25), 结果无统计学意义(P = 0.75). 共显性模型(AA vs TT)中, 各项研究无统计学异质性(I2 = 0%, P = 0.65), 采用固定效应模型分析, OR = 1.02(95%CI: 0.82-1.27), 结果无统计学意义(P = 0.83). 等位基因模型(A vs T)中, 各项研究无统计学异质性(I2 = 42%, P = 0.11), 采用固定效应模型分析, OR = 1.06(95%CI: 0.95-1.17), 结果无统计学意义(P = 0.29)(图2A).
2.2.2 G428A多态性与UC: 显性遗传模型[(GG+GA) vs AA]中, 有4项研究[14-16,19]AA基因型在病例组和对照组中人数均为0, 不能计算OR值, 故最后纳入3项研究, 各项研究无统计学异质性(I2 = 0%, P = 0.90), 采用固定效应模型分析, OR = 1.05(95%CI: 0.81-1.36), 结果无统计学意义(P = 0.73). 隐性遗传模型[(GA+AA) vs GG]中, 各项研究存在统计学异质性(I2 = 67%, P = 0.005), 采用随机效应模型分析, OR = 0.70(95%CI: 0.36-1.36), 结果无统计学意义(P = 0.30). 共显性模型(GG vs AA)中, 有4项研究[14-16,19]AA基因型在病例组和对照组人数均为0, 无法计算OR, 故最终纳入3项研究, 各项研究无统计学异质性(I2 = 0%, P = 0.45), 采用固定效应模型分析, OR = 1.23(95%CI: 0.93-1.63), 结果无统计学意义(P = 0.14). 等位基因模型(G vs A)中, 各项研究存在统计学异质性(I2 = 63%, P = 0.01), 采用随机效应模型分析, OR = 1.18(95%CI: 0.68-2.04), 结果无统计学意义(P = 0.55)(图2B).
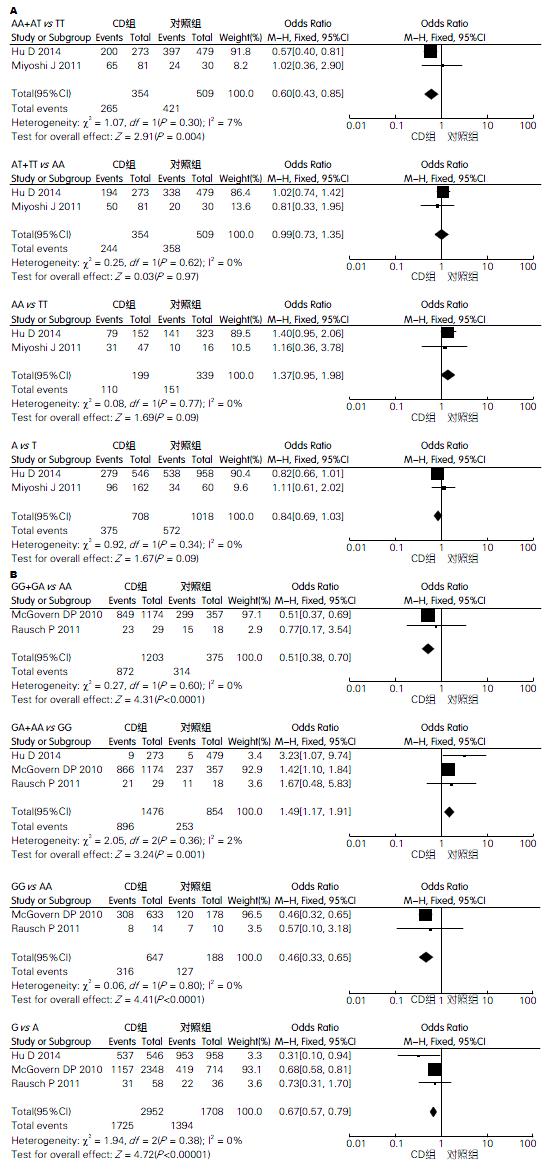
2.2.3 A385T多态性与CD: 显性遗传模型[(AA+AT) vs TT]中, 各项研究无统计学异质性(I2 = 7%, P = 0.30), 采用固定效应模型分析, OR = 0.60(95%CI: 0.43-0.85), 结果有统计学意义(P = 0.004). 隐性遗传模型[(AT+TT) vs AA]中, 各项研究存无统计学异质性(I2 = 0%, P = 0.62), 采用固定效应模型分析, OR = 0.99(95%CI: 0.73-1.35), 结果无统计学意义(P = 0.97). 共显性模型(AA vs TT)中, 各项研究无统计学异质性(I2 = 0%, P = 0.77), 采用固定效应模型分析, OR = 1.37(95%CI: 0.95-1.98), 结果无统计学意义(P = 0.09). 等位基因模型(A vs T)中, 各项研究无统计学异质性(I2 = 0%, P = 0.34), 采用固定效应模型分析, OR = 0.84(95%CI: 0.69-1.03), 结果无统计学意义(P = 0.09)(图3A).
2.2.4 G428A多态性与CD: 在4种遗传模型中, 检测异质性均较高(I2>90%), 除去Parmar等[12]的研究后, 异质性均消失, 考虑该项研究为异质性来源, 故对剩余文献进行亚组分析. 显性遗传模型[(GG+GA) vs AA]中, 有1项研究[20]AA基因型在病例组和对照组中人数均为0, 不能计算OR值, 故最后纳入2项研究, 各项研究无统计学异质性(I2 = 0%, P = 0.60), 采用固定效应模型分析, OR = 0.51(95%CI: 0.38-0.70), 结果有统计学意义(P = 0.000). 隐性遗传模型[(GA+AA) vs GG], 各项研究无统计学异质性(I2 = 2%, P = 0.36), 采用固定效应模型分析, OR = 1.49(95%CI: 1.17-1.91), 结果有统计学意义(P = 0.001). 共显性模型(GG vs AA)中, 有1项研究[20]AA基因型在病例组和对照组中人数均为0, 无法计算OR, 故最终纳入2项研究, 各项研究无统计学异质性(I2 = 0%, P = 0.80), 采用固定效应模型分析, OR = 0.46(95%CI: 0.33-0.65), 结果有统计学意义(P<0.001). 等位基因模型(G vs A)中, 各项研究无统计学异质性(I2 = 0%, P = 0.38), 采用固定效应模型分析, OR = 0.67(95%CI: 0.57-0.79), 结果有统计学意义(P = 0.000)(图3B).
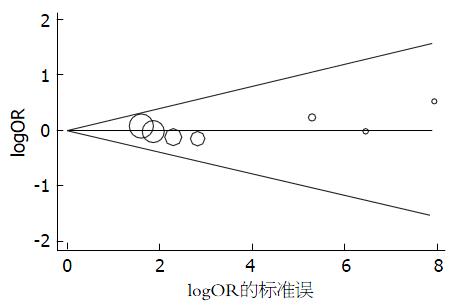
Begg's秩相关法检测结果显示: A385T显性遗传模型(AA+AT vs TT)在UC中P = 0.746(图4); G428A隐性遗传模型(GA+AA vs GG)在UC中P =1.00. Begg's秩相关法检测未见发表偏倚.
FUT2是决定HBGA在肠黏膜组织表达的关键酶, 包括ABH抗原和Lewis抗原. 若个体的肠黏膜存在HBGA的表达, 称为分泌型, 反之称为非分泌型. 相关研究显示, 欧洲人群中非分泌型主要由FUT2 G428A发生纯合型突变所致. 而亚洲人群中, FUT2 A385T发生纯合型突变是导致非分泌型的主要原因. 大量研究[10]表明, FUT2基因突变导致的非分泌型状态对诺瓦克病毒抵抗力增加, 但会增加嗜血杆菌的易感性. 分泌型状态对H. pylori[22,23]、流感病毒、呼吸道合胞病毒的易感性增高. 故FUT2基因多态性可能是影响肠道菌群的分布与构成的重要遗传因素[24]. FUT2的基因多态性不仅与IBD有关, 还与原发性硬化性胆管炎[25]等自身免疫性疾病相关.
本次研究显示, FUT2 A385T与G428A两个位点上, 无论显性模型或隐性模型或共显性模型还是等位基因模型, 结果均显示A385T与G428A基因多态性与UC无关. 既往研究[26]显示, FUT2基因多态性导致的人体的非分泌状态, 肠道黏膜表面缺乏糖基转移酶合成的特定碳水化合物(如岩藻糖脂1), 这阻止了病原体的入侵. 但这不能解释FUT2基因多态性与UC无关的全部原因, 因为UC发病不仅仅是基因遗传因素作用, 还与人种、环境等其他因素有关, 是多个因素共同作用的复杂过程[27], 具体机制还需要进一步研究.
本次研究还显示, 在亚洲人群中, A385T位点的纯合型突变TT基因型所导致的非分泌状态会增加CD的易感性. 而对G428A位点分析显示, 不仅非分泌状态的基因型AA会增加CD的易感性, 而且等位基因A的携带者亦会是CD的易感因素, 这与来自芬兰人群的一项研究结论相悖, 进一步说明FUT2的基因多态性对IBD的易感性影响可能与种族相关. 目前认为, 对肠道细菌的过度异常的免疫反应可能是CD的发病机制[28]. 有研究显示, FUT2基因多态性导致的非分泌状态通过改变肠道菌群的构成[29,30]来调节机体固有免疫应答[31]. 除此之外, FUT2基因多态性还与CD的病变位置有关[18,20], 这可能是因为FUT2基因突变导致特异位置的HBGA表达缺如, 从而造成该段肠道的菌群组成和免疫应答异常, 但具体机制仍然需要进一步研究.
异质性是影响结果的一个重要因素. 在UC中, 隐性模型[(AT+TT) vs TT]中, 排除Aheman等[17]中基于维族人群的研究后, 异质性消失(I2 = 0%, P = 0.86); 在隐性模型[(GA+AA) vs GG]中, 排除Aheman等[17]对维族人群的研究后, 异质性消失(I2 = 30%, P = 0.21); 在等位基因模型(G vs A)中, 排除Aheman等[17]对维族人群的研究后, 异质性消失(I2 = 40%, P = 0.11). 在CD中, 排除Parmar等[12]的研究后, 各种遗传模型的异质性均消失. 在排除上述研究后, 进行固定效应模型分析, OR未见统计学意义上的改变. 上述对异质性来源的分析, 说明种族差异可能是异质性的来源, 通过Begg's秩相关法检测未见发表偏倚.
本次研究存在一些局限性. 首先, 纳入研究的样本量相差较大, 可能对结果有所影响; 其次, 本次Meta分析未纳入未公开发表的研究, 因此可能存在选择偏倚; 最后, 所有纳入研究均缺乏基因与环境或基因与基因相互作用的研究, 故尚不能明确FUT2 A385T和G428T的多态性对IBD易感性的影响是否还存在与环境或其他基因的共同作用. 因此, 下一步可开展多中心、大样本及全基因测序的病例对照研究来证实本次Meta分析的结果.
总之, 本次Meta分析显示, FUT2 A385T与G428A的基因多态性与UC易感性无关, 但FUT2 G428A上G→A的突变会增加CD的易感性, 说明FUT2在A385T与G428A上的基因多态性在两种IBD上的作用机制可能有所不同, 还需要进一步的研究.
近年来炎症性肠病(inflammatory bowel disease, IBD)的发病率不断增高, 且其病因尚不明确, 导致该病治疗难度大. 目前关于岩藻糖基转移酶2(fucosyltransferase 2, FUT2)的A385T位点与G428A位点基因多态性和IBD的关系研究结论不一致.
张燕, 主任医师, 四川大学华西医院消化内科
IBD病因尚不明确, 故其治疗效果欠佳, 严重影响该病患者的生活质量. 随着经济的发展, 其患者数量增加, 给社会经济带来了巨大的负担. 因此, IBD的病因研究刻不容缓.
近年, 许多国内外学者对FUT2的A385T位点与G428A位点基因多态性与IBD的患病关系进行研究, 本文纳入相关文献, 进行Meta分析, 明确两者的关系.
本文主要通过对FUT2的A385T位点与G428A位点基因多态性与IBD易感性的研究, 进一步明确IBD的病因, 为该病的治疗提供依据.
炎症性肠病(IBD): 指一组慢性肠道非特异性炎症性疾病, 包括溃疡性结肠炎与克罗恩病. FUT2的基因位于人类染色体19q13上, 决定组织血型抗原的表达, 该抗原在肠道组织是否表达, 可能对肠道菌群的构成、分布有重要影响.
本文具有一定的新意, 数据分析中文献纳入标准明确, 讨论条理清晰.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 重庆市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 2. | Cortot A, Pineton de Chambrun G, Vernier-Massouille G, Vigneron B, Gower Rousseau C. [Inflammatory bowel disease: genetic or environmental diseases?]. Gastroenterol Clin Biol. 2009;33:681-691. [PubMed] [DOI] |
| 3. | Lakatos PL. Environmental factors affecting inflammatory bowel disease: have we made progress? Dig Dis. 2009;27:215-225. [PubMed] [DOI] |
| 5. | Nunes T, Fiorino G, Danese S, Sans M. Familial aggregation in inflammatory bowel disease: is it genes or environment? World J Gastroenterol. 2011;17:2715-2722. [PubMed] [DOI] |
| 7. | Kelly RJ, Rouquier S, Giorgi D, Lennon GG, Lowe JB. Sequence and expression of a candidate for the human Secretor blood group alpha(1,2)fucosyltransferase gene (FUT2). Homozygosity for an enzyme-inactivating nonsense mutation commonly correlates with the non-secretor phenotype. J Biol Chem. 1995;270:4640-4649. [PubMed] |
| 8. | Forni D, Cleynen I, Ferrante M, Cassinotti A, Cagliani R, Ardizzone S, Vermeire S, Fichera M, Lombardini M, Maconi G. ABO histo-blood group might modulate predisposition to Crohn's disease and affect disease behavior. J Crohns Colitis. 2014;8:489-494. [PubMed] [DOI] |
| 9. | Anstee DJ. The relationship between blood groups and disease. Blood. 2010;115:4635-4643. [PubMed] [DOI] |
| 10. | Gospodarek E, Zalas-Wiecek P. [Noroviruses--tactic of spread]. Przegl Epidemiol. 2009;63:5-9. [PubMed] |
| 11. | McGovern DP, Jones MR, Taylor KD, Marciante K, Yan X, Dubinsky M, Ippoliti A, Vasiliauskas E, Berel D, Derkowski C. Fucosyltransferase 2 (FUT2) non-secretor status is associated with Crohn's disease. Hum Mol Genet. 2010;19:3468-3476. [PubMed] [DOI] |
| 12. | Parmar AS, Alakulppi N, Paavola-Sakki P, Kurppa K, Halme L, Färkkilä M, Turunen U, Lappalainen M, Kontula K, Kaukinen K. Association study of FUT2 (rs601338) with celiac disease and inflammatory bowel disease in the Finnish population. Tissue Antigens. 2012;80:488-493. [PubMed] [DOI] |
| 13. | Wells GA, Shea B, O'Connell D, Peterson J, Welch V, Losos M, Tugwell P. The Newcastle-Ottawa Scale for assessing the quality of nonrandomized studies in meta-analyses[EB/OL].[2016-3-24]. Available from: http: //www.ohri.ca/programs/clinical_epidemiology/oxford.asp. |
| 16. | 胡 定元, 邵 晓晓, 郑 波, 姜 利佳, 金 捷, 林 秀清, 李 士林, 蒋 益. 岩藻糖基转移酶2和3基因多态性与溃疡性结肠炎的关系. 中华内科杂志. 2013;52:1053-1055. |
| 17. | Aheman A, Luo HS, Gao F. Association of fucosyltransferase 2 gene variants with ulcerative colitis in Han and Uyghur patients in China. World J Gastroenterol. 2012;18:4758-4764. [PubMed] [DOI] |
| 18. | Miyoshi J, Yajima T, Okamoto S, Matsuoka K, Inoue N, Hisamatsu T, Shimamura K, Nakazawa A, Kanai T, Ogata H. Ectopic expression of blood type antigens in inflamed mucosa with higher incidence of FUT2 secretor status in colonic Crohn's disease. J Gastroenterol. 2011;46:1056-1063. [PubMed] [DOI] |
| 19. | Hu D, Zhang D, Zheng S, Guo M, Lin X, Jiang Y. Association of Ulcerative Colitis with FUT2 and FUT3 Polymorphisms in Patients from Southeast China. PLoS One. 2016;11:e0146557. [PubMed] [DOI] |
| 20. | Hu DY, Shao XX, Xu CL, Xia SL, Yu LQ, Jiang LJ, Jin J, Lin XQ, Jiang Y. Associations of FUT2 and FUT3 gene polymorphisms with Crohn's disease in Chinese patients. J Gastroenterol Hepatol. 2014;29:1778-1785. [PubMed] [DOI] |
| 21. | Rausch P, Rehman A, Künzel S, Häsler R, Ott SJ, Schreiber S, Rosenstiel P, Franke A, Baines JF. Colonic mucosa-associated microbiota is influenced by an interaction of Crohn disease and FUT2 (Secretor) genotype. Proc Natl Acad Sci USA. 2011;108:19030-19035. [PubMed] [DOI] |
| 22. | Lindén S, Mahdavi J, Semino-Mora C, Olsen C, Carlstedt I, Borén T, Dubois A. Role of ABO secretor status in mucosal innate immunity and H. pylori infection. PLoS Pathog. 2008;4:e2. [PubMed] [DOI] |
| 23. | Azevedo M, Eriksson S, Mendes N, Serpa J, Figueiredo C, Resende LP, Ruvoën-Clouet N, Haas R, Borén T, Le Pendu J. Infection by Helicobacter pylori expressing the BabA adhesin is influenced by the secretor phenotype. J Pathol. 2008;215:308-316. [PubMed] [DOI] |
| 24. | Wacklin P, Mäkivuokko H, Alakulppi N, Nikkilä J, Tenkanen H, Räbinä J, Partanen J, Aranko K, Mättö J. Secretor genotype (FUT2 gene) is strongly associated with the composition of Bifidobacteria in the human intestine. PLoS One. 2011;6:e20113. [PubMed] [DOI] |
| 25. | Folseraas T, Melum E, Rausch P, Juran BD, Ellinghaus E, Shiryaev A, Laerdahl JK, Ellinghaus D, Schramm C, Weismüller TJ. Extended analysis of a genome-wide association study in primary sclerosing cholangitis detects multiple novel risk loci. J Hepatol. 2012;57:366-375. [PubMed] [DOI] |
| 26. | Meng D, Newburg DS, Young C, Baker A, Tonkonogy SL, Sartor RB, Walker WA, Nanthakumar NN. Bacterial symbionts induce a FUT2-dependent fucosylated niche on colonic epithelium via ERK and JNK signaling. Am J Physiol Gastrointest Liver Physiol. 2007;293:G780-G787. [PubMed] [DOI] |
| 27. | Harrison OJ, Maloy KJ. Innate immune activation in intestinal homeostasis. J Innate Immun. 2011;3:585-593. [PubMed] [DOI] |
| 28. | Loh G, Blaut M. Role of commensal gut bacteria in inflammatory bowel diseases. Gut Microbes. 2012;3:544-555. [PubMed] [DOI] |
| 29. | Franks I. Gut microbiota: FUT2 genotype influences the gut microbiota in patients with Crohn's disease and healthy individuals. Nat Rev Gastroenterol Hepatol. 2012;9:2. [PubMed] [DOI] |