修回日期: 2016-08-16
接受日期: 2016-08-23
在线出版日期: 2016-09-28
研究骨髓间充质干细胞(mesenchymal stem cell, MSC)对胃癌细胞体内成瘤能力及化疗耐药性的影响.
体外培养人胃癌细胞系SGC7901及原代培养MSC, 裸鼠先分为两组予以SGC7901、SGC7901+MSC皮下注射成瘤; 待移植瘤体积达250-400 mm3时, 每组再分为化疗组[腹腔内注射5-氟尿嘧啶(5-fluorouridine, 5-Fu)]及对照组(生理盐水, NS). 4组具体分为: A组(SGC7901+NS), 5只; B组(SGC7901+MSC+NS), 5只; C组(SGC7901+Fu), 5只; D组(SGC7901 +MSC+Fu), 5只. 18 d(腹腔注射治疗9次)后处死, 检测各组移植瘤的体积、瘤体质量及裸鼠的净质量, 光学倒置显微镜下观察病理学变化.
SGC7901、SGC7901+MSC、SGC7901+5-Fu、SGC7901+MSC+5-Fu各组之间的移植瘤体积、瘤质量、裸鼠净质量具有统计学差异, MSC增加了SGC7901的成瘤能力及5-Fu耐药性, 但是在同等条件下SGC7901+MSC组裸鼠净质量明显高于SGC7901组.
MSC提高SGC7901移植瘤细胞的增殖活性及对5-Fu的耐药性, 但同时也部分改善了移植瘤小鼠的营养状况.
核心提要: 本文证实了间充质干细胞(mesenchymal stem cell, MSC)提高SGC7901移植瘤细胞的增殖活性及移植瘤细胞对5-氟尿嘧啶的耐药性, 并发现了化疗后MSC部分改善了移植瘤小鼠的营养状况, 具体机制及应用前景还有待进一步研究.
引文著录: 盛潇磊, 袁睿, 刘子梦. 骨髓间充质干细胞对人胃癌细胞系SGC7901体内成瘤能力及化疗耐药性的影响. 世界华人消化杂志 2016; 24(27): 3877-3883
Revised: August 16, 2016
Accepted: August 23, 2016
Published online: September 28, 2016
To investigate the effect of bone marrow mesenchymal stem cells (MSCs) on the proliferation and chemotherapeutic resistance of gastric cancer cells SGC7901.
SGC7901 cells and primary bone marrow MSCs were cultured in vitro. Nude mice were divided into two groups and received subcutaneous injection of SGC7901cells alone and SGC7901 cells plus bone marrow MSCs, respectively. After the tumors grew up to 250-400 mm3, each group was further randomly divided into two groups and received intraperitoneal injection of 5-fluorouridine (5-Fu) and normal saline (NS), respectively. The four groups were as follows: SGC7901 + NS (group A), SGC7901 + MSCs + NS (group B), SGC7901 + Fu (group C), and SGC7901 + MSCs + Fu (group D). All the nude mice were sacrificed on days 18 after 9 intraperitoneal injections. Tumor volume, tumor weight, and net weight of nude mice were measured at the end of the experiment, and pathological changes of tumors were detected under an inverted microscope.
The differences in tumor volume, tumor weight, and net weight of mice were significant between each group. MSCs increased the proliferation ability and 5-Fu resistance of SGC7901 cells, but under the same conditions (5-Fu+/-), the net weight of nude mice in the SGC7901 + MSC group was significantly more than that of the SGC7901 group.
MSC can not only enhance the proliferation and 5-Fu resistance of transplanted SGC7901 cells, but also improve the nutritional condition of nude mice simultaneously.
- Citation: Sheng XL, Yuan R, Liu ZM. Effect of mesenchymal stem cells on proliferation and chemotherapeutic resistance of human gastric cancer cells SGC7901 in vivo. Shijie Huaren Xiaohua Zazhi 2016; 24(27): 3877-3883
- URL: https://www.wjgnet.com/1009-3079/full/v24/i27/3877.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i27.3877
骨髓间充质干细胞(mesenchymal stem cell, MSC)是存在于骨髓基质中的一种成体多能干细胞, 1966年Fridenstein等[1]率先从鼠骨髓的成骨祖细胞中发现. 近年研究[2-4]结果显示骨髓MSC有助于恶性肿瘤的增殖、肿瘤血管的生成和远隔器官的转移. 关于MSC和胃癌的关系, 研究[5-7]发现MSC明显促进胃癌的生长和侵袭能力, 而体外修饰携带抗癌基因的MSC则可以抑制肿瘤的生长[8,9]. 深入理解机体中MSC和肿瘤细胞的相互作用, 可以更好地开发新的抗肿瘤策略[10]. 本实验旨在通过裸鼠移植瘤实验观察MSC对胃癌细胞成瘤及裸鼠营养状况的影响.
人胃腺癌细胞株SGC7901为苏州大学附属第二医院中心实验室惠赠; 小牛血清(杭州四季青生物公司); 胰蛋白酶(AMRESCO公司); 胎牛血清(fetal bovine serum, FBS)、DMEM及α-MEM培养基为Gibco公司产品; 5-氟尿嘧啶(5-fluorouridine, 5-Fu)购自上海旭东海普制药公司; Balb/c♀裸鼠及SD大鼠(上海斯莱克实验动物有限责任公司).
1.2.1 人胃癌细胞株SGC7901: SGC7901细胞株常规复苏之后, 在含有10%胎牛血清、双抗(100 U/mL青霉素和100 U/mL链霉素)的DMEM培养基中, 于37 ℃、95%湿度、50 mL/L CO2混合空气条件下培养, 实验用细胞均处于对数生长期.
1.2.2 SD大鼠MSC: 取4周龄清洁级SD大鼠, 体质量150-200 g, 颈椎脱臼处死, 75%的乙醇消毒10 min, 无菌条件下分离大鼠股骨及胫骨, 从股骨干和胫骨干两端剪断, 用PBS缓冲液反复冲洗骨髓腔, 冲洗液经200目不锈钢标准筛过滤掉大的团块后充分吹打混匀获取细胞悬液, 收集细胞悬液并将其转入15 mL离心管中1000 r/min, 离心5 min, 弃上清液, 加入含10%FBS的α-MEM培养液重悬, 以1×106/cm3密度接种于25 cm2的培养瓶中, 置于37 ℃、饱和湿度、50 mL/L CO2混合空气条件培养箱中培养. 于接种第24 h半量换液, 以后各每3 d全量换液1次. MSC采用流式细胞仪进行鉴定, 细胞呈现为CD34(-)、CD45(-)、CD29(+)、CD90(+).
1.2.3 动物实验: 8周龄♀Balb/c裸鼠, 45只, 分两组, 分别予以胃癌细胞SGC7901(15只)、及混合细胞(SGC7901+MSC, 30只)于裸鼠右腋窝皮下注射: 接种时SGC7901细胞数约8×106、MSC细胞总数约8×105, 每只裸鼠以0.2 mL(SGC7901细胞)及0.25 mL(混合细胞SGC7901+MSC)液量皮下注射形成移植瘤. 待移植瘤体积达250-400 mm3时, 选取移植瘤体积大小相似的SGC7901细胞组裸鼠及混合组(SGC7901+MSC)各10只, 每组分别再随机分为5-Fu腹腔内化疗组5只及生理盐水(NS)对照组5只, 共分为4组: A组(SGC7901+NS), 5只; B组(SGC7901+MSC+NS), 5只; C组(SGC7901+Fu), 5只; D组(SGC7901+MSC+Fu), 5只. 腹腔内注射的5-Fu剂量为17 mg/kg, 生理盐水按同样体积注射. 每2 d注射1次, 并且每2 d观察移植瘤的体积大小, 描绘各组的肿瘤生长曲线, 计算肿瘤生长抑制率. 共注射治疗9次, 18 d后颈椎脱臼处死, 快速剥离瘤体组织, 称量瘤体净质量, 计算裸鼠净质量. 部分移植瘤组织石蜡包埋保存, 其余组织置于-80 ℃冰箱冻存备用. 体积按照公式: V = 0.5×a×b2(a为皮下移植瘤长径, b为短径).
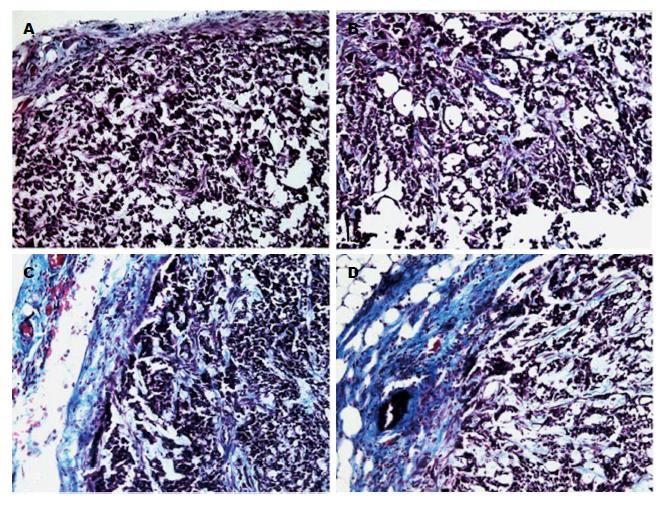
1.2.4 病理学观察: 石蜡切片机以5 μm厚度切片, 置于APES处理的载玻片上. Mason染色, 评价移植瘤组织, 观察SGC7901胃癌细胞、间质及间质细胞等在光学倒置显微镜下的变化.
统计学处理 采用SPSS13.0统计软件分析, 所有数据以mean±SD表示. 多组间比较采用单因素方差分析(One-way ANOVA), 方差齐时应用LSD法, 方差不齐时采用Dunnett法; 对比干预治疗前后的裸鼠净质量、移植瘤体积数据有无统计学意义时采用一般线性模型中的重复测量统计, Mauchly球形检验, 当P<0.05时采用Greenhouse-Geisser法矫正. P<0.05为差异有统计学意义.
实验过程中各组裸鼠进食、饮水等情况均无明显变化, 实验过程顺利, 无裸鼠意外死亡.
皮下单独接种SGC7901细胞及混合接种SGC7901+MSC细胞后, 均可形成皮下瘤, 移植瘤长径达5-7 d左右即可观察到成瘤.
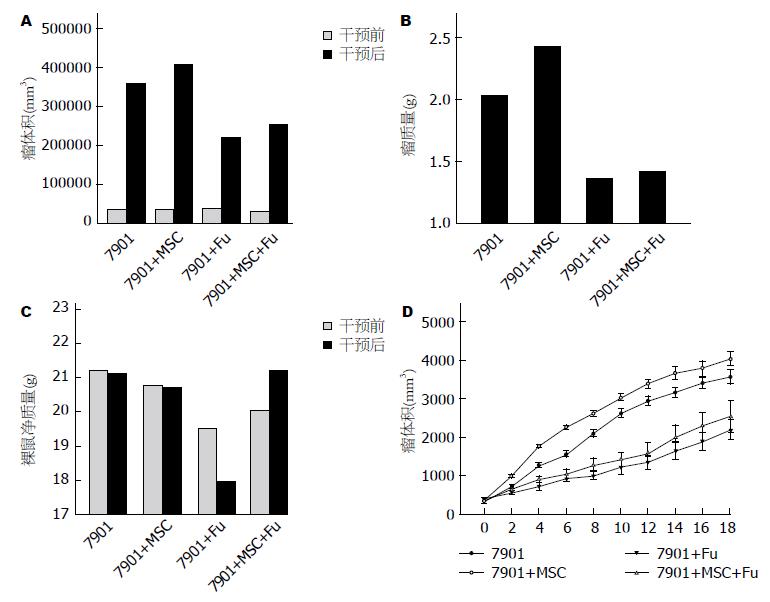
腹腔注射5-Fu化疗后, 第18天终止实验. 腹腔内注射生理盐水的A组移植瘤体积<B组, 而腹腔内注射5-Fu的C组<D组; 5-Fu化疗的C、D组移植瘤体积均<A、B组, 使用一般线性模型的重复测量统计方法, 4组之间均有显著统计学意义(P<0.01, 图1). A、B、C、D 4组的瘤体质量比较, 差异均有显著统计学意义(P<0.01)(表1, 图1). 裸鼠净质量在化疗前后的比较具体结果如表1. 裸鼠净质量指的是挖除种植瘤体后的裸鼠质量. 使用一般线性模型的重复测量统计方法, 尽管各因素间存在交互作用, 各组之间比较有显著统计学意义(P<0.01)(表1, 图1). 然而, 与C组相比, D组中移植瘤体积及瘤质量明显增加(P<0.01), 但同时D组裸鼠净质量也明显增加(P<0.01), 表明D组的裸鼠营养状况优于C组, 提示虽然MSC增强了移植瘤的增殖活性, 但MSC也具有改善裸鼠营养状况的能力.
| 分组 | 瘤体积(mm3) | 裸鼠净质量(g) | 瘤质量(g) | ||
| 化疗前 | 化疗后 | 化疗前 | 化疗后 | ||
| A组 | 373.92±23.66 | 3544.38±137.89 | 21.23±0.05 | 19.34±0.26 | 2.03±0.06 |
| B组 | 368.31±8.16 | 4007.95±154.21 | 20.77±0.12 | 20.74±0.13 | 2.42±0.08 |
| C组 | 395.87±8.94 | 2190.13±208.07 | 19.55±0.57 | 18.02±0.32 | 1.35±0.15 |
| D组 | 332.27±40.49 | 2553.83±321.46 | 20.09±0.45 | 21.25±0.54 | 1.43±0.16 |
与A组相比, B组的移植瘤组织中有极为丰富的血管脉管系统及纤维组织, 尤其在瘤周明显; 瘤周有更为丰富的脂肪细胞、成纤维母细胞、肌纤维; 肿瘤细胞的胞体、胞核更大, 异型性明显, 细胞密度较高. 而在使用5-Fu化疗后, D组的移植瘤较C组的坏死有所减轻, 坏死程度明显减轻(图2).
在我国, 胃癌死亡数居各种消化系恶性肿瘤之首, 是一种恶性度极高的实体肿瘤, 具有生长速度快、高转移复发等特点[11]. 近年的研究[12-14]结果显示MSC在胃癌的发生发展过程中起着极为重要的作用, 研究MSC在胃癌中的作用具有重要意义.
MSC广泛存在于各种组织, 具有分化成软骨细胞、骨细胞、脂肪细胞等各种间质细胞的潜力[15-17]. 肿瘤可诱导MSC在体内的增殖、动员和归巢, 归巢的MSC具有免疫抑制能力及促血管生成能力, 可在肿瘤原发及转移部位发挥重要作用[2,18-20]. 本实验采用裸鼠移植瘤的方法, 采用SGC7901及MSC(比例为10:1)混合皮下注射形成移植瘤, 结果发现混合细胞组的移植瘤体积及瘤质量较SGC7901组明显增加, 有着更强的增殖能力, 表明MSC对胃癌细胞SGC7901的生长起着明显的促进作用. 作用具体机制可能涉及: (1)参与改造肿瘤微环境[20-23]. MSC分化为具有血管内皮细胞特征的细胞, 促使肿瘤组织出现丰富脉管系统. 实验中证实SGC7901+MSC组的移植瘤组织中有极为丰富的血管脉管系统及纤维组织、脂肪组织, 尤其在瘤周明显; (2)增强肿瘤细胞活性[22,23]. MSC可通过与癌细胞之间的直接接触及分泌细胞因子如血管内皮生长因子、人成纤维细胞生长因子2、促血小板生长因子等促进肿瘤细胞的增殖活性、侵袭性、转移能力. 实验中观察到SGC7901+MSC组的肿瘤细胞胞体、胞核更大, 异型性明显, 癌细胞密度更高, 5-Fu化疗后坏死灶较SGC7901组明显减少. 本研究中在使用5-Fu化疗后, 混合细胞组的移植瘤体积及瘤质量仍较SGC7901组明显增加, 提示MSC提高了SGC7901细胞的5-Fu耐药性, 有研究发现, 这可能和MSC分泌的外泌体[24], 尤其是外泌体中含有的miR-15b和miR-16有关[25]. 当然, 间充质干细胞与肿瘤细胞的关系尚待进一步深入研究[26], 也有相反的研究报导, Hou等[27]研究发现间充质干细胞通过干预Wnt通路抑制了肝癌细胞HepG2增殖, 并且促进其凋亡. Han等[28]发现脐带间充质干细胞具有抑制前列腺癌细胞PC-3增殖的抗肿瘤细胞效应.
近年来有少数关于研究机体营养状况对于MSC的影响[29,30], 但是MSC对于肿瘤机体营养状况的研究尚未有. 本实验中对照裸鼠净质量数据发现, 5-Fu化疗后, D组的裸鼠净质量优于单纯C组. 在相同的5-Fu化疗药物不良反应影响下, D组的移植瘤体积及瘤质量明显高于C组. 因此, 理论上推测D组更易发生恶液质. 然而, 有意思的是, 实验中发现恶液质更为明显的是C组, 小鼠的体型消瘦更明显, 皮下脂肪更少, 营养状况更差, 其具体机制有待进一步考证. 当然统计中也并未对各个影响因素的交互作用进一步分析; 遗憾的还有本实验过程中我们未能完成对各组裸鼠的移植瘤生存期、器官组织的转移的观察, 及各组裸鼠的饮水量、进食量监测; 亟待开展进一步的相关研究.
尽管MSC对胃癌细胞的作用机制尚不完全明确, 但有效的抑制MSC的促进增殖作用具有重要的意义, MSC可能成为新的干预治疗靶点.
本研究发现骨髓间充质干细胞(mesenchymal stem cell, MSC)明显促进胃癌的生长和侵袭能力, 而体外修饰携带抗癌基因的MSC则可以抑制肿瘤的生长. 进一步深入理解机体中MSC和肿瘤细胞的相互作用, 可以更好地开发新的抗肿瘤策略.
崔梅花, 主任医师, 航天中心医院消化科, 北京大学航天临床医学院; 陈卫昌, 教授, 主任医师, 苏州大学附属第一医院
本文进一步深入研究MSC和胃癌的关系, 及MSC对于肿瘤机体营养状况的研究.
近年较多研究证实MSC在胃癌的发生发展及治疗过程中起着极为重要的作用. 也有少数关于研究机体营养状况对于MSC增殖分化的影响, 但是MSC对于肿瘤机体营养状况的研究尚未有.
本文发现5-氟尿嘧啶化疗后MSC改善了移植瘤小鼠的营养状况, 具体机制及应用前景还有待进一步研究.
本文为胃癌发病机制、治疗靶点的选择及改善胃癌患者的营养状况提供了一种思路.
本文研究了MSC对胃癌细胞体内成瘤能力及化疗耐药性的影响, 及MSC对于肿瘤机体营养状况的研究, 为胃癌发病机制及治疗靶点的选择提供其一思路.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 云南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV. Osteogenesis in transplants of bone marrow cells. J Embryol Exp Morphol. 1966;16:381-390. [PubMed] |
| 2. | Wu XZ, Chen D, Xie GR. Bone marrow-derived cells: roles in solid tumor. Minireview. Neoplasma. 2007;54:1-6. [PubMed] |
| 3. | Quante M, Tu SP, Tomita H, Gonda T, Wang SS, Takashi S, Baik GH, Shibata W, Diprete B, Betz KS. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer Cell. 2011;19:257-272. [PubMed] [DOI] |
| 4. | Nishimura K, Semba S, Aoyagi K, Sasaki H, Yokozaki H. Mesenchymal stem cells provide an advantageous tumor microenvironment for the restoration of cancer stem cells. Pathobiology. 2012;79:290-306. [PubMed] [DOI] |
| 5. | Nomoto-Kojima N, Aoki S, Uchihashi K, Matsunobu A, Koike E, Ootani A, Yonemitsu N, Fujimoto K, Toda S. Interaction between adipose tissue stromal cells and gastric cancer cells in vitro. Cell Tissue Res. 2011;344:287-298. [PubMed] [DOI] |
| 6. | Huang F, Wang M, Yang T, Cai J, Zhang Q, Sun Z, Wu X, Zhang X, Zhu W, Qian H. Gastric cancer-derived MSC-secreted PDGF-DD promotes gastric cancer progression. J Cancer Res Clin Oncol. 2014;140:1835-1848. [PubMed] [DOI] |
| 7. | Song B, Kim B, Choi SH, Song KY, Chung YG, Lee YS, Park G. Mesenchymal stromal cells promote tumor progression in fibrosarcoma and gastric cancer cells. Korean J Pathol. 2014;48:217-224. [PubMed] [DOI] |
| 8. | Niess H, Bao Q, Conrad C, Zischek C, Notohamiprodjo M, Schwab F, Schwarz B, Huss R, Jauch KW, Nelson PJ. Selective targeting of genetically engineered mesenchymal stem cells to tumor stroma microenvironments using tissue-specific suicide gene expression suppresses growth of hepatocellular carcinoma. Ann Surg. 2011;254:767-774; discussion 774-775. [PubMed] [DOI] |
| 9. | Zhu Y, Cheng M, Yang Z, Zeng CY, Chen J, Xie Y, Luo SW, Zhang KH, Zhou SF, Lu NH. Mesenchymal stem cell-based NK4 gene therapy in nude mice bearing gastric cancer xenografts. Drug Des Devel Ther. 2014;8:2449-2462. [PubMed] [DOI] |
| 10. | Berger L, Shamai Y, Skorecki KL, Tzukerman M. Tumor Specific Recruitment and Reprogramming of Mesenchymal Stem Cells in Tumorigenesis. Stem Cells. 2016;34:1011-1026. [PubMed] [DOI] |
| 11. | Zhou YL, Li YM, He WT. Application of Mesenchymal Stem Cells in the Targeted Gene Therapy for Gastric Cancer. Curr Stem Cell Res Ther. 2016;11:434-439. [PubMed] |
| 12. | Sun C, Zhao D, Dai X, Chen J, Rong X, Wang H, Wang A, Li M, Dong J, Huang Q. Fusion of cancer stem cells and mesenchymal stem cells contributes to glioma neovascularization. Oncol Rep. 2015;34:2022-2030. [PubMed] [DOI] |
| 13. | Tian LL, Yue W, Zhu F, Li S, Li W. Human mesenchymal stem cells play a dual role on tumor cell growth in vitro and in vivo. J Cell Physiol. 2011;226:1860-1867. [PubMed] [DOI] |
| 14. | Zhang Q, Ding J, Liu J, Wang W, Zhang F, Wang J, Li Y. Helicobacter pylori-infected MSCs acquire a pro-inflammatory phenotype and induce human gastric cancer migration by promoting EMT in gastric cancer cells. Oncol Lett. 2016;11:449-457. [PubMed] [DOI] |
| 15. | Weir C, Morel-Kopp MC, Gill A, Tinworth K, Ladd L, Hunyor SN, Ward C. Mesenchymal stem cells: isolation, characterisation and in vivo fluorescent dye tracking. Heart Lung Circ. 2008;17:395-403. [PubMed] [DOI] |
| 16. | Karp JM, Leng Teo GS. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 2009;4:206-216. [PubMed] |
| 17. | Meirelles Lda S, Fontes AM, Covas DT, Caplan AI. Mechanisms involved in the therapeutic properties of mesenchymal stem cells. Cytokine Growth Factor Rev. 2009;20:419-427. [PubMed] [DOI] |
| 18. | Lazennec G, Jorgensen C. Concise review: adult multipotent stromal cells and cancer: risk or benefit? Stem Cells. 2008;26:1387-1394. [PubMed] [DOI] |
| 19. | Ohta N, Ishiguro S, Kawabata A, Uppalapati D, Pyle M, Troyer D, De S, Zhang Y, Becker KG, Tamura M. Human umbilical cord matrix mesenchymal stem cells suppress the growth of breast cancer by expression of tumor suppressor genes. PLoS One. 2015;10:e0123756. [PubMed] [DOI] |
| 20. | Yao XH, Ping YF, Bian XW. Contribution of cancer stem cells to tumor vasculogenic mimicry. Protein Cell. 2011;2:266-272. [PubMed] [DOI] |
| 21. | Bernhard EJ. Interventions that induce modifications in the tumor microenvironment. Cancer Radiother. 2011;15:376-382. [PubMed] [DOI] |
| 22. | Leber MF, Efferth T. Molecular principles of cancer invasion and metastasis (review). Int J Oncol. 2009;34:881-895. [PubMed] |
| 23. | Scherzad A, Steber M, Gehrke T, Rak K, Froelich K, Schendzielorz P, Hagen R, Kleinsasser N, Hackenberg S. Human mesenchymal stem cells enhance cancer cell proliferation via IL-6 secretion and activation of ERK1/2. Int J Oncol. 2015;47:391-397. [PubMed] [DOI] |
| 24. | Ji R, Zhang B, Zhang X, Xue J, Yuan X, Yan Y, Wang M, Zhu W, Qian H, Xu W. Exosomes derived from human mesenchymal stem cells confer drug resistance in gastric cancer. Cell Cycle. 2015;14:2473-2483. [PubMed] [DOI] |
| 25. | Xia L, Zhang D, Du R, Pan Y, Zhao L, Sun S, Hong L, Liu J, Fan D. miR-15b and miR-16 modulate multidrug resistance by targeting BCL2 in human gastric cancer cells. Int J Cancer. 2008;123:372-379. [PubMed] [DOI] |
| 26. | Hong IS, Lee HY, Kang KS. Mesenchymal stem cells and cancer: friends or enemies? Mutat Res. 2014;768:98-106. [PubMed] [DOI] |
| 27. | Hou L, Wang X, Zhou Y, Ma H, Wang Z, He J, Hu H, Guan W, Ma Y. Inhibitory effect and mechanism of mesenchymal stem cells on liver cancer cells. Tumour Biol. 2014;35:1239-1250. [PubMed] [DOI] |
| 28. | Han I, Yun M, Kim EO, Kim B, Jung MH, Kim SH. Umbilical cord tissue-derived mesenchymal stem cells induce apoptosis in PC-3 prostate cancer cells through activation of JNK and downregulation of PI3K/AKT signaling. Stem Cell Res Ther. 2014;5:54. [PubMed] [DOI] |
| 29. | Mahajan A, Alexander LS, Seabolt BS, Catrambone DE, McClung JP, Odle J, Pfeiler TW, Loboa EG, Stahl CH. Dietary calcium restriction affects mesenchymal stem cell activity and bone development in neonatal pigs. J Nutr. 2011;141:373-379. [PubMed] [DOI] |
| 30. | Fani N, Ziadlou R, Shahhoseini M, Baghaban Eslaminejad M. Comparative epigenetic influence of autologous versus fetal bovine serum on mesenchymal stem cells through in vitro osteogenic and adipogenic differentiation. Exp Cell Res. 2016;344:176-182. [PubMed] [DOI] |