修回日期: 2016-07-22
接受日期: 2016-07-31
在线出版日期: 2016-08-28
探究经腹体表超声(transabdominal ultrasoud, TUS)在食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)术前评估的临床应用价值.
2014-12/2016-05接受手术切除的65例经胃镜初诊的AEG患者, 所有研究对象均于术前行TUS和电子计算机断层扫描(computed tomography, CT)检查, 结合术后病理进行分析对比.
参照Siewert分型, TUS对AEG临床分型诊断正确率为90.8%, 其中Ⅰ型85.7%, 非Ⅰ型92.2%.TUS及CT对AEG T分期的诊断准确率分别为33.8%、63.1%, 其中T1-3 29.4%、52.9%; T4 35.4%、66.7%, 两者在T分期诊断中差异有统计学意义(χ2 = 10.85, P = 0.001), 但在术前诊断为低分化的腺癌的AEG患者中, TUS与CT在T分期诊断中差异无统计学意义(χ2 = 0.26, P = 0.61).TUS及CT对AEG N分期的诊断准确率分别为38.5%、50.8%, 其中N0 87.5%、91.7%; N+ 9.8%、26.8%, 两者在N分期诊断中差异无统计学意义(χ2 = 0.07, P = 0.79).TUS及CT对AEG M分期的诊断一致.
术前TUS能准确判断AEG的分型, 有助于临床制定手术路径; TUS对AEG的N、M分期有较高的临床应用价值; 当AEG患者术前胃镜初诊为低分化腺癌时, TUS和CT均可用于术前TNM分期.
核心提要: 经腹体表超声(transabdominal ultrasoud, TUS)作为廉价、无创、无风险的检查方法可作为食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)临床分型的一种有效补充手段从而对部分病例术前制定出手术路径, 且对N、M分期有较高的临床价值, 当AEG患者术前胃镜初诊为低分化的腺癌时, TUS诊断术前TNM分期价值与CT相当.
引文著录: 丁柏成, 徐阿曼, 叶早群, 韩文秀, 韦之见, 陈章明, 袁笑, 刘虎. 经腹体表超声对食管胃结合部腺癌术前评估的应用价值. 世界华人消化杂志 2016; 24(24): 3612-3617
Revised: July 22, 2016
Accepted: July 31, 2016
Published online: August 28, 2016
To assess the value of transabdominal ultrasound (TUS) in the preoperative assessment of adenocarcinoma of the esophagogastric junction (AEG).
A total of 65 patients who underwent TUS and computed tomography (CT) preoperatively and were pathologically diagnosed with AEG after surgery from December 2014 to May 2016 were included in this study. The TUS or CT results were compared with pathological findings.
With regard to Siewert's classification, the diagnostic accuracy of TUS in AEG was 90.8% (85.7% for type Ⅰ and 92.2% for non-type Ⅰ). The accuracy of TUS and CT in T-staging of AEG was 33.8% and 63.1%, respectively, and there was a significant difference between the two diagnostic modalities (P < 0.05), although there was no significant difference in accuracy of N-staging and M-staging between CT and TUS (P > 0.05). For those who were preoperatively diagnosed with poorly differentiated adenocarcinoma, there was no significant difference in the accuracy of T-staging of AEG between TUS and CT (P > 0.05).
TUS is an available tool for the typing of AEG, which is useful for deciding surgical approaches. TUS has high value in preoperative N- and M-staging, and for patients who are preoperatively diagnosed with poorly differentiated adenocarcinoma, both TUS and CT can be used in preoperative TNM-staging.
- Citation: Ding BC, Xu AM, Ye ZQ, Han WX, Wei ZJ, Chen ZM, Yuan X, Liu H. Value of transabdominal ultrasoud in preoperative assessment of adenocarcinoma of the esophagogastric junction. Shijie Huaren Xiaohua Zazhi 2016; 24(24): 3612-3617
- URL: https://www.wjgnet.com/1009-3079/full/v24/i24/3612.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i24.3612
食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)是有别于食管癌和胃癌的独立疾病, 发病率呈现逐年上升趋势[1-3]. 目前AEG仍以手术治疗为主[4], 术前影像学检查可以对AEG进行分型和TNM分期, 有助于制定手术方案、判断预后. 术前对AEG分型诊断意见尚不统一, 且多使用CT对AEG进行TNM分期诊断[5], 但CT在患者胃肠道内残存钡剂、碘过敏以及危重患者的诊断上有局限性[6]. AEG位于食管和胃交界的特殊相对固定部位, 经腹体表超声(transabdominal ultrasoud, TUS)诊断时受胃内气体影响较小, 并具有廉价、快速、非侵入性、安全等优势. 本研究以术后病理为金标准, 分析TUS和CT对AEG的术前诊断, 探讨TUS在AEG术前评估的临床应用价值.
收集2014-12/2016-05安徽医科大学第一附属医院AEG患者102例, 纳入标准: (1)胃镜活检病理初诊为AEG; (2)拟行根治性切除或姑息性切除手术; (3)无CT检查禁忌证(如目前患有甲状腺功能亢进或重症肌无力; 曾有对含碘对比剂过敏的病史; 妊娠等); (4)肾功能正常(肾小球滤过率≥30 mL/min). 排除标准: (1)术后病理证实非AEG; (2)术前未同时行TUS及CT; (3)术前行化、放疗. 剔除无效数据后, 余65例纳入研究. 其中男49例, 女16例, 年龄35-80岁, 平均65岁±8岁. 患者术前均签署知情同意书, 术后均有病理证实. 日本东芝Sario超声诊断仪, 凸阵探头, 频率3.0-5.0 MHz; 德国西门子Siemens Sensation 64层螺旋CT机, 扫描参数: 200 mAs, 120 kv, 层厚0.625 mm.
TUS扫描前受检者禁食、水12 h并经排便后检查, 先观察空腹腹腔有无腹腔淋巴结肿大及周围脏器转移情况, 然后饮水500-800 mL检查胃部, 发现肿瘤后, 观察肿瘤形态、大小、内部血流分布, 病灶处胃壁厚度、浸润深度等[7]; CT检查时所有病例检查前空腹8 h, 扫描前10 min肌注盐酸山良菪碱20 mg, 饮水800-1000 mL, 先平扫, 然后注射对比剂碘海醇80 mL扫描. 分型根据肿瘤的解剖位置进行Siewert分型[8]; 临床TNM分期根据1987年国际抗癌联盟(Union for International Cancer Control, UICC)公布的胃癌TNM分期法[9]; 术后病理TNM分期采用2010年美国癌症联合委员会及UICC共同颁布的胃癌TNM分期(第七版)[10].
统计学处理 采用SPSS16.0统计学软件, 连续型变量采用Kolmogorov-Smirnov正态性检验. 定性资料多组间比较采用配对样本χ2检验, 配对资料的差值分析采用Wilcoxon符号秩和检验. P<0.05为差异有统计学意义.
AEG各型的临床基本特征如. 65例AEG患者, 参照Siewert分型, Ⅰ型14例(21.6%), Ⅱ型35例(53.8%), Ⅲ型16例(24.6%). 在手术方式的选择上, Ⅰ型多采用食管次全切除术和近端胃切除术+远端食管切除术, Ⅱ型和Ⅲ型多采用全胃切除+远端食管切除术. Ⅰ型AEG手术入路主要经胸, Ⅱ型和Ⅲ型多经腹(表1).
| 临床特征 | Ⅰ型(n = 14) | Ⅱ型(n = 35) | Ⅲ型(n = 16) | P值 |
| 男/女 | 9/5 | 27/8 | 13/3 | - |
| 年龄(岁) | 68±8 | 65±6 | 61±10 | 0.032 |
| CEA(ng/mL) | 3.5(1.9, 8.1) | 3.4(1.8, 8.2) | 4.1(1.5, 24.0) | 0.917 |
| CA199(U/mL) | 7.83(4.43, 23.66) | 9.45(3.92, 21.36) | 16.68(6.93, 22.98) | 0.431 |
| 胸骨下角(°) | 77±13 | 80±12 | 82±12 | 0.557 |
| 手术方式[n(%)] | ||||
| 食管次全切除术 | 7(50) | 0 | 0 | - |
| 全胃+远端食管切除术 | 2(14) | 27(77) | 14(88) | - |
| 近端胃+远端食管切除术 | 5(36) | 8(23) | 2(13) | - |
| 经胸手术 | 11(79) | 0 | 0 | - |
| 胸腹联合手术 | 3(21) | 2(6) | 0 | - |
| 经腹手术 | 0 | 33(94) | 16(100) | - |
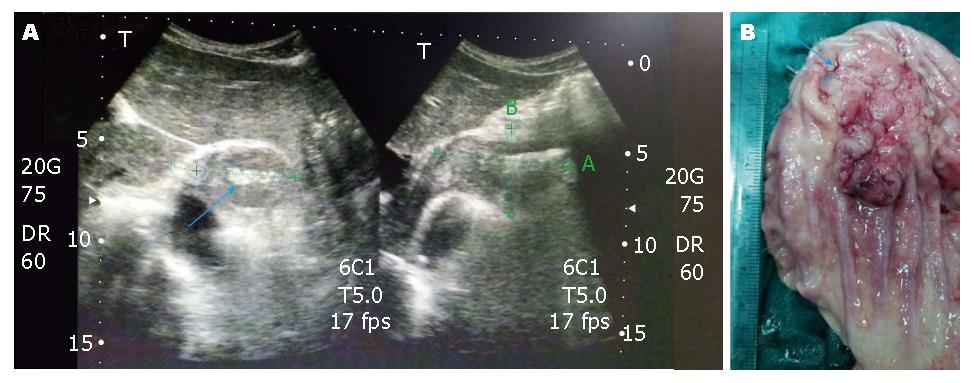
TUS对AEG患者分型诊断的总正确率为90.8%, Ⅰ型诊断正确率为85.7%, 非Ⅰ型诊断正确率为92.2%. 其中2例Ⅰ型误诊为非Ⅰ型, 4例非Ⅰ型误诊为Ⅰ型(表2). 图1展示了TUS诊断AEG分型且和术后标本进行比较.
| 病理分型 | n | TUS | 正确率(%) | |
| Ⅰ型 | 非Ⅰ型 | |||
| Ⅰ型 | 14 | 12 | 2 | 85.7 |
| 非Ⅰ型 | 51 | 4 | 47 | 92.2 |
| 合计 | 65 | 16 | 49 | 90.8 |
TUS对AEG T分期的诊断准确率为33.8%; CT对AEG T分期诊断准确率为63.1%, 两者在T分期诊断中差异有统计学意义(P<0.05). TUS对AEG N分期的诊断准确率为38.5%; CT对AEG N分期的诊断准确率为50.8%, 两者在N分期诊断中差异无统计学意义. TUS及CT对AEG M分期的诊断准确率均为98.5%(表3, 4).
| 分组 | T分期 | N分期 | M分期 | |||||
| T总 | T1-3 | T4 | N总 | N0 | N+ | M0 | M1 | |
| 病理 | 65 | 17 | 48 | 65 | 24 | 41 | 63 | 2 |
| TUS | 22(33.8) | 5(29.4) | 17(35.4) | 25(38.5) | 21(87.5) | 4(9.8) | 63(100) | 1(50) |
| CT | 41(63.1) | 9(52.9) | 32(66.7) | 33(50.8) | 22(91.7) | 11(26.8) | 63(100) | 1(50) |
| 分化程度 | TUS | CT | 合计 | χ2值 | P值 | |
| T1-3 | T4 | |||||
| 低分化 | T1-3 | 7 | 12 | 19 | 0.26 | >0.05 |
| T4 | 2 | 8 | 10 | |||
| 合计 | 9 | 20 | 29 | |||
| 非低分化 | T1-3 | 20 | 5 | 25 | 13.02 | <0.05 |
| T4 | 1 | 10 | 11 | |||
| 合计 | 21 | 15 | 36 | |||
| 低分化+非低分化 | T1-3 | 27 | 17 | 44 | 10.85 | <0.05 |
| T4 | 3 | 18 | 21 | |||
| 合计 | 30 | 35 | 65 | |||
65例AEG患者, 其中8例高级别上皮内瘤变, 24例中分化腺癌, 26例低分化腺癌, 2例差分化腺癌, 4例中分化腺癌伴部分黏液腺癌, 1例印戒细胞癌. 表4提示术前进行TUS及CT检查在低分化组腺癌(低分化腺癌、差分化腺癌、印戒细胞癌)患者的T分期诊断上差异无统计意义, 在非低分化组腺癌(高级别上皮内瘤变、中分化腺癌)当中差异有统计学意义(P<0.05).
近年来, AEG的发病率以每年5%-10%增长速度逐年升高, AEG的治疗仍然是以手术为主的综合治疗, 预后也与肿瘤大小、TNM分期密切相关. 因此, 术前准确的了解肿瘤分型、大小、浸润深度、局部淋巴结转移和远处转移情况对于指导手术和评估预后具有重大意义. 目前多采用CT行术前评估, 但TUS作为廉价、快速、非侵入性、安全的诊断方法, 可以补充CT在胃肠道内残存钡剂、碘过敏以及危重患者诊断上的局限性.
AEG的分型还存在争议[11-13], 本研究采用Siewert分型. TUS在诊断AEG分型时, 患者取仰卧位或头低脚高位加压腹部动态观察肿瘤, 凸阵探头探查垂直于剑突水平或斜向下(凸阵探头与前正中线向下水平呈钝角)可见肿瘤上缘时, 定义为Ⅱ型、Ⅲ型(非Ⅰ型); 凸阵探头在剑突水平斜向上(凸阵探头与前正中线向下水平呈锐角)观察到肿瘤上缘, 则定义为Ⅰ型. 本研究2例Ⅰ型误诊为非Ⅰ型当中, 胸骨下角为90°、86°; 4例非Ⅰ型误诊为Ⅰ型当中, 胸骨下角为70°、70°、75°以及68°. 分析原因可能是胸骨下角越大, 食管胃交界部(esophagogastric junction, EGJ)偏离了剑突水平越往下, 导致误差, 反之亦然. 另外, TUS观察到AEG肿瘤上缘与右侧膈肌位置关系: 如肿瘤上缘在右侧膈肌上方, 则指导术者可能需经胸手术, 如肿瘤上缘在右侧膈肌下方, 则术者应综合考虑各种因素决定手术方式[14-18].
肿瘤是否侵犯浆膜层直接影响患者术后五年生存率, 故将T1、T2、T3纳入一组研究, 表3、4比较提示CT在T分期诊断的正确率高于TUS, TUS对T分期的总体诊断正确率为33.8%, 较张艳华等[19]的研究略低, 原因可能为超声在T分期的诊断中仍然存在着过深或者过浅的现象, 过深判断因癌肿周围炎症水肿和疤痕形成所致; 过浅可能与病变侵犯程度、病变部位、扫查的切面有关. 廖盛日等[20]研究也表明: TUS在对胃壁浸润深度的判断中, T1的符合率最低, 而对T2、T3、T4的总符合率较高. 另外, 淋巴结的诊断决定着手术清扫范围[14,21-23], TUS和CT的正确率分别为38.5%、50.8%, 差异无统计学意义.两种检查方法对M分期的诊断正确率均较高.
肿瘤分化程度越差, 浸润程度越深, 伴随着预后也越差[23]. 其机理可能是肿瘤分化程度差, 缺乏细胞连接, 一般不形成腺管, 癌细胞广泛和弥散地浸润胃壁各层. 本组资料将患者按照胃镜病理分为低分化腺癌组和非低分化腺癌组, 在非低分化腺癌组, CT在T分期的诊断正确率要高于TUS. 而在低分化的腺癌组, TUS及CT在T分期诊断中差异无统计学意义, 提示此时TUS和CT均可以进行T分期检查.
TUS对AEG术前评估是具有局限性的. 首先, 本研究是一个小样本量的研究; 其次, 本研究的超声由2名高年资副主任医师进行TNM分期, 存在一定主观性差异.
总之, TUS作为廉价, 无创, 无风险的检查方法可作为AEG临床分型的一种有效补充手段从而对部分病例术前制定出手术路径, 且对N、M分期有较高的临床价值, 当AEG患者术前胃镜初诊为低分化的腺癌时, TUS诊断术前TNM分期价值与CT相当.
近年来, 食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)的发病率逐年升高, 目前对AEG的分型仍存在争议, 且AEG缺乏独立的TNM分期系统, 学者们对AEG处于深入研究阶段. 本研究立足于临床, 希望借助简单、方便的诊断对AEG的术前评估提供有效方案, 达到有利于患者的效果.
郭晓钟, 教授, 沈阳军区总医院消化内科; 危安, 主任医师, 湖南省人民医院超声科
临床对AEG的术前评估常用CT. 本研究从AEG的分型, 分期和分化三方面介绍经腹体表超声(transabdominal ultrasoud, TUS)对AEG进行术前评估, 希望可以弥补CT的不足之处, 使两者可以共同应用于临床.
既往鲜有报道TUS和CT对AEG术前TNM分期的比较, 另外TUS对AEG的诊断价值也少有研究. 本研究系统介绍了TUS在AEG术前评估中的应用价值.
CT在患者胃肠道内残存钡剂、碘过敏以及危重患者的诊断上有局限性, TUS弥补了这些不足, 且对于分化程度差的AEG诊断TNM分期与CT相当.
食管胃结合部腺癌(AEG): 介于贲门齿状线上下5 cm的肿瘤; Siewert分型: 是单纯基于肿瘤中心的解剖位置, 该肿瘤中心可以应用纵向胃黏膜皱襞的近端作为镜下贲门(零点)的有效参考来确定. 远端食管腺癌(>1到+5 cm)是指起源于专门的肠化生区域(Barrett食管)的肿瘤, 被归类为Ⅰ型; Ⅱ型肿瘤是指直接起源于胃食管交界部的贲门癌(+1到-2 cm); Ⅲ型肿瘤(-2到-5 cm)是指贲门下胃癌从下方侵犯到食管胃交界部或远端食管.
本文探讨了经腹体表超声对食管胃结合部腺癌术前评估的价值, 选题新型, 具有一定的临床价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 安徽省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:胡珊
| 1. | Yamashita H, Seto Y. [Optimal surgical approach for esophagogastric junction carcinoma]. Nihon Geka Gakkai Zasshi. 2015;116:40-44. [PubMed] |
| 2. | Sehdev A, Catenacci DV. Gastroesophageal cancer: focus on epidemiology, classification, and staging. Discov Med. 2013;16:103-111. [PubMed] |
| 3. | Buas MF, Vaughan TL. Epidemiology and risk factors for gastroesophageal junction tumors: understanding the rising incidence of this disease. Semin Radiat Oncol. 2013;23:3-9. [PubMed] [DOI] |
| 4. | Lerut T, Decker G, Coosemans W, De Leyn P, Decaluwé H, Nafteux P, Van Raemdonck D. Quality indicators of surgery for adenocarcinoma of the esophagus and gastroesophageal junction. Recent Results Cancer Res. 2010;182:127-142. [PubMed] [DOI] |
| 5. | Kim JW, Shin SS, Heo SH, Choi YD, Lim HS, Park YK, Park CH, Jeong YY, Kang HK. Diagnostic performance of 64-section CT using CT gastrography in preoperative T staging of gastric cancer according to 7th edition of AJCC cancer staging manual. Eur Radiol. 2012;22:654-662. [PubMed] [DOI] |
| 6. | Rossi C, Reginelli A, D'Amora M, Di Grezia G, Mandato Y, D'Andrea A, Brunese L, Grassi R, Rotondi A. Safety profile and protocol prevention of adverse reactions to uroangiographic contrast media in diagnostic imaging. J Biol Regul Homeost Agents. 2014;28:155-165. [PubMed] |
| 8. | Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg. 1998;85:1457-1459. [PubMed] [DOI] |
| 9. | 吴 在德, 吴 肇汉, 郑 树, 安 洪, 汪 建平. 外科学. 第7版. 北京: 人民卫生出版社 2008; 439. |
| 10. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 11. | Ajani JA, D'Amico TA, Almhanna K, Bentrem DJ, Besh S, Chao J, Das P, Denlinger C, Fanta P, Fuchs CS. Esophageal and esophagogastric junction cancers, version 1.2015. J Natl Compr Canc Netw. 2015;13:194-227. [PubMed] |
| 12. | Suh YS, Han DS, Kong SH, Lee HJ, Kim YT, Kim WH, Lee KU, Yang HK. Should adenocarcinoma of the esophagogastric junction be classified as esophageal cancer? A comparative analysis according to the seventh AJCC TNM classification. Ann Surg. 2012;255:908-915. [PubMed] [DOI] |
| 13. | Kim HI, Cheong JH, Song KJ, An JY, Hyung WJ, Noh SH, Kim CB. Staging of adenocarcinoma of the esophagogastric junction: comparison of AJCC 6th and 7th gastric and 7th esophageal staging systems. Ann Surg Oncol. 2013;20:2713-2720. [PubMed] [DOI] |
| 14. | Huang L, Xu AM. Adenocarcinoma of esophagogastric junction: controversial classification, surgical management, and clinicopathology. Chin J Cancer Res. 2014;26:226-230. [PubMed] [DOI] |
| 15. | Xiao JW, Liu ZL, Ye PC, Luo YJ, Fu ZM, Zou Q, Wei SJ. Clinical comparison of antrum-preserving double tract reconstruction vs roux-en-Y reconstruction after gastrectomy for Siewert types II and III adenocarcinoma of the esophagogastric junction. World J Gastroenterol. 2015;21:9999-10007. [PubMed] [DOI] |
| 16. | Nai C, Liu Z, Lian X, Liu S, Guo M, Xiao S, Liu J, Yang X, Zhang H. [Survival rate of proximal and total gastrectomy in treatment of esophagogastric junction adenocarcinoma (Siewert II( Types)]. Zhonghua Weichang Waike Zazhi. 2016;19:195-199. [PubMed] |
| 17. | Hosokawa Y, Kinoshita T, Konishi M, Takahashi S, Gotohda N, Kato Y, Daiko H, Nishimura M, Katsumata K, Sugiyama Y. Clinicopathological features and prognostic factors of adenocarcinoma of the esophagogastric junction according to Siewert classification: experiences at a single institution in Japan. Ann Surg Oncol. 2012;19:677-683. [PubMed] [DOI] |
| 18. | Wang W, Chen XL, Zhao SY, Xu YH, Zhang WH, Liu K, Chen XZ, Yang K, Zhang B, Chen ZX. Prognostic significance of preoperative serum CA125, CA19-9 and CEA in gastric carcinoma. Oncotarget. 2016; Apr 16. [Epub ahead of print]. [PubMed] [DOI] |
| 21. | Mine S, Sano T, Hiki N, Yamada K, Kosuga T, Nunobe S, Shigaki H, Yamaguchi T. Thoracic lymph node involvement in adenocarcinoma of the esophagogastric junction and lower esophageal squamous cell carcinoma relative to the location of the proximal end of the tumor. Ann Surg Oncol. 2014;21:1596-1601. [PubMed] [DOI] |
| 22. | Turkington RC, Parkes E, Kennedy RD, Eatock MM, Harrison C, McCloskey P, Purcell C. Clinical tumor staging of adenocarcinoma of the esophagus and esophagogastric junction. J Clin Oncol. 2015;33:1088. [PubMed] [DOI] |