修回日期: 2016-07-19
接受日期: 2016-08-01
在线出版日期: 2016-08-28
研究雷公藤甲素(triptolide, TP)对人结肠癌HCT116细胞中B细胞淋巴瘤/白血病-2相关X蛋白(B cell lymphoma/leukmia-2 associated X protein, Bax)/B细胞淋巴瘤/白血病-2(B cell lymphoma/leukmia-2, Bcl-2)和活性Caspase 3表达的影响, 从而研究TP对结肠癌细胞增殖的抑制作用及其可能的机制.
用不同浓度的TP(5、10、20、30、40、80 nmol/L)和空白对照组(0 nmol/L)处理HCT116细胞24、48、72 h, 用MTT法检测TP对结肠癌细胞增殖的抑制作用. 流式细胞仪检测细胞凋亡率, Western blot检测蛋白Bcl-2、Bax和Caspase 3、cleaved Caspase 3蛋白表达水平的变化.
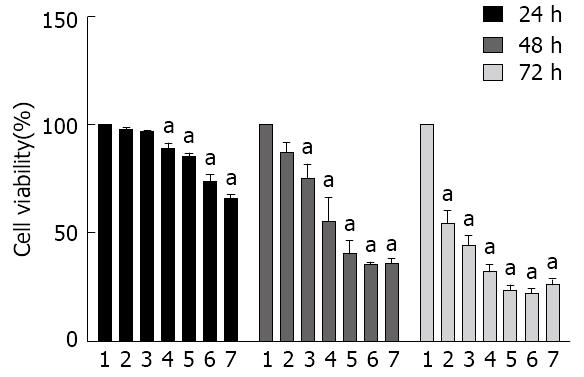
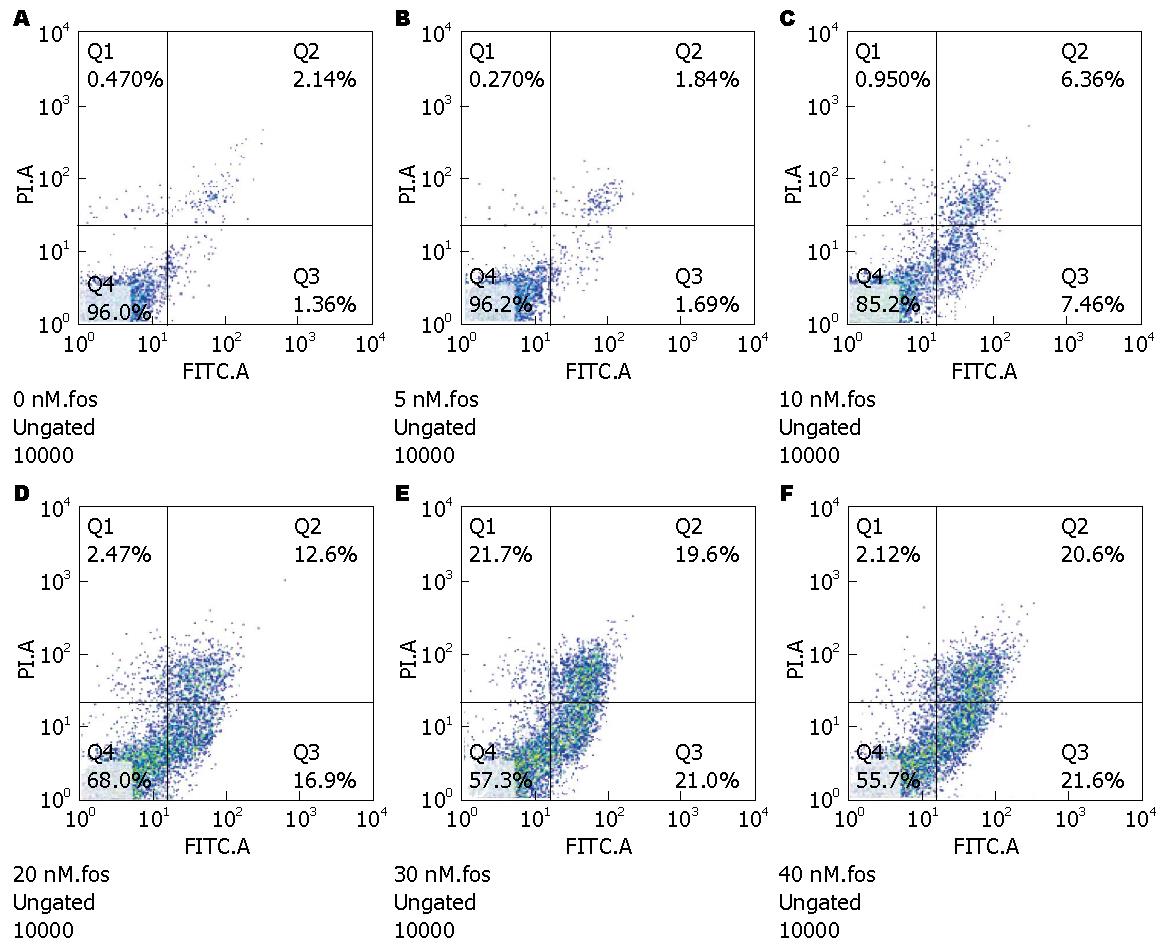
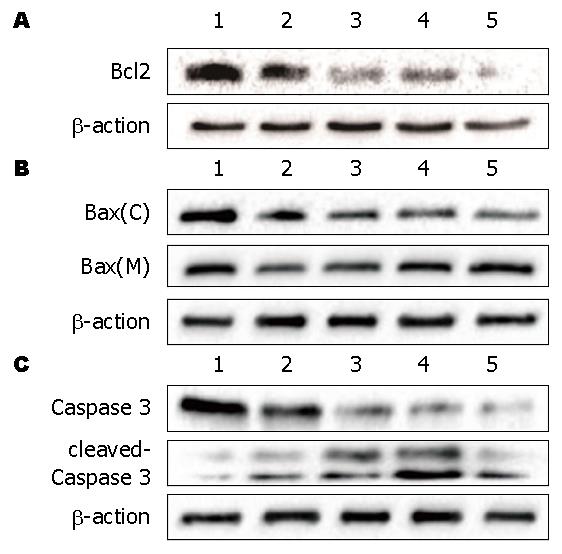
TP可显著抑制HCT116细胞的增殖, 且细胞的存活率随着TP浓度和作用时间的增加而下降, 呈浓度和时间效应. 5、10、20、30、40 nmol/L浓度的TP分别作用HCT116细胞48 h, 细胞凋亡率分别为4.25%、13.6%、34.4%、43.8%、44.5%, 呈剂量依赖关系(P<0.01). 10、20、30、40 nmol/L TP处理T116细胞48h, 随TP浓度的增加, Bcl-2的蛋白水平不断降低, Bax在细胞质的蛋白水平下降, 而在线粒体的蛋白水平升高, 呈剂量依赖关系; Caspase 3的蛋白水平不断降低, 促进cleaved Caspase 3的蛋白水平升高, 呈剂量依赖关系.
TP可显著抑制HCT116细胞的增殖, 可能通过抑制Bcl-2表达水平, 促进cleaved Caspase 3表达水平, 使其诱导人结肠癌HCT116细胞凋亡抵抗能力减弱.
核心提要: 本研究采用流式细胞仪及Western blot检测雷公藤甲素(triptolide, TP)处理后的结肠癌细胞凋亡及Bcl-2和Caspase-3蛋白表达. 提示TP可能是通过调节Bcl-2表达和线粒体内外的Bax表达, 改变Bcl-2/Bax比例, 以及Caspase 3和cleaved Caspase 3蛋白表达, 最终诱导结肠癌细胞凋亡的机制.
引文著录: 赵林, 吴鹏, 章平贵, 谢大泽, 高典, 周南进. 雷公藤甲素对人结肠癌HCT116细胞Bcl-2/Bax和活性Caspase 3表达的影响. 世界华人消化杂志 2016; 24(24): 3580-3586
Revised: July 19, 2016
Accepted: August 1, 2016
Published online: August 28, 2016
To investigate the effect of triptolide (TP) on the expression of Bax/B cell lymphoma/leukmia-2 (Bcl-2) and cleaved Caspase 3 in HCT116 cells and the mechanism of TP induced apoptosis.
HCT116 cells were divided into six groups and treated with 5, 10, 20, 30, 40, and 80 nmol/L TP, respectively. HCT116 cells treated with PBS were used control cells. After HCT116 cells were exposed to TP for 24 h, 48 h or 72 h, MTT assay was used for estimating the survival rates of HCT116 cells, flow cytometry (FCM) was applied to test the effects of TP on cell apoptosis, and Western blot was used for testing the expression of Bcl-2, Bax, Caspase 3, and activated Caspase 3.
TP could inhibit the proliferation of HCT116 cells. The survival rates of HCT116 cells decreased with the increase in the concentration and treatment time of TP. The survival rates were 4.25%, 13.6%, 34.4%, 43.8% and 44.5%, respectively, for cells exposed to 5, 10, 20, 30, and 40 nmol/L TP for 48h. The expression of Bcl-2 was decreased with the increase in the concentration of TP. Additionally, the level of Bax was decreased in the cytoplasm but increased in mitochondria, indicating that TP can promote Bax translocation from the cytoplasm to mitochondria. TP reduced the level of Caspase 3 in a concentration dependent manner; however, cleaved Caspase 3 level was increased.
TP can induce apoptosis of HCT116 cells by inhibiting the expression of Bcl-2, increasing the expression of Bax, and promoting the activation of Caspase 3.
- Citation: Zhao L, Wu P, Zhang PG, Xie DZ, Gao G, Zhou NJ. Effect of triptolide on expression of Bax/Bcl-2 and cleaved Caspase 3 in HCT116 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(24): 3580-3586
- URL: https://www.wjgnet.com/1009-3079/full/v24/i24/3580.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i24.3580
自上世纪80年代首个中药雷公藤制剂-雷公藤多苷片上市, 他已经世界卫生组织认定为治疗关节炎的"中国首创植物新药制剂", 其意义不亚于抗疟药"青篙素"的开发上市[1]. 雷公藤制剂是目前国内用于治疗类风湿疾病、系统性红斑狼疮等自身免疫性疾病的最主要免疫抑制剂之一[2]. 雷公藤甲素(triptolide, TP)是雷公藤的主要活性成分, 具有广谱、高效的抗肿瘤活性[3], TP对多种肿瘤均有抑制作用等[4,5]. 细胞凋亡是细胞在一定的生理或病理条件下, 受多种基因精确调控的主动的、程序化的死亡过程, 是机体重要的自稳调节机制. 近年来研究[6]表明, 线粒体参与很多凋亡信号通路, 在细胞存亡机制中起着至关重要的作用, 起着起始、放大的中枢作用. 功能完好的线粒体可以抑制细胞凋亡的发生[7], 反之可导致细胞出现衰老和凋亡, 乃至疾病的发生[8-11]. 而在众多的凋亡调控基因中, B细胞淋巴瘤/白血病-2(B cell lymphoma/leukmia-2, Bcl-2)蛋白家族和Caspase家族最受关注. Bcl-2和B细胞淋巴瘤/白血病-2相关X蛋白(B cell lymphoma/leukmia-2 associated X protein, Bax)是重要胞内蛋白质及平衡体系[12], 两者在肿瘤的发生和发展中具有重要作用[13]. 细胞凋亡可分为受体依赖的外源性途径和线粒体损伤的内源性途径以及内质网途径等. 外源性途径导致Caspase 8的活化[14], 内源性途径导致Caspase 9的活化[15]; 最终是Caspase 3被激活导致细胞凋亡. Caspase 3是凋亡过程中关键的凋亡执行蛋白酶, 他和Bcl-2/Bax在细胞凋亡过程中的关系已成为凋亡研究中的热点[16,17]. cleaved Caspase 3是Caspase 3切割的活化形式, 促凋亡作用. 本研究以人结肠癌HCT116细胞为研究对象, 通过TP在体外对其进行干预, 观察TP调节Bcl-2、Bax和Caspase 3、cleaved Caspase 3促细胞凋亡作用, 以期为结肠癌的临床治疗提供实验依据.
TP购自上海融禾制药; RPMI 1640、MTT试剂盒购自Solarbio; 胎牛血清购自杭州四季青; Annexin V-FITC/PI凋亡检测试剂盒购自BD; PMSF购自Amresco; 线粒体蛋白和胞浆蛋白提取试剂盒购自上海索莱宝生物公司; Bcl-2、Bax、cleaved Caspase 3和β-actin抗体均购自CellSignaling; Caspase 3抗体购自Affinity; 二抗购自中杉金桥, 增强化学发光试剂盒购自Pierce; 其余试剂均为国产AR级分析纯. 细胞培养箱购自ESCO; Western blot电泳仪购自BIO-RAD; 流式细胞仪购自BD.
1.2.1 药液配制: TP用DMSO配成5.5 mmol/L贮液, -20 ℃保存. 临用前以RPMI 1640细胞培养液稀释成5、10、20、30、40、80 nmol/L.
1.2.2 细胞培养: 人结肠癌HCT116细胞株, 购自中国医学科学院, 由江西省医学科学院保存. 细胞复苏后, 培养在RPMI 1640细胞培养液(含10%FBS, 100 U/L青霉素和100 U/L链霉素)中, 置37 ℃、50 mL/L CO2的细胞培养箱中培养, 隔2-3 d消化传代. 选取对数生长期细胞进行实验.
1.2.3 MTT检测细胞增殖: 胰酶消化HCT116细胞, 接种于96孔板中, 过夜培养后加入不同剂量的TP(5、10、20、30、40、80 nmol/L)处理HCT116细胞, 对照组加入PBS, 培养24、48、72 h. 终止培养前4 h, 加20 μL MTT(5 g/L)于各个孔中. 吸去培养基, 加入150 μl/L DMSO, 室温振荡10 min, 490 nm波长下测定各孔吸光度值.
1.2.4 FCM检测细胞凋亡: 制备单细胞悬液, 细胞计数调整细胞浓度为1×105/mL, 加入6孔板中, 1 mL/孔, 再加1 mL细胞培养液, 37 ℃ 50 mL/L CO2细胞培养箱中过夜; 次日分别加不同浓度TP(0、5、10、20、30、40 nmol/L)处理HCT116细胞, 继续培养48 h. 采用Annexin V-FITC/PI双标法检测HCT116细胞凋亡, 操作方法参照试剂盒说明书, 根据荧光强度计算细胞凋亡百分率.
1.2.5 Western blot检测Bax蛋白水平: 以不加TP处理的细胞为对照组, 实验组为不同浓度TP(10、20、30、40 nmol/L)处理HCT116细胞48 h. 收集经过处理的细胞, 线粒体蛋白和胞浆蛋白提取: 配制100 mmol/L PMSF溶液1.5 mL. 取线粒体分离试剂与裂解液, 向线粒体裂解液中加入PMSF, 使PMSF的最终浓度为1 mmol/L, 并加入样品; 依据试剂盒说明书操作.
1.2.6 Western blot检测Bcl-2和活性Caspase 3蛋白水平: 以不加TP处理的细胞为对照组, 实验组为不同浓度TP(10、20、30、40 nmol/L)处理HCT116细胞48 h. 收集经过处理的细胞, 用预冷的RIPA蛋白裂解液冰上裂解20 min, 然后4 ℃ 12000 r/min离心20 min, 收集上清, 用BCA试剂盒测定蛋白水平, 经SDS-PAGE分离蛋白, 将凝胶上的蛋白质电转至硝酸纤维素膜上. 用5%脱脂奶粉封闭2 h, 加入稀释的抗Bcl-2、Bax和活性Caspase 3抗体和抗β-actin抗体(内参), 4 ℃反应过夜; TBST洗膜3次, 加入稀释的相应二抗, 室温反应1 h; TBST洗膜3次, 增强化学发光试剂显色. 采用Image Pro Plus软件进行灰度值分析, 以各目的条带与内参条带的平均灰度值的比值作为目的蛋白的相对表达水平.
统计学处理 实验均重复3次, 统计分析SPSS16.0软件. 计量数据采用mean±SD表示, 定量资料采用t检验, P<0.05为差异具有统计学意义.
TP作用HCT116细胞24 h, 20 nmol/L TP可诱导细胞存活率下降; 作用48 h后, 结果显示, 10 nmol/L TP即可引起HCT116细胞的存活率明显降低, 此时, 40、80 nmol/L TP组的细胞存活率分别为35.18%、35.68%, 表明TP剂量再增加, 对HCT116细胞的存活率影响已不再明显(图1).
5、10、20、30以及40 nmol/L浓度的TP分别作用HCT116细胞48 h, 细胞凋亡率分别为4.25%、13.6%、34.4%、43.8%以及44.5%(图2), 提示TP可诱导HCT116细胞发生调亡, 并呈现出浓度依赖关系.
经10、20、30、40 nmol/L TP处理T116细胞48 h后, TP对Bcl-2蛋白水平的影响, 与空白对照组相比, β-actin的表达水平不受TP的影响, 随着TP浓度的增加, Bcl-2的表达不断降低, 呈剂量依赖性(图3A). TP对Bax蛋白水平的影响, 与空白对照组相比, β-actin的表达水平不受TP的影响, 随着TP浓度的增加, Bax在细胞质的表达水平下降, 而在线粒体的表达水平升高(图3B). 表明TP能够促进胞质中的Bax向线粒体内转移. TP对Caspase 3和cleaved Caspase 3蛋白水平的影响, 与空白对照组相比, β-actin的表达水平不受TP的影响, 随着TP浓度增加Caspase 3表达逐渐下降; 相反, 剪切蛋白cleaved Caspase 3随着TP浓度增加蛋白水平逐渐增加, 呈剂量依赖性(图3C), 提示其促凋亡增加.
结肠癌是临床最常见的消化系恶性肿瘤之一, 在发达国家每年影响人数超过一百万人[18]. 2012年, 美国的结肠癌发病率及病死率均居癌症发病率和病死率的第3位[19], 在国内结肠癌的发病率和病死率均较高[20]. 结肠癌的治疗, 目前仍以外科手术为主的综合治疗. 而传统植物来源的天然药物毒副作用小, 具有靶向杀伤肿瘤细胞的特点, 在治疗各种肿瘤中发挥着重要作用, 是目前抗肿瘤研究的热点[21-23]. 已有研究表明TP可通过不同途径抑制肿瘤细胞的增殖并诱导凋亡, 如TP处理对胰腺癌AsPC-1细胞活性有显著的抑制作用[5], TP可诱导人胰腺癌细胞凋亡[24], TP联合吉西他滨或/和紫杉醇治疗可使胰腺癌小鼠生存率提高、减少转移和恶性腹水[22,23]. TP处理结肠癌细胞株HCT116和HT29降低细胞活性呈剂量和时间依赖性, TP能通过抑制转录因子E2F1活性引起细胞周期G1阻滞[25]. 本研究结果表明, TP可以抑制HCT116细胞的增殖, 且细胞的存活率随着TP浓度和作用时间的增加而下降, 呈浓度和时间效应.
细胞凋亡的发生和发展分为凋亡诱导、调控执行和效应阶段, 现已证明至少有死亡受体途径、线粒体途径和内质网途径参与凋亡的发生. 其中死亡受体通路是比较成熟的信号传导途径[26]. 线粒体参与很多凋亡信号通路, 起着起始、放大的中枢作用[6]. 目前认为, 在凋亡信号的诱导下线粒体内外膜之间通透性转运孔开放, 线粒体渗透转换孔大量开启能引起膜电位崩解并导致细胞凋亡[27]. Bcl-2家族蛋白广泛分布在线粒体外膜, 是重要的线粒体凋亡调节因子, 对线粒体介导的细胞凋亡起调控作用[28]. 我们的研究表明, TP处理T116细胞48 h, 随TP浓度的增加, Bcl-2的蛋白水平不断降低, Bax在细胞质的蛋白水平下降, 而在线粒体的蛋白水平升高; 表明Bc1-2 家族蛋白成员间的相互作用对线粒体介导的细胞凋亡起调控作用. 有学者将Bcl-2和Bax的比值称作"凋亡开关", Bax蛋白占优时细胞凋亡, Bcl-2蛋白占优时则细胞存活[29]. 研究[25]发现, 在大鼠自发性乳腺肿瘤中Bax蛋白及mRNA的表达量均呈下降趋势、Bcl-2蛋白及mRNA的表达量则升高, 且Bcl-2/Bax的比例不断升高. Bcl-2、Bax结合可形成Bcl-2/Bax 异二聚体, 这一比值决定了细胞接受调控信号后细胞凋亡与否的状态. 冯俊伟等[30]研究结果显示, Bcl-2在结直肠癌中的表达强于癌旁组织, 而Bax表达在两种组织中无明显差异; 结直肠癌中Bcl-2与Bax存在负相关. 我们的研究显示, TP处理HCT116细胞后, Bax在细胞质的表达下降, 而在线粒体的表达升高, TP能够促进胞质中的Bax向线粒体内转移. 表明Bax二聚体在膜上打开通道, 增加通透性, 所以, 蛋白Bcl-2水平的降低和Bax的水平升高, HCT116细胞对凋亡的抵抗性下降, TP发挥抗肿瘤效应. 这认同了何双艳等[31]研究, 细胞凋亡调节蛋白Bax、Bcl-2表达上调, 二者表达的相对比例发生异常, 可能是大鼠非酒精性脂肪性肝病中肝细胞发生凋亡的重要原因之一.
崔雨婷等[32]对雌性SD大鼠乳腺癌的研究认为, Caspase 3参与了一系列与凋亡相关的细胞变化过程, 且与Bcl-2共同参与了细胞凋亡的调节机制, 在乳腺癌的发生和发展过程中发挥重要作用. 姜辉等[33]研究发现, 给予新风胶囊干预后, 可显著降低佐剂性关节炎大鼠滑膜组织中Bcl-2蛋白和mRNA的表达, 增加Bax、Caspase 3蛋白和mRNA的表达, 提示新风胶囊可通过调节Bcl-2、Bax、Caspase 3的表达, 增加细胞凋亡来对抗滑膜细胞的过度增殖. 线粒体外膜通透性的改变, 引起凋亡相关因子的释放, 激活caspase 9, 最后激活效应器caspase 3, 进入内源性线粒体凋亡通路, 最终引起细胞凋亡. 崔雨婷等[32]还发现, Caspase 3蛋白和mRNA的表达量随乳腺肿瘤病变程度的加深而不断降低, 且Caspase 3的表达与Bcl-2的表达呈负相关; 说明当发生乳腺肿瘤时, 细胞凋亡功能被抑制, 从而使癌细胞不断增殖. Caspase 3切割(cleaved)活化之后就会变成cleaved Caspase 3, 后者是前者的活化形式. 我们的研究表明, TP呈浓度依赖抑制Caspase 3的蛋白水平, 促进cleaved Caspase 3的蛋白水平; 与Zhou等[24]在人胰腺癌细胞的研究结果相一致, 表明TP可能通过抑制Bcl-2表达、促进Caspase 3活化, 进而导致结直肠癌细胞凋亡抵抗能力减弱.
总之, 大量研究显示Bcl-2 家族和Caspase 家族在细胞凋亡转导通路尤其是线粒体途径中发挥了极为重要的调控作用, 本实验通过动态结肠癌HCT116细胞凋亡百分数、Bcl-2/Bax、Caspase 3的表达, 为细胞凋亡运用于结肠癌的诊治提供有力的理论依据, 然而对Caspase家族的认识还有待更进一步深入, 研究也日益受到关注, 如Caspase 9、Caspase 8和 Caspase 2, 奥曲肽在人肝癌细胞HepG2能显著增加Caspase 8和Caspase 2的活性[34]. 这都要求我们进一步揭示结肠癌细胞凋亡的复杂的分子机制, 给临床的诊断、治疗、及预后判定开辟一条新的途径.
结肠癌是临床最常见的消化系恶性肿瘤之一, 在国内随着人们生活水平和饮食结构的不断改变, 其发病率和死亡率呈逐年升高的趋势. 结肠癌的治疗, 目前仍以外科手术为主的综合治疗, 但是临床效果尚不理想, 故进一步寻求有效的干预阻断结肠癌发生发展的线索和有效的天然植物药物具有重要的理论及实用意义.
李树德, 副教授, 云南省昆明市昆明医科大学基础医学院生物化学与分子生物学系; 周建奖, 教授, 贵州省贵阳市贵阳医学院分子生物学重点实验室
雷公藤甲素(triptolide, TP)具有抗肿瘤活性. 细胞凋亡是受多种基因精确调控的主动的、程序化的死亡过程, 有研究表明B细胞淋巴瘤/白血病-2(B cell lymphoma/leukmia-2, Bcl-2)/B细胞淋巴瘤/白血病-2相关X蛋白(B cell lymphoma/leukmia-2 associated X protein, Bax)以及Caspase 3是决定细胞凋亡的重要因素, 而TP对癌细胞增殖具有明显的抑制、促进凋亡及控制转移的作用, 但关于其是否可影响Bcl-2/Bax以及Caspase 3蛋白还没有报道, 因此研究其可填补这方面的内容.
Oliveira研究发现, 在大鼠乳腺肿瘤中Bax表达下降、Bcl-2表达升高, 且Bcl-2/Bax的比例升高; Caspase 3表达随乳腺肿瘤病变程度的加深而不断降低, 且Caspase 3的表达与Bcl-2的表达呈负相关. 毛等检测TP处理后的胰腺癌AsPC-1细胞, 发现p-GSK-3β的高表达诱导胰腺癌细胞凋亡.
本研究显示TP处理结肠癌T116细胞后, 降低Bcl-2的蛋白水平, 线粒体内的Bax较体外的蛋白水平增高, 表明Bc1-2家族蛋白成员间的相互作用对线粒体介导的细胞凋亡起调控作用; TP可能通过抑制Bcl-2表达、促进Caspase 3而导致结肠癌细胞凋亡抵抗能力减弱.
本研究显示TP可在体外诱导结肠癌T116细胞的凋亡, 并呈剂量和时间依赖性, 提示调节凋亡相关蛋白Bcl-2和Caspase 3表达是其可能作用机制, 但对TP是否还有其他介导途径及Caspase家族的作用均需进一步深入研究.
本文用不同浓度的TP处理结肠癌HCT116细胞不同的时间, 检测了细胞增殖、凋亡及凋亡相关蛋白的表达, 探讨TP引起结肠癌细胞凋亡的机制, 因此该文有一定的科学意义和实用价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 3. | Liu Q. Triptolide and its expanding multiple pharmacological functions. Int Immunopharmacol. 2011;11:377-383. [PubMed] [DOI] |
| 4. | Li XJ, Jiang ZZ, Zhang LY. Triptolide: progress on research in pharmacodynamics and toxicology. J Ethnopharmacol. 2014;155:67-79. [PubMed] [DOI] |
| 6. | Penninger JM, Kroemer G. Mitochondria, AIF and caspases--rivaling for cell death execution. Nat Cell Biol. 2003;5:97-99. [PubMed] [DOI] |
| 7. | Scarabelli TM, Stephanou A, Pasini E, Gitti G, Townsend P, Lawrence K, Chen-Scarabelli C, Saravolatz L, Latchman D, Knight R. Minocycline inhibits caspase activation and reactivation, increases the ratio of XIAP to smac/DIABLO, and reduces the mitochondrial leakage of cytochrome C and smac/DIABLO. J Am Coll Cardiol. 2004;43:865-874. [PubMed] [DOI] |
| 8. | Tocchi A, Quarles EK, Basisty N, Gitari L, Rabinovitch PS. Mitochondrial dysfunction in cardiac aging. Biochim Biophys Acta. 2015;1847:1424-1433. [PubMed] [DOI] |
| 9. | Wang CH, Tsai TF, Wei YH. Role of mitochondrial dysfunction and dysregulation of Ca(2+) homeostasis in insulin insensitivity of mammalian cells. Ann N Y Acad Sci. 2015;1350:66-76. [PubMed] [DOI] |
| 11. | Seydi E, Motallebi A, Dastbaz M, Dehghan S, Salimi A, Nazemi M, Pourahmad J. Selective Toxicity of Persian Gulf Sea Cucumber (Holothuria parva) and Sponge (Haliclona oculata) Methanolic Extracts on Liver Mitochondria Isolated from an Animal Model of Hepatocellular Carcinoma. Hepat Mon. 2015;15:e33073. [PubMed] [DOI] |
| 12. | Fan H, Li X, Wang W, Lai Q, Tang X, Gao D, Yin X, Xu T. Effects of NMDA-Receptor Antagonist on the Expressions of Bcl-2 and Bax in the Subventricular Zone of Neonatal Rats with Hypoxia-Ischemia Brain Damage. Cell Biochem Biophys. 2015;73:323-330. [PubMed] [DOI] |
| 13. | Moazami-Goudarzi M, Farshdousti-Hagh M, Hoseinpour-Feizi A, Talebi M, Movassaghpour-Akbari AA, Shams-Asanjan K, Eyvazi-Ziyaee J, Seifi M. The acute lymphoblastic leukemia prognostic scoring whether it is possible by BCL-2, BAX gene promoter genotyping. Caspian J Intern Med. 2016;7:105-113. [PubMed] |
| 14. | Helmke C, Raab M, Rödel F, Matthess Y, Oellerich T, Mandal R, Sanhaji M, Urlaub H, Rödel C, Becker S. Ligand stimulation of CD95 induces activation of Plk3 followed by phosphorylation of caspase-8. Cell Res. 2016;26:914-934. [PubMed] [DOI] |
| 15. | Zhu Q, Yang J, Zhu R, Jiang X, Li W, He S, Jin J. Dihydroceramide-desaturase-1-mediated caspase 9 activation through ceramide plays a pivotal role in palmitic acid-induced HepG2 cell apoptosis. Apoptosis. 2016;21:1033-1044. [PubMed] [DOI] |
| 16. | Teshima TH, Ianez RC, Coutinho-Camillo CM, Tucker AS, Lourenço SV. Apoptosis-associated protein expression in human salivary gland morphogenesis. Arch Oral Biol. 2016;69:71-81. [PubMed] [DOI] |
| 17. | Huang WH, Liao WR, Sun RX. Astragalus polysaccharide induces the apoptosis of human hepatocellular carcinoma cells by decreasing the expression of Notch1. Int J Mol Med. 2016;38:551-557. [PubMed] [DOI] |
| 18. | DeSantis CE, Lin CC, Mariotto AB, Siegel RL, Stein KD, Kramer JL, Alteri R, Robbins AS, Jemal A. Cancer treatment and survivorship statistics, 2014. CA Cancer J Clin. 2014;64:252-271. [PubMed] [DOI] |
| 19. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 22. | Dudeja V, Modi S, Giri B, Majumder K, Banerjee S, Saluja A. Synergy of water soluble prodrug triptolide (minnelide) with gemcitabine and nab-paclitaxel in pancreatic cancer. J Clin Oncol. 2016;34:259. |
| 23. | Qiao Z, He M, He MU, Li W, Wang X, Wang Y, Kuai Q, Li C, Ren S, Yu Q. Synergistic antitumor activity of gemcitabine combined with triptolide in pancreatic cancer cells. Oncol Lett. 2016;11:3527-3533. [PubMed] [DOI] |
| 24. | Zhou GX, Ding XL, Huang JF, Zhang H, Wu SB, Cheng JP, Wei Q. Apoptosis of human pancreatic cancer cells induced by Triptolide. World J Gastroenterol. 2008;14:1504-1509. [PubMed] |
| 25. | Oliveira AR, Beyer G, Chugh R, Skube SJ, Majumder K, Banerjee S, Sangwan V, Li L, Dawra RK, Subramanian S. Triptolide abrogates growth of colon cancer and induces cell cycle arrest by inhibiting transcriptional activation of E2F. Lab Invest. 2015;95:648-659. [PubMed] [DOI] |
| 28. | Tischner D, Woess C, Ottina E, Villunger A. Bcl-2-regulated cell death signalling in the prevention of autoimmunity. Cell Death Dis. 2010;1:e48. [PubMed] [DOI] |
| 29. | Panasiuk A, Dzieciol J, Panasiuk B, Prokopowicz D. Expression of p53, Bax and Bcl-2 proteins in hepatocytes in non-alcoholic fatty liver disease. World J Gastroenterol. 2006;12:6198-6202. [PubMed] |
| 30. | 冯 俊伟, 张 志勇, 王 爱军, 王 红钰, 徐 晋珩, 吴 肖, 程 健, 张 超, 郑 宝军, 施 华. 结直肠癌组织中TAZ表达与Bcl-2、Bax、Caspase-3的关系及临床意义. 中国老年学杂志. 2014;34:5419-5420. |
| 31. | 何 双艳, 李 昌平, 李 鹏, 钟 晓琳. Fas/FasL、Bcl-2/Bax、Caspase-8在大鼠非酒精性脂肪性肝病中的作用机制. 世界华人消化杂志. 2012;20:3761-3766. [DOI] |
| 32. | 崔 雨婷, 张 睿, 陈 正礼, 罗 启慧, 祝 春梅, 孙 凤娇, 陈 梦鹿. 大鼠自发性乳腺肿瘤中Bax、Bcl-2和Caspase-3的表达. 江大学学报(业与生命科学版). 2016;42:119-126. |
| 33. | 姜 辉, 刘 健, 高 家荣, 孟 楣, 秦 秀娟, 王 婷. 新风胶囊上调佐剂性关节炎大鼠滑膜组织Bax和caspase-3表达并下调Bcl-2表达. 细胞与分子免疫学杂志. 2016;32:457-461. |
| 34. | Sun KW, Ma YY, Guan TP, Xia YJ, Shao CM, Chen LG, Ren YJ, Yao HB, Yang Q, He XJ. Oridonin induces apoptosis in gastric cancer through Apaf-1, cytochrome c and caspase-3 signaling pathway. World J Gastroenterol. 2012;18:7166-7174. [PubMed] [DOI] |