修回日期: 2016-07-25
接受日期: 2016-08-07
在线出版日期: 2016-08-28
研究精氨酸脱亚胺酶(arginine deiminase, ADI)对胰腺癌细胞株迁移、侵袭能力的影响及可能的分子机制.
选取精氨琥珀酸合成酶表达缺陷和表达阳性的胰腺癌细胞株PANC-1和BxPC-3接受含ADI培养基或普通培养基培养干预. 细胞划痕及Transwell试验检测细胞迁移和侵袭能力; 实时定量PCR技术及Western blot检测侵袭相关基因mRNA和蛋白的改变. Western blot和Transwell试验检测ADI联合PI3K信号抑制剂LY29400对PANC-1细胞侵袭行为及分子的影响.
ADI可抑制PANC-1细胞的迁移、侵袭(P<0.05), 下调PANC-1细胞尿激酶型纤溶酶原激活因子、基质蛋白金属酶(matrix metalloproteinases, MMP)-2、MMP-9, 和上调金属蛋白酶类组织抑制剂-2和E-Cadherin的mRNA和/或蛋白表达水平(P<0.05); 而对BxPC-3细胞侵袭能力影响不明显. ADI可下调PANC-1细胞PI3K/AKT/核转录因子-κB(nuclear factor-kappa B, NF-κB)信号通路蛋白p-AKT、p-p65的表达水平, 而LY294002则协同ADI的这种作用, 并协同下调MMP-2水平; Transwell侵袭试验也显示LY294002可协同ADI抑制胰腺癌细胞的侵袭能力(P<0.05).
ADI通过阻断PI3K-AKT信号通路调控侵袭相关基因表达抑制胰腺癌细胞侵袭.
核心提要: 本研究探讨了精氨酸脱亚胺酶(arginine deiminase, ADI)对胰腺癌细胞侵袭行为的影响及侵袭相关基因mRNA及蛋白表达的改变, 并联合应用PI3K通路抑制剂干预观察胰腺癌细胞侵袭行为和分子的改变, 验证ADI通过阻断PI3K-AKT信号通路抑制胰腺癌细胞侵袭的分子机制, 为ADI精氨酸剥夺及联合PI3K抑制剂作为胰腺癌的治疗策略提供理论依据.
引文著录: 刘江波, 雷亮亮, 杨延辉, 黎韡, 马清涌, 刘德纯, 李三强. 精氨酸脱亚胺酶阻断PI3K-AKT通路抑制胰腺癌细胞侵袭. 世界华人消化杂志 2016; 24(24): 3570-3579
Revised: July 25, 2016
Accepted: August 7, 2016
Published online: August 28, 2016
To investigate the impact of arginine deiminase (ADI) on the migration and invasion of human pancreatic cancer cells and the possible mechanism involved.
The pancreatic cancer cell lines PANC-1 expressing defective argininosuccinate synthase (ASS) and BxPC-3 expressing ASS protein were chosen for the ADI treatment experiments, and they were cultured in the medium containing ADI (experimental group) or the common medium without ADI (control group). The impact of ADI on the migration and invasion of the two pancreatic cancer cell lines was examined by scratch assay and transwell invasion assay. The mRNA and protein expression of invasion-related genes in pancreatic cancer cells treated with ADI was detected by real-time quantitative PCR and/or Western blot. The expression of signal transduction proteins and invasion-related proteins in PANC-1 cell treated with ADI in combination with PI3K signaling inhibitor LY294002 was also analyzed.
ADI significantly inhibited cell migration and invasion (P < 0.05), down-regulated the mRNA and protein levels of urokinase plasminogen activator, matrix metalloproteinases (MMP)-2, as well as MMP-9, and elevated the levels of tissue inhibitor of metalloproteinase-2 and E-Cadherin (P < 0.05) in ASS deficient pancreatic cancer cell line PANC-1; while there were no obvious changes for ASS-positive pancreatic cancer cell line BxPC-3. ADI reduced the expression levels of p-AKT and p-p65, which are involved in the PI3K/AKT/nuclear factor-kappa B (NF-κB) signaling, in PANC-1 cells, and PI3K inhibitor LY294002 can synergize the effect of ADI on reducing the levels of phosphorylation of the signaling protein and MMP-2. Furthermore, in combination with ADI, LY294002 synergistically inhibited the invasion ability of pancreatic cancer PANC-1 cells (P < 0.05).
ADI inhibits the invasion of pancreatic cancer cells by regulating the expression of invasion-related genes via blocking the PI3K-AKT signaling pathway.
- Citation: Liu JB, Lei LL, Yang YH, Li W, Ma QY, Liu DC, Li SQ. Arginine deiminase inhibits pancreatic cancer cell invasion by blocking PI3K-AKT signaling pathway. Shijie Huaren Xiaohua Zazhi 2016; 24(24): 3570-3579
- URL: https://www.wjgnet.com/1009-3079/full/v24/i24/3570.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i24.3570
胰腺癌恶性程度高、进展迅速, 早期即发生局部浸润和转移, 且对化疗和放射治疗耐受, 因此预后极差, 死亡率几乎与发病率相等[1-3]. 因此, 研究胰腺癌治疗的新方法迫在眉睫. 精氨酸是一种半必需氨基酸, 参与人体多种生理功能[4]. 人类细胞可以利用瓜氨酸经尿素循环关键酶精氨琥珀酸合成酶(argininosuccinate synthetase, ASS)合成精氨酸[5,6]. 研究[7,8]显示恶性肿瘤患者的血清精氨酸水平通常比健康人低, 提示肿瘤细胞可能需要较多的精氨酸供应才可维持持续的生长及侵袭转移. 一些恶性肿瘤细胞, 如黑色素瘤、胰腺癌和肝细胞癌等ASS表达缺陷, 不能利用瓜氨酸合成精氨酸, 称为精氨酸营养缺陷型肿瘤[6,9-13]. 靶向精氨酸可用性的干预方法已受到广泛的关注, 且已在某些肿瘤显示出抗肿瘤效应[14,15]. 精氨酸脱亚胺酶(arginine deiminase, ADI), EC3.5.3.6能将精氨酸转换成瓜氨酸而达到精氨酸剥夺, 阻断癌细胞对精氨酸的利用, 有可能作为ASS表达缺陷肿瘤的潜在治疗制剂[11,16]. 我们以前的研究显示, ADI可改变胰腺癌细胞的增殖和克隆能力[17], 因此, 本研究拟通过应用ADI干预胰腺癌细胞株观察其对癌细胞迁移、侵袭能力的改变, 以及探讨这种改变的分子机制.
人胰腺癌细胞株PANC-1和BxPC-3均购自中科院上海细胞所, 由西安交通大学医学院第一附属医院中心实验室保存. 细胞培养器皿及Transwell小室均购自Corning公司. ADI由北京天宇祥达生物技术有限公司合成. DMEM液体培养基、胎牛血清购自Hyclone公司; 胰蛋白酶购自GIBCO公司; 细胞总蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒购自Pierce公司; 蛋白质预染Marker购自美国Fermentas(MBI)公司; PVDF膜购自美国Millipore公司; 基质蛋白金属酶(matrix metalloproteinases, MMP)-2, MMP-9, 尿激酶纤维蛋白溶酶原激活因子(urokinase plasminogen activator, uPA)、核转录因子-κB(nuclear factor-kappa B, NF-κB)p65、β-actin抗体购自Santa Cruz公司; p-p65、ERK、p-ERK、AKT、p-AKT抗体购自Bioworld公司; E-Cadherin, PI3KCA抗体购自Proteintech公司; Anti-rabbit IgG及Anti-mouse IgG二抗购自Santa Cruz公司; 总RNA提取试剂TRIzol购自Invitrogen公司; 逆转录试剂盒购自Fermentas公司; 实时定量PCR检测(realtime quantitative PCR, qRT-PCR)试剂盒及检测的uPA、MMP-2、MMP-9、TIMP-2、E-Cadherin和GAPDH基因的特异性引物由TaKaRa宝生物工程(大连)有限公司提供(表1).
| 引物名称 | 序列 | 扩增大小(bp) |
| uPA | F: 5'-GTGAGATCACTGGCTTTGGA-3' | 220 |
| R: 5'-CCTTGGAGGGAACAGACGAG-3' | ||
| MMP-2 | F: 5'-GACGGTAAGGACGGACTC-3' | 172 |
| R: 5'-TGCCATTGAACAAGAAGGG-3' | ||
| MMP-9 | F: 5'-TTGACAGCGACAAGAAGTGG-3' | 207 |
| R: 5'-CAGGGCGAGGACCATAGA-3' | ||
| TIMP-2 | F: 5'-GAACATCAACGGGCACCAG-3' | 299 |
| R: 5'-TCCCTCCAGACCCACAACC-3' | ||
| E-Cadherin | F: 5'-TCCCATCAGCTGCCCAGAAA-3' | 500 |
| R: 5'-TGACTCCTGTGTTCCTGTTA-3' | ||
| GAPDH | F: 5'-CTCTGATTTGGTCGTATTGGG-3' | 209 |
| R: 5'-TGGAAGATGGTGATGGGATT-3' |
1.2.1 细胞培养: PANC-1和BxPC-3细胞株接种于含10%胎牛血清的经改良的DMEM培养液中传代培养. 根据培养要求添加和1%青霉素/链霉素双抗液, 在37 ℃、50 mL/L CO2恒湿培养箱培养. 用0.25%胰蛋白酶进行消化传代, 选用对数生长期的细胞进行实验.
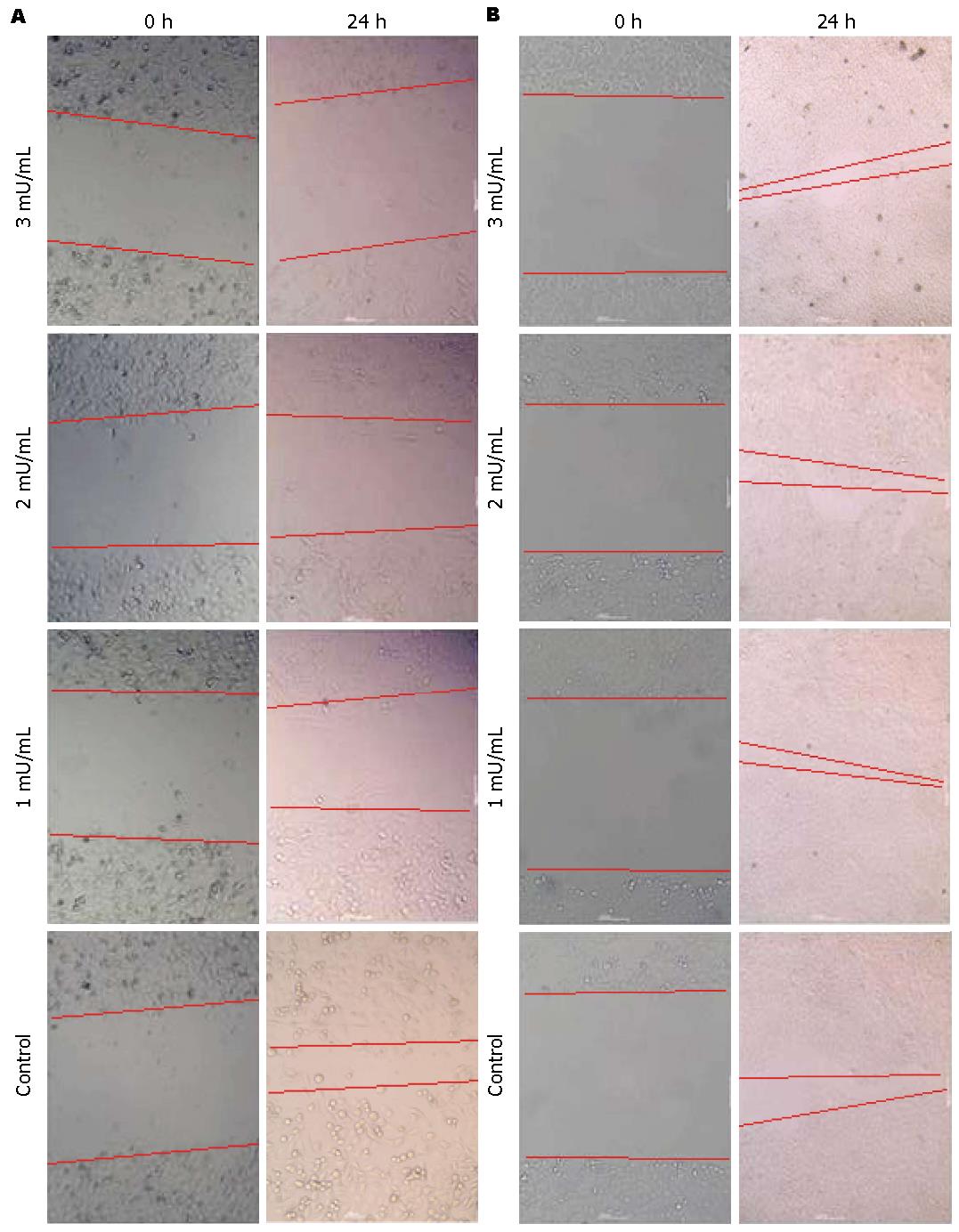
1.2.2 划痕试验: 每孔以1×105个细胞接种于6孔培养板, 每组2个复孔, 培养4 h或过夜至细胞贴壁后弃去原培养基, 加入无(Control)或含药物(ADI)的干预培养基2 mL培养24 h; 细胞经干预培养后, 沿培养孔正中垂直培养板长轴处用10 μL枪头划一直线(约500 μm), PBS轻洗2次, 然后每组分别加入2 mL培养基, 照0 h划痕像, 继续培养至24 h并照相分析.
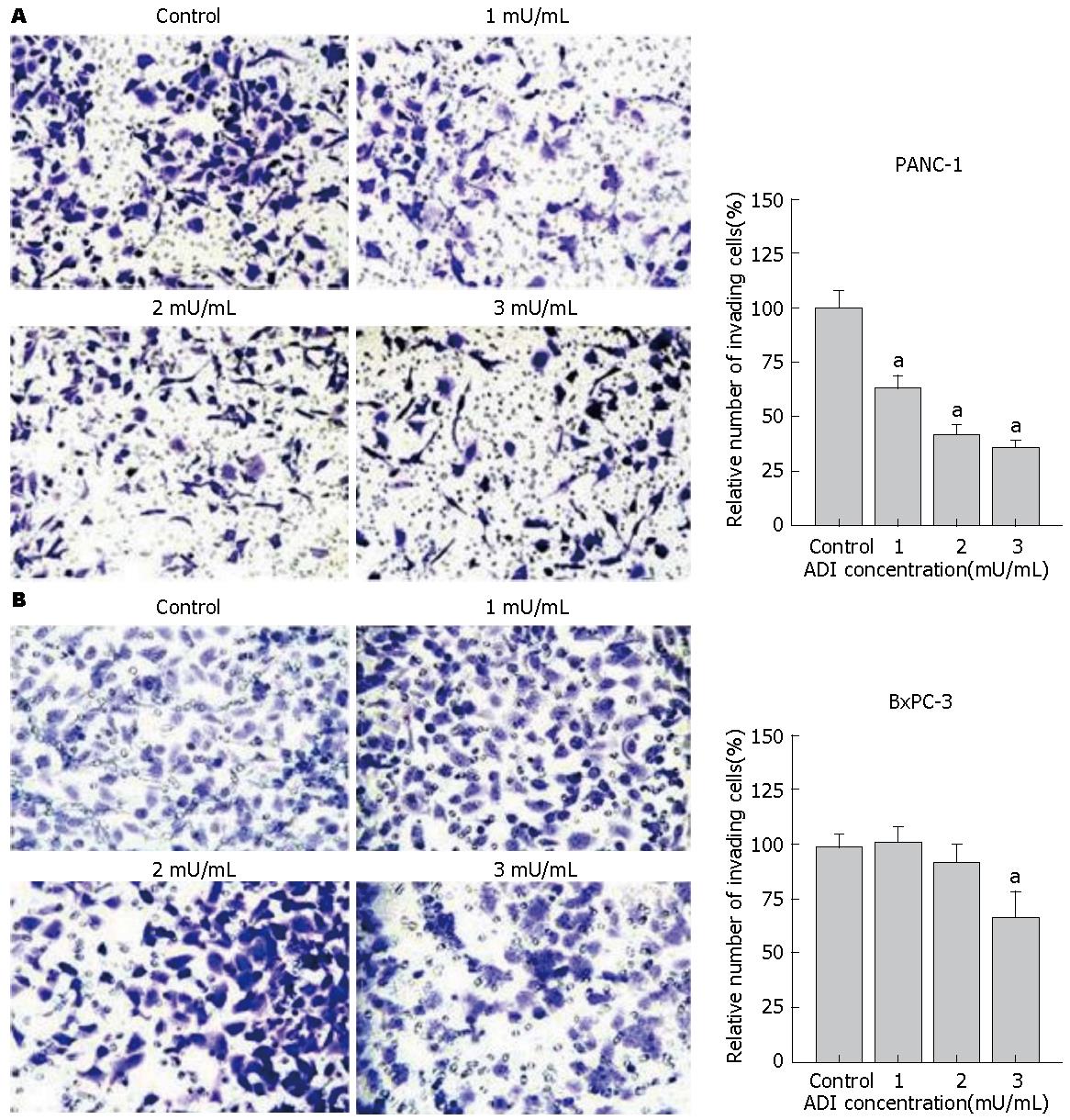
1.2.3 Transwell细胞侵袭试验: 每孔以1×105个细胞接种于6孔培养板, 培养4 h或过夜至细胞贴壁后, 弃去原培养基, 每组分别加入干预培养基2 mL, 继续干预培养24 h; 无血清培养基重悬干预后细胞, 加入Transwell小室上室100 μL, 细胞数目为8×104, Transwell小室下室为20% FBS培养基, 每组两个复孔, 继续培养48 h; 取出Transwell小室, 观察下室有无细胞, 然后用PBS轻洗小室上室和膜面, 甲醇固定, 结晶紫染色, 用湿棉签轻轻搽除上室内未穿过的细胞, PBS轻洗; 倒置显微镜下随机观察膜中心、周围5个视野的细胞数并照相.
1.2.4 qRT-PCR检测: 采用TRIzol试剂盒提取ADI干预12 h后胰腺癌细胞的总RNA, TaKaRa反转录试剂盒将总RNA反转录成cDNA. 使用TaKaRa公司SYBR Premix Ex TaqⅡ进行qRT-PCR, 分别加入2 μL cDNA, 10 μL SYBRGreen, 0.8 μL目标引物(以GAPDH为内参照), 加入无菌无酶水至总反应体积20 μL, 轻轻混匀后上机进行PCR扩增. 每组样本相同条件下重复3孔, 得到每个PCR反应的循环域(Ct)值, 通过GAPDH基因水平校正, 用2-ΔΔCt值计算各组目标RNA产物的相对表达量.
1.2.5 Western blot检测: 收集ADI干预12 h后的胰腺癌细胞, 按照试剂盒说明提取总蛋白并定量. 取蛋白质样品40 μg, 12%SDSPAGE电泳, 转膜, 5%脱脂奶粉封闭1 h, 加入按比例稀释的一抗MMP-2、E-Cadherin、uPA、NF-κB p65、p-p65、ERK、p-ERK、AKT、p-AKT、PI3KCA及β-actin, 4 ℃孵育过夜, HRP标记二抗(1:5000)室温摇床孵育2 h, ECL曝光显影, GeneBox(SynGene, United Kingdom)凝胶成像仪扫描, Quantity One软件分析结果. 以β-actin作为内参照, 目标蛋白表达量用其蛋白灰度值与内参蛋白灰度值的比值表示. 试验重复两遍.
统计学处理 应用SPSS19.0统计软件进行分析. 数据均采用mean±SD表示, 两组间均数比较采用独立样本t检验(student非配对t-检验), 检验水准α = 0.05. P<0.05为差异具有统计学意义.
经0-3 mU/mL ADI培养干预PANC-1和BxPC-3细胞, 发现与对照组相比, 24 h后ADI呈浓度依赖性抑制PANC-1细胞迁移(图1A), 而对BxPC-3细胞迁移能力抑制不明显(图1B). 经0-3 mU/mL ADI预先培养干预两株胰腺癌细胞24 h后, 按8×104/孔接种于Transwell小室上室, 48 h后计数穿过小室基质胶膜的细胞. 结果显示ADI依浓度梯度明显降低ASS低表达PANC-1胰腺癌细胞株的侵袭能力(P<0.05)(图2A), 而ASS表达阳性的BxPC-3细胞的侵袭能力则仅在ADI达到3 mU/mL时受到影响(P<0.05)(图2B).
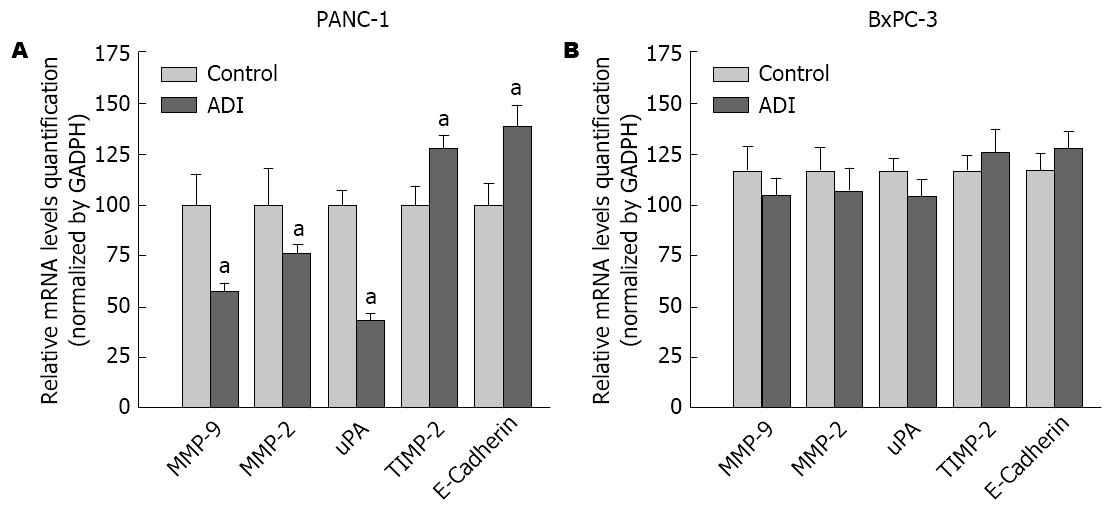
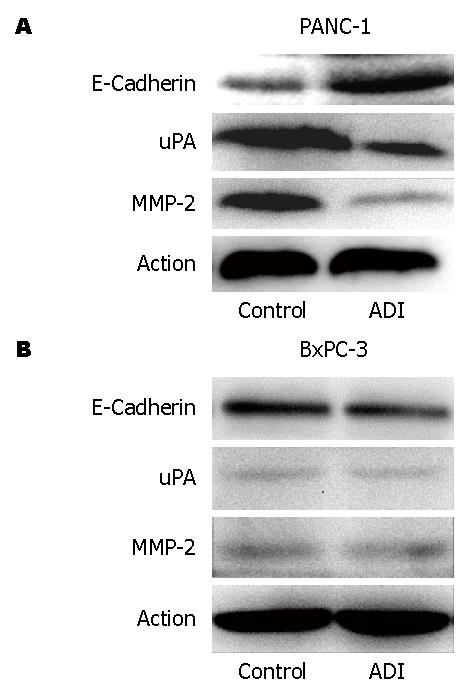
我们以前研究显示1 mU/mL ADI对PANC-1干预48 h的增殖抑制约为20%, 而对ASS高表达的BxPC-3细胞增殖活性几无抑制[17]. 因此本研究选用1 mU/mL ADI对两株细胞进行干预研究. qRT-PCR结果发现, 与对照组相比, 1 mU/mL ADI可明显上调PANC-1细胞的E-Cadherin和TIMP-2的mRNA水平, 及下调uPA、MMP-2、MMP-9的mRNA水平(P<0.05), 而这种改变在BxPC-3细胞株则不明显(图3). 相似, Western blot结果也发现ADI可上调PANC-1细胞的E-Cadherin蛋白表达, 下调MMP-2、uPA的蛋白表达(图4).
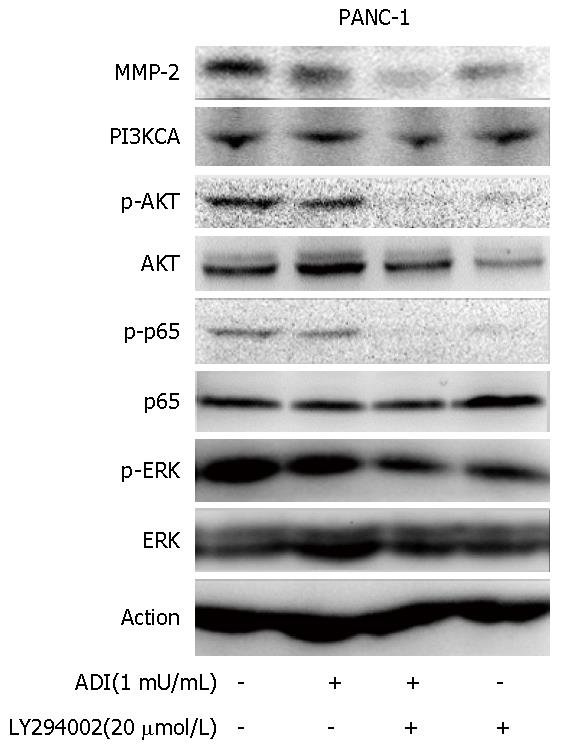
为明确ADI影响胰腺癌细胞侵袭能力的分子机制, 我们检测了细胞侵袭重要信号途径PI3K-AKT通路的蛋白表达及蛋白磷酸化水平, 结果显示, 与对照组相比, ADI(1 mU/mL)可下调PANC-1细胞株的p-AKT和p-p65水平, 而PI3K抑制剂LY294002(20 μmol/L)可协同这种作用, 并能协同ADI下调PANC-1细胞的MMP-2水平(图5).
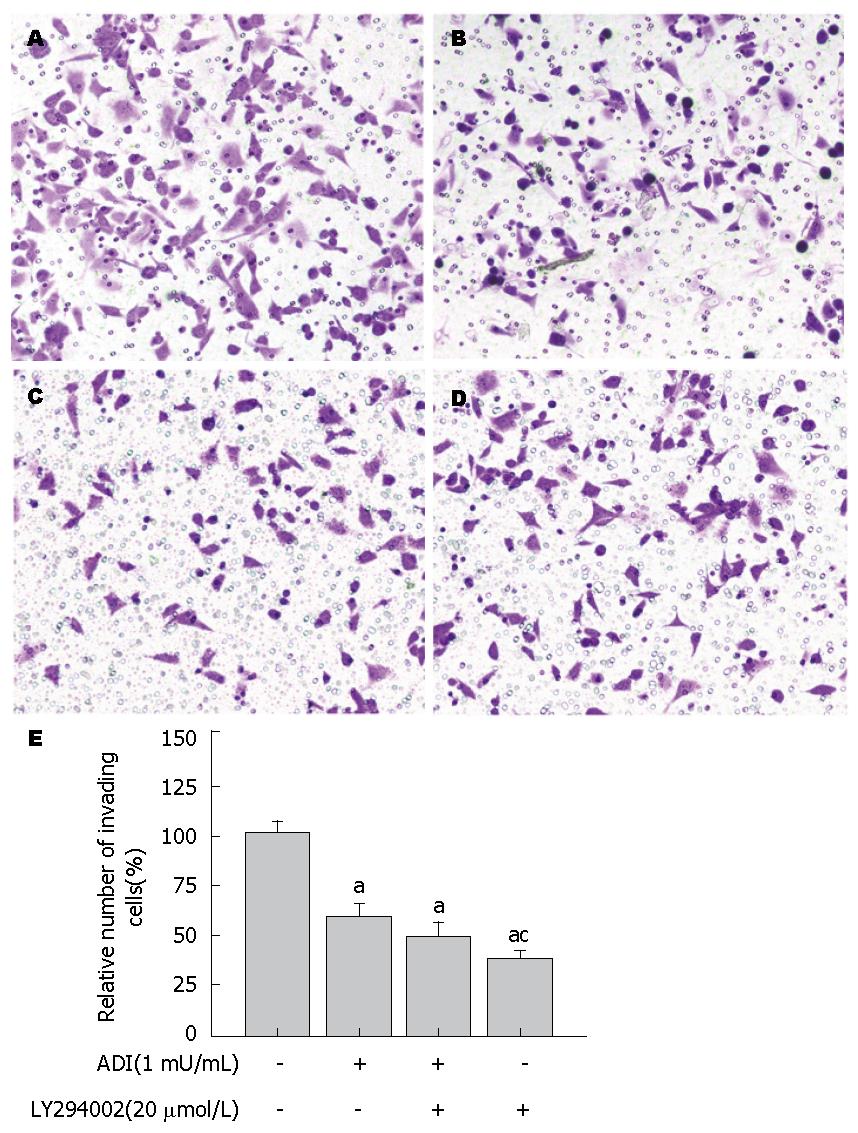
PI3K抑制剂LY294002可协同ADI对p-AKT、p-p65的影响, 进而下调侵袭相关蛋白, 我们进一步检测了ADI联合应用LY294002后胰腺癌细胞侵袭能力的改变. Transwell试验结果显示ADI(1 mU/mL)联合PI3K抑制剂LY294002(20 μmol/L)明显降低ASS低表达PANC-1胰腺癌细胞株的侵袭能力, LY294002能协同ADI抑制PANC-1胰腺癌细胞的侵袭(P<0.05)(图6).
精氨酸参与人体细胞多种生理功能, 对于保持快速增殖阶段的恶性肿瘤细胞生存更为重要[18,19]. 研究[14,20]证明精氨酸参与恶性肿瘤发生发展的多个步骤. 肿瘤细胞代谢需要更多的精氨酸参与以维持其增殖等侵袭性生物学行为, 而如清除细胞内精氨酸剥夺癌细胞的精氨酸供应, 有可能抑制或协同其他药物抑制肿瘤细胞的生长及侵袭[8,21,22]. 因此, 精氨酸剥夺可在体外和体内通过各种机制干预肿瘤细胞的增殖和癌症的进展[14-16,23]. ADI为通过将精氨酸转换成瓜氨酸而清除细胞内精氨酸的一种精氨酸剥夺剂[24,25]. ADI清除细胞精氨酸后, 由于精氨酸营养缺陷型肿瘤不表达ASS, 不能重新利用瓜氨酸合成精氨酸, 即可达到精氨酸剥夺而影响肿瘤细胞的增殖侵袭行为[6,9]. 既往研究发现ADI作为精氨酸剥夺剂可抑制多种肿瘤细胞的增殖等生物学行为[21,22]. 因此, ADI精氨酸剥夺有可能作为多种ASS表达缺陷肿瘤的治疗策略[11,17,23].
我们在体外对胰腺癌细胞株进行ADI精氨酸剥夺干预可抑制ASS缺陷胰腺癌细胞株的增殖; 而对ASS阳性表达的BxPC-3细胞的增殖几无明显影响, 提示ASS表达是ADI对胰腺癌细胞产生精氨酸剥夺作用的关键因子[17]. 本研究进一步探讨了ADI对胰腺癌细胞侵袭转移行为的影响及可能的分子机制. 我们的研究结果显示ADI仅可抑制ASS缺陷表达的PANC-1胰腺癌细胞株迁移和侵袭能力, 而对ASS表达BxPC-3细胞株影响极小; 而这种对PANC-1细胞侵袭转移生物学行为的抑制可能由ADI阻断肿瘤细胞PI3K-AKT信号活化调节侵袭相关基因的转录表达所介导.
胰腺癌细胞的迁移与侵袭涉及多种侵袭相关因子和黏附蛋白. 既往研究中未见报道ADI改变胰腺癌细胞侵袭能力的分子机制研究[10,22]. MMPs、TIMPs、细胞黏附分子等侵袭相关蛋白均参与了胰腺癌细胞的侵袭转移过程. 本研究发现ADI可下调ASS缺陷胰腺癌细胞PANC-1的MMP-2、MMP-9、uPA mRNA和/或蛋白水平, 上调E-Cadherin、TIMP-2基因的转录和/或蛋白表达水平. 提示ADI干预影响胰腺癌侵袭转移生物学行为与调控侵袭相关基因的转录表达有关.
胰腺癌侵袭转移与多种分子机制有关, 如PI3K、STAT3、MAPK等信号通路[26-28]. ADI可调节胰腺癌细胞侵袭相关的基因表达水平, 但具体的分子机制尚不清楚. 既往研究提示精氨酸剥夺可阻断PI3K/AKT信号通路, 继而抑制肿瘤细胞的生长[17]. 而且, 根据胰腺癌易对化放疗产生耐受, 而这些治疗耐受的产生多涉及NF-κB信号的激活[22,29,30]. 因此, 我们假设ADI可能通过阻断PI3K-AKT信号通路而改变胰腺癌侵袭转移特性. 本研究通过应用ADI及联合PI3K通路小分子抑制剂LY294002对PANC-1胰腺癌细胞进行干预, 结果发现ADI可阻断AKT、p65的磷酸化, 下调p-AKT、p-p65的表达水平, 而PI3K抑制剂LY294002可进一步协同这种作用. 此外, LY294002联合干预可协同ADI下调侵袭相关蛋白MMP-2的表达水平, 与p-AKT、p-p65下调一致. 通过Transwell细胞侵袭试验进一步验证了LY294002联合ADI干预胰腺癌细胞PANC-1后侵袭能力的改变. 因此, 根据本研究结果, 可推测ADI精氨酸剥夺通过下调AKT、p65的磷酸化阻断PI3K-AKT信号通路, 进一步调控侵袭相关基因转录表达而影响胰腺癌细胞的侵袭转移行为.
总之, ADI可通过精氨酸剥夺抑制ASS表达缺陷胰腺癌细胞株迁移及侵袭的能力; 而ADI对胰腺癌细胞的这种侵袭抑制可能通过阻断PI3K-AKT信号通路活化而调控侵袭相关基因的转录表达所介导. PI3K/AKT信号通路介导肿瘤的多种生物学行为, 如细胞生存、侵袭、耐药等. PI3K抑制剂可协同ADI影响胰腺癌细胞的侵袭能力, 从而阻止胰腺癌侵袭转移, 提示ADI精氨酸剥夺及联合PI3K抑制剂的治疗策略可作为晚期和复发胰腺癌的一种治疗选择.
胰腺癌预后极差, 研究胰腺癌治疗新方法迫在眉睫. 肿瘤细胞需要较多的精氨酸供应维持其增殖和侵袭. 精氨酸剥夺已在某些肿瘤显示出抗肿瘤效应. 胰腺癌缺乏利用瓜氨酸合成精氨酸的关键酶精氨琥珀酸合成酶, 为精氨酸营养缺陷型肿瘤. 精氨酸脱亚胺酶能将精氨酸转换成瓜氨酸而达到精氨酸剥夺, 阻断胰腺癌细胞对精氨酸的利用, 有可能作为胰腺癌潜在的治疗制剂.
江建新, 教授, 主任医师, 湖北省肿瘤医院肝胆胰腺外科; 刘亮, 副主任医师, 复旦大学胰腺癌研究所, 复旦大学附属肿瘤医院胰腺肝胆外科; 郑建明, 教授, 主任医师, 第二军医大学附属长海医院病理科.
胰腺癌预后极差, 死亡率几乎与发病率相等, 研究早期诊断和治疗新方法是目前胰腺癌研究的热点. 精氨酸脱亚胺酶(arginine deiminase, ADI)通过精氨酸剥夺阻断癌细胞对精氨酸的利用, 有可能作为胰腺癌潜在的治疗制剂, 但ADI精氨酸剥夺对胰腺癌细胞的侵袭转移影响及其相关的分子机制未明.
Bowles等的研究及本课题组前期研究发现人胰腺癌组织及胰腺癌细胞株精氨琥珀酸合成酶(argininosuccinate synthetase, ASS)表达缺陷率较高, 即胰腺癌为精氨酸缺陷性肿瘤; ADI通过精氨酸剥夺可改变胰腺癌细胞的增殖和克隆能力. 本课题组前期研究进一步发现ASS表达缺陷与胰腺癌淋巴结转移、局部浸润相关, 提示ADI可能通过精氨酸剥夺抑制ASS表达缺陷型胰腺癌的侵袭转移.
精氨酸代谢关键酶ASS表达缺陷与胰腺癌淋巴结转移、局部浸润相关. 本研究通过应用ADI干预胰腺癌细胞株观察其对癌细胞迁移、侵袭行为及侵袭相关基因转录表达的改变, 以及影响改变可能的分子机制. 本研究发现ADI可通过阻断PI3K-AKT信号通路抑制ASS表达缺陷胰腺癌细胞的侵袭.
本研究揭示了ADI通过阻断PI3K-AKT信号通路下调侵袭相关基因的转录与表达而抑制胰腺癌细胞的侵袭转移, 为ADI联合PI3K抑制剂作为胰腺癌治疗新策略提供理论依据. ADI精氨酸剥夺有望成为不可切除胰腺癌的潜在治疗方法.
精氨酸剥夺: 指应用精氨酸脱亚胺酶或精氨酸酶等精氨酸剥夺剂清除细胞生存环境的精氨酸, 降低精氨酸的可用性, 使需精氨酸参与的各种细胞代谢等生理活动受损或终止, 产生精氨酸剥夺相关的病理状态. 精氨酸剥夺可使精氨酸缺陷型肿瘤细胞造成精氨酸缺乏的代谢压力, 使其产生细胞毒性反应, 如增殖活性受抑, 发生凋亡等.
本文选题新颖, 研究方法得当, 结果可靠, 结论可信, 具有一定的学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:胡珊
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66:7-30. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 5. | Barbul A. Arginine: biochemistry, physiology, and therapeutic implications. JPEN J Parenter Enteral Nutr. 1986;10:227-238. [PubMed] |
| 6. | Wheatley DN, Kilfeather R, Stitt A, Campbell E. Integrity and stability of the citrulline-arginine pathway in normal and tumour cell lines. Cancer Lett. 2005;227:141-152. [PubMed] [DOI] |
| 7. | Wu L, Li L, Meng S, Qi R, Mao Z, Lin M. Expression of argininosuccinate synthetase in patients with hepatocellular carcinoma. J Gastroenterol Hepatol. 2013;28:365-368. [PubMed] [DOI] |
| 8. | Vissers YL, Dejong CH, Luiking YC, Fearon KC, von Meyenfeldt MF, Deutz NE. Plasma arginine concentrations are reduced in cancer patients: evidence for arginine deficiency? Am J Clin Nutr. 2005;81:1142-1146. [PubMed] |
| 9. | Dillon BJ, Prieto VG, Curley SA, Ensor CM, Holtsberg FW, Bomalaski JS, Clark MA. Incidence and distribution of argininosuccinate synthetase deficiency in human cancers: a method for identifying cancers sensitive to arginine deprivation. Cancer. 2004;100:826-833. [PubMed] [DOI] |
| 10. | Bowles TL, Kim R, Galante J, Parsons CM, Virudachalam S, Kung HJ, Bold RJ. Pancreatic cancer cell lines deficient in argininosuccinate synthetase are sensitive to arginine deprivation by arginine deiminase. Int J Cancer. 2008;123:1950-1955. [PubMed] [DOI] |
| 11. | Kelly MP, Jungbluth AA, Wu BW, Bomalaski J, Old LJ, Ritter G. Arginine deiminase PEG20 inhibits growth of small cell lung cancers lacking expression of argininosuccinate synthetase. Br J Cancer. 2012;106:324-332. [PubMed] [DOI] |
| 12. | Yoon CY, Shim YJ, Kim EH, Lee JH, Won NH, Kim JH, Park IS, Yoon DK, Min BH. Renal cell carcinoma does not express argininosuccinate synthetase and is highly sensitive to arginine deprivation via arginine deiminase. Int J Cancer. 2007;120:897-905. [PubMed] [DOI] |
| 13. | Ensor CM, Holtsberg FW, Bomalaski JS, Clark MA. Pegylated arginine deiminase (ADI-SS PEG20,000 mw) inhibits human melanomas and hepatocellular carcinomas in vitro and in vivo. Cancer Res. 2002;62:5443-5450. [PubMed] |
| 14. | Kuo MT, Savaraj N, Feun LG. Targeted cellular metabolism for cancer chemotherapy with recombinant arginine-degrading enzymes. Oncotarget. 2010;1:246-251. [PubMed] [DOI] |
| 15. | Feun L, You M, Wu CJ, Kuo MT, Wangpaichitr M, Spector S, Savaraj N. Arginine deprivation as a targeted therapy for cancer. Curr Pharm Des. 2008;14:1049-1057. [PubMed] |
| 16. | Lam TL, Wong GK, Chong HC, Cheng PN, Choi SC, Chow TL, Kwok SY, Poon RT, Wheatley DN, Lo WH. Recombinant human arginase inhibits proliferation of human hepatocellular carcinoma by inducing cell cycle arrest. Cancer Lett. 2009;277:91-100. [PubMed] [DOI] |
| 17. | Liu J, Ma J, Wu Z, Li W, Zhang D, Han L, Wang F, Reindl KM, Wu E, Ma Q. Arginine deiminase augments the chemosensitivity of argininosuccinate synthetase-deficient pancreatic cancer cells to gemcitabine via inhibition of NF-κB signaling. BMC Cancer. 2014;14:686. [PubMed] [DOI] |
| 18. | Chiaviello A, Paciello I, Veneziani BM, Palumbo G, Aloj SM. Cells derived from normal or cancer breast tissue exhibit different growth properties when deprived of arginine. Med Oncol. 2012;29:2543-2551. [PubMed] [DOI] |
| 19. | Szende B, Tyihák E, Trézl L. Role of arginine and its methylated derivatives in cancer biology and treatment. Cancer Cell Int. 2001;1:3. [PubMed] |
| 20. | Vynnytska-Myronovska B, Bobak Y, Garbe Y, Dittfeld C, Stasyk O, Kunz-Schughart LA. Single amino acid arginine starvation efficiently sensitizes cancer cells to canavanine treatment and irradiation. Int J Cancer. 2012;130:2164-2175. [PubMed] [DOI] |
| 21. | Kim JE, Kim SY, Lee KW, Lee HJ. Arginine deiminase originating from Lactococcus lactis ssp. lactis American Type Culture Collection (ATCC) 7962 induces G1-phase cell-cycle arrest and apoptosis in SNU-1 stomach adenocarcinoma cells. Br J Nutr. 2009;102:1469-1476. [PubMed] [DOI] |
| 22. | Daylami R, Muilenburg DJ, Virudachalam S, Bold RJ. Pegylated arginine deiminase synergistically increases the cytotoxicity of gemcitabine in human pancreatic cancer. J Exp Clin Cancer Res. 2014;33:102. [PubMed] [DOI] |
| 23. | Glazer ES, Piccirillo M, Albino V, Di Giacomo R, Palaia R, Mastro AA, Beneduce G, Castello G, De Rosa V, Petrillo A. Phase II study of pegylated arginine deiminase for nonresectable and metastatic hepatocellular carcinoma. J Clin Oncol. 2010;28:2220-2226. [PubMed] [DOI] |
| 24. | Zhang L, Liu M, Jamil S, Han R, Xu G, Ni Y. PEGylation and pharmacological characterization of a potential anti-tumor drug, an engineered arginine deiminase originated from Pseudomonas plecoglossicida. Cancer Lett. 2015;357:346-354. [PubMed] [DOI] |
| 25. | Shen LJ, Beloussow K, Shen WC. Modulation of arginine metabolic pathways as the potential anti-tumor mechanism of recombinant arginine deiminase. Cancer Lett. 2006;231:30-35. [PubMed] [DOI] |
| 26. | Cao L, Chen X, Xiao X, Ma Q, Li W. Resveratrol inhibits hyperglycemia-driven ROS-induced invasion and migration of pancreatic cancer cells via suppression of the ERK and p38 MAPK signaling pathways. Int J Oncol. 2016;49:735-743. [PubMed] [DOI] |
| 27. | Wang MC, Jiao M, Wu T, Jing L, Cui J, Guo H, Tian T, Ruan ZP, Wei YC, Jiang LL. Polycomb complex protein BMI-1 promotes invasion and metastasis of pancreatic cancer stem cells by activating PI3K/AKT signaling, an ex vivo, in vitro, and in vivo study. Oncotarget. 2016;7:9586-9599. [PubMed] [DOI] |
| 28. | Huang L, Hu B, Ni J, Wu J, Jiang W, Chen C, Yang L, Zeng Y, Wan R, Hu G. Transcriptional repression of SOCS3 mediated by IL-6/STAT3 signaling via DNMT1 promotes pancreatic cancer growth and metastasis. J Exp Clin Cancer Res. 2016;35:27. [PubMed] [DOI] |
| 29. | Weng CJ, Chau CF, Hsieh YS, Yang SF, Yen GC. Lucidenic acid inhibits PMA-induced invasion of human hepatoma cells through inactivating MAPK/ERK signal transduction pathway and reducing binding activities of NF-kappaB and AP-1. Carcinogenesis. 2008;29:147-156. [PubMed] [DOI] |